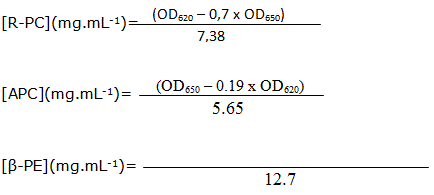Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.29 no.2 Santiago de Cuba may.-ago. 2017
ARTICULOS
Obtención de ß-Ficoeritrina y su uso en la conjugación de anticuerpos murinos
Obtention of ß-phycoerythrin and its use in the conjugation of specific antibodies
MSc. George Fernández-DuarteI, Dr.C Esteban Gutiérrez-CalzadoI, Lic. Maibis L. García-ReyesII
ILaboratorio de Anticuerpos y Biomodelos Experimentales, Santiago de Cuba, Cuba, george@cim.sld.cu, esteban@cim.sld.cu
IILaboratorio Provincial Criminalística, Santiago de Cuba, Cuba
RESUMEN
El objetivo de este trabajo fue la obtención de preparados puros de ß ficoeritrina y su conjugación con anticuerpos específicos. Para ello, se estableció un proceso de purificación de biomasa obtenida del alga Porphyridium cruentum, de la que se obtuvo un filtrado inicial, sometido a proceso cromatográfico de exclusión molecular con Sephadex G-25, y posteriormente, a intercambio iónico con DEAE celulosa. Luego se conjugó a anticuerpos específicos mediante el protocolo de Hardy, que involucra tres etapas, con reactivos derivatizantes, que culminan, en un enlace covalente ficoeritrina-anticuerpo. La calidad del conjugado obtenido se evaluó por Citometría de Flujo. Los resultados obtenidos muestran un rendimiento entre el 30 y 51 %, con niveles de pureza de la molécula de ficoeritrina mayores al 90 %, y la interpretación de los diagramas obtenidos por Citometría de Flujo, testifican la calidad del conjugado obtenido, para su posterior uso con fines diagnósticos.
Palabras clave: ficoeritrina, conjugado, citometría de flujo, diagnóstico.
ABSTRACT
The objective of this work was to obtain pure preparations of ß-phycoerythrin and its conjugation with specific antibodies. For this, a process of purification of biomass obtained from the Porphyridium cruentum alga, from which an initial filtration was obtained, was submitted to a molecular exclusion chromatographic process with Sephadex G-25, and later to ion exchange with DEAE cellulose. It was then conjugated to antibodies by the Hardy protocol, which involves three steps, with derivatizing reagents, culminating in a covalent phycoerythrin-antibody binding. The quality of the conjugate obtained was evaluated by Flow Cytometry. The results obtained show a yield between 30 and 51 %, with purity levels of ß- phycoerythrin molecule greater than 90%, and the interpretation of the diagrams obtained by Flow Cytometry, testifying the quality of the conjugate obtained, for later use for diagnostic purposes.
Keywords: phycoerythrin, conjugated, flow cytometry, diagnoses.
INTRODUCCIÓN
Las ficobiliproteínas actúan como pigmentos accesorios para la fotosíntesis en algas marinas de las Rhodophyceae, Cyanophyceae, Cryptophyceae y algunas Pirrophyceae, se encuentran organizadas en estructuras celulares, llamadas ficobilisomas, las cuales están unidas en conjuntos regulares a la superficie exterior de los tilacoides [1].
Las ficobiliproteínas se encuentran en muy alta concentración en muchas algas (P. cruentum o cianobacteria Anabaena variabilis) y pueden ser encontrados numerosos reportes en literatura, de protocolos, donde estas algas, pueden crecer relativamente fácil en laboratorio, a escala de cultivo [2].
La microalga marina roja Porphyridium cruentum es una Rhodophyta de interés creciente como una fuente valiosa de ficobiliproteínas así como de exopolisacáridos sulfatados, de superóxido dismutasa y ácidos grasos polinsaturados [3], con aplicaciones en la industria alimentaria y farmacéutica.
Se ha podido demostrar un amplio uso de las ficobiliproteínas extraídas de estas algas, entre los que se destacan, como colorantes en los alimentos (las gomas de mascar, los producto lácteos, etc.) [3] y cosméticos como el lápiz de labios, así como, delineadores de ojos, en Japón, Tailandia y China [4]. También se ha mostrado su valor terapéutico, por su actividad inmunomoduladora, y anticancerígena [5].
Debido a su fluorocromocidad, estas han ganado gran importancia en el desarrollo de sondas fluorescentes para el inmunodiagnóstico [6].
Por lo antes mencionado, en este trabajo nos propusimos la obtención de ficoeritrina a partir de Porphyridium cruentum, y su posterior conjugación a moléculas de anticuerpos murinos, la actividad biológica de los conjugados se evaluó por Citometría de flujo.
Fundamentación teórica
La introducción de ficobiliproteínas como etiquetas fluorescentes de células y macromoléculas se ha extendido por su aplicación en técnicas de fluorescencia muy sensibles como la citometría de flujo, el inmunoensayo y la microscopía de fluorescencia, respectivamente [7]. La beta ficoeritrina (ß–PE) ha mostrado ser particularmente útil por su gran coeficiente de absorción, y las excelentes propiedades de fluorescencia, así como por el rendimiento quantum alto. La ß-PE está en una región espectral que, normalmente, es distinto de la región de emisión de los tintes orgánicos simples usados como indicadores fluorescentes. Por consiguiente, el pigmento es un valioso candidato como biosensor [8]. La ficoeritrina puede ser dividida en tres clases principales, dependiendo de su espectro de absorción, ß-Ficoeritrina (las crestas a 545, 565 nm con un surco a 499), R-ficoeritrina (las crestas a 499, 565 nm y un surco a 545) y C-ficoeritrina (la cresta a las 565) [9].
Todo este conocimiento, fundamenta la obtención de ficoeritrina a partir de algas como el Porphyridium cruentum, para utilizarla en la conjugación a moléculas proteicas, como pueden ser, los anticuerpos murinos, de gran utilidad como reactivo revelador en diversos inmunoensayos para el diagnóstico.
MATERIALES Y MÉTODOS
Los anticuerpos empleados para la investigación (anti CD4 y IgG ratón) procedieron del grupo de Desarrollo de Tecnologías del LABEX. La pureza de estos anticuerpos fue garantizada por el proveedor.
Biomasa de microalga
Se utilizaron las cepas de la microalga roja Porphyridium Cruentum (colección de cultivo TREBON, Checoslovaquia), estas se pusieron a crecer en medio Walnes el cual tiene la siguiente formulación descrita en la tablas 1-4; bajo las siguientes condiciones de cultivo: 20 o C de temperatura, un banco de iluminación compuesto de lámparas de 20 W (GEDEME, Suecia), donde se le garantizó entre 125 y 275 lux, una mezcla de aire y dióxido de carbono, y el pH del medio mantenido a 7,5.
TABLA 1. FORMULACIÓN FINAL DEL MEDIO WALNES POR LITRO DE AGUA DE MAR
| Solución | Volumen |
| Solución nutriente (3) | 1,0 mL |
| Solución de vitaminas (2) | 0,1 mL |
| Agua de mar filtrada | 1,0 L |
| Reactivo | Cantidad para 100 mL de agua destilada |
| ZnCl2 | 2,1 g |
| CoCl2.6H2O | 2,0 g |
| (NH4)6Mo7O24.4H2O | 0,9 g |
| CuSO4.5H2O | 2,0 g |
TABLA 3. SOLUCIÓN DE VITAMINAS (2)
| Vitamina | Cantidad para 100 mL de agua destilada |
| Vitamina B12 (Cianocobalamina) | 10,0 mg |
| Vitamina B1 (Tiamina) | 10,0 mg |
| Vitamina H (Biotina) | 200,0 µg |
| Reactivo | Cantidad para 1L de agua destilada |
| FeCl3.6H2O | 1,3 g |
| MnCl2.4H20 | 0,36 g |
| H3BO3 | 33,6 g |
| EDTA disódico | 45,0 g |
| NaH2PO4.2H2O | 20,0 g |
| NaNO3 | 100,0 g |
| Solución de micronutrientes (1) | 1 mL |
Extracción y purificación de ficobiliproteínas
Se realizó una ruptura y lisis de la biomasa, mezclando la misma con buffer acetato de sodio pH 5,5, en una proporción de 1g de biomasa húmeda (20 % biomasa seca) en 4 mL de buffer acetato de sodio 1 mol/L agitando, en un agitador magnético convencional (Polymix, Suecia) durante 50 minutos a 2,0 W de potencia, a temperatura de laboratorio, produciendo la lisis celular mediante choque osmótico. Luego se remueve el debris celular en una centrífuga refrigerada (SELECTA, España) a 25 ºC y a una velocidad de 2 500 rpm, durante 15–25 min, obteniéndose un sólido que se desecha y un sobrenadante que se filtró posteriormente a través de un filtro con un diámetro de poro de 1,2 µm obteniéndose un extracto de ficobiliproteínas, el cual se sometió a una diálisis con buffer acetato 50 mM, pH 5,5. Con posterioridad, se procedió a una purificación cromatográfica de este extracto mediante un intercambio iónico con una matriz de DEAE-celulosa, según Bermejo y Fernández [10, 11], a razón de 3 mg de ficobiliproteínas por cada mL de matriz. Las corridas cromatográficas se llevaron a cabo en tres diámetros diferentes 1,6, 2,6 y 5 cm, a un flujo lineal de 250 cm h-1 y eluidas con buffer de mayor fuerza iónica (250 mM de buffer acetato pH 5,5 y a 350 mM de buffer acetato pH 5,5). Se realizaron tres réplicas por cada corrida.
Estos purificados resultantes se concentraron y dializaron en un solo paso para su posterior utilización mediante tubos concentradores (Vivaspin, Suecia) de un tamaño de poro 100 kDa en buffer fosfato EDTA 50 mM.
Métodos Espectrofotométricos
A las fraccionadas coloreadas se les realizó un barrido espectrofotométrico, donde se miden las absorbancias a 280, 545, 565, 620 y 650 nm en un espectrofotómetro (Espectrofotómetro UV-visible PG Instruments T60U, China) en cubeta de cuarzo de 1 cm de espesor, todas las lecturas fueron tomadas a temperatura de laboratorio.
Una vez obtenida la proteína, se corroboró la pureza, midiendo la absorbancia a 545 y 495 nm y desarrollando la siguiente relación DO545 nm/DO 495 nm ≥ 2.
Las cantidades de ß-PE, R-PC y APC en los diferentes extractos donde están contenidas las ficobiliproteínas se calcularon teniendo en cuenta las absorbancias de 565, 620 y 650 nm mediante las ecuaciones siguientes:
De estas ecuaciones se obtienen las concentraciones de R-PC, APC Y B-PE.
donde:
R-PC: ficocianina.
APC: aloficocianina.
ß -PE: ß-ficoeritrina.
DO620: densidad óptica para una longitud de onda de 620 nm.
DO650: densidad óptica para una longitud de onda de 650 nm.
DO565: densidad óptica para una longitud de onda de 565 nm.
Electroforesis en geles de poliacrilamida
La pureza se determinó además, mediante la técnica de electroforesis [12] en condiciones reducidas. Se utilizó un sistema de electroforesis vertical con patrón comercial de peso molecular (Unstained de Biorad®) en un equipo de electroforesis Mini Protean 3®Cell (Bio-rad; Alemania).
Almacenamiento de la ß-PE
Se le añadió sulfato de amonio hasta lograr una solución al 40 % y luego fue envasada en frascos color ámbar y almacenada en un refrigerador (LG) a una temperatura de 4 a 8 o C para su posterior uso.
Obtención de los Anticuerpos conjugados con ficoeritrina (PE)
La conjugación se lleva a cabo mediante el protocolo de Hardy [13].
Preparación de la ficoeritrina (PE)
Se dializó la ficoeritrina primeramente contra 2 L de buffer PBS y posteriormente contra 1 L de buffer fosfato 50 mM, 1mM EDTA pH7.
Se utilizaron 3,2 mg de B-PE por mg de anticuerpo, lo que incluye un 10 % de la pérdida durante los intercambios de amortiguamiento.
La pureza y la concentración de la PE se determinaron midiendo la absorbancia a 495 y 545 nm. Una razón de 545/495 ≥ 2 indicó una eliminación adecuada de todas las otras proteínas.
Derivatización de la ficoeritrina (PE)
Se preparó una solución madre de 10 mg/mL de SMCC (Succinimidil 4- (N-maleidometil) ciclohexano-1-carboxilato) en DMSO (Dimetilsulfóxido) seco inmediatamente antes de su uso. Luego se añadió 11 uL de SMCC por mg de PE, en un tubo de reacción cubierto en papel de aluminio y se sometió a rotación a temperatura ambiente durante 60 minutos. Seguidamente se purificó la PE derivatizada empleando una columna de filtración en gel (PD-10) prequilibrada con buffer fosfato 50 mM 1mM EDTA pH7.
Reducción de los anticuerpos
Se preparó una solución fresca de 1 mol/L DTT (15,4 mg/100 uL) en agua destilada. Se añadieron 20 uL de DTT por mL de solución de anticuerpo, luego se dejó reposar a temperatura ambiente durante 30 minutos sin mezcla adicional. Posteriormente se pasó el anticuerpo reducido por una columna de filtración en gel (PD-10) prequilibrada con cambio de buffer, se colectaron 0,25 mL para determinar la concentración por espectrofotometría, seguidamente se llevó a cabo la conjugación.
Conjugación covalente
Se adicionaron 3,2 mg de SMCC-PE por mg de anticuerpo, se envolvió el tubo de reacción en papel de aluminio y se sometió a rotación durante 60 minutos a temperatura ambiente.
Una vez transcurridos 60 minutos se preparó una solución fresca de 10 mg de NEM en 1,0 mL de DMSO anhidro. Se añadieron 34 mg (3,4 uL) por mg de anticuerpo. Luego se envolvió el tubo de reacción en papel de aluminio y se sometió a rotación a temperatura ambiente durante 20 minutos.
Purificación de los Conjugados
La purificación de los anticuerpos conjugados por el protocolo de conjugación descrito se realizó por filtración en gel en columnas PD-10 (Pharmacia®) utilizando una matriz de Sephadex G-25 y un Buffer Fosfato Salino 0,01 M como tampón a pH 7,2.
RESULTADOS Y DISCUSIÓN
Recobrado en el proceso de purificación
Se realizaron 9 corridas experimentales para conocer qué efecto traería consigo sobre el rendimiento y la pureza del recobrado de las ficobiliproteínas. Como se observa en la figura 1, no existen diferencias significativas en cuanto al rendimiento obtenido en la columna xk 16 en relación a las columnas xk 50, aunque si se observa diferencia entre las corridas que utilizan columnas xk 26 y las xk 50.
Aunque estadísticamente se aprecia diferencia significativa, entre las corridas desarrolladas en columna xk 26 y xk 50, seleccionamos las columna XK para realizar futuras purificaciones ya que se obtiene mayor cantidad de pigmento en una sola corrida cromatográfica, por lo que disminuye el número de corridas a realizar en el tiempo, así como permite un mayor ahorro de recursos al proceso.
En la figura 2 se observa la cantidad de ficoeritrina obtenida por cada diámetro de columna, así como el factor de escala calculado teniendo en cuenta el volumen de matriz contra la capacidad dinámica (3,3 ml/mg de proteína) para el caso de la columna de diámetro de 1,6 cm fue de 10, en el caso de la columna de 2,6 cm fue de 27 y en el caso de la columna de 5,0 cm fue de 99, destacándose que el escalado de la columna de 5,0 cm aproximadamente 10 veces mayor, con respecto a la de 1,6 cm y 4 veces mayor con respecto a la de 2,6 cm.
En cuanto a las cantidades de ß-ficoeritrina pura obtenida, se puede observar que en las columnas de diámetro 5,0 cm fueron aproximadamente 9 veces a las obtenidas en la columna de 1,6 cm y 5 veces con respecto a las obtenidas en el diámetro de 2,6 cm.
Después de la filtración del extracto crudo se pasó a la etapa siguiente la cual consiste en una cromatografía de exclusión molecular, la misma sustituye a la diálisis. Esta etapa se realiza ya que los volúmenes a trabajar son muy grandes, debido a que hay que eliminar el exceso de sales que contiene el extracto filtrado y llevar a la proteína a un buffer acetato menor conductividad, estamos hablando de una diferencia de 20 veces, con la cromatografía de exclusión los tiempos y los volúmenes a trabajar son factibles para el escalado productivo y además influye positivamente en la reducción de los costos.
Luego del proceso de purificación se realizó la concentración de la muestra purificada mediante filtros con una membrana de 100 KDa de cutoff para eliminar fragmentos de la molécula purificada contenido en el eluato, posteriormente se dializaron las muestras en Buffer EDTA pH 7 para remover las sales del ión acetato presentes en el eluato.
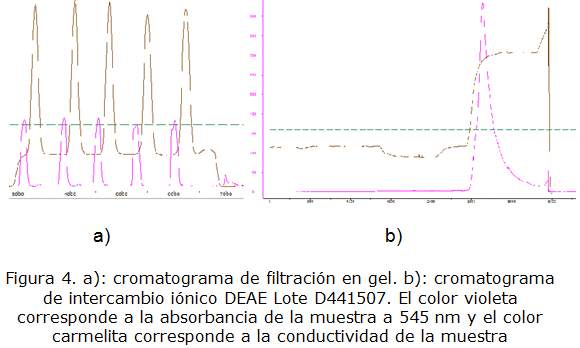
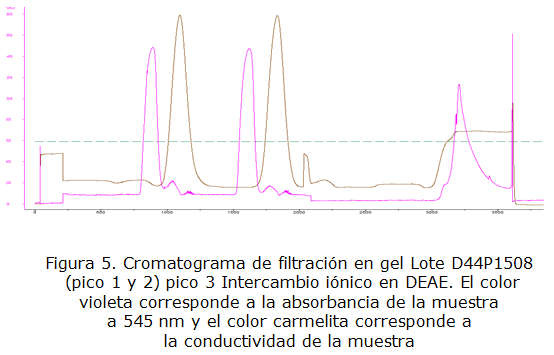
En las figuras 3, 4 y 5 se muestran los cromatogramas de filtración en gel G-25 y de intercambio iónico obtenidos en la purificación de los lotes D44P1506, D44P1507 y D44P1508. En los gráficos se observan dos curvas, una de color violeta que representa los valores de absorbancia de la muestra a 545 nm y la curva de color marrón correspondiente a la conductividad de la muestra en el proceso de desalado a un 20 % a través de la filtración en gel Sephadex G-25. Se puede observar que hay una separación efectiva entre el exceso de sales y la proteína ficoeritrina, en los gráficos se aprecia por ejemplo, en los lotes D44P1506 y D441507, 4 picos que corresponden a las 4 purificaciones aquí se puede observar que para la cromatografía de exclusión molecular se aprecian varios picos, esto es debido a que la capacidad de la columna es pequeña y se realizaron varios pases de cromatografía para purificar todo el extracto filtrado; esta metodología se puede utilizar como alternativa en caso de no tener la capacidad de columna necesaria.
Análisis del Porciento de Recobrado.
El recobrado de los procesos cromatográficos se realiza en función de la masa de la proteína de interés, inicial y final en el proceso. El rango del porciento de Recobrado en el proceso de purificación de la B-ficoeritrina está descrito entre 20 y 30 %; en la figura 6 se observan los lotes de purificados obtenidos con un comportamiento entre 30 y 51 %, obteniéndose valores acordes a los descritos para este proceso, por lo que podemos decir que el proceso cromatográfico permitió la obtención del mayor porcentaje de la proteína purificada según los datos descritos. Los lotes D44P1504 y D44P1505 tienen un menor porciento de recobrado, lo que puede deberse a que en estos se utilizó diálisis en vez cromatografía evidenciándose las ventajas de la cromatografía de exclusión molecular con respecto a diálisis.
Determinación de la pureza de la ficoeritrina
La pureza de la proteína se corroboró empleando dos métodos: Espectrofotometría UV-Vis y Electroforesis en geles de poliacrilamida SDS-PAGE.
Inicialmente el análisis de la pureza de la muestra purificada se realizó mediante espectrofometría, basado en los valores de absorbancia de las muestras en función de una relación de pureza establecida según documentos técnicos descritos en el acápite anterior; la cual se muestran a continuación:
A545/A495 > 2 (4)
Las relaciones de pureza permiten determinar la presencia en la muestra purificada de la B-ficoeritrina, en proporción al resto de las proteínas presentes en el extracto a purificar lo cual permite determinar si la muestra purificada quedó libre del resto de las proteínas (APC, RP-C) presentes que constituyen contaminantes en un purificado de B-ficoeritrina. Como se muestra en la tabla 5, los valores de pureza cumplen con las relaciones ya especificadas, por lo que la ficoeritrina fue purificada, cumpliendo con el rango de pureza establecido para esta biomolécula.
TABLA 5. RELACIÓN DE PUREZA DE LOS PURIFICADOS
| Lote purificado | Relación de Pureza |
| D44P1504 | 2,58 |
| D44P1505 | 2,40 |
| D44P1506 | 2,24 |
| D44P1507 | 2,46 |
| D44P1508 | 2,63 |
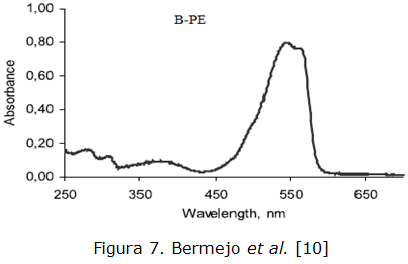
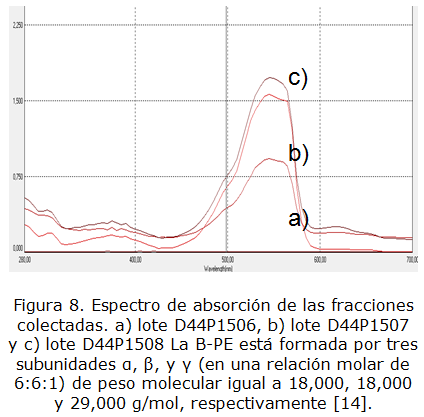
El análisis de la muestra purificada se realizó además, basado en el barrido espectrofotométrico de las muestras purificadas al compararlo con el descrito en la literatura. A continuación se observa el gráfico correspondiente al espectro descrito en literatura para la B-ficoeritrina purificada reportada por Bermejo et al. [10] (figura 7). Al realizar la comparación del espectro obtenido por las muestras purificadas mostrado en la figura 8, se observa que el comportamiento gráfico coincide con el reportado en la literatura, pues es conocido que de los tres tipos de ficoeritrina que existen en Porphyridium cruentum, es la ß-ficoeritrina la que exhibe picos a 545 y 565 nm y un hombro a los 499 nm, este parámetro se considera crítico e influye directamente en la relación de pureza obtenida en el purificado; ese resultado nos permite argumentar que los lotes purificados (B-ficoeritrina), conservan el criterio de selección para el cual fueron diseñados.
La B-PE está formada por tres subunidades a, ß, y γ (en una relación molar de 6:6:1) de peso molecular igual a 18,000, 18,000 y 29,000 g/mol, respectivamente [14].
Los resultados de SDS-PAGE reducida se muestran en la figura 9 apreciándose una banda muy ancha aproximadamente a 17 kDa, la cual corresponde a las subunidades a y ß encontradas en las principales ficobiliproteinas de cianobacterias y algas rojas [4], se observó también otra banda no tan ancha a los 28 kDa, correspondiente a la subunidad γ, arrojando similares resultados a los expuestos por Bermejo et al. [4, 14].
Obtención del conjugado anticuerpo-ficoeritrina
Se conocen diferentes métodos para la conjugación con ficobiliproteínas, en los cuales se emplean reactivos heterobifuncionales (SPDP, SMCC y GMBS) que dan lugar a la formación de enlaces covalentes permitiendo así la unión de las ficobiliproteínas a moléculas específicas [15].
En nuestro trabajo el protocolo empleado para la obtención de los anticuerpos conjugados con ficoeritrina fue el propuesto por Hardy.
Los valores de concentración para los dos conjugados obtenidos, se comportaron entre 0,01 y 0,07 mg/mL, ya que se trabajó con pequeñas cantidades de anticuerpo y pigmento, por lo que si se desea obtener conjugados con mayor concentración se deben trabajar con mayores masas de ambos.
Determinación de la actividad biológica por Citometría de Flujo
La actividad biológica de los productos conjugados anti CD4-PE y IgG ratón-PE se determinó mediante la detección del porciento de reconocimiento por la técnica de Citometría de Flujo (C.F), en la figura 10 se muestran los histogramas por citometría de flujo del conjugado anti CD4-PE; en ella se muestran no solo la calidad de conjugación, la cual se comparó contra un reactivo de referencia de la DAKO ® , en la que se observa que estos reactivos reconocen a los linfocitos CD4 positivos.
Con relación al conjugado IgG ratón-PE, sus resultados se muestran en la figura 11; para ello se comparó el porcentaje de reconocimiento específico de un conjugado comercial DAKO ® anti IgG ratón- PE con el conjugado IgG de ratón PE obtenido en Labex.
De los análisis realizados para el conjugado comercial en todas sus diluciones se obtuvo marcaje específico, lo que ratifica la reacción antígeno-anticuerpo donde reconoce con alto grado de especificidad al IgG de ratón-PE. Se observa además que a mayor dilución tuvo una mayor intensidad de fluorescencia, indicando que el anticuerpo estaba más concentrado que los antígenos que expresa la línea celular empleada.
La figura 11 muestra que al realizar la comparación del conjugado obtenido con el conjugado comercial no se aprecia ni intensidad de fluorescencia, ni frecuencia de medición, equivalente a la ausencia de marcaje específico, por lo que se recomienda el uso del conjugado IgG ratón-PE como control negativo contra anticuerpos primarios monoclonales conjugados con ficoeritrina, para eliminar el efecto que pudiera causar la fluorescencia de los marcadores empleados influyendo sobre el resultado final, siendo compensada con la fluorescencia del control negativo [16].
CONCLUSIONES
En el proceso de purificación de la B-ficoeritrina en la etapa de Desarrollo del producto se realizaron cambios en la etapa de filtración del extracto de ficobiliproteinas, no incidiendo negativamente en el proceso de obtención del purificado.
Se obtuvieron los conjugados anti CD4-ficoeritrina (PE), IgG ratón-ficoeritrina (PE) mediante el protocolo de Hardy cumpliendo con el parámetro técnico para estos productos.
El conjugado IgG ratón-ficoeritrina (PE) no mostró porciento de reconocimiento específico, revelando su potencialidad como control negativo para Citometría de Flujo.
La actividad biológica del conjugado anti CD4-ficoeritrina (PE) evidenció el reconocimiento específico de las células CD4+ en sueros de pacientes humanos a diferentes diluciones comparables a las del reactivo comercial.
REFERENCIAS BIBLIOGRÁFICAS
1. BOROWITZKA, M. A. "High-value products from microalgaetheir development and commercialization". Journal of Applied Phycology. 2013, 25, 743–756.
2. SEKA, S.; CHANDRAMOHAN, M. "Phycobiliproteins as a commodity: trends in applied research, patents and commercialization". Journal of Applied Phycology. 2008, 20, 113–136.
3. BENAVIDES, J.; RITO PALOMARES, M. "Potential aqueous two-phase processes for the primary recovery of colored proteins from microbial origin". Eng Life Sci. 2005, 5, 259–266.
4. BERMEJO, R.; AVERA, E. M.; ÁLVAREZ-PEZ, J. M. "Chromatographic purification and characterization of B-phycoerythrin from Porphyridium cruentum. Semipreparative HPLC separation and characterization of its subunits". Journal of Chromatography. 2001, 917, 135–145.
5. GANTT, E. "Structure and function of phycobilisomes: light harvesting pigment complexes in red and blue-green algae". International Review of Cytology. 1980, 66, 45–80.
6. BENAVIDES, M.; RITO PALOMARES, M. "Simplified two-stage method to B-phycoerythrin recovery from Porphyridium cruentum". Journal of Chromatography B. 2006, 844, 39–44.
7. BENAVIDES, J.; RITO PALOMARES, M. "Bioprocess intensification: a potential aqueous two-phase process for the primary recovery of B-phycoerythrin from Porphyridium Cruentum". Journal of Chromatography B. 2004, 807, 33–38.
8. CISNEROS RUIZ, M.; RITO PALOMARES, M. "Estrategias de bioingeniería para la recuperación primaria de productos biológicos". Revista mexicana de ingeniería Química. 2005, 4, 131-139.
9. GALLAND IRMOULI, A. V. et al. "One-step purification of R -phycoerythrin from the red macroalga Palmaria palmata using preparative polyacrylamide gel electrophoresis". Journal of Chromatography. B. 2000, 739(1), 117–123.
10. BERMEJO, R.; ALVAREZ PEZ, J. M; ACIÉN FERNÁNDEZ, F. G; MOLINA GRIMA, E. "Recovery of pure B-phycoerythrin from the microalga Porphyridium cruentum". Journal of Biotechnology. 2002, 93, 73–85.
11. FERNÁNDEZ, J. "Obtención de B-PE a partir de Porphyridium cruentum y su uso en el inmunodiagnóstico". Tesis de Maestría, Univer sidad de Oriente, Santiago de Cuba, Cuba, 2007.
12. LAEMMLI, U. K. "Clavage of estructural proteins during de assembly of the head of bacteriophage T4". Nature. 1970, 227, 680-685.
13. HARDY, R. R. Purification and coupling of fluorescent proteins for use in flow Cytometry. En: Handbook of experimental immunology. 4th. Edición. Oxford: Black-well scientific, 1986, pp 25-32.
14. BERMEJO , R; ACIÉN FERNÁNDEZ, F. G; IBÁÑEZ, M. J; FERNÁNDEZ, J. M. "Preparative purification of B-phycoerythrin from the microalga Porphyridium cruentum by expanded-bed adsorption chromatography". Journal of Chromatography. 2003, 790, 317–325.
15. KOKUINA, E. et al "Autoanticuerpos diagnósticos en enfermedades autoinmunes sistémicas y específicas de órgano". Revista Cubana Medicina. 2006, 45(2), 45-47.
16. JANEWAY, Ch. A. Inmunobiology. The inmune system in health and diease. 2da Edición. New York: Taylor & Francis Group, 1996, p 2:28-2:29.
Recibido: 12/05/2016
Aceptado: 23/01/2017
MSc. George Fernández-Duarte, Laboratorio de Anticuerpos y Biomodelos Experimentales, george@cim.sld.cu