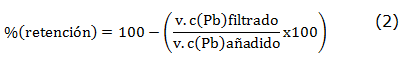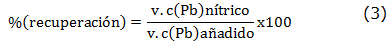Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.29 no.2 Santiago de Cuba may.-ago. 2017
ARTICULOS
Inmovilización de Quercetina sobre resina de Merrifield mediante Síntesis Orgánica en Fase Sólida asistida por microondas. Estudio preliminar de la retención de Pb(II)
Quercetin functionalized Merrifield's resin by microwave-assisted Solid Phase Organic Synthesis. Preliminary study of the retention of Pb(II). A new material for enrichment of Pb(II)
Dr.C. Markel Denet Luaces-AlbertoI, Dr.C. Arístides Camilo Valdés-GonzálezII, Lic. Carlos Ariel Alonso-VilchesI, Lic. Liván Lázaro Alba-GutierrezIII, MSc. Soane Fernandez-PuigII, Dra.C. Ana María Gutiérrez-CarrerasIV
IUniversidad de la Habana, La Habana, Cuba, markel@fq.uh.cu, carloskate@fq.uh.cu
IILaboratorio Universitario de Caracterización y Estructura de la Sustancia (LUCES). Instituto de Ciencia y Tecnología de los Materiales (IMRE). La Habana, Cuba, camiloaristides@yahoo.es, soanefernandez34@gmail.com
IIIInstituto Cubano de Investigaciones de los Derivados de la Caña de Azúcar (ICIDCA), Habana, Cuba, livan.alba@icidca.edu.cu
IVUniversidad Complutense de Madrid, carreras@quim.ucm.es
RESUMEN
Se reporta la inmovilización covalente de quercetina sobre resina de Merrifield, mediante Síntesis Orgánica en Fase Sólida asistida por microondas para su empleo en el reconocimiento y preconcentración de Pb(II). La caracterización por espectroscopia IR, microscopia óptica y electrónica de barrido permitió corroborar la ocurrencia de la reacción de inmovilización, así como los cambios en las propiedades morfológicas de la resina modificada. Se obtuvo un nuevo material con porcentajes de conversión superiores al 99 % después de 10 minutos de reacción, con un carácter ácido (de 8,4 mmol g-1 de resina). Por su parte, los ensayos preliminares mostraron una alta capacidad de retención del nuevo material para iones Pb(II) [620 mg(Pb)/g (resina modificada)] en medio hidrogenoftalato y pH 4,5. El tiempo de equilibrio fue inferior a 30 segundos con porcentajes de retención de 97,9 ± 0,5 % y recuperación del 100,4 ± 3, 4 % con HNO3 6 mol L-1.
Palabras clave: Resina de Merrifield, quercetina, SOFS, síntesis asistida por microondas, retención de Pb(II).
ABSTRACT
This work shows the immobilization of quercetin on Merrifield resin by microwave-assisted Solid Phase Organic Synthesis (SPOS) for use in the recognition and preconcentration of Pb(II). Characterization of the modified resin by IR spectroscopy as well as by optical and scanning electron microscopy corroborated the occurrence of the immobilization reaction and the morphological changes in the resin properties compared to the original one. The performed characterization and potentiometric titrations showed that a new material was obtained, with conversion yields of >99 % and the acid character of the modified resin, which was found to be 8.4 mmol g-1 resin. In addition, preliminary essays using modified resin exhibited high Pb(II) retention capacity [620 mg(Pb) /g (modified resin)] in a biphthalate buffer with pH 4.5. The time to establish equilibrium was <30 s with retention of 97.9 ± 0.5 % and recovery of 100.4 ± 3,4 % with 6 mol L-1 HNO3.
Keywords: Merrifield's resin, quercetin, sorbent material for Pb(II), Organic Solid Phase Synthesis, microwave.
INTRODUCCIÓN
La extracción en fase sólida es hoy en día una de las áreas más interesantes para la investigación en Química Analítica. Esta técnica ha alcanzado una importancia transcendental dentro del análisis de diferentes contaminantes medioambientales al exhibir altos factores de preconcentración, gran eficiencia y alta reproducibilidad con una manipulación relativamente sencilla [1]. Dentro de la gran cantidad de materiales sólidos que han sido utilizados como sorbentes de iones metálicos, las resinas quelatantes han jugado un papel preponderante, apoyadas, como ventaja adicional en su gran selectividad y/o gran capacidad de extracción [2].
La contaminación por metales pesados representa una preocupación ambiental debido a sus efectos tóxicos para la salud humana, en particular el Pb(II) es uno de los más tóxicos para hombres y animales causando varias enfermedades [3]. Se han utilizado diferentes resinas quelatantes para la retención de iones Pb(II) variando tanto el soporte sólido inerte como el reactivo quelatante inmovilizado. Este último es el más importante pues es el que interactúa directamente con el ión proporcionando la retención y posterior liberación del mismo según convenga. Reactivos como la dietanolamina, ácido iminodiacético [4] ácido 3-ferrocenil-3-hidroxiditioacrilico [5] y o-aminofenol [6] han sido empleados con buenos resultados.
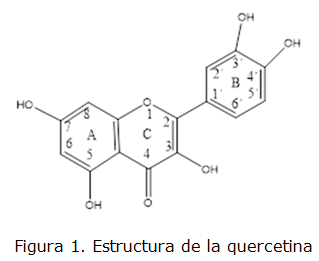
Los flavonoides han llamado la atención como reactivos quelatantes para la determinación de diferentes iones metálicos, tanto en disolución como en fase sólida para la separación y concentración [4, 6]. Particularmente la quercetina (figura 1), [2-(3,4-dihidroxifenil)-3,5,7-trihidroxi-4H-cromon-4-ona o 3,3',4',5,7 pentahidroxiflavona] [7, 8] se ha utilizado como reactivo quelatante inmovilizado, para la sorción de diferentes iones metálicos. Su principal ventaja consiste en tener 2 posibles sitios de quelación, uno entre los hidroxilos de las posiciones 3' y 4' del anillo B y otro entre el grupo carbonilo y los hidroxilos de las posiciones 3 o 5. Esto, en principio, provee a la resina quelatante de una relación metal: quercetina inmovilizada de 2:1, aunque se conoce que no resulta así en todos los casos [9].
Se ha publicado su inmovilización sobre sílica gel por adsorción física de una mezcla de acetona-hexano para la preconcentración de Sn (IV) y su posterior determinación por espectrofotometría de reflectancia difusa. Este material se desarrolló con el objetivo de determinar Sn (IV) en zinc de alta pureza. Los autores de esta investigación lograron límites de detección en el orden de los 0,06 mgL-1, trabajando a pH entre 1,8 y 2,2 con una excelente selectividad en presencia de ácido ascórbico [10]. Otros autores realizan una comparación de su comportamiento como quelatante de Sn(IV), pero esta vez unida de forma covalente a la sílica gel y a poliuretano. La determinación se realiza por Espectrometría de Absorción Atómica con Generación de Hidruros y llegan a la conclusión de que todos los sorbentes presentan excelentes características como quelatantes del Sn(IV) a pH 3,8 con muy buena selectividad ante una gran variedad de iones además de un relativo bajo costo y una durabilidad aceptable [11].
También se ha inmovilizado este reactivo sobre vidrio de poro controlado mediante enlace covalente con el objetivo de separar y preconcentrar iones Mn(II), Co(II), Ni(II), Cu(II) y Zn(II), empleando como método de determinación final ICP-MS. Para todos los metales la relación Quercetina-metal resultó 1:2, excepto para el manganeso (1:1). En este caso los investigadores logran un producto con el cual aprovechan la gran capacidad que tiene la quercetina como reactivo quelatante con las ventajas de su inmovilización por enlace covalente, mayor durabilidad, pero para eso se involucran en varios pasos de reacción que hacen lento y costoso el proceso, logrando solo hasta un 40 % de funcionalización del vidrio de poro controlado [9].
Aunque la quercetina se ha utilizado para la retención de varios iones metálicos y se ha logrado cierta selectividad ajustando las condiciones de retención y/o elución de los mismos, aún no se ha publicado su utilización como reactivo quelatante inmovilizado para la retención de Pb(II).
Para evitar el lavado del reactivo quelatante de los sorbentes y con esto darle mayor durabilidad se prefiere inmovilizar el mismo de manera covalente. No obstante, esto requiere la realización de Síntesis Orgánica en Fase Sólida (SOFS) que, utilizando las técnicas convencionales de agitación y calentamiento consumen mucho tiempo, en ocasiones varios días para su terminación [12]. Esto es debido a que la reacción ocurre entre dos fases diferentes y por lo tanto es muy limitada el área de contacto entre el soporte sólido y los reactivos. Con la utilización de técnicas no convencionales de síntesis, como las microondas, se ha logrado reducir entre 10 y 1 000 veces el tiempo de las reacciones orgánicas. Esto ha tenido una trascendental importancia en la Síntesis Orgánica en Fase Sólida, pasando las reacciones a durar solo unos pocos minutos en muchos casos [13].
La resina de Merrifield (poliestireno entrecruzado con divinilbenceno al 2 % y funcionalizada cloruro) ha sido ampliamente empleada para la SOFS de péptidos, sin embargo, su utilización como soporte sólido de diferentes moléculas para fines analíticos no ha tenido el mismo desarrollo [14]. Se han publicado trabajos donde se funcionaliza con 4,4, 4-trifluoro-1-(tiofen-2-yl) butano-1,3-dionabajo condiciones anhidras utilizando tetrahidrofurano (THF) como solvente e hidruro de sodio como base auxiliar. La resina funcionalizada es empleada para la separación y preconcentración selectiva de Uranio(VI) y Torio(IV) antes de la determinación por espectrofluorimetría, logrando una capacidad de 32,98 y 27,19 mg/g de resina, respectivamente [15]. Recientemente en nuestro grupo se realizó la inmovilización de morina sobre resina de Merrifield [2] y se estudiaron sus propiedades como material sorbente y de sensado fluorescente de iones Cu(II), Pb(II), Zn(II) y Cd(II) con muy buenos resultados.
En este trabajo se reporta la funcionalización de la resina de Merrifield con quercetina, realizando la reacción mediante SOFS asistida por microondas, de manera rápida y en un solo paso. El objetivo es obtener una nueva resina quelatante con alta capacidad de retención de iones Pb(II),empleando en ello el menor tiempo posible. La nueva resina es caracterizada y se presentan los resultados preliminares de su interacción con los iones Pb(II) mediante un estudio en estático.
Parte experimental
Reactivos
Todos los reactivos utilizados fueron de grados analíticos y obtenidos de las firmas Merk (Darmstadt, Germany) y BDH Chemicals Ltd (Poole, England). La resina de Merrifield se obtuvo de la firma Argonaut Technologies, Inc. (Tijuana, México) con una carga de 1,62 mmolg-1 y tamaño de partículas entre 50 y 100 µm. Se utilizó una disolución estándar de Pb(II) de 1 000 mg L-1 obtenida de la Merk y las disoluciones intermedias se prepararon mediante la dilución apropiada de la misma con agua milli-Q.
Instrumentación
Para la SOFS se utilizó un horno de microondas µChemist MLS GMBH con programación de calentamiento. Las micrografías se tomaron con un microscopio electrónico de barrido Vega Tescan, poniendo una pequeña porción de la muestra y recubriéndola con una fina capa de aleación Au-Pd y aplicando un potencial de 10kV.
Los espectros infrarrojos se obtuvieron con un Espectrofotómetro FT-IR Bruker Optic Tensor 27 con ATR acoplado. La muestra se colocó sobre un cristal de Seleniuro de Zinc y el espectro de reflectancia se tomó entre 800 y 4 000 cm-1.
Las medidas potenciométricas se realizaron con un pH-metro Crison Basic-20,con un electrodo combinado de vidrio de la misma firma para las medidas de pH y un sistema a base de un electrodo de alambre de plata como indicador y un electrodo de Calomel saturado con puente salino de KNO3 (15 %) como referencia, para la valoración de iones cloruros.
Para el análisis elemental se utilizó un equipo de microanálisis elemental automático LECO CHNS-932, con el que se obtuvieron los porcentajes de C, H y N.
Las medidas de Absorción Atómica se realizaron en un equipo GBC Avanta, con las condiciones que se muestran en la tabla 1. El calibrado utilizado para la determinación cuantitativa de los iones Pb(II) fue realizado con disoluciones patrones de entre 3 y 90 mgL-1.
TABLA 1. CONDICIONES INSTRUMENTALES PARA LA DETERMINACIÓN Pb (II) POR EAA.
| Parámetro | Valor |
| Longitud de onda(nm) | 283,3 |
| Corriente de la lámpara (mA) | 5 |
| Paso de banda (nm) | 0,2 |
| Flujo de aire (cm.equiv) | 35 |
| Flujo de acetileno (cm.equiv) | 30 |
| Altura del quemador (mm) | 10 |
Procedimientos
Reacción de inmovilización
La mezcla de reacción consiste en una suspensión de 500 mg de la resina de Merrifield en 5 mL de dimetilformamida (DMF) anhidro, 367 mg de quercetina y 138 mg de K2CO3 anhidro. Estas cantidades se trasvasan a un matraz redondo de 100 mL, se introduce en el horno de microondas y se programa utilizando una rampa inicial de 3min hasta alcanzar 140 grados Celsius con una potencia de radiación de 700 Watts. La reacción se completa en un tiempo total de 10min a reflujo constante. Posteriormente la mezcla es trasvasada cuantitativamente a un filtro de placa porosa y filtrada al vacío. El filtro se lava 5 veces con porciones de 5 mL de DMF y agua milli-Q de forma alterna, recogiéndose cuantitativamente, el filtrado y los lavados, en el mismo vaso de precipitados (250 mL), para la valoración potenciométrica de cloruros. Posterior a estos lavados, el filtro se lava nuevamente con una mezcla de Acetona/Agua/Metanol (5×5 mL) y Acetona/Metanol (5×5 mL). Finalmente se lava con Acetona (3×5 mL), Metanol (3×5 mL) y Diclorometano (DCM) (3×5 mL), antes de su secado al vacío por un periodo de 2 horas.
Caracterización
Determinación del porcentaje de conversión
El filtrado y los lavados recogidos anteriormente en el vaso de precipitadosse acidularon con 0,5 mL de ácido nítrico al 70 % y se realizó la valoración potenciométrica con solución estándar de nitrato de plata 0,01 molL-1. El volumen final fue determinado mediante el método de la segunda derivada. El porcentaje de conversión fue calculado según la ecuación (1):
Determinación de la acidez total
Se ponen en contacto 10 mg de resina modificada y 50 mL de agua, se le adicionan 10 mL de NaOH 0,01 mol L-1 y el exceso de NaOH es valorado por retroceso potenciométricamente, con disolución de HCl 0,01 molL-1.
Estudio preliminar de la retención de Pb(II)
Efecto del pH y estudio de la capacidad estática en el equilibrio
10 mg de la resina modificada pesados por triplicado para cada pH se sometieron al siguiente tratamiento. Se le añadió 7 mL de una solución patrón de plomo de 1 000 mg L-1 (7 mg) y 13 mL de buffer de hidrogenoftalato de potasio 10 mmolL-1 con valores de pH 2,2, 4, 5 y 5,8. Las disoluciones se agitaron durante 24 horas, se filtraron y el filtrado se recogió en matraces aforados de 100 mL enrasándolos con agua milli-Q. La concentración de Pb(II) en disolución se determinó por Espectrometría de Absorción Atómica (EAA) con llama utilizando las condiciones reflejadas en la tabla 1. Utilizando el método estático con la variante de intercambio en el equilibrio bajo las condiciones de trabajo en el laboratorio, se determinó la capacidad de la resina modificada dividiendo la masa Pb(II) retenida, a cada pH, entre la masa total de resina modificada utilizada para los experimentos. En todos los casos la masa de Pb(II) añadida fue superior a la necesaria para saturar todos los grupos funcionales.
Estudio del tiempo de fijación y los porcentajes de retención y recuperación
Para estos estudios se invierte la relación masa de resina modificada Pb(II) utilizada en el estudio anterior, para lo cual se mantienen las mismas cantidades del ion metálico y buffer, a pH 4.5±0.1 y se duplica la masa de resina utilizada (20 mg). La suspensión se agita por diferentes intervalos de tiempo tomando 0,5, 1, 5, 10 y 30 minutos. Se filtra, se lavan con 5 ml de buffer, se recoge el filtrado en matraces aforados de 50 mL, enrasándolos con agua milli-Q. La resina que queda en el filtro de placa porosa se lava con 2 porciones de 5 mL de HNO3 6 mol L-1 para recuperar el plomo retenido. Los porcentajes de retención y recuperación se calculan según las ecuaciones (2) y (3):
RESULTADOS Y DISCUSIÓN
Reacción de inmovilización
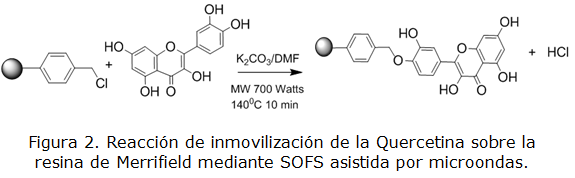
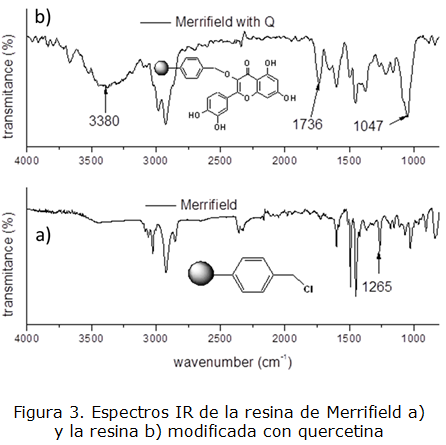
El esquema representado en la figura 2 muestra la reacción de inmovilización de la quercetina sobre la resina de Merrifield bajo las condiciones anteriormente señaladas.
La reacción se completa en el tiempo señalado lo cual se confirma mediante las valoraciones potenciométricas de cloruros realizada (% de conversión 100,7 ± 0,9).
Es necesario señalar que, en principio la inmovilización puede tener lugar por cualquiera de los 5 grupos hidroxilos presentes en la molécula de quercetina, por lo que se debe esperar una mezcla de productos y no un producto único. Se propone como producto principal la unión por el hidroxilo de la posición 3 teniendo en cuenta que su hidrogeno es el más lábil y unido a que la reacción ocurre en medio básico, el oxígeno tendrá una carga negativa asociada [2]. En todo caso, la incorporación de grupos fenólicos a la resina le aporta un carácter ácido a la misma, el cual resulto ser de 8,4 mmol g-1 de resina modificada.
Los resultados del microanálisis elemental de la resina modificada (C = 74,19 %, H = 6,05 %) están de acuerdo con lo esperado según el proceso de funcionalización de la resina de Merrifield con quercetina. En este proceso se sustituye un ion cloruro por una molécula de quercetina más voluminosa y pesada. Por otra parte, la molécula de quercetina tiene 7 átomos de oxígeno en su composición, por lo tanto, las cantidades relativas de carbono e hidrógeno disminuyen con respecto a la resina original (C = 82,92 %, H = 6,92 %). Las cantidades relativas de nitrógeno están por debajo del límite de detección del equipo, lo que ofrece una medida de la eficiencia de los lavados realizados para eliminar la DMF utilizada como solvente de la reacción.
Caracterización espectroscópica y microscópica
Espectroscopia IR
En el espectro para la resina modificada (figura 3, b) se pueden apreciar las bandas correspondientes a las vibraciones de valencia de los enlaces O-H (3 380 cm-1), C=O (1 736 cm-1) y C-O (1 047 cm-1), de la quercetina incorporada covalentemente a la resina de Merrifield (figura 3, a). Por otra parte, la banda que aparece en 1 265 cm-1 en el espectro de la resina de Merrifieldy que se asigna a la vibración de doblaje C-Cl, desaparece después de la reacción, corroborando su funcionalización con quercetina.
Microscopia Electrónica de barrido
En la reacción de funcionalización de la resina de Merrifield se produce un intercambio neto de masa, correspondiente a la salida de un átomo de cloro y la entrada de un grupo de mayor masa molar y tamaño (quercetina), por lo que es de esperar un aumento del tamaño de las partículas y por consiguiente un cambio en la morfología de las mismas. La figura 4 muestra las micrografías obtenidas en las cuales se puede apreciar lo antes expuesto. La resina de Merrifield se presenta en forma de partículas esféricas de superficie casi homogénea. Después de su modificación las mismas adquieren una estructura amorfa con una superficie totalmente heterogénea.
Ensayos preliminares de la sorción de iones Pb (II) sobre la resina modificada mediante SOFS asistida por microondas
Capacidad estática en el equilibrio e influencia del pH
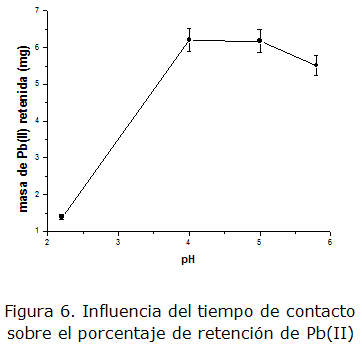
La figura 5 muestra el gráfico de masa de Pb (II) retenida vs pH en medio hidrogenoftalato. Como se puede observar, el intervalo de mayor retención está entre los pH 4 y 5, alcanzando una capacidad estática en el equilibrio de 620 mg (Pb)/g (resina) o 3 mmol (Pb)/g (resina). En el intervalo señalado se alcanza la mayor estabilidad del quelato formado. A pH inferiores existe una fuerte competencia del Pb(II) con los iones H3O+ por los sitios activos de la resina, mientras que a pH superiores pueden formarse hidroxocomplejos de Pb(II) estables, reduciendo la capacidad de los iones para la formación del quelato con los sitios activos de la resina.
La capacidad estática en el equilibrio encontrada para la resina modificada representa una relación Metal-Quercetina inmovilizada de 2,3:1. Esta relación es ligeramente mayor a la esperada (2:1) atendiendo a los posibles sitios de quelación de la quercetina. Este comportamiento puede explicarse en función de una posible interacción de algún grupo hidroxilo libre de la quercetina después de formar quelato, con iones Pb(II), reteniendo un pequeño exceso de los mismos.
Estudio del tiempo y porcentajes de retención y recuperación
Como se puede apreciar de la figura 6, la retención de los iones Pb(II) por la resina modificada ocurre en un alto porcentaje (97,9 ± 0,5 %) y en un tiempo menor de 30 segundos. Estos valores son superiores a los obtenidos porAbou-El-Sherbini, et al. para la retención de Mn(II), Co(II), Ni(II), Cu(II) y Zn(II) [9]. Los porcentajes de recuperación en medio HNO3 6 mol L-1 fueron de 100,4 ± 3,4 %.
CONCLUSIONES
En el trabajo se demostró que la reacción de inmovilización de la quercetina sobre resina de Merrifield, empleando síntesis orgánica en fase sólida asistida por microondas, posibilitó la obtención de un material altamente eficiente para la sorción de iones plomo, en un tiempo muy corto (10 min) y con elevado rendimiento. Los ensayos preliminares mostraron que la resina modificada posee buenas características como material sorbente de iones Pb (II), con una capacidad estática en el equilibrio de 620 mg/g; un tiempo para establecer el equilibrio inferior a los 30 segundos con porcentaje de retención alrededor del 98 % y recuperación entre el 95 y 105 %, utilizando HNO3 6 mol L-1 como eluyente. A pesar de que en nuestro trabajo se describen únicamente las mediciones para Pb (II), tanto la reacción de inmovilización como los estudios de sorción pueden aplicarse al análisis de otros iones metálicos. Los resultados presentados en este documento, sin duda, sientan las bases para futuros enfoques en el desarrollo de nuevos materiales sorbentes que permitan el monitoreo de iones metálicos en tiempo real.
REFERENCIAS BIBLIOGRÁFICAS
1. CASTILLO, M. et al. "Solid-Phase Organic Synthesis of Sensing Sorbent Materials for Copper and Lead Recovery". J. Mex. Chem. Soc. 2005, 49(2), 174-179. ISSN: 1678-4790
2. PINA LUIS, G.; ROSQUETE PINA, G. A. et al. "Morin functionalized Merrifield's resin: A new material for enrichment and sensing heavy metals". Reactive and Functional Polymers. 2012, 72(1), 61-68.ISSN:1381-5148
3. RAMÍREZ, A. V. et al. "El cuadro clínico de la intoxicación ocupacional por plomo". Anuario Facultad Medicina Lima. 2005, 66(1), 57-70. ISSN 1025-5583
4. SUNDD, S.; PRASAD, S. K. et al. "Chelating resin-impregnated paper chromatography, applications to trace element collection of ferrous and ferric ions, and determination by differential pulse anodic stripping voltammetry". Talanta. 1994, 41(11), 1943-1949.
5. ZHAO, X.; SONG, N. et al. "Preconcentration procedures for the determination of chromium using atomic spectrometric techniques: A review ". Central European Journal of Chemistry. 2012, 10(4), 1-11. ISSN: 1895-1066
6. KARTAL, S. et al. "Determination of Cd(II), Co(II), Cu(II), Ni(II), and Pb(II) Ions by FAAS after Separation/Preconcentration using Amberlite XAD-1180 Chelating Resin Chemically Modified with o Aminophenol". Separation Science and Technology. 2007, 42(14), 3199-3215. ISSN: 1520-5754
7. PYRZYNSKA, K.; PEKAL, A. "Flavonoids as Analytical Reagents". Critical Reviews in Analytical Chemistry, 2011, 41(4), 335-345. ISSN:1547-6510
8. CORNARD, J. P.; MERLIN, J. C. et al. "Structural study of quercetin by vibrational and electronic spectroscopies combined with semiempirical calculations". Biospectroscopy. 1997, 3(3), 183-193. ISSN:1520-6343
9. ABOU EL SHERBINI, K. S.; HASSANIEN, M. M. "Synthesis of controlled-pore silica glass functionalized with quercetin and its application for the separation and preconcentration of Mn(ll), Co(ll), Ni(ll), Cu(ll), and Zn(ll)". Separation Science and Technology. 2004, 39(5), 1177-1201. ISSN:1520-5754
10. ZAPOROZHETS, O. A. et al. "Quercetin immobilized on silica gel as a solid phase reagent for tin(IV) determination by using the sorption-spectroscopic method". Talanta. 2001, 55, 313-319. ISSN:0167-6369
11. ABOU EL SHERBINI, K. S. et al. "Selective Separation and Preconcentration of Total Tin Using Quercetin as Chelating Agent". Separation Science and Technology. 2007, 42(15), 3447-3463. ISSN:1520-5754
12. VALDÉS GONZALEZ A.; PINA LUIS, G. et al. "Parallel synthesis of polystyrene anchored imine sulfide materials: sorption and metal sensing studies". J. Mex. Chem. Soc. 2007, 51(2), 80-88. ISSN:1870-249X
13. AL OBEIDI, F. et al. "Microwave-Assisted Solid-phase Synthesis (MASS): Parallel and Combinatorial Chemical Library Synthesis". Mini Reviews in Medicinal Chemistry. 2003, 3(5), 449-460. ISSN:1389-5575
14. DE LA ROSA ROMO, L. M. et al. "Flavone functionalized magnetic nanoparticles: A new fluorescent sensor for Cu2+ ions with nanomolar detection limit". Sensors and Actuators B. 2016, 233, 459–468.
15. RAO, T. P. e t al. "Styrene–Divinyl Benzene Copolymers: Synthesis, Characterization, and Their Role in Inorganic Trace Analysis". Analytical Chemistry. 2004, 34, 177–193.ISSN:1547-6510.
Recibido: 29/10/2016
Aceptado: 7/02/2017
Dr.C. Markel Denet Luaces-Alberto, Universidad de la Habana, La Habana, Cuba, markel@fq.uh.cu