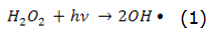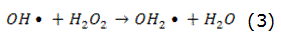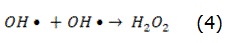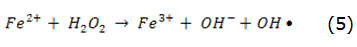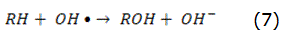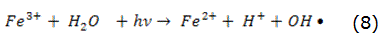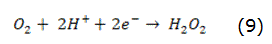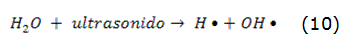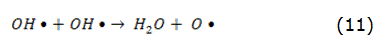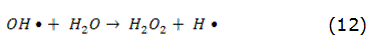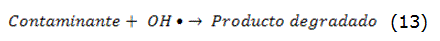Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.29 no.3 Santiago de Cuba set.-dic. 2017
ARTICULOS
El Estado actual y perspectivas de la degradación de pesticidas por procesos avanzados de oxidación
State of the art and perspectives of pesticides degradation by advanced oxidation processes
MSc. Germán Cruz-GonzálezI,II,III , Dr. C. Carine JulcourII,III, Dr .C. Ulises Jáuregui-HazaI
IInstituto Superior de Tecnologías y Ciencias Aplicadas, Universidad de La Habana, Cuba, ulises@instec.cu
IIUniversité de Toulouse, INPT, UPS, LGC, 4BP 84234, F-31432 Toulouse, France
IIICNRS, Laboratoire de Génie Chimique, BP 84234, F-31432 Toulouse, France
RESUMEN
La contaminación de las aguas superficiales y subterráneas con pesticidas es uno de los mayores problemas ambientales en un gran número de países, debido a la persistencia de estos contaminantes en medios acuáticos y su consecuente riesgo potencial a la salud humana y animal. Los Procesos Avanzados de Oxidación (PAOs) constituyen un importante y prometedor método para eliminar compuestos orgánicos persistentes presentes en aguas. Este artículo presenta un análisis bibliográfico de la utilización de los principales tipos de PAOs, basados en reacciones fotoquímicas, sonoquímicas, electroquímicas y su combinación con otros agentes oxidantes para el tratamiento de pesticidas y abarca el período 2010-2016. Se discute el grado de degradación de los pesticidas, la cinética de las reacciones, la identidad y características de los productos de degradación. Se analizan las principales tendencias en investigación en el tema y las perspectivas de trabajo, según la experiencia de los autores.
Palabras clave: pesticidas, procesos avanzados de oxidación, radical hidroxilo, degradación, tratamiento de aguas.
ABSTRACT
Pesticide pollution of surface water and groundwater has been recognized as a major problem in many countries because of the persistence of pollutants in aquatic environments and the consequent potential adverse health effects. Advanced oxidation processes (AOPs) constitute important, promising and efficient methods developed to remove persistent organic pollutants (POPs) from waters and wastewaters. This review presents a description of recent literature (period 2010-2016) concerning the main types of AOPs, based on photochemical, sonochemical, and electrochemical reactions, and its combination with different chemical oxidants. The degree of pesticide degradation, reaction kinetics, identity and characteristics of degradation by-products and intermediates, and possible degradation pathways are covered and discussed. The trends and perspectives of these studies were also analyzed.
Keywords: pesticides, advanced oxidation processes, hydroxyl radical, degradation, water treatment.
INTRODUCCIÓN
El desarrollo agrícola mundial que tuvo lugar en la segunda mitad del siglo XX llevó consigo la proliferación del uso de pesticidas para mejorar la calidad y cantidad de la producción agrícola a nivel mundial. Los pesticidas o plaguicidas son sustancias químicas destinadas a matar, repeler, atraer, regular o interrumpir el crecimiento de plagas (insectos, hongos, nemátodos, entre otros). Estos están divididos en grandes grupos dependiendo de su uso. Las categorías incluyen herbicidas, insecticidas, fungicidas, rodenticidas, nematicidas, microbiocidas, y reguladores del crecimiento de plantas e insectos. Debido a sus características químicas, los plaguicidas son contaminantes persistentes que resisten en grado variable la degradación fotoquímica, química y bioquímica, por lo que su vida media en el ambiente puede ser elevada [1, 2]. La aplicación de estos ha sido una práctica rutinaria en la agricultura en los últimos cincuenta años. El uso indiscriminado que en el pasado se ha dado a estos compuestos, conlleva a que en la actualidad se detecten residuos de ellos en el ambiente y se asocien con riesgo potencial a la salud humana y animal [3].
Actualmente los residuos de los plaguicidas han sido identificados en todos los compartimientos ambientales (aire, agua y suelo), en todas las regiones geográficas incluyendo aquellas muy remotas al sitio original de su liberación ambiental, como océanos, desiertos y zonas polares [4]. Igualmente, se ha demostrado su presencia en organismos de todos los niveles tróficos, desde el plancton hasta las ballenas y los animales del ártico. Estos compuestos se bioacumulan en numerosas especies y se han biomagnificado a través de todas las redes tróficas del mundo [4].
Los seres humanos no están exentos de esta contaminación y los plaguicidas se han podido identificar en diversos tejidos y secreciones humanas [5, 6]. De esta forma, el incremento en el uso de pesticidas ha dado lugar a una creciente preocupación sobre el efecto que dichas sustancias tienen sobre los ecosistemas, tanto acuáticos como terrestres. De hecho, distintos informes de las Naciones Unidas han indicado que, de todos los pesticidas usados en la agricultura, menos del 1 %, son incorporados a los cultivos. El resto termina contaminando la tierra, el aire y principalmente el agua. Como estos contaminantes son habitualmente no biodegradables y solo una pequeña cantidad de los residuos son tratados actualmente por la carencia de tecnologías de tratamiento disponibles in situ , existe un gran problema de acumulación de consecuencias no predecibles en un futuro cercano. A pesar de las características nocivas de estos compuestos, la venta de plaguicidas en todo el mundo aumenta sustancialmente todos los años, sobre todo en los países en desarrollo [7].
Varios tratamientos se han investigado con el fin de reducir las concentraciones de pesticidas en medios acuáticos y, de esta forma, minimizar los riesgos potenciales a la salud asociados a la exposición y el consumo de aguas contaminadas.
DESARROLLO
Clasificación de los pesticidas según su familia química
Los pesticidas, por su naturaleza química, se agrupan en distintas familias. Con el fin de facilitar la lectura de este trabajo, se organizan a continuación los pesticidas aquí estudiados clasificados en catorce familias:
1- Compuestos organoclorados: endosulfán, pentaclorofenol, metolachlor, heptacloro, 4-clorofenol, hexaclorohexanos, aldrín, dieldrín, endrina, dicofol, clorobenceno, diclorodifeniltricloroetano (DDT), ácido 2, 4 diclorofenoxiacético (2,4-D).
2- Triazinas y triazinonas: atrazine, simazine, terbutryn.
3- Sustitutos de Urea: diuron, isoproturon, linuron.
4- Ácidos ariloxialcanoicos: mecoprop-P.
5- Piridinas y pirimidinas: clopiralyd, imidacloprid (couraze), pirimetanil (Scala).
6- Tetroxocanos: metaldehído.
7- Hidroxibenzonitrilos: bromoxinil.
8- Derivados de la anilina: trifluralin, alaclor.
9- Neocotinoides: thiacloprid.
10- Carbamatos y tiocarbamatos: oxamil (vydate), carbofuran.
11- Compuestos organofosfatos: clorfenvinfós (CFVP), clorpirifós.
12- Piretroides: cipermetrina.
13- Uracil: bromacil.
14- Benzotiazinonas: bentazona.
Procesos avanzados de oxidación
El concepto de proceso avanzado de oxidación fue inicialmente establecido por Glaze et al. [8], quienes definieron los PAOs como procesos que involucran la generación y uso de especies transitorias poderosas, principalmente el radical hidroxilo (OH) con un potencial de oxidación de 2,80 eV [8]. Estos radicales son más potentes que los agentes químicos tradicionales y se caracterizan por su poca selectividad, lo que representa una ventaja para un oxidante que debe ser usado en el tratamiento de aguas residuales. La tabla 1 muestra un listado de los potenciales de oxidación en medio ácido de los principales oxidantes químicos, en la cual se aprecia el elevado poder de oxidación del radical hidroxilo con respecto a otros oxidantes [9, 10].
Estos radicales se pueden generar por vía fotoquímica (incluida la luz solar) o a través de otras formas de energía. Poseen alta efectividad para la oxidación de la materia orgánica. La descomposición de los contaminantes conlleva a la formación de dióxido de carbono, agua y compuestos inorgánicos, o al menos a su transformación en productos menos perjudiciales y más biodegradables. Estas nuevas tecnologías, cuando se aplican de la manera correcta, brindan la oportunidad de eliminar una gran cantidad de compuestos orgánicos refractarios [11, 12].
TABLA 1. POTENCIALES ESTÁNDAR DE OXIDACIÓN FRENTE AL ELECTRODO DE HIDRÓGENO
DE ALGUNOS OXIDANTES QUÍMICOS EN MEDIO ÁCIDO A 25 °C [9, 10]
| Oxidantes | Eº (V) |
| Fluoruro (F-) | 3,03 |
| Radical hidroxilo (OH) | 2,8 |
| Oxígeno molecular (O2) | 2,42 |
| Ozono (O3) | 2,07 |
| Peróxido de hidrógeno (H2O2) | 1,77 |
| Permanganato de potasio (K2MnO7) | 1,67 |
| Ácido hipobromoso (HBrO) | 1,59 |
| Dióxido de cloro (ClO2) | 1,5 |
| Ácido hipocloroso (HClO) | 1,49 |
| Cloro (Cl2) | 1,36 |
| Bromo (Br2) | 1,09 |
La versatilidad de los PAOs se debe a que existen diferentes formas de producir los radicales libres y puede escogerse cual utilizar, incluso una combinación de ellos, dependiendo de los requerimientos específicos de cada tratamiento. Una clasificación de estos procesos pudiera hacerse de la manera siguiente [13]:
Procesos homogéneos:
a) Sin aporte de energía externa:
• Ozonización en medio alcalino (O3/OH-)
• Ozonización con peróxido de hidrógeno (O3/H2O2) y (O3/H2O2/OH-)
• Oxidación con reactivo de Fenton (H2O2/Fe2+)
b) Con aporte de energía externa:
• Energía procedente de radiación ultravioleta (UV)
- Radiación UV en presencia de ozono (O3/UV)
- Radiación UV con peróxido de hidrógeno (H2O2/UV)
- Radiación UV en presencia de ozono y peróxido de hidrógeno (O3/H2O2/UV)
- Foto-Fenton (Fe2+/H2O2/UV)
• Energía procedente de ultrasonido
- US y Ozonización (O3/US)
- US y Peróxido de hidrógeno (H2O2/US)
- Sono-Fenton (Fe2+/H2O2/US)
• Electroquímica
- Oxidación electroquímica
- Oxidación anódica
- Electro-Fenton
Procesos heterogéneos:
• Ozonización catalítica (O3/catalizador)
• Ozonización fotocatalítica (O3/catalizador/UV)
• Fotocatálisis heterogénea (catalizador/UV)
Fotólisis y fotólisis con peróxido de hidrógeno
La fotólisis puede producirse de forma directa o indirecta [14]. En la fotólisis directa, una molécula absorbe la radiación solar disociándose en fragmentos más simples. En la fotólisis indirecta tienen lugar la formación de radicales libres altamente reactivos, por esta razón, en todo proceso en el que se emplee la radiación UV, la fotólisis puede tener lugar. La intensidad y la longitud de onda de la radiación o el rendimiento cuántico del compuesto que se pretende eliminar son factores que influyen en el rendimiento del proceso. Como fuente de radiación UV, habitualmente, se utilizan lámparas de vapor de mercurio [15]. El uso del H2O2 como agente oxidante combinado con el empleo de la radiación UV incrementa la eficiencia del proceso [16, 17], ya que con la fotólisis del H2O2 tiene lugar la formación de los radicales hidroxilos, reacción expresada por la ecuación (1), que en presencia de contaminantes orgánicos forma compuestos más simples, reacción expresada por la ecuación (2). También tienen lugar otras reacciones de propagación asociadas a este fenómeno. Las principales reacciones de este mecanismo vienen dadas por las ecuaciones (1)–(4):
En exceso de peróxido y con altas concentraciones de OH, tienen lugar reacciones competitivas que producen un efecto inhibitorio para la degradación. Los OH son susceptibles de recombinarse o de reaccionar de acuerdo con las ecuaciones (3) y (4).
Dentro de los estudios publicados con estos procesos se encuentra la degradación del endosulfan [18] y la atrazine [19] en medio acuoso a concentraciones iniciales de 1 y 350-1 500 mg.L-1 respectivamente. En ambos casos se estudió la degradación por fotólisis directa a 254 nm y mediante su combinación con diferentes tipos de peróxidos (H2O2, S2O82-, HSO5-), siendo el persulfato el más eficiente en ambos casos.
Por otra parte, Souza et al. [20] lograron eliminar concentraciones de 1 mg.L-1 de atrazine presentes en muestras de aguas residuales de plantas de tratamiento utilizando luz UV y H2O2. En esta investigación se observó un efecto negativo de la matriz natural estudiada al funcionar como captor de radicales. La atrazine fue también estudiada en combinación con el diuron, isoproturon y el fármaco diclofenaco, por Lekkerkerker-Teunissen et al. [21], utilizando como proceso la combinación UV/H2O2 en aguas superficiales, obteniendo degradaciones entre 30 y 90 % para todos los compuestos. En la investigación realizada por Semitsoglou-Tsiapou et al. [17] para los pesticidas mecoprop-P, clopiralyd y metaldehído [17] se observó cómo al intensificar el proceso de fotólisis con peróxido de hidrógeno la degradación de los mismos aumenta, obteniéndose en 1,6 horas de reacción un 99,6, 84 y 97 % de degradación respectivamente.
De igual forma, en un estudio realizado para el bromoxinil y el trifluralin [22] y el thiacloprid [23] se observó como la eficiencia de degradación de los pesticidas aumentaba al combinar la fotólisis con el peróxido de hidrógeno. Finalmente, se utilizó una lámpara de KrCl en el estudio del ácido 2,4-diclorofenoxiacético (2,4-D). En este estudio se observó que el 2,4-D se elimina más fácilmente cuando se encuentra en concentraciones bajas, y que la presencia de peróxido de hidrógeno mejora la eficiencia de degradación hasta alcanzar una concentración de peróxido de hidrógeno correspondiente a la relación másica H2O2:2,4-D de 2:1. Se determinaron también algunos de los productos de degradación, siendo los principales el 2,4-diclorofenol, el 4-clorofenol y el 2-chlorofenol [16].
Fotocatálisis heterogénea
A principio de los años ´70, Fujishima y Honda [24] mostraron por primera vez la descomposición fotoquímica del agua sin la utilización de electricidad utilizando TiO2. A partir de este descubrimiento surgieron un sin número de estudios [25-27] naciendo así un nuevo PAO basado en la fotocatálisis con semiconductores. Este PAO involucra la radiación UV y un catalizador semiconductor que pueda ser excitado fácilmente, formándose de esta forma sitios donadores y captores de electrones, dando lugar a la aparición de reacciones de oxidación-reducción. El catalizador ideal debería tener una alta estabilidad fotoquímica, con la habilidad de adsorber reactivos bajo una eficiente activación lumínica; ser barato y con una alta disponibilidad. El TiO2 ha sido uno de los catalizadores más comercializado con este fin debido a su relativa baja toxicidad, alta estabilidad fotoquímica, una excelente actividad, aceptable energía de banda y bajo costo [28, 29]. No obstante, un gran número de estudios con diferentes tipos de catalizadores se ha publicado [30, 31].
Varios pesticidas fueron estudiados en diferentes matrices (agua destilada, aguas superficiales y aguas subterráneas) mediante la fotocatálisis heterogénea con TiO2, con resultados similares en todas las matrices estudiadas: degradación insignificante del isoproturon, el alaclor, el pentaclorofenol y la atrazine con valores similares de degradación, mientras que el diuron y el CFVP fueron eliminados eficientemente [32]. En otro estudio, para la atrazine, CFVP, diuron, isoproturon y simazine, presentes en efluentes de una planta de tratamiento de residuales en concentraciones reales (ppb), en una planta piloto utilizando luz solar y TiO2, se determinó que al utilizar pequeñas cantidades del catalizador (20 mg.L-1) es necesario aumentar el diámetro del reactor para mejorar la eficiencia del tratamiento [33]. La degradación del alaclor, atrazine, simazine y terbutryn fue estudiada utilizando como catalizador el ZnO, con el que se obtuvo mejores resultados que con el convencional TiO2 [30]. Este mismo grupo de investigadores analizó la degradación del diuron y el isoproturon mediante el tratamiento fotocatalítico de varios catalizadores y demostraron que el poder catalítico aumentó de la siguiente forma: ZnS< WO3≈SnO2»TiO2<ZnO [31].
Por otro lado, la búsqueda de mejoras en los catalizadores convencionales ha logrado grandes avances. Un ejemplo de esto fue en la degradación del 2,4-D, con Ca–Ce–W–TiO2 [34] y Au/TiO2–CeO22 [35]. Para el caso del Ca–Ce–W–TiO2 se obtuvo un 100 % de eliminación del pesticida en 90 minutos, mientras que para los catalizadores comerciales TiO2 puro y TiO2 -Sigma esto ocurrió a los 150 y 240 minutos, respectivamente. Para el Au/TiO 2 –CeO 2 se observó un aumento de la degradación de la molécula de un 78 a 99 % y la mineralización de un 61 a 88 %. La importancia del tratamiento fotocatalítico como pretratamiento a los procesos biológicos fue analizado por Fourcade et al. [36] donde el diuron, isoproturon y el 2,4-D fueron eliminados totalmente entre las 3 y 5 horas utilizando tres lámparas UV, y TiO2 y SiO2 como catalizadores.
Por último, Affam et al. [37] estudiaron la combinación UV/TiO2 y su intensificación con H2O2, para el clorpirifós, la cipermetrina y el clorotalonil. En este análisis se pudo observar como al añadir el H2O2 algunos parámetros como la demanda química de oxígeno (DQO) y el carbono orgánico total (COT) disminuyeron variando la eficiencia de 25,95 y 8,45 % a 53,62 y 21,54 %, respectivamente.
Procesos Fenton
En los procesos Fenton, los radicales (OH) son generados por la descomposición catalítica del H2O2 usando como catalizador iones Fe2+ en medio ácido, a pH en el intervalo 2–4 [38-40].
Los conocidos ensayos de Henry J.H. Fenton a finales del siglo XIX demostraron que las soluciones de peróxido de hidrógeno y sales ferrosas eran capaces de oxidar los ácidos tartárico y málico, y otros compuestos orgánicos [41]. Más tarde, Haber y Weiss sugirieron que se formaba HO [42] por la reacción dada en la ecuación (5). Dichos radicales podían reaccionar luego por dos vías, la oxidación de Fe2+ (una reacción improductiva) y el ataque a la materia orgánica:
A pH menor que 3, la reacción es autocatalítica, ya que el Fe3+ descompone el H2O2 en O2 y H2O. El proceso es potencialmente útil para destruir contaminantes, ya que es muy efectivo para la generación de OH, pero un exceso de iones Fe2+, puede atraparlos, reacción representada por la ecuación (6), al igual que los halógenos, el mismo H2O2 o el radical perhidroxilo [42].
Dentro de las aplicaciones de este proceso en la eliminación de pesticidas se encuentran el estudio de Muñoz et al. [43] con 4-clorofenol a una concentración inicial 100 mgL-1, donde se obtuvo una degradación total y su conversión en CO2 y algunos ácidos de cadenas cortas. No obstante, se observó que cuando la concentración de H2O2 se encontraba por debajo de la cantidad estequiométrica, o se utilizaban pequeñas cantidades de Fe3+, el valor del carbono orgánico total analizado era significativamente mayor. De igual forma, Sanchis et al. [44] evaluaron la combinación de la reacción Fenton con la oxidación biológica para la degradación del diuron y la atrazine (27 mgL-1) y el alaclor (180 mg.L-1). Las dosis de H2O2 utilizadas variaron entre un 20 y un 100 % de la cantidad estequiométrica relacionada con la DQO inicial. Como resultado de este estudio, se obtuvo un incremento importante en la biodegradabilidad de los efluentes de alaclor y atrazine, trabajando a un 60 % de la estequiometría, mientras que para el caso del diuron solamente con un 40 % de la estequiometría se obtuvieron resultados similares.
En otro estudio llevado a cabo por Oliveira et al. [45] se fijaron las condiciones de la reacción Fenton en la degradación de CFVP, se evidenció el importante rol de la temperatura, entre 10 y 70 °C, donde el tiempo para la degradación total de la molécula disminuyó de 3 horas a solo 5 minutos y para el caso de la mineralización, después de 3 horas esta aumentó de un 5 % a un 35 %. Finalmente, la degradación del herbicida 2,4-D se estudió por el proceso Fenton heterogéneo utilizando como catalizador FeS. El herbicida se degrada eficientemente en un rango de pH entre 2,0 hasta 6,5, alcanzando la degradación total a pH 4,5 en un tiempo de 300 min y una mineralización de un 70,4 %. Como subproductos de degradación se identificaron el 2,4 -diclorofenol, la 2-clorohidroquinona, el 4,6-diclororesorcinol, la 2-clorobenzoquinona y un gran número de ácidos de cadenas cortas [46].
Procesos foto-Fenton
El proceso foto-Fenton, por su parte, consiste en una versión mejorada de la reacción Fenton con la presencia de radiación UV. En este proceso, la radiación UV incrementa la velocidad de formación de radicales OH y además mejora la regeneración del catalizador ferroso por la reducción de iones Fe3+ y la destrucción de complejos férricos (reacción dada por la ecuación 8), permitiendo de esta manera que el ciclo de reducción-oxidación continúe tanto tiempo como esté disponible el H2O2 en el medio reaccionante [47].
Una mezcla de tres pesticidas comerciales (Vydate, Couraze y Scala) utilizados comúnmente en la agricultura intensiva se trató por el proceso de foto-Fenton con luz solar en una planta piloto. Varios parámetros de operación fueron analizados en este estudio y como resultados principales se obtuvo que este tipo de plantas solares deben ser diseñadas para trabajar a temperaturas por debajo de los 45 °C para evitar pérdidas significativas de hierro y el peróxido de hidrógeno se debe añadir cuidadosamente para evitar un exceso continuo y un uso ineficiente [48]. Una combinación a escala piloto de foto-Fenton (9,4 mg.L-1 de Fe2+ y 72 mg.L-1 de H2O2) con luz solar y un sistema biológico se utilizó para la eliminación del diuron presente en soluciones reales y sintéticas, obteniéndose una mineralización de aproximadamente 80 % en ambos casos [49].
En otro estudio con efluentes de un tratamiento secundario de una planta de tratamiento de aguas residuales contaminadas también con diuron, las concentraciones de Fe2+ y H2O2 utilizadas fueron 5 mg.L-1 y 50 mg.L-1, respectivamente, obteniéndose una degradación del 97 % en 50 minutos [50]. Por su parte Luna et al. [8] estudiaron la influencia de varios parámetros como el pH, la concentración inicial de Fe2+ (1–2,5 mM) y la velocidad de adición de H2O2 (1,87–3,74 mmol min-1) en el proceso de foto-Fenton con luz solar, para una solución de 2,4-D y 2,4 diclorofenol. Los resultados revelaron que las varialbles Fe2+ y H2O2 jugaron un papel importante en la degradación de los contaminantes mientras que el pH no mostró ninguna influencia [51]. Por último, Nitoi et al. [52] utilizaron el proceso foto-Fenton para la eliminación del lindano, alcanzando una mineralización de un 95 % en dos horas de reacción.
Procesos electro-Fenton
El proceso de electro-Fenton (EF) no es más que la reacción Fenton asistida eléctricamente. En este proceso el reactivo de Fenton se añadió al reactor donde el ánodo es un electrodo inerte o puede llevarse a cabo mediante la electrogeneración catódica del peróxido de hidrógeno (reacción expresada en la ecuación 9) y la generación catalítica del Fe2+ proporcionado por un ánodo de hierro [53, 54].
La mineralización completa de la atrazine se obtuvo para el proceso EF utilizando un ánodo de diamante dopado con boro. Este resultado es superior a los obtenidos para la oxidación anódica utilizando este mismo electrodo o el proceso de EF con un ánodo de platino [55]. Un estudio similar fue realizado para esta misma molécula, comparando esta vez los resultados con el proceso de fotoelectro-Fenton (UV/EF). En esta ocasión el proceso más eficiente resultó ser el UV/EF [56]. Igualmente, Pipi et al. [57] demostraron la efectividad del proceso fotoelectro-Fenton (UV y solar) con respecto al proceso EF, para el diuron, obteniéndose para las mejores condiciones un 93 % de mineralización del compuesto en 360 minutos.
Por otra parte, en una comparación realizada entre los procesos foto-Fenton y EF para la mineralización del diuron se evidenció la superioridad del proceso foto-Fenton, no obstante, los autores demostraron las ventajas económicas que representa el proceso EF [58]. La degradación del herbicida 2,4-D se estudió por electrooxidación y EF utilizando una planta a escala piloto con una célula de diamante dopada con boro. La máxima degradación del herbicida se obtuvo para el proceso EF con un 83 % de mineralización en 120 minutos [59]. La factibilidad del catalizador Y-zeolita en el proceso de electro-Fenton heterogéneo se demostró en la eliminación de los pesticidas imidacloprid y clorpirifós [60]. En la degradación del clorobenceno por EF se optimizaron los parámetros: corriente aplicada y concentración del catalizador, donde se obtuvo para las mejores condiciones un 95 % de mineralización del pesticida en 4 horas de tratamiento [61].
Finalmente, Sedaghat et al. [62] investigaron la eficiencia de la degradación del imidacloprid (20 mg L-1) mediante los procesos EF y UV/EF, utilizando un electrodo de grafito, con una eficiencia de degradación de 59,23 y 80,49 % para el EF y el UV/EF respectivamente. En este estudio las condiciones fueron, pH de 2,8, concentración de Fe2+ de 0,36 mMy 0,15 M de Na2SO4, que se utilizó como electrolito.
Procesos basados en la ozonación
En el tratamiento de aguas el ozono es utilizado, ante todo, por su poder oxidante, que le confiere una importante reactividad frente a un gran número de compuestos orgánicos e inorgánicos. No obstante, en el año 1976 Hoigné y Bader [63] demostraron la existencia de dos vías principales de reacción del ozono, la vía molecular, donde el ozono reacciona directamente con la materia orgánica o inorgánica, siendo este un proceso lento y selectivo, y la vía indirecta, donde le ozono molecular se descompone en el agua produciendo radicales hidroxilo, que poseen una reactividad no selectiva mucho más potente que la del propio ozono. El mecanismo completo de la ozonación es complejo debido a que parámetros como el pH o la naturaleza de las moléculas a destruir se deben tener en cuenta para conocer la vía que será privilegiada [63]. Por otra parte, la utilización del ozono en combinación con otros agentes oxidantes como el H2O2, diversos catalizadores o con otros PAOs como la radiación UV han sido profundamente estudiadas con resultados prometedores.
En un estudio realizado en el 2010 se comparó la efectividad de varios procesos basados en la ozonación como O3, O3/H2O2, O3/TiO2 y O3/H2O2/TiO2 para el tratamiento de muestras reales obtenidas del río Ebro en España, las cuales contenían una mezcla de alaclor, aldrin, atrazine, CFVP, clorpirifós, DDT,dicofol, dieldrin, diuron, endrina, a-HCH, ß-HCH, lindano (γ-HCH), d-HCH, heptaclor, isoproturon, simazine, terbutryn, y trifluralin en concentraciones en el orden deng.L-1, determinándose que solo O3/H2O2/TiO2 fue superior al proceso de ozonación directa [64]. En el estudio de los subproductos de degradación del alaclor mediante los procesos de ozonación directa y O3/H2O2 se obtuvieron un gran número de moléculas complejas comunes a ambos tratamientos. Se observó una reducción de la toxicidad determinada con el test Daphnia Magna [65].
La eliminación de este contaminante fue evaluada también mediante la ozonación directa y catalítica, donde se obtuvieron resultados similiares de degradación para ambos procesos, sin embargo, la mineralización fue mejorada con la introducción del catalizador [66]. Con el objetivo de estudiar la influencia de la calidad del agua a tratar mediante la ozonación se utilizaron varios métodos de filtración por membranas (ultrafiltración, nano filtración y ósmosis inversa) como pretratamientos en la oxidación química de la atrazine. La eficiencia de la combinación de estos procesos con la ozonación resultó dependiente del pH y de la composición de la materia orgánica natural de las aguas a tratar [67].
La degradación de los pesticidas bromacil, bentazona, atrazine e isoproturon se estudió mediante los procesos O3/H2O2 y O3/H2O2/UV en una instalación piloto. Para una concentración de 6 ppm de peróxido de hidrógeno, 1,5 mg L-1 de ozono y una dosis de irradiación UV variable entre los 700 y 950 mJ cm-2 la degradación de los pesticidas siguió el orden siguiente: bromacil>bentazona>isoproturon>atrazine [68]. La ozonación catalítica de la atrazine y el metolachlor se estudiaron a escala piloto utilizando como catalizador nano fibras de carbono. En todos los casos la presencia del catalizador mejoró la eliminación de los pesticidas en comparación con la ozonación directa [69]. En otro estudio similar se obtuvo una mineralización mayor de la atrazine utilizando nanotubos de carbono como catalizadores [70].
En un estudio utilizando como catalizador carbones activados soportados con hierro y niquel se observaron, de igual forma, mejoras importantes en la eliminación del pesticida, con un 72 % de mineralización en una hora de reacción [71]. Por otra parte, la degradación del 2,4-D ha sido ampliamente estudiada mediante los procesos basados en la ozonación. En 2013, Gilliard et al. [72] estudiaron el efecto de la variación del pH inicial de la solución, en la degradación del 2,4-D con ozono y, a su vez compararon estos resultados con los obtenidos para la combinación del ozono con la luz ultravioleta. De este estudio se pudo concluir que los mejores resultados se obtuvieron para el mayor de los pH estudiados (pH 10), siendo estos incluso, superiores a los obtenidos para la combinación O3/UV. En otros estudios realizados con este mismo pesticida, se evidenció el papel positivo jugado por catalizadores como el Ni/TiO2 o el NiO2 [73, 74] al utilizarlos junto al ozono, con mejoras significativas en la degradación y la mineralización del mismo.
Procesos basados en el ultrasonido
Cuando una onda ultrasonora se propaga en un medio líquido, se produce el fenómeno de cavitación acústica, formándose burbujas de vapor o gas. Una vez que las burbujas de cavitación están formadas, ellas crecen, oscilan e implotan bajo la acción del campo ultrasonoro. El tiempo de vida de las burbujas de cavitación es del orden de los microsegundos y la implosión violenta de las mismas genera, de manera localizada y transitoria, altas temperaturas (5 000 °C en el interior de la burbuja), presiones (100 MPa) y la formación de especies altamente reactivas tales como los radicales hidroxilos (OH), los radicales hidroxiperoxilo (HO2) y el peróxido de hidrógeno (H2O2). Las reacciones representadas por las ecuaciones 10-13 muestran la sonólisis en solución acuosa y la subsecuente oxidación de contaminantes en presencia del US [75].
La técnica del ultrasonido (US) ha sido muy estudiada para el tratamiento de aguas contaminadas con pesticidas [76-85]. Dentro de estos estudios podemos encontrar la degradación del carbofuran [76] donde se estudió la influencia de la concentración inicial del pesticida y la dosificación del peróxido de hidrógeno y el hierro, para la sonólisis y la combinación US/Fenton. El proceso US/Fenton demostró ser más efectivo en la eliminación del contaminante que el US solo y el aumento de la concentración inicial del carbofuran conllevó a una disminución en su degradación. Por otra parte, la degradación del linuron por sono-fotodegradación (US/UV/Fe2+) mostró ser más eficiente que la obtenida por la sonólisis, donde para una frecuencia de 200 kHz y una potencia de 100 W la degradación del herbicida pasó de un 79 a un 100 % en solo 20 minutos, utilizando 1,2 mol.L-1 de Fe (II) y una intensidad luminosa de 20 mW.cm-2 [77]. Esta misma combinación (US/UV/Fe2+) fue utilizada en la degradación del isoproturon observándose el mismo comportamiento que en el caso anterior y un 100 % de degradación en una hora de reacción [78].
En una investigación realizada para el alaclor se determinó la influencia del pH, la adición de diferentes reactivos como el peróxido de hidrógeno, el tetracloruro de carbono, el reactivo de Fenton y bicarbonato de sodio sobre la degradación del mismo. Como resultados se obtuvo que las condiciones ácidas, así como la adición de los diferentes reactivos excepto el bicarbonato de sodio, debido al papel de captor de radicales del bicarbonato [79], favoreció la eliminación del contaminante. Este mismo comportamiento lo reportaron Wang et al. [80, 81] para el mismo contaminante, donde además se encontró que el aumento de la temperatura de reacción inhibe la degradación. Finalmente, Kidak et al. [82] determinaron los diferentes productos de degradación de la degradación sonoquímica del alaclor. Otras combinaciones muy estudiadas para la eliminación de compuestos orgánicos persistentes han sido la sonólisis con el ozono (US/O3) donde el US ayuda a la descomposición del ozono provocando una mayor producción de radicales hidroxilo y la sonólisis con la radiación UV (US/UV). Un ejemplo de la combinación (US/O3) fue la estudiada para la atrazine, donde se obtuvo un aumento de la degradación de un 78 % en 90 minutos para el US hasta un 100 % de degradación en solo 20 minutos para el US/O3 [83].
Por otra parte, la combinación US/UV fue efectiva con una mejora de la mineralización de la atrazine [84]. La sinergia de acoplamiento de los procesos US y fotofenton solar fue estudiada para la degradación del diuron en un reactor piloto, los resultados del acoplamiento beneficiaron tanto la degradación como la mineralización del pesticida, alcanzándose valores de sinergia de hasta 1,99 [85].
Tendencias y perspectivas
En esta revisión se evidencia el interés mundial por la búsqueda de nuevos métodos para la degradación de pesticidas con el fin de tratar aguas residuales o descontaminar aguas que los contienen. La amplia gama de pesticidas aquí presentados, pertenecientes a los grupos organoclorados (22 %), triazinas y triazinonas (21 %), sustitutos de urea (20 %), derivados de anilina (13 %), organofosfatos (7 %), piridinas y pirimidinas (3 %), carbamatos y tiocarbamatos (2 %), ácidos ariloxialcanoicos (1 %), tetroxocanos (1 %), hidroxibenzonitrilos (1 %), neocotinoides, piretroides (1 %), uracilos (1 %) y benzotiazinonas (1 %), son degradables por varios de los procesos avanzados de oxidación investigados por los diferentes autores en este período. En más del 90 % de las investigaciones incluidas en este artículo se obtiene un 100 % de degradación del pesticida objeto de estudio, lo que significa un gran avance para el tratamiento de aguas. Entre los tratamientos más encontrados en la etapa estudiada se encuentran la ozonación y el ultrasonido, representando estos dos prácticamente un 50 % de todos los trabajos analizados.
No obstante, la inmensa mayoría de estos estudios no incluyen un solo proceso, ya que la combinación de procesos (foto-Fenton, foto-US, foto-O3, US-Fenton, US-O3, foto-US-O3, electro-Fenton, foto-electro-Fenton), su intensificación con agentes oxidantes (H2O2, CCl4, S2O82-, HSO5-) y con catalizadores (TiO2, Au/TiO2, CeO2, SiO2, ZnS, ZnO) aumenta la degradación de los pesticidas, permite alcanzar una mayor mineralización y disminuye los tiempos de reacción. Los esfuerzos de los investigadores estuvieron orientados en gran medida a la optimización de los parámetros generales (pH, temperatura, concentración inicial del contaminante) y específicos de cada uno de los procesos. También se observó un interés creciente por la búsqueda y mejora de nuevos agentes oxidantes, catalizadores y ánodos.
En opinión de los autores existen varios aspectos a los que habrá que prestar atención en las investigaciones futuras relacionadas con este tema. Uno de estos puntos es la elucidación de los productos de degradación obtenidos y la toxicidad de los mismos. Solamente el 20 % de las investigaciones analizadas hace referencia a este tema, pues se ha evidenciado como en algunos casos los productos obtenidos al final del tratamiento poseen una mayor toxicidad que el compuesto de partida. La importancia de este aspecto tiene dos aristas, la posibilidad de disponer de manera segura las aguas tratadas o la opción de vincular los procesos avanzados de oxidación con otros métodos convencionales de tratamiento, como los procesos biológicos, siempre que se garantice la formación de productos biodegradables.
Otra cuestión poco presente, y de gran relevancia, lo constituye el análisis de sistemas con matrices reales y a bajas concentraciones de los contaminantes, pues estos aspectos acercan las investigaciones a las condiciones reales. Para ello un reto importante es el desarrollo y validación de técnicas analíticas que permitan trabajar en estas condiciones y que, sin duda, encarecen el proceso de investigación.
Especial atención habrá que prestar al escalado de los procesos. Un primer paso importante es que en el 7 % de los artículos publicados se abordan estudios de cambio de escala e ingenieriles. En nuestra opinión, entre los principales problemas que limitan la introducción de los PAOs a la práctica industrial se encuentra el hecho de tener que tratar grandes volúmenes de agua con bajas concentraciones de contaminante y el alto consumo de energía que demandan. Algunas opciones para resolver estos problemas podrían ser:
1- Combinar los PAOs con otros procesos como la absorción de los pesticidas en carbones activados u otros sorbentes con el fin de aumentar la concentración de los mismos y disminuir los volúmenes a tratar. Los PAOs se utilizarán entonces en circuitos cerrados de desorción-oxidación, similar a lo propuesto con el proceso AD-OX [86].
2- Priorizar los estudios con el empleo de la radiación solar como fuente renovable de energía. Esto implica la combinación de las investigaciones de degradación por PAOs con estudios de almacenamiento y conversión de la energía solar a energía eléctrica para garantizar la continuidad del proceso en los momentos de ausencia de luz solar, donde necesariamente habría que recurrir a la radiación UV artificial.
3- Como se mencionó anteriormente, los PAOs por sí solo no serán la alternativa más eficiente desde el punto de vista económico y tecnológico, por lo que deberán continuar los estudios de su uso como pre o post-tratamiento combinados con las tecnologías convencionales de tratamiento y descontaminación de aguas.
Por último, y como consecuencia de lo ya planteado, habrá que dedicar atención a la selección y estudio de los criterios energéticos y económicos que permiten la selección adecuada de los PAOs como procesos para la degradación de pesticidas y su combinación con otras tecnologías, que permitan una introducción de las investigaciones actuales a la práctica social, como vía de ayudar a resolver un importante problema ambiental.
CONCLUSIONES
Debido al auge de la actividad industrial y la agricultura a nivel mundial, el incremento de contaminantes persistentes como los pesticidas, en las fuentes de aguas se hace cada vez más crítico, de ahí la vital importancia del desarrollo de nuevos métodos capaces de eliminar estos compuestos de los cuerpos de aguas. Los Procesos Avanzados de Oxidación (PAOs) son una de las herramientas que han demostrado su eficiencia en esta importante tarea, surgiendo entonces un gran interés en la comunidad científica por su investigación y desarrollo. Los progresos obtenidos en el periodo 2010-2016 para diferentes PAOs como los foto-procesos (UV, UV/H2O2), la reacción Fenton y foto-Fenton, el electro-Fenton, la fotocatálisis heterogénea, los procesos basados en el ozono (O3, O3/H2O2, O3/UV, O3/UV/H2O2,O3/ catalizadores heterogéneos) y los procesos basados en el ultrasonido (US, US/H2O2, US/Fenton, US/UV, US/UV/Fe2+, US/O3) en la eliminación de una amplia gama de pesticidas fueron mostrados en este artículo. Todos los contaminantes estudiados son degradables, en diferente medida, por los diferentes PAOs analizados, llegando en algunos casos a obtenerse un 100 % de mineralización. Como mejores procesos podemos encontrar las combinaciones entre ellos (UV/Fenton, US/Fenton, US/UV, US/UV/Fe2+, US/O3, O3/UV) en todos los casos estas lograron una mayor mineralización en comparación a cada proceso de manera individual. No obstante, se identificaron un grupo de temas a los que prestar atención con el fin de acelerarla introducción de los PAOs a la práctica industrial: la identificación de los productos de degradación y su toxicidad; la combinación de los PAOs con otros procesos convencionales como etapa de pre o postratamiento; el papel de las matrices reales; acelerar los estudios de escalado y los criterios energéticos y económicos para el desarrollo de sistemas integrados de tratamiento y descontaminación de aguas con pesticidas.
REFERENCIAS BIBLIOGRÁFICAS
1. FENNER, K.; CANONICA, S.; WACKETT, L. P.; ELSNER, M. "Evaluating pesticide degradation in the environment: blind spots and emerging opportunities". Science. 2013, 341, 752-758.
2. GILL, H. K.; HARSH, G. "Pesticides: environmental impacts and management strategies. Pesticides: toxic aspects". InTech. 2014.
3. PAPADAKIS, E. N. et al. "A pesticide monitoring survey in rivers and lakes of northern Greece and its human and ecotoxicological risk assessment". Ecotoxicology and Environmental Safety. 2015, 116, 1–9.
4. ARROYAVE ROJAS, J. A.; GARCES GIRALDO, L. F.; CRUZ CASTELLANOS, A. F. "Fotodegradación del pesticida Mertect empleando fotofenton con lámpara de luz ultravioleta". Revista Lasallista de Investigacion. 2006, 3, 19-24.
5. GULDNER, L. et al. "Pesticide exposure of pregnant women in Guadeloupe: Ability of a food frequency questionnaire to estimate blood concentration of chlordecone". Environmental Research. 2010, 110(2), 146-151.
6. DALLAIRE, R. et al. "Cognitive, visual, and motor development of 7-month-old Guadeloupean infants exposed to chlordecone". Environmental Research. 2012, 118, 79–85.
7. ORGANIZACIÓN MUNDIAL DE LA SALUD (OMS), Investigación en Salud y Ambiente. XXXIII Reunión del Comité Asesor de Investigaciones en Salud de la Organización Panamericana de la Salud, OPS/CAIS/98.05, Caracas, Venezuela, 1998.
8. GLAZE, W. H. "Drinking water treatment with ozone". Environmental Science Technology. 1987, 3(21), 224-230.
9. LEGRINI, O.; OLIVEROS, E.; BRAUN, A. M. "Photochemical processes for water treatment". Chemical Reviews. 1993, 93, 671-698.
10. CRIADO, S. et al. "Oxidation of ophthalmic drugs photopromoted by inorganic radicals". Journal of Photochemistry and Photobiology A: Chemistry. 2012, 244, 32–37.
11. OLLER, I.; MALATO, S.; SÁNCHEZ, J. A. "Combination of advanced oxidation processes and biological treatments for wastewater decontamination". Science of the Total Environment. 2011, 409, 4141-4166.
12. BENÍTEZ, J. et al. "Comparison of different chemical oxidation treatments for the removal of selected pharmaceuticals in water matrices". Chemical Engineering Journal. 2011, 168, 1149–1156.
13. QUESADA PEÑATE, I. "Métodos no convencionales para el tratamiento de aguas contaminadas con productos farmacéuticos", Tesis doctoral, Université de Toulouse, France, 2009.
14. FATTA KASSINOS, D.; VASQUEZ, M. I.; KÜMMERER, K. "Transformation products of pharmaceuticals in surface waters and wastewater formed during photolysis and advanced oxidation processes – Degradation, elucidation of byproducts and assessment of their biological potency". Chemosphere. 2011, 85, 693–709.
15. OPPENLANDER, T. "Photochemical purification of water and air. Advanced oxidation processes (AOPs): principles, reaction mechanisms, reactor concepts", Wiley-VCH, Weinheim, Alemania. 2003.
16. MURCIA, M. D. et al. "Development of a kinetic model for the UV/H2O2 photodegradation of 2,4-dichlorophenoxiacetic acid". Chemical Engineering Journal. 2015, 266, 256-267.
17. SEMITSOGLOU TSIAPOU, S. et al. "Low pressure UV/H2O2 treatment for the degradation of the pesticides metaldehyde, clopyralid and mecoprop: Kinetics and reaction product formation". Water Research. 2016, 91, 285-294.
18. SHAH, N. S. et al. "Efficient removal of endosulfan from aqueous solution by UV-C/peroxides: a comparative study". Journal of Hazardous Materials. 2013, 263, 584–592.
19. KHAN, J. A. et al. "Kinetic and mechanism investigation on the photochemical degradation of atrazine with activated H2O2, S2O82-and HSO5-". Chemical Engineering Journal. 2014, 252, 393–403.
20. SOUZA, B. S. et al. "Photochemical oxidation of municipal secondary effluents at low H2O2 dosage: study of hydroxyl radical scavenging and process performance". Chemical Engineering Journal. 2014, 237, 268–276.
21. LEKKERKERKER TEUNISSEN, K. "Pilot plant results with three different types of UV lamps for advanced oxidation". Ozone Science and Engineering. 2013, 35, 38–48.
22. CHELME AYALA, P.; EL DIN, M. G.; SMITH, D. W. "Degradation of bromoxynil and trifluralin in natural water by direct photolysis and UV plus H2O2 advanced oxidation process". Water Research. 2010, 44, 2221–2228.
23. ABRAMOVIC, B. F.; BANIC, N. D.; SOJIC, D. V. "Degradation of thiacloprid in aqueous solution by UV and UV/H2O2 treatments". Chemosphere. 2010, 81, 114–119.
24. FUJISHIMA, A.; HONDA, K. "Electrochemical photolysis of water at a semiconductor electrode". Nature. 1972, 238, 37–38.
25. MILLS, A.; LE HUNTE, S. "An overview of semiconductor photocatalysis". Journal of Photochemistry and Photobiology A: Chemistry. 1997, 108(1), 1–35.
26. FUJISHIMA, A.; RAO, T. N.; TRYK, D. A. "Titanium dioxide photocatalysis". Journal of Photochemistry and Photobiology C: Photochemistry. 2000, 1(1), 1–21.
27. PELAEZ, M. et al. "A review on the visible light active titanium dioxide photocatalysts for environmental applications". Applied Catalysis B: Environmental. 2012, 125, 331–349.
28. HOFFMANN, M. R.; MARTIN, S. T.; CHOI, W.; BAHNEMANN, D. W. "Environmental applications of semiconductor photocatalysis". Chemical Reviews. 1995, 95, 69–96.
29. KABRA, K.; CHAUDHARY, R.; SAWHNEY, R. L. "Treatment of hazardous organic and inorganic compounds through aqueous-phase photocatalysis: a review". Industrial and Engineering Chemistry Research. 2004, 43, 7683–7696.
30. FENOLL, J. et al. "Semiconductor-sensitized photodegradation of s-triazine and chloroacetanilide herbicides in leaching water using TiO 2 and ZnO as catalyst under natural sunlight". Journal of Photochemistry and Photobiology A: Chemistry. 2012, 238, 81–87.
31. FENOLL, J. et al. "Photocatalytic transformation of sixteen substituted phenylurea herbicides in aqueous semiconductor suspensions: intermediates and degradation pathways". Journal of Hazardous Materials. 2013, 244, 370–379.
32. SANCHES, S.; BARRETO CRESPO, M. T.; PEREIRA, V. J. "Drinking water treatment of priority pesticides using low pressure UV photolysis and advanced oxidation processes". Water Research. 2010, 44, 1809–1818.
33. PRIETO RODRIGUEZ. et al. "Treatment of emerging contaminants in wastewater treatment plants (WWTP) effluents by solar photocatalysis using low TiO2 concentrations". Journal of Hazardous Materials. 2012, 211, 131–137.
34. AKPAN, U. G.; HAMEED, B. H. "Photocatalytic degradation of 2,4-dichlorophenoxyacetic acid by Ca–Ce–W–TiO2 composite photocatalyst". Chemical Engineering Journal. 2011, 173, 369– 375.
35. GUZMÁN, C. et al. "Degradation of the herbicide 2, 4-dichlorophenoxyacetic acid over Au/TiO2–CeO2 photocatalysts: effect of the CeO 2 content on the photoactivity". Catalysis Today. 2011, 166(1), 146-151.
36. FOURCADE, F. et al. "Relevance of photocatalysis prior to biological treatment of organic pollutantsselection criteria". Chemical Engineering and Technology. 2012, 35, 238–246.
37. AFFAM, A. C.; CHAUDHURI, M. "Degradation of pesticides chlorpyrifos, cypermethrin and chlorothalonil in aqueous solution by TiO2 photocatalysis". Journal of Environmental Management. 2013, 130, 160–165.
38. JIANG, W. et al. "Combined Fenton oxidation and biological activated carbon process for recycling of coking plant effluent". Journal of Hazardous Materials. 2011, 189, 308–314.
39. KARTHIKEYAN, S. et al. "Treatment of textile wastewater by homogeneous and heterogeneous Fenton oxidation processes". Desalination. 2011, 281, 438–445.
40. ORTÍZ DE LA PLATA, G. B.; ALFANO, O. M.; CASSANO, A. E. "2-Chlorophenol degradation via photo Fenton reaction employing zero valent iron nanoparticles". Journal of Photochemistry and Photobiology A: Chemistry. 2012, 233, 53–59.
41. DOMÈNECH, X.; JARDIM, W. F.; LITTER, M.I. "Procesos avanzados de oxidación para la eliminación de contaminantes". Eliminiación de Contaminantes por Fotocatálisis Heterogênea, 2001, 1.
42. ECKENFELDER, W. W.; BOWERS, A. R.; ROTH, J. A. "Chemical Oxidation: Technology for the Nineties", CRC Press, 1993.
43. MUÑOZ, M.; DE PEDRO, Z. M.; CASAS, J.A.; RODRIGUEZ, J. J. "Assessment of the generation of chlorinated byproducts upon Fenton-like oxidation of chlorophenols at different conditions". Journal of Hazardous Materials. 2011, 190, 993–1000.
44. SANCHIS, S. et al. "Coupling Fenton and biological oxidation for the removal of nitrochlorinated herbicides from water". Water Research. 2014, 49, 197–206.
45. OLIVEIRA, C.; ALVES, A.; MADEIRA, L. M. "Treatment of water networks (waters and deposits) contaminated with chlorfenvinphos by oxidation with Fenton's reagent". Chemical Engineering Journal. 2014, 241, 190–199.
46. CHEN, H. et al. "Heterogeneous Fenton-like catalytic degradation of 2,4-dichlorophenoxyacetic acid in water with FeS". Chemical Engineering Journal. 2015, 273, 481–489.
47. ZEPP, R. G.; FAUST, B. C.; HOIGNÉ, J. "Hydroxyl radical formation in aqueous reactions (pH 3–8) of iron(II) with hydrogen peroxide: The photo-Fenton reaction". Environmental Science and Technology. 1992, 26(2), 313–319.
48. ZAPATA, A. et al. "Evaluation of operating parameters involved in solar photo–Fenton treatment of wastewater: interdependence of initial pollutant concentration, temperature and iron concentration". Applied Catalysis B: Environmental. 2010, 97(1), 292–298.
49. MENDOZA MARIN, C.; OSORIO, P.; BENITEZ, N. "Decontamination of industrial wastewater from sugarcane crops by combining solar photo-Fenton and biological treatments". Journal of Hazardous Materials. 2010, 177, 851–855.
50. KLAMERTH, N.; MALATO, S.; AGUERA, A.; FERNANDEZ-ALBA, A. "Photo-Fenton and modified photo-Fenton at neutral pH for the treatment of emerging contaminants in wastewater treatment plant effluents: a comparison". Water Research. 2013, 47, 833–840.
51. LUNA, A. J. et al. "Photo-Fenton degradation of phenol, 2,4-dichlorophenoxyacetic acid and 2,4-dichlorophenol mixture in saline solution using a falling-film solar reactor". Environmental Technology. 2014, 35(3), 364–371.
52. NITOI, I.; ONCESCU, T.; OANCEA, P. "Mechanism and kinetic study for the degradation of lindane by photo-Fenton process". Journal of Industrial and Engineering Chemistry. 2013, 19(1), 305-309.
53. NIDHEESH, P. V.; GANDHIMATHI, R. "Trends in electro-Fenton process for water and wastewater treatment: an overview". Desalination. 2012, 299, 1–15.
54. SIRES, I.; BRILLAS, E. "Remediation of water pollution caused by pharmaceutical residues based on electrochemical separation and degradation technologies: A review". Environment International. 2012, 40(1), 212–229.
55. OTURAN, N.; BRILLAS, E.; OTURAN, M. A. "Unprecedented total mineralization of atrazine and cyanuric acid by anodic oxidation and electro-Fenton with a boron-doped diamond anode". Environmental Chemistry Letters. 2012, 10, 165–170.
56. BORRÁS, N.; OLIVER, R.; ARIAS, C. E. "Degradation of atrazine by electrochemical advanced oxidation processes using a boron-doped diamond anode". Journal of Physical Chemistry A. 2010, 114, 6613–6621.
57. PIPI, A. R. F.; SIRÉS, I.; DE ANDRADE, A. R.; BRILLAS, E. "Application of electrochemical advanced oxidation processes to the mineralization of the herbicide diuron". Chemosphere. 2014, 109, 49–55.
58. OTURAN, M. A. "Oxidative degradation of herbicide diuron in aqueous medium by Fenton's reaction based advanced oxidation processes". Chemical Engineering Journal. 2011, 171, 127–135.
59. GARCÍA, O. "Degradation of 2,4-Dichlorophenoxyacetic acid by electro-oxidation and electro-Fenton/BDD processes using a pre-pilot plant". Electrocatalysis. 2013, 4, 224–234.
60. IGLESIAS, O. "Heterogeneous electro-Fenton treatment: preparation, characterization and performance in groundwater pesticide removal". Journal of Industrial and Engineering Chemistry. 2015, 27, 276-282.
61. ZAZOU, H. "Mineralization of chlorobenzene in aqueous medium by anodic oxidation and electro-Fenton processes using Pt or BDD anode and carbon felt cathode". Journal of Electroanalytical Chemistry. 2016, 774, 22-30.
62. SEDAGHAT, M. "Electrochemical and photo-assisted electrochemical treatment of the pesticide imidacloprid in aqueous solution by the Fenton process: effect of operational parameters". Research on Chemical Intermediates. 2016, 42(2), 855-868.
63. HOIGNE, J.; BADER, H. "The role of hydroxyl radical reactions in ozonation processes in aqueous solutions". Water Research. 1976, 10(5), 377-386.
64. ORMAD, M. P. "Effect of application of ozone and ozone combined with hydrogen peroxide and titanium dioxide in the removal of pesticides from water". Ozone: Science and Engineering. 2010, 32, 25–32.
65. QIANG, Z.; LIU, C, DONG, B.; ZHANG, Y. "Degradation mechanism of alachlor during direct ozonation and O3/H2O2 advanced oxidation process". Chemosphere. 2010, 78, 517–526.
66. SANCHES, S. et al. "Removal of pesticides from water combining low pressure UV photolysis with nanofiltration". Separation and Purification Technolog. 2013, 115, 73–82.
67. LUIS, P.; SAQUIB, M.; VINCKIER, C.; VAN DER BRUGGEN, B. "Effect of membrane filtration on ozonation efficiency for removal of atrazine from surface water". Industrial and Engineering Chemistry Research. 2011, 5, 8686–8692.
68. LEKKERKERKER TEUNISSEN, K. "Serial ozone/peroxide/low pressure UV treatment for synergistic and effective organic micropollutant conversion". Separation and Purification Technology. 2012, 10, 22–29.
69. DERROUICHE, S. et al. "Process design for wastewater treatment: catalytic ozonation of organic pollutants". Water Science and Technology. 2013, 68, 1377–1383.
70. FAN, X. et al. "The role of multiwalled carbon nanotubes (MWCNTs) in the catalytic ozonation of atrazine". Chemical Engineering Journal. 2014, 241, 66–76.
71. LU, X. et al. "Catalytic ozonation of 2,4-dichlorophenoxyacetic acid over novel Fe–Ni/AC". RSC Advances. 2015, 5, 10537-10545.
72. GILLIARD, M. B.; MARTÍN, C. A.; CASSANO, A. E.; LOVATO, M. E. "Reaction Kinetic Model for 2, 4-dichlorophenoxyacetic acid decomposition in aqueous media including direct photolysis, direct ozonation, ultraviolet C, and pH enhancement". Industrial & Engineering Chemistry Research. 2013, 52(39), 14034-14048.
73. RODRÍGUEZ, J. L. et al. "Surface interactions and mechanistic studies of 2,4-dichlorophenoxyacetic acid degradation by catalytic ozonation in presence of Ni/TiO2". Chemical Engineering Journal. 2013, 222, 426–434.
74. RODRÍGUEZ, J. L. et al. "Reactivity of NiO for 2,4-D degradation with ozone: XPS studies". Journal of Hazardous Materials. 2013, 262, 472– 481.
75. QUESADA, I. et al. "Sonolysis of levodopa and paracetamol in aqueous solutions". UltrasonicsSonochemistry. 2009, 16, 610–616.
76. YING SHIH, M.; CHI FANGA, S.; JIH GAW, L. "Degradation of carbofuran in aqueous solution by ultrasound and Fenton processes: Effect of system parameters and kinetic study". Journal of Hazardous Materials. 2010, 178, 320–325.
77. KATSUMATA, H. et al. "Degradation of linuron by ultrasound combined with photo-Fenton treatment". Chemical Engineering Journal. 2011, 166, 468–473.
78. AZIZI, S.; SEHILI, T.; DJEBBAR, K. "Comparative study of degradation of isoproturon (3-(4-isopropylphenyl)-1,1dimethylurea) photoinduced by Fe (III) and Ee(III)-photoinduced sonochemical in aqueous solution". Sciences and Technologie A. 2014, 39, 31-39.
79. BAGAL, M. V.; GOGATE, P. R. "Sonochemical degradation of alachlor in the presence of process intensifying additives". Separation and Purification Technology. 2012, 90, 92–100.
80. WANG, C.; LIU, C. "Decontamination of alachlor herbicide wastewater by a continuous dosing mode ultrasound/Fe2+/H2O2 process". Journal of Environmental Sciences. 2014, 26, 1332–1339.
81. WANG, C.; LIU, Z. "Degradation of alachlor using an enhanced sono-Fenton process with efficient Fenton's reagent dosages". Journal of Environmental Science and Health Part B. 2015, 50(7), 504-513.
82. KIDAK, R.; DOGAN, S. "Degradation of trace concentrations of alachlor by medium frequency ultrasound". Chemical Engineering and Processing. 2015, 89, 19–27.
83. KIDAK, R.; DOGAN, S. "Degradation of atrazine by advanced oxidation processes. Sixteenth International Water Technology Conference, IWTC 16, Istanbul, Turkey, 2012.
84. XU, L. J.; CHU, W.; GRAHAM, N. "Atrazine degradation using chemical-free process of USUV: analysis of the micro-heterogeneous environments and the degradation mechanisms". Journal of Hazardous Materials. 2014, 275, 166-174.
85. PAPOUTSAKIS, S. et al. "Coupling between high-frequency ultrasound and solar photo-Fenton at pilot scale for the treatment of organic contaminants: An initial approach". Ultrasonics Sonochemistry. 2015, 22, 527-534.
86. QUESADA PEÑATE, I. et al. "Degradation of paracetamol by catalytic wet air oxidation and sequential adsorption-Catalytic wet air oxidation on activated carbons". Journal of Hazardous Materials. 221, 222, 131-138.
Recibido: 3/09/2016
Aceptado: 11/02/2017
Dr.C. Ulises Jáuregui-Haza, Instituto Superior de Tecnologías y Ciencias Aplicadas, Universidad de La Habana, Cuba, ulises@instec.cu