Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.30 no.1 Santiago de Cuba ene.-abr. 2018
ARTICULOS
Estudio cinético de la combustión de la cáscara de naranja
Kinetic study of orange peel combustion
Dra. C. Omaida. Quesada-GonzálezI, Lic. Félix Enrique Alfonso-MartínezI, Dr. C. Enelio Torres-GarcíaII, MSc. Manuel Ángel Cantos-MacíasIII, MSc. Juan Antonio-RevillaI
IFacultad de Ciencias Naturales y Exactas, Universidad de Oriente, Cuba, oquesada@uo.edu.cu
IIInstituto Mexicano del Petróleo, México
IIIFacultad de Ciencias Matemáticas, Físicas y Químicas, Universidad Técnica de Manabí, Ecuador
RESUMEN
Se realiza el estudio cinético de la combustión de la cáscara de naranja, a partir de resultados experimentales de análisis termogavimétrico (ATG). El mismo se efectúa combinando varias metodologías de cálculo: las ecuaciones de Coats (integral), Sharp y Achar (diferenciales) e isoconversión (Cinética libre). Al combinar dichas metodologías se logra resultados cinéticos más confiables, esencial para el tratamiento de materiales naturales. La combustión de la cáscara de naranja transcurre mediante modelos cinéticos D4-D2 para la deshidratación, la descomposición de la hemicelulosa y celulosa por el modelo difusivo D4 y para la lignina F1, en ambas velocidades de calentamiento. Los valores de la energía de activación se comportaron en un rango de valores entre 80-90 kJ/mol para isoconversión y 48-162 kJ/mol por ajuste de las funciones, lo que se justifica por la ocurrencia de reacciones simultáneas. Se demuestra la menor influencia de la velocidad de calentamiento en los resultados cinéticos precisados.
Palabras clave: cáscara de naranja, cinética, combustión.
ABSTRACT
The kinetic study of orange peel combustion has been conducted using experimental results of the termogravimetric analysis. This study made use of several equations: Coats (integral), Sharp y Achar (differentials) and Isoconversion (free kinetic). By means of the combination of these equations, the kinetic results for natural materials are more reliable. The final kinetic models are D4-D2 for dehydration, decompositions of hemicellulose and cellulose by D4, and F1 for lignin. The rank of energy activation ranges 80-90 kJ/mol (kinetic free) and 48-162 kJ/mol (model fitting method) because simultaneous reactions occur.
Keywords: orange peel, kinetics, combustion.
INTRODUCCIÓN
La cáscara de naranja es una biomasa constituida por material lignocelulósico. La misma se define como la materia orgánica originada en un proceso biológico, espontáneo o provocado, utilizable como fuente de energía [1]. Para su uso con estos fines, es necesario investigar los procesos de termoconversión que la hacen aprovechable, de ahí la importancia de abordar los aspectos cinéticos relacionados con estos procesos.
En los trabajos más recientes relacionados con cinética heterogénea, se aprecia una gran diversidad de maneras, modos, procedimientos, de abordar este estudio [2]. Esta diversidad está sustentada en la variedad de metodologías de cálculo a emplear, la influencia de las condiciones de registros y en las limitaciones de la tecnología utilizada, de modo tal que los resultados cinéticos no siempre son característicos de la reacción química objeto de estudio, por lo que en ocasiones se les llama parámetros operacionales [3].
Cuando hablamos de metodologías de cálculos, nos referimos al uso del método de ajuste de las funciones y/o de cinética libre. Para estos métodos, existe una gran cantidad de expresiones matemáticas que describen un procedimiento teórico-experimental específico, para llevar a cabo el estudio cinético de una reacción en particular. Dentro de los que se pueden hallar los métodos integrales, diferenciales y los de cinética libre que involucran dos, tres y n velocidades de calentamiento y los que presuponen un modelo cinético específico. Para el método de ajuste de las funciones es indispensable estudiar, cuando sea posible, la influencia de las condiciones de registro en las curvas térmicas y en el estudio cinético resultante del análisis de las mismas. De ahí la tendencia de abordar la cinética a diferentes velocidades de calentamiento y combinando varias expresiones matemáticas [4].
En lo relacionado con los métodos de cinética libre, su particularidad de determinar la dependencia de la Ea en función del grado de transformación, hacen de esta una técnica eficaz y versátil muy difundida en la literatura [5-7] y en el estudio de procesos de termodescomposición de diferentes biomasas [8-10]. Esta ventaja se puede convertir en ocasiones en una limitación, por la imposibilidad de determinar el modelo cinético. No obstante, cuando los valores de la Ea calculados por ambos métodos son similares, la combinación de los mismos elimina esta limitación [11-12].
MATERIALES Y MÉTODOS
Preparación de la biomasa
Las muestras son procedentes de las jugueras de Veracruz, la mayor zona de producción de cítricos de México. Como biomasa consideramos solo la cáscara del cítrico, con lo que damos valor agregado a un residuo y se disminuye el impacto ambiental.
Preparación la cáscara de naranja
La cáscara de naranja fue secada primeramente a temperatura ambiente, durante quince días. Luego se secó en un horno a 120 ºC en flujo de aire, por 24 h. Finalmente se trituró en un molino de bolas y fue tamizado hasta tamaño de partículas de 0,1 a 0,3 mm. El contenido de humedad determinado por ATG fue de 2,7 % a 100 ºC.
ATG-CDB
La combustión de la cáscara de naranja fue llevada a cabo en equipos simultáneos de ATG y CDB (NEZTZSCH STA 409 PC). Se partió de una masa inicial de 12 mg de muestra, la cual fue calentada desde temperatura ambiente hasta 700 ºC, a una velocidad de calentamiento de 5 y 10 ºC/min, usando una atmósfera de aire ultraseco (100 mL/min).
Metodología de Cálculo
La ecuación básica que define la velocidad de una reacción heterogénea (ver expresión 1):
Este modelo describe la dependencia de la velocidad de reacción con el grado de avance de la reacción y se presentan en la tabla 1 [13-14].
Cuando se emplean métodos no isotérmicos para el estudio cinético se introduce el término velocidad de calentamiento que no es más que la primera derivada de la temperatura respecto al tiempo [15].
En sistemas heterogéneos, la validez de la ecuación de Arrehenius está asociada a la interpretación física que le atribuimos a los valores experimentales de la energía de activación y el factor pre-exponencial. Nos encontramos entonces ante una ecuación de Arrhenius donde la energía de activación está directamente relacionada con la entalpía de activación y el factor pre-exponencial es la frecuencia de vibración de los átomos en la red cristalina [13].
TABLA 1. FUNCIONES DIFERENCIALES f(α) E INTEGRALES g(α) MÁS COMUNES UTILIZADAS
EN EL MÉTODO DE AJUSTE DE MODELOS

Método de ajuste de las funciones
Se basa en el ajuste por correlación estadística de una serie de modelos matemáticos (diferenciales o integrales) que describen a los mecanismos de reacción.
Consideraciones del método:
1. Asume como constantes al triplete cinético (E, Z y f(α)).
2. Determina el triplete cinético a partir de una sola velocidad de calentamiento.
3. Una simple velocidad calentamiento no es siempre suficiente para describir la cinética de las reacciones [16].
Para el estudio cinético se tomaron las ecuaciones de Coats-Redfern (método integral) y las ecuaciones de Sharp y Achar (método diferencial), combinando estos resultados con los obtenidos por el método de cinética libre.
Ecuación Integral
Método de Coats-Redfern
Integrando la ecuación (1) y aproximando la integral de temperatura (la cual no tiene solución exacta) mediante la serie asintótica y tomando hasta el primer término de la serie, al aplicar logaritmos y reordenar, para un programa de calentamiento no isotérmico, se tiene la expresión 2:
Graficando el miembro izquierdo con respecto a 1 000/T se obtiene E y Z de la pendiente y el intercepto respectivamente. El modelo se obtiene por el mejor ajuste linear [16].
Ecuaciones diferenciales
Estas son más empleadas cuando se puede medir directamente la velocidad del cambio de la propiedad física da/dt, que al tener solución exacta, brinda más confiabilidad en los resultados calculados.
Método de Achar o Método diferencial directo
A partir de la expresión (1) y al aplicar logaritmo natural y reordenarla se obtiene (3):
Al graficar en la expresión (3), el miembro izquierdo vs. 1 000/T para cada función f(α), el modelo que mejor describe la reacción es seleccionado a partir de los valores del coeficiente de regresión (r) y (Z). Entonces el valor de la pendiente estará relacionado con el término E/R y el intercepto permite calcular Z [17].
Método de Sharp
Se reordena la expresión (3) para obtener la (4):
Y al graficar el miembro izquierdo vs. 1 000/T para cada función f(α) se obtiene el triplete cinético.
Debe escogerse entre todos los posibles modelos el que mejor se ajuste a los datos experimentales, es decir que (r) se encuentre más cercano a 1, así como (Z) que debe estar entre 1011 y 1014. Aplicando estos formalismos, logramos que la cinética global de la reacción quede completamente especificada a partir del triplete: modelo de reacción y los parámetros de Arrhenius (Ea y Z) [16].
Método de isoconversión
A estos métodos se le denomina también cinética libre porque permiten precisar la dependencia de la energía de activación en función de alfa, sin determinar el modelo cinético que mejor se ajusta.
Para dos series de experimentos en puntos de isoconversión se obtiene la expresión (5) a partir de la ecuación (1):
Los valores de Ea calculados al aplicar este método permite tener un criterio de mayor fiabilidad que los determinados por ajuste de las funciones f(α); debido a que es posible describir el comportamiento energético durante el curso de la reacción, lo que elimina hasta cierto punto, el carácter aparente de dicho parámetro. La combinación de estos métodos puede resultar una herramienta útil en la evaluación cinética de un proceso, lo que facilita su comprensión y disminuye las inconsistencias antes mencionadas [17-19].
RESULTADOS Y DISCUSIÓN
Estudio cinético de la cáscara de naranja. Condiciones de registro
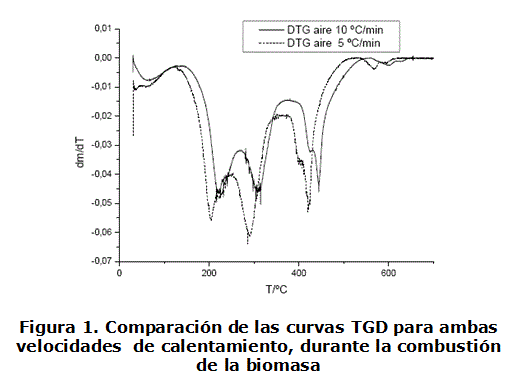
Tal como lo muestran las curvas TGD (figura 1), el cambio en la velocidad de calentamiento no provoca de forma general una variación en el comportamiento térmico de la muestra, en lo que respecta a las etapas de degradación de la cáscara. Estas han sido ampliamente estudiadas y se ha concluido que están relacionadas con la deshidratación de la biomasa y la descomposición de la hemicelulosa, celulosa y lignina, constituyentes principales de la biomasa [20]. No así en cuanto a sus intervalos, los que se desplazan ligeramente, como era de esperarse. Estas similitudes y diferencias argumentan la decisión de estudiar la cinética para cada una de las etapas.
Cinética de la deshidratación de la cáscara de naranja
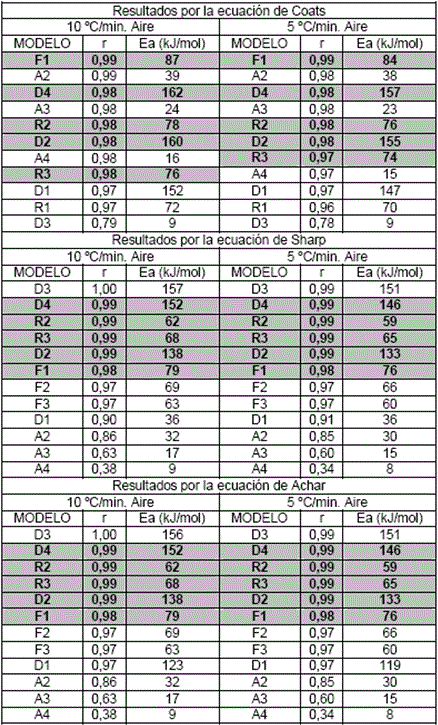
La tabla 2 muestra los resultados obtenidos para esta etapa, al aplicar el método de ajuste de las funciones a través de sus expresiones: integral (Coats) y diferenciales (Sharp y Achar) y dos velocidades de calentamiento.
TABLA 2. RESULTADOS CINÉTICOS DE LA DESHIDRATACIÓN DE LA BIOMASA, AL APLICAR
EL MÉTODO DE AJUSTE DE LAS FUNCIONES

Para esta etapa, de forma general se observa para las tres expresiones matemáticas y las dos velocidades de calentamiento, que los valores de (r) no son muy cercanos a uno, lo que demuestra la complejidad del proceso químico que tiene lugar. Además, se distingue el predominio de los procesos difusivos en esta etapa.
Del análisis de los resultados para la ß=10 ºC/min, se escogen los modelos D2 y D4 por ser los que más se repiten dentro de los probables, para las tres expresiones matemáticas. Se considera hasta Δr =0,06 para distinguir los modelos más probables, dentro de una misma expresión de cálculo. Vale resaltar que los valores de Ea calculados para cada uno de estos modelos son muy cercanos, entre 40-51 kJ/mol para las tres expresiones, lo que resulta característico de procesos difusivos. Este resultado demuestra las potencialidades de combinar las tres expresiones, pues de utilizar solo una de ellas tendríamos varios modelos cinéticos como posibles.
Para una ß=5 ºC/min, se escoge D4 por ser el que más se repite entre los más probables, para las tres expresiones matemáticas. Los valores de Ea calculados se encuentran entre (48-66 kJ/mol), característicos de procesos difusivos. Vuelve a resaltar las potencialidades de utilizar las tres expresiones matemáticas y que para ambas ß prevalecen los modelos difusivos, corrobora la no influencia de ésta en los resultados cinéticos obtenidos.
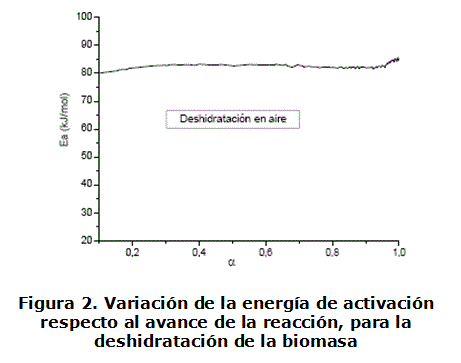
Los resultados precisados al aplicar el método de isoconversión, para esta etapa y ambas velocidades de calentamiento, se muestran en la figura 2. Los valores de Ea vs. a calculados, son algo superiores que los obtenidos por el método de ajuste de los modelos, aunque siguen correspondiendo a procesos difusivos. Es interesante la dependencia lineal observada, indicando que el requerimiento energético de la reacción para diferentes α, es similar. Esto apoya la idea de que en esta etapa ocurre fundamentalmente la reacción de deshidratación de la biomasa.
Cinética de la descomposición de la hemicelulosa
En los resultados cinéticos obtenidos durante la combustión de la hemicelulosa (tabla 3), resulta interesante que el orden de probabilidad de ocurrencia de los modelos cinéticos para las dos ß; en cada una de las expresiones matemáticas utilizadas, es el mismo.
TABLA 3. RESULTADOS CINÉTICOS DE LA COMBUSTIÓN DE LA HEMICELULOSA,
AL APLICAR EL MÉTODO DE AJUSTE DE LAS FUNCIONES
Además, a partir del criterio del Δr, varios modelos son probables para cada una de dichas expresiones (D4, D2, F1, R2 y R3), esto nos conduce a considerar la complejidad del proceso químico y vuelve a corroborar la no influencia de la ß en los resultados cinéticos, por lo que no vamos a distinguir este aspecto en el análisis.
Al comparar los resultados obtenidos para las tres expresiones matemáticas, salta a la vista la gran similitud entre los coeficientes de correlación (muy cercanos a uno) para varios modelos cinéticos estudiados, lo que demuestra la inconsistencia del método de ajuste de las funciones, para discriminar el modelo cinético. Esto pudiera explicarse porque tienen lugar varias reacciones simultáneas, con velocidades de transformación muy parecidas, que impiden que predomine la cinética de una de ellas en particular. Sin embargo, los altos valores de r alcanzados para los modelos más probables, nos guían a pensar que esta diversidad está enmarcada dentro de un todo, que sería la degradación de la hemicelulosa. El poder precisar un intervalo de temperatura único (123-280 °C) de esta etapa, para todas las curvas térmicas estudiadas, demuestra también el predominio de esta reacción.
Al escoger el modelo cinético que más se repite entre los más probables, pudiera proponerse el D4; porque se encuentra entre los tres primeros para las expresiones matemáticas utilizadas. Aunque no excluimos que pudieran coexistir otros modelos. Los valores de Ea calculados por el método de ajuste (146-161 kJ/mol) son altos para procesos difusivos, pero esperables si más de una reacción está teniendo lugar. De no haber aplicado la metodología teórico-experimental propuesta, hubiera sido imposible escoger un único modelo cinético.
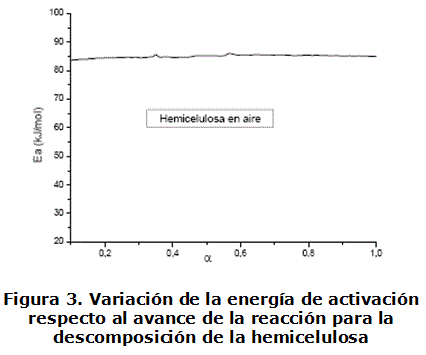
Los valores de Ea calculados por isoconversión y reflejados en la figura 3 se encuentran en un intervalo entre 83-85 kJ/mol, que coinciden con los obtenidos para la etapa anterior. Estos valores de Ea son diferentes a los obtenidos por el método de ajuste de las funciones. Sin embargo, es conocido que por este último método, el valor de Ea es global; a diferencia de isoconversión que permiten determinar la dependencia de Ea vs. α por lo que sus resultados se consideran más representativos del proceso que tiene lugar.
Cinética de la descomposición de la celulosa
Los resultados cinéticos obtenidos durante la combustión de la celulosa para las dos velocidades de calentamiento y las tres expresiones matemáticas son mostrados en la tabla 4.
TABLA 4. RESULTADOS CINÉTICOS DE LA COMBUSTIÓN DE LA CELULOSA, AL APLICAR EL MÉTODO DE AJUSTE

De forma general, para ambas ß, no se logran valores de r muy cercanos a uno, que corrobora que varias reacciones químicas pueden tener lugar, lo que hace más complejo el estudio cinético. Además, vuelve a demostrarse la inconsistencia del método de ajuste de las funciones para seleccionar el triplete cinético. Sin embargo, para la ß=10 °C/min a partir de los criterios aplicados se escoge D4 por ser el que más se repite entre los más probables, con valores de Ea entre 131-181 kJ/mol. Le sigue en probabilidad el modelo F1 con valores de Ea entre 74-112 kJ/mol. Para ß=5 °C/min vuelve a ser el modelo D4 el que más se repite entre los más probables, con valores de Ea 116-162 kJ/mol. Le sigue en probabilidad el modelo F1 con valores de Ea entre 65-99 kJ/mol.
Al aplicar el método de isoconversión, cuyos resultados se presentan en la figura 4, los valores de Ea se encuentran entre 85-90 kJ/mol. Llama la atención la similitud de estos valores para todas las etapas involucradas en la transformación del material.
Cinética de la descomposición de la lignina
En la tabla 5 se muestran los resultados cinéticos de esta etapa. Durante la combustión de la lignina a una ß=10 ºC/min, se escoge el modelo F1 como el posible, por ser el que se repite con mayor frecuencia entre los más probables, para las tres expresiones matemáticas estudiadas. Los valores de Ea del modelo escogido se encuentran entre 91-124 kJ/mol. Al aplicar el mismo criterio de selección para la ß=5 ºC/min, se obtiene el mismo modelo con valores de Ea entre 83-128 kJ/mol. Vale destacar las ventajas de aplicar la metodología propuesta.
Los valores de Ea calculados por el método de isoconversión (ver figura 5) se hallan en el intervalo de 88-90 kJ/mol, los cuales son consistentes con los valores obtenidos por el método de ajuste para las expresiones de Sharp y Achar.
TABLA 5. RESULTADOS CINÉTICOS DE LA COMBUSTIÓN DE LA LIGNINA, AL APLICAR
EL MÉTODO DE AJUSTE DE LAS FUNCIONES

En la tabla 6 se resume los resultados cinéticos precisados en este trabajo. Se muestra que los modelos D4, D2 y F1 se ajustan mejor a los resultados experimentales, para cada una de las etapas estudiadas durante la combustión de la cáscara de naranja. La similitud entre ellos para ambas velocidades de calentamiento, en las etapas estudiadas, permite concluir que la velocidad de calentamiento no influye en la cinética del proceso. Durante la degradación de la biomasa en atmósfera de aire se determina que los procesos difusivos predominan en las tres primeras etapas. En el caso de la degradación de la lignina predomina el modelo F1, lo que resulta comprensible si consideramos que en esta etapa los procesos difusivos son menos marcados, porque la biomasa se ha degradado casi totalmente.
En cuanto a los valores de Ea calculados por el método de isoconversión, vale destacar la gran similitud entre los mismos (81-90 kJ/mol). Lo que contrarresta con los calculados por el método de ajuste que están más dispersos. El significado físico de los modelos D4 y D2 es una difusión tridimensional con simetría esférica y bidimensional con simetría cilíndrica, respectivamente. El modelo F1 representa una cinética de primer orden con n=1.
TABLA 6. RESUMEN DE LOS RESULTADOS CINÉTICOS OBTENIDOS PARA AMBAS ATMÓSFERAS,
VELOCIDADES DE CALENTAMIENTO Y MÉTODO DE AJUSTE DE LAS FUNCIONES E ISOCONVERSIÓN
| ETAPAS | Atmósfera de AIRE (combustión) | ||||
| 10 ºC/min | 5 ºC/min | Isoconversión | |||
| Modelo | Ea (kJ/mol) | Modelo | Ea (kJ/mol) | ||
| Deshidratación | D4 | 48-49 | D4 | 48-66 | 80-85 |
| D2 | 44-51 | ||||
| Hemicelulosa | D4 | 152-162 | D4 | 146-157 | 83-85 |
| Celulosa | D4 | 131-181 | D4 | 116-162 | 85-90 |
| Lignina | F1 | 91-124 | F1 | 83-128 | 88-90 |
Por último, el disponer de varios registros de un mismo proceso, posibilita aplicar los métodos de cinética libre (método de isoconversión) muy útiles y eficaces en la determinación de la dependencia de Ea vs. α. Esta metodología teórico-experimental podría incluir el uso de equipos modernos que de alguna forma tratan de disminuir la influencia de parámetros experimentales y que deben ser utilizados en trabajos futuros.
CONCLUSIONES
La combinación de los métodos de ajuste de las funciones (diferenciales e integrales) con los de cinética libre, permitió estudiar la cinética del proceso de oxidación de la cáscara de naranja, lo que aportó riqueza, precisión al análisis y contrarrestó la inconsistencia del método de ajuste de las funciones. La deshidratación de la biomasa está determinada por procesos D4-D2 con valores de Ea entre 44-51 kJ/mol característicos de procesos difusivos. Las etapas de degradación de la hemicelulosa y celulosa están determinadas por un modelo D4, con Ea entre 116-162 kJ/mol y la lignina por un modelo F1 con Ea entre 83-128 kJ/mol. Los valores de Ea por isoconversión oscilan entre 80-90 kJ/mol para las cuatro etapas, lo que verifica la mayor exactitud de este método.
REFERENCIAS BIBLIOGRÁFICAS
1. NOGUÉS SEBASTIAN, F. Energías Renovables. Energía de la biomasa. Volumen1. España: Editorial Prensas Universitarias de Zaragoza, 2010. ISBN 978-84-92774-91-3.
2. TORRES GARCÍA, E. et al. "Thermal decomposition kinetics of MgAl layered double hydroxides". Materials Chemistry and Physics. 2012, 133, 621–629.
3. TORRES, GARCÍA, E. et al. "Structural and thermal study of calcium undecanoate". Journal of Solid State Chemistry. 2003, 172, 471–479.
4. LIU, Y. et al. "The decomposition of Co(NIA)2(H2O)4 in nitrogen atmosphere". Thermochimica Acta. 2005, 433, 101-112.
5. KHAWAM, A.; FLANAGAN, D. R. "Role of isoconversional methods in varying activations energies of solid state kinetics II. Non issotermal kinetics studies". Termochimica Acta. 2005, 436, 170–172.
6. ALEMAN, L. O.; TORRES GARCÍA, E.; RODRÍGUEZ GATTORNO, G. "Oxidation process of MoO X Cy to MoC: kinetics and mechanism". Journal of Solid State Chemistry. 2004, 177, 3281–3289.
7. ARIAS, A. Análisis térmico diferencial y otras técnicas termoanalíticas. 1ra Edición. La Habana: Editorial Científico-Técnica, 1985.
8. MELGAR, A.; BORGE, D.; PÉREZ, J. F. "Estudio cinético del proceso de devolatilización de biomasa lignocelulósica mediante análisis termogravimétrico para tamaños de partícula de 2 a 19 mm". Dyna. 2008, 75, 123-131. ISSN 0012-7353.
9. ACELAS SOTO, N.; RUÍZ MACHADO, W.; LÓPEZ LÓPEZ, D. "Determinación de los parámetros cinéticos en la pirólisis del pino ciprés". Quim. Nova. 2010, 33(7), 1500-1505.
10. CANTOS MACÍAS, M. A.; QUESADA GONZÁLEZ, O.; RODRÍGUEZ MCFARLANES, R.; BRITO SOUBANELL, A. L.; CASANOVA GÓMEZIV, A. "Guachapelí contra Marabú y la cinética de sus pirolisis". Rev. Cubana Quím. 2017, 29(3), 362-378. ISSN: 2224-5421.
11. CRIADO, J.; ORTEGA, A.; PÉREZ, L. "The use of master for discriminating the kinetics model of solid state reactions from a si ngle constant-rate thermal analysis (CRTA) experiment". Thermochimica Acta. 1996, 277, 165-173.
12. WORZAKOWSKA, M.; TORRES GARCIA, E. "Thermo-oxidative-kinetic study of cinnamyl diesters". Thermochimica Acta. 2015, 604, 94-105.
13. GALWEY, A.; BROWN, M. "Application of the Arrenius equation to solid state kinetics: can this be justified?". Termochimica Acta. 2002, 386, 91-98.
14. VYAZOVKIN, S.; CHEN, K. "Increase in effective activation energy during physical aging of a glass". Chemical Physics Letters. 2007, 448, 203-207.
15. ROUQUEROL, J. Sample Controlled thermal Analysis. 1ra Edición. Francia: Kluwer, Academic Press, 2003.
16. HAINES, P. I. "Thermal Methods of Analysis. Principles, Applications and Problems". 1ra Edición. Great Britain: Editorial Backie Academic and Professional Publishing, 1995.
17. VYAZOVKIN, S. et al. "ICTAC Kinetics Committee recommendations for performing kinetic computations on thermal analysis data". Thermochimica Acta. 2011, 520, 1-19.
18. TORRES, E. et al. "Thermal evolution of microporous nitroprussides on their dehydration process". Journal of thermal analysis and calorimetry. 2006, 86(2), 371-377.
19. VYAZOVKIN, S. et al. "ICTAC Kinetics Committee recommendations for collecting experimental thermal analysis data for kinetic computations". Thermochimica Acta. 2014, 590, 1-12.
20. QUESADA GONZÁLEZ, O.; TORRES GARCÍA, E.; ALFONSO MARTÍNEZ, F. E. "Estudio de la degradación térmica del residuo de la naranja". Revista Cubana de Química. 2011, 23(1), 25-33.
Recibido: 9/02/2017
Aceptado: 4/09/2017
Dra. C. Omaida. Quesada-González, Facultad de Ciencias Naturales y Exactas, Universidad de Oriente, Cuba, oquesada@uo.edu.cu