Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Química
versão On-line ISSN 2224-5421
Rev Cub Quim vol.30 no.2 Santiago de Cuba maio.-ago. 2018
ARTICULOS
Aislamiento e identificación de compuestos esteroidales de los frutos del Solanum jamaicense Mill
Isolation and identification of steroidal compounds from fruit of Solanum jamaicense Mill.
Dr. C. Anselmo Enrique Ferrer-HernandezI; Lic. Eliane Ferreira-CoelhoI; Lic. Faiane Tenório-FeitosaII; Lic. Karina Santana-BritoII; Lic. Maria Eunice Aiardes-FerrerIII
ILaboratório de Productos Naturales, (L.P.Q. P. N), Universidad Federal de Rondônia, UNIR, Rondônia, Brasil, ansenrique@yahoo.es
IIFacultad São Lucas, Rondônia, Brasil
IIIFio Cruz Mato Grosso do Sul /Fio Cruz Rondônia, Universidad Federal de Rondônia, Rondônia, Brasil
RESUMEN
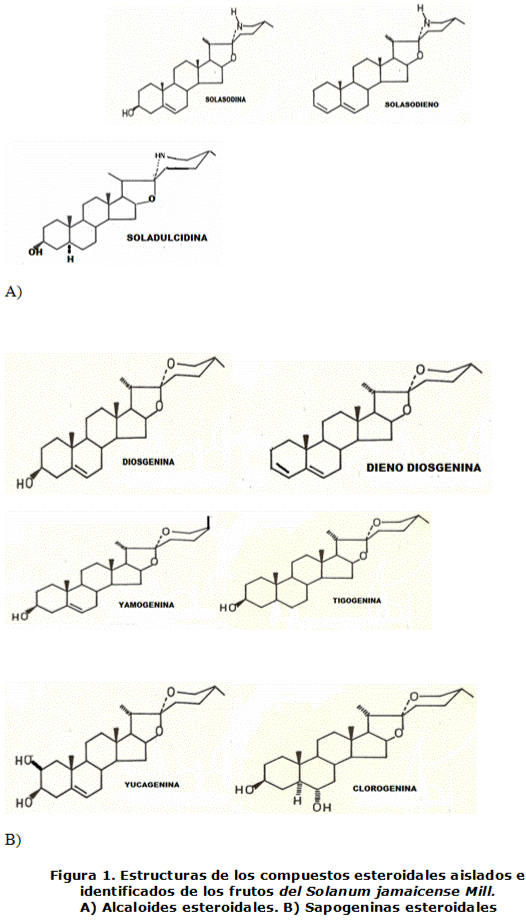
De los frutos de Solanum jamaicense Mill. fueron aislados e identificados nueve compuestos esteroidales, por medio de cromatografía de capa delgada y espectroscopia RMN H1 y RMN C13. Los compuestos identificados son: Solasodina, Solasodieno, Diosgenina, Dieno Diosgenina, Yucagenina, Yamogenina, Tigogenina, Soladulcidina y Clorogenina.
Palabras clave: CMC, celulosa, extracción alcalina, Jacinto de agua, Eichhornia crassipes.
ABSTRACT
The fruits of Solanumjamaicense Mill were isolated and identified nine steroidal compounds, through chromatographic and spectroscopic studies of H-NMR and C13- NMR. The identified compounds are Solasodine, Solasodieno, Diosgenin, Diene Diosgenin, Yucagenin, Yamogenin, Tigogenin, Soladuldicin and Clorogenin.
Keywords: Solanaceae, Solanum jamaicense Mill, steroidal compounds.
INTRODUCCIÓN
La familia Solanaceae es constituida por cerca de 3 000 especies, distribuidas en 96 géneros con distribución cosmopolita, siendo la América del Sur uno de los principales centros endémicos y de mayor diversidad. El género Solanum es el mayor de la familia Solanaceae, con aproximadamente 1 400 especies y 5 000 epítetos descritos [1]. En la región Nordeste de Brasil existen, aproximadamente, 20 especies endémicas de la misma [2].
Las especiesde este género pueden ser hierbas o arbustos, muchas de las cuales son comúnmente conocidas como "Jurubebas" y utilizadas en la medicina popular, especialmente como tónico y diurético [3].
El Solanum jamaicense Mill, es una mala hierba exótica, de pastos y pastizales y nativa del Caribe, América Central y América del Sur (tropical) [4]. La planta está registrada como invasora de Categoría II por Florida Exotic Pest Plant Council (Consejo de Plagas Vegetales Exóticas de la Florida) [5], y fue identificada en la Florida desde 1930, cuando se identificó esta especie cerca de Saint Cloud en Osceola Co [6]. La misma es generalmente encontrada en ambientes húmedos o sombreados y se encuentra predominantemente en Brasil en los estados del Norte, entre ellos Maranhão e Pará.
Esta especie fue estudiada por Lima [7] logrando aislar e identificar los siguientes compuestos: Diosgenina, Tigogenina, Solasodina, Solasodieno, Soladulcidina, Gitogenina y la Isocaelagenina, una sapogenina esteroidal.
Parte experimental
MATERIALES Y MÉTODOS
La colecta del material vegetal fue realizada en zona rural del municipio de Candelas do Jamari, Rondônia, Brasil, en febrero de 2011, cerca de la extensión 55 B de la carretera Balneario Rio Preto. Tras la identificación botánica de la planta esto siguió el proceso habitual de incorporación a la colección del Herbario Dr. Ary Pinheiro Penna Tupinambá de la Facultad San Lucas (HFSL), con número de registro 005182 y 6230.
Los frutos de esta especia fueron secados en una estufa eléctrica Marca Electro Termal, a temperaturas entre (40 – 50) °C, durante unas 48 h y después fue triturado en un molino Marca Marconia un polvo fino y homogéneo. La muestra de material vegetal triturado (fruto) se pesa en balanza monoplato marca Marconi y se coloca en un filtro de celulosa porosa o papel. El filtro se coloca en la cámara de extracción del aparato de Soxhletmarca MOGI GLAS, de un litro de capacidad, y fue calentado con una manta de calentamiento ELETRO – TERMAL por espacio de 4 h. Luego se concentran los extractos hasta un jarabe, en un equipo a presión reducida MOGIS GLAS de destilación, utilizando una bomba de vacío de la marca MARCONI, con control de la presión a 0,5 mm de mercurio.
En la tabla 1 se muestran los resultados obtenidos del proceso de preparación del material vegetal de los frutos del Solanum jamaicense Mill.
TABLA 1. RESULTADO DEL PROCESO DE PREPARACIÓN DEL MATERIAL VEGETAL DE Solanum jamaicense Mill
| Solanum jamaicense Mill | |||
| Órgano estudiado | Masa del material vegetal fresco (g) | Masa del material vegetal seco (g) | Masa total del Crudo (g) |
| Frutos | 147,80 | 34,00 | 5,16 |
La hidrólisis ácida de los extractos se llevó a cabo utilizando el siguiente procedimiento: se prepara una disolución de ácido clorhídrico con concentración de 1,5 Mol/L. La solución ácida se calienta a reflujo durante 3 h alcanzando ebullición. Después de este tiempo, la solución de hidrólisis se adiciona sobre una mezcla de hielo y agua y se alcaliniza con hidróxido de amonio hasta pH = 10. La solución se deja reposar hasta la precipitación completa de los agliconas. A continuación, se decanta o filtra y el sólido obtenido se diluye con disolvente de mayor afinidad, cloroformo y alcohol metílico.
El extracto bruto de esteroides se disolvió en cloroformo – metanol y se adsorbió sobre gel de sílice y posteriormente se calentó en baño de María para eliminar el solvente utilizado. El producto obtenido se colocó en un cartucho de Soxhlet y se extrajo con disolventes diferentes de polaridad creciente: éter de petróleo (SJ-EP), cloroformo (SJ-CL), diclorometano (SJ-DiCl), acetato de etilo (SJ-EA) y metanol (SJ-MeOH), respectivamente. Cada fracción obtenida se concentró y después se sometió a cromatografía de capa delgada, para confirmar los metabolitos secundarios.
Para la cromatografía en capa delgada comparativa (CCDC) se utilizaron placas de vidrio de (5 x 10) cm, sobre las que se colocó una capa fina de gel de sílice 60-GF Merck de 0,5 mm de espesor, para el seguimiento del proceso de separación de los extractos y fracciones.
Los espectros de masas fueron registrados en un espectrómetro JEOL- IMS100. Los espectros RMN 1H y RMN 13C fueron realizados en un espectrómetro VARIAN (Century 300 BB), de 300 MHz, utilizando CDCl3 e D3 COD y como estándar interno TMS.
RESULTADOS Y DISCUSIÓN
Resultados obtenidos del estudio de cromatografía de capa delgada
El extracto de aglicona fue analizado por cromatografía de capa delgada, para la confirmación de los metabolitos secundarios presentes. Se observa que las fracciones analizadas presentan valores de Rf diferentes, lo que indica la variedad de compuestos a ser aislados y purificados y la aplicabilidad de los métodos para realizar la separación y fraccionamiento de los metabolitos secundarios [9]. Estos valores fueron comparados con los valores de las sustancias patrones (aisladas de otras plantas del género Solanum ), encontrando los siguientes resultados: valores de RF de compuestos esteroidales obtenidos de otras especies de Solanum: 0,42 (Solasodina), 0,71 – 0,72 (Dieno de Solasodina), 0,77 (Soladulcidina), 0,75 (Dieno de Diosgenina); 0,62 (Diosgenina); 0,69 (Tigogenina); 0,66 (Yamogenina); 0,33 (Yucagenina), y 0,35 (clorogenina) [8].
De acuerdo con estos resultados podemos inferir que estos compuestos forman parte del extracto de Solanum jamaicense Mill. lo cual debe ser corroborado a través de los estudios espectroscópicos. Las estructuras de los compuestos identificados son las siguientes:
Estas estructuras fueron confirmadas a través del estudio espectroscópico. En la tabla 2 y 3 se reportan los Corrimientos Químicos de los espectros de RMN 13C de los compuestos aislados e identificados a partir de los frutos.
Alcaloides esteroidales aislados e identificados:
Solasodina
Fue aislado por cromatografía de capa delgada con Silicagel F254 (0,25 mm) y como fase móvil CHCl3\metanol (95,5) y se obtuvo un Rf = 0,43. Posteriormente fue recristalizado a partir de acetona con la produción de agujas incoloras de Punto de Fusión de (200 – 202) ºC.
IR en KBr: Max. en cm-1: 3 550 γ OH, 1 050 γ C-O, 1 628 γ C = C, 925, 960 y 895.
EM:IE 70 EV (m/e) I.R %: M+ 413 (15) (M+ - H2O) 395 (10), 138 (65) y 114 (100) (espirosolano).
RMN 1H CDCl3/TMS (ppm): 0,86 (s, CH3-18) 1,02 (s, CH3-19) 1,04 (d, J=6,9 Hz, CH3-21) 0,96 (d, J=6,0Hz, CH3-27) 3,56 (m, H-3a) 4,70 (m, H-16a) 5,34 (m, H-6).
Estos datos coinciden con los reportados en la literatura para la Solasodina /9/, segun se muestra en la Tabla 2.
Solasodieno
Este compuesto es formado en el proceso de hidrólisis de los glicoalcaloides y su abundancia depende de las condiciones de hidrólisis [10]. En cromatografía de capa delgada, utilizando Silicagel 60 F 254 (0,25 mm) y como fase móvil CHCl3/ MeOH (95:5) se obtuvo un Rf = 0,73. Fue recristalizado con acetona, obteniéndose un sólido de TF (176 – 177) ºC.
IR en KBr: max. en cm-1: 3005 γ CH, 1665 γ C=C (dieno), 972, 955 y 890.
U.V. en EtOH: maxennm : 234 (25800) (? 3,5 esteroide).
EM: IE 70 Ev. m/e(I. Relativa %): M+ 395 (10), 138 (100) y 114 (80).
Soladulcidina
En cromatografía de capa delgada con Silicagel F254 (0,25 mm) y como fase móvil CHCl3\ metanol (95.5), se obtuvo un Rf = 0,56. Fue recristalizado de acetona en forma de agujas de PF= (200 – 2001) ºC.
EM: IE 70 Ev. m/e (I. Relativa %): M+ 415 ( 31 ), 387 (100) ,273 (6), 255 (2), 138 (7) , 114 (10).
RMN 1H CDC13/ TMS (ppm): 0,80 (s, C-18) 0,82 (s, C-19) 1,04 (d, J=6,2 Hz, C-21) 0,84 (d, J=6,2 Hz, C-27) 3,58 (m, H-3 a ) 4,31 (m, H-16 a ) 5,38 (m, H-6).
Estos datos coinciden con los reportados en la literatura para la Soladulcidina [11].
TABLA 2. CORRIMIENTOS QUÍMICOS DE LOS ESPECTROS DE RMN C13, DE LOS ALCALOIDES
ESTEROIDALES AISLADOS E IDENTIFICADOS DE LOS FRUOTS DEL Solanum jamaicense Mill.
| C | Solasodina | Soladulcidina | C | Solasodina | Soladulcidina | ||||
| Lit.9 | Exp. | Lit.11 | Exp. | Lit.9 | Exp. | Lit.11. | Exp. | ||
| 1 | 37,2 | 37,2 | 37,0 | 37,1 | 15 | 32,0 | 32,08 | 32,1 | 32,5 |
| 2 | 31,5 | 32,08 | 31,5 | 31,6 | 16 | 78,7 | 78,92 | 80, | 83,6 |
| 3 | 71,6 | 71,69 | 71,1 | 71,2 | 17 | 62,7 | 62,76 | 62,6 | 62,0 |
| 4 | 42,2 | 42,27 | 38,2 | 38,1 | 18 | 16,4 | 16,40 | 16,5 | 16,8 |
| 5 | 140,8 | 140,8 | 44,9 | 45,1 | 19 | 19,4 | 19,27 | 12,4 | 12,7 |
| 6 | 121,4 | 121,3 | 28,6 | 28,6 | 20 | 41,2 | 41,27 | 41,6 | 42,1 |
| 7 | 32,1 | 32,10 | 32,3 | 32,4 | 21 | 15,2 | 15,26 | 15,0 | 15,2 |
| 8 | 31,3 | 31,42 | 35,2 | 35,6 | 22 | 98,2 | 98,24 | 98,3 | 99,0 |
| 9 | 50,0 | 50,09 | 54,4 | 54,5 | 23 | 34,0 | 33,98 | 33,3 | 32,8 |
| 10 | 36,6 | 36,65 | 35,6 | 36,0 | 24 | 30,2 | 30,21 | 29,6 | 29,0 |
| 11 | 20,8 | 20,90 | 21.1 | 21,1 | 25 | 31,3 | 31,42 | 30,3 | 31,9 |
| 12 | 39,9 | 39,92 | 40,1 | 39,9 | 26 | 47,6 | 47,58 | 46,9 | 46,0 |
| 13 | 40,4 | 40,53 | 41,0 | 41,0 | 27 | 19,3 | 19,27 | 19,1 | 19,0 |
| 14 | 56,4 | 56,50 | 56,3 | 56,4 |
|
|
| ||
Sapogeninas esteroidales aisladas e identificadas
Diosgenina
Fue eluida con CHCl3/ MeOH (95:5) con cromatografía de capa fina, utilizando sílica gel 60 F254 (0,25 mm) y como fase móvil CHCI3/ MeOH (95:5), obteniéndose un Rf = 0,66 y recristalizado a partir de acetona con la obtención de un sólido de TF = (203 – 205) ºC.
IR em KBr: máx. em cm-1: 3 350 – 3 420 γ (OH), 1100 γ (CO), 980, 920, 895 (f) y 860 (espirostanos).
MS: EI m / e (I.Relativa%) : M+ 414 (4), 396 (7), 342 (5), 300 (12), 282 (17), 267 (7), 253 (10), 139 (100) e 115 (7).
RMN 1H CDC13/ TMS (ppm): 0,78 (s, C-18) 0,82 (s, C-19) 0,98 (d, J=6,2 Hz, C-21) 0,79 (d, J=6,2 Hz, C-27) 3,49 (m, H-3a) 4,40 (m, H-16a) 5,34 (m, H-6).
Dieno de diosgenina
Fue aislado a partir de los frutos del Solanum jamaicense Mill. El mismo es producido durante la reacción de hidrólisis ácida de las saponinas [10]. Fue eluida con CHCl3/ MeOH (95:5) con cromatografía de capa fina, utilizando sílica gel 60 F254 (0,25 mm) y como fase móvil CHCI3/ MeOH (95:5), obteniéndose un Rf = 0,75 y recristalizado a partir de acetona con la obtención de un sólido de TF = (185 – 187) ºC.
IR en KBr: max. en cm-1: 3030 γ (O-H) vinílico, 985, 920, 900 (f) y 870 (espirostano25R).
EM:IE m/e (I. Relativa %): M+ 396 (15), 282 (2), 253 (12) 139 (100) y 115 (7).
UV en EtOH: maxennm: 236 (25800) ( ?3,5 -esteroide).
Yucagenina
Fue aislado del Solanum jamaicense Mill. al ser eluido con CHCl3/ MeOH (90:10) v/v y recristalizado con acetona obteniendo un sólido cristalino de TF (244 – 245) ºC. En cromatografía de capa delgada empleando Silicagel 60 F254 (0,25 mm) y como fase móvil CHCl3/ MeOH (95:5), mostró un Rf = 0,53.
IR en Kbr: max. en cm-1: 3 450 – 3 350 γ (OH), 1040 γ (C-O). 988, 923, 900 (f), 880 Y 840 (espirostano25R).
EM:IE m/e (I. Relativa %): M+ 430 (5), 361 (2), 358 (7) 301 (6), 287 (22), 283 (5), 269 (4) 139 (100), 115 (22).
RMN 1H CDC13/ TMS (ppm): 0,76 (s, C-18) 0,86 (s, C-19) 0,96 (d, J=6,2 Hz, C-21) 0,78 (d, J=6,2 Hz, C-27) 3,45 (m, H-3a) 4,40 (m, H-16a) 5,4 (m, H-6).
Yamogenina
Fue aislado y recristalizado de acetona, obteniéndose un sólido cristalino de TF (185 – 188) ºC. En cromatografía de capa delgada empleando Silicagel 60 F 254 (0,25 mm) y como fase móvil CHCl3/ MeOH (95:5), mostró un Rf = 0,67.
IR en KBr: max. en cm-1: 3 450 γ (OH), 1060 γ (C-0), 986, 926 (f), 903 y 870 (espirostano25S).
EM:IE m/e (I. Relativa %): M+ 414 (21), 139 (100), 399 (8), 395 (13), 355 (6), 345 (7), 342 (13), 300 (8), 205 (13), 282 (84), 271 (24), 267 (14), 253 (6) y 115 (19).
RMN 1H CDCl3/ TMS (ppm) : 0,78 (s, C-18) 0,86 (s, C-19) 0,98 (d, J=5,0 Hz, C-27) 1,05 ( d, J = 7,0 Hz, C-21) 3,00 (m, H-3a) 4,45 (m, H-16) 5,35 (m, H-6)
Tigogenina
Fue aislada al eluir la columna con CHCl3/Acetato de etilo (90:10). Fue recristalizado de acetona, obteniéndose un sólido de TF (205 – 208) ºC. En cromatografía de capa delgada empleando Silicagel 60 F254 (0,25 mm) y como fase móvil CHCl3/ MeOH (95:5), mostró un Rf = 0,68.
IR en KBr: max. en cm-1: 3 480 γ (OH), 1050 γ (C-0), 982, 920, 900 (f) y 868 (espirostano25R).
EM: IE m/e (I. Relativa %): M+ 416, (M+ - CH3) 401, (M+ - H2O) 398, 357, 347, 344, 302, 287, 284, 273, 269, 255, 139 (100) y 115.
RMN 1H CDCl3/ TMS (ppm): 0,78 (s, C-18) 0,81 (s, C-19) 0,97 (d, J=7,0 Hz, C-21) 0,82 (d, J=6,5 Hz, C-27) y 4,45 (m, H-16).
Clorogenina
Fue aislado al eluir con CHCl3/MeOH (90:10). El sólido obtenido se recristalizó de acetona con la obtención de un sólido de TF (273 – 275) ºC.
IR en KBr: max. en cm-1: 3 440 γ (OH), 1 050 γ (C-0), 980, 925, 900 (f) y 860 (espirostano25R).
EM:IE 70 Ev. m/e (I. Relativa %): M+ 432 (18), 414 (M+ - H2O) (4), 399 (M+ - H2O – CH3), 373 (5), 363 (8), 360 (20), 318 (10), 303 (8), 139 (100), 126 (10), 122 (8) y 115 (30).
RMN 1H 90 MHz CDCl3/TMS (ppm): 0,80 (s, C-18) 1,03 (s. C-19) 0,76 (d, J=6,5 Hz, C-21) 0,85 (d, J=5,0 Hz, C-27) 3,38 (m, H-3a), (H-6ß) y (H-26) 4,42 (m, H-16a).
TABLA 3. CORRIMIENTOS QUÍMICOS DE LOS ESPECTROS DE RMN C13, DE LAS SAPOGENINAS
ESTEROIDALES AISLADAS E IDENTIFICADAS DE LOS FRUTOS DEL Solanum jamaicense Mill.
|
| Diosgenina | Yamogenina | Tigogenina | Yucagenina | Clorogenina | |||||
| C | Lit.8 | Exp. | Lit.8 | Exp. | Lit. 8 | Exp. | Lit.8 | Exp. | Lit.8 | Exp. |
| 1 | 38,3 | 39,81 | 37,2 | 37,3 | 37,0 | 37,1 | 39,1 | 40.0 | 37,6 | 37,7 |
| 2 | 33,0 | 33,08 | 31,6 | 31,7 | 31,4 | 31,6 | 72,3 | 72,7 | 30,8 | 31,1 |
| 3 | 71.7 | 71,74 | 71,6 | 71,9 | 71,2 | 71,4 | 76,6 | 76,4 | 71,0 | 70,6 |
| 4 | 43,9 | 44,84 | 42,3 | 42,5 | 38,2 | 38,5 | 44,9 | 40,9 | 32,0 | 33,1 |
| 5 | 142,4 | 139,2 | 140,9 | 140,7 | 44,9 | 45,0 | 139,5 | 139,5 | 51,8 | 51.3 |
| 6 | 121,1 | 121,4 | 121,3 | 121,4 | 28,6 | 28,6 | 122,0 | 122,2 | 69,0 | 71.7 |
| 7 | 32,8 | 32,07 | 32,0 | 32,4 | 32,2 | 32,4 | 32,0 | 32,0 | 41,0 | 41,4 |
| 8 | 32,2 | 32,07 | 31,4 | 31,6 | 35,1 | 35,5 | 30,8 | 30,9 | 34,2 | 34,2 |
| 9 | 50,9 | 50,08 | 50,1 | 50,3 | 54,4 | 54,5 | 49,9 | 50,1 | 54,1 | 53,9 |
| 10 | 37,5 | 37,23 | 36,6 | 36,7 | 35,6 | 35,8 | 38,3 | 38,0 | 36,6 | 36,7 |
| 11 | 21,7 | 19,44 | 20,9 | 20,8 | 21,1 | 21,1 | 20,9 | 21,0 | 21,2 | 21,5 |
| 12 | 40,4 | 40,29 | 39,8 | 39,7 | 40,1 | 40,4 | 39,7 | 39,8 | 40,1 | 39,4 |
| 13 | 40,9 | 41,62 | 40,2 | 40,3 | 40,6 | 40,6 | 40,3 | 40,3 | 40,9 | 40,9 |
| 14 | 57,2 | 56,54 | 56,6 | 56,8 | 56,3 | 56,3 | 56,4 | 56,3 | 56,3 | 56,3 |
| 15 | 32,7 | 31,87 | 31,8 | 31,9 | 31,8 | 31,9 | 31,8 | 31,9 | 3,9 | 31,6 |
| 16 | 81,6 | 80,83 | 80,9 | 80,6 | 80,8 | 80,9 | 80,9 | 80,8 | 81,2 | 80,3 |
| 17 | 63,4 | 62,11 | 62,0 | 62,3 | 62,3 | 62,4 | 62,0 | 62,3 | 62,4 | 62,0 |
| 18 | 16,9 | 17,15 | 16,2 | 16,5 | 16,5 | 16,6 | 16,3 | 16,3 | 16,6 | 16,4 |
| 19 | 20,1 | 20,89 | 19,4 | 19,6 | 12,3 | 12,4 | 20,4 | 20,5 | 13,9 | 12,6 |
| 20 | 42,4 | 42,29 | 42,2 | 42,4 | 41,6 | 41,7 | 41,6 | 41,7 | 41,9 | 41,6 |
| 21 | 15,5 | 14.53 | 14.3 | 14,5 | 14,5 | 14,7 | 14,5 | 14,5 | 14,5 | 14,5 |
| 22 | 109,7 | 109,2 | 109,8 | 109,7 | 109,2 | 109,0 | 109,5 | 109,3 | 109,8 | 109,0 |
| 23 | 32,3 | 32,07 | 26,0 | 26,3 | 31,4 | 31,5 | 31,3 | 31,5 | 31,6 | 31,3 |
| 24 | 29,7 | 28,82 | 25,8 | 25,9 | 28,8 | 30,0 | 29,8 | 28,9 | 28,9 | 28,7 |
| 25 | 31,1 | 31,47 | 27,1 | 27,4 | 30,3 | 30,5 | 30,3 | 30,4 | 30,5 | 30,2 |
| 26 | 67,3 | 66,86 | 65,1 | 65,6 | 66,8 | 66,9 | 66,9 | 66,9 | 67,2 | 69,9 |
| 27 | 17,8 | 17,1 | 16,0 | 16,3 | 17,1 | 17,3 | 17,1 | 17,1 | 17,23 | 17,1 |
CONCLUSIONES
Los compuestos esteroidales fueron aislados a partir del fruto de la especie Solanum jamaicense Mill e identificados a través de métodos espectroscópicos de Resonancia Magnética Nuclear H1 y C13, además de Espectrometría de Masa, logrando identificar nueve compuestos esteroidales, confirmando la presencia de Solasodina, Solasodieno, Soladulcidina, Diosgenina, Dieno de la Diosgenina, Yamogenina, Clorogenina, Yucagenina, y la Tigogenina.
REFERENCIAS BIBLIOGRÁFICAS
1. AGRA, F.; NURIT SILVA, K.; BERGER, L. R.: Flora de Paraiba, Brasil: Solanum L. (Solanaceae). Acta Botânica Brasilica, v. 23, pp. 826 – 842, 2009.
2. SILVA, T. M. S.; AGRA, M. F.; BHATTACHARYYA, J. "Studies on the alkaloids of Solanum of northeastern Brazil". Revista Brasileira de Farmacognosia. 2005, 15 (4), 292–293. ISSN 1981-528X
3. SILVA, T. M. S. "Steroidal glycoalkaloids and mollusicidal activity of Solanum asperum". Rich, Fruits. J. Braz. Chem. Soc. 2008, 19 (5), 1048–1052. ISSN 1678-4790
4. D'Arcy, W. G. Solanum and its close relatives in Florida. Ann. Missouri Botanical Garden 61, 819 – 867, 1974.
5. FLEPPC Florida Exotic Pest Plant Council's 2005 List of invasive species. 2007. [Disponible en: www.fleppc.org.] [Consultado el: 01-01-2017].
6. NYBG New York Botanical Garden Virtual Herbarium, 2007. [Disponible en: http://sciweb.nybg.org/science2/vii2.asp] [Consultado el: 01-01-2017].
7. NOGUEIRASLIMA, C. Isolamento e caracterização de sapogeninasesteroidais no Solanum jamaicense Mill., e do Solanumtorvum Swartz. Tese de Doutorado: Orientador: Werner Döpke, Universidade de Humboldt, Alemanha, 1975.
8. HERNANDEZ, A. E. F. Estudo fitoquimico das plantas del gênero Solanum e Cestrum. Tesis Doctoral. Facultad de química, Universidad de La Habana, Cuba, 1989.
9. RIPPERGER, H.; PORZEL, A. "N-Hydroxy- Solasodine from Solanum robustum". Phytochemistry. 1992, 31(5), 1837–1839. ISSN 0031-9422
10. MOLA, J. L.; DE ARAUJO, E. R.; GOUVAN, E.; DE MAGALHÃES, C. "Solasodina em espécies de solanum do cerrado do Distrito Federal". Química nova. 1997, 20(5), 460–462. ISSN 1678-7064
11. RIPPERGER, H.; PORZEL, A. "(23R)-23hydroxy Soladulcidine and related compounds from Solanum panduraeforme". Phytochemistry. 1993, 32(6), 1607–1609. ISSN 0031-9422.
Recibido: 10/10/2017
Aceptado: 28/01/2018
Dr. C. Anselmo Enrique Ferrer-Hernandez, Laboratório de Productos Naturales, (L.P.Q. P. N), Universidad Federal de Rondônia, UNIR, Rondônia, Brasil, ansenrique@yahoo.es