Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.30 no.2 Santiago de Cuba may.-ago. 2018
ARTICULOS
Valoración conductimétrica de ion sulfato en salmueras de la industria salinera marina
Conductometric titration of sulfate ion in brines from the marine salt industry
MSc. Ángel Fernández-Heredia, MSc. Roberto Machado-García, Lic. Diaby Bangaly
Departamento de Química, Facultad de Ciencias Naturales y Exactas, Universidad de Oriente, Santiago de Cuba, Cuba, robertomg@uo.edu.cu
RESUMEN
En este trabajo se estudian las condiciones óptimas que permiten realizar de forma rápida y fiable la valoración conductimétrica de ion sulfato en salmueras de la industria salinera marina y obtener resultados exactos y precisos con un mínimo coste. Para ello se tomaron cuatro muestras de diferentes partes del proceso tecnológico y se analizaron por el procedimiento propuesto y se comparó con los resultados obtenidos al aplicar gravimetría por precipitación, como método de referencia. Los resultados indicaron que es posible determinar el ion sulfato con una precisión aceptable, aunque se detectó la presencia de un sesgo significativo de + 6 % en todo el intervalo de concentraciones estudiado. Este problema puede corregirse multiplicando el resultado del análisis volumétrico por 0,94 o eliminarse realizando la valoración en un medio que contenga 5 % de etanol.
Palabras clave: sulfato, valoración conductimétrica, salmueras.
ABSTRACT
In this work optimal conditions for the rapid and reliable determination by conductometric titration of sulfate ion in brines from the marine salt industry are studied in order to obtain accuracy and precise results with a minimal cost. Four samples from different parts of technological process are evaluated with the proposal procedure and using precipitation gravimetry as reference method. The results indicate that is possible determinate sulfate ion with an acceptable precision, although the presence of a significant bias of + 6 % in all studied concentration interval was detected. This problem can be corrected multiplying the volumetric analysis result by 0,94 or eliminated developing the titration in ethanol 5 % media.
Keywords: sulfate, conductometric titration, brines.
INTRODUCCIÓN
En la industria salinera marina se realiza la evaporación solar controlada del agua de mar para incrementar su densidad hasta alcanzar la cristalización del NaCl y obtener un producto de aceptable pureza, el cual se refina por lavado y secado. Durante este proceso se van concentrando también otros iones presentes (Mg2+, K+, SO42-, etc.) que junto con Na+ y Cl- se mantienen en solución (salmueras). En el caso específico del ion sulfato los incrementos de concentración varían desde 2,7 g.L-1 en el agua de mar [1] hasta aproximadamente 100 g.L-1 en la salmuera residual [2].
Desde el punto de vista práctico es útil controlar los contenidos de ion sulfato en cada una de las lagunas donde se concentran las salmueras, sin embargo los métodos analíticos para la determinación de este ion son largos y complejos (gravimetría) o requieren de equipamientos costosos (cromatografía iónica) [3, 4]. Dado que la industria demanda de métodos rápidos, simples y de bajo coste, en este trabajo se propone realizar la determinación de sulfato en salmueras, aplicando la volumetría por precipitación con indicación conductimétrica del punto final usando como valorante una solución patrón de BaCl2 según la reacción:
SO42- (ac) + Ba2+ (ac) = BaSO4 (s)
Aun cuando la conductividad electrolítica se usa comúnmente para indicar la concentración total de los constituyentes ionizados de las soluciones y está estrechamente relacionada con la suma de los cationes o aniones y por tanto con el total de sólidos disueltos, el método conductimétrico por sí solo constituye una determinación precisa y razonable [5].
Las salmueras de la industria salinera marina presentan ventajas que permiten la aplicación de este método:
- Tienen un pH neutro, por lo que la propiedad medida no está afectada por iones de elevada conductividad iónica equivalente como H+ y OH-.
- No contienen aniones que reaccionen o formen precipitados con las soluciones de Ba2+ y por tanto el valorante reaccionará cuantitativamente con el sulfato presente.
- Todos los iones constituyentes exhiben conductividades iónicas equivalentes aproximadamente iguales, por lo que solo ocurrirá un incremento significativo de la propiedad cuando se adicione un exceso del valorante, es decir después del punto de equivalencia de la reacción.
Independiente de estas ventajas, la presencia de iones extraños al precipitado puede provocar la coprecipitación de los mismos por oclusión, inconveniente que podría solucionarse por calentamiento de la solución o con adiciones lenta del valorante [6] , pero estas correcciones atentan contra la rapidez del análisis.
La literatura refiere que en las valoraciones conductimétricas de sulfatos alcalinos puros con BaCl2, el punto final se encuentra antes del punto de equivalencia y que este error (del orden de 5 % para soluciones 0,05 mol.L-1) depende fundamentalmente de la dilución, el contenido de etanol, la acidez y del tipo de catión presente, pero no puede atribuirse a la coprecipitación, ya que la conductividad en presencia del precipitado es significativamente mayor que en las soluciones filtradas, lo cual puede ser provocado por la carga del BaSO4 en suspensión y por su influencia sobre la constante de la celda [7].
Durante la valoración conductimétrica de ion sulfato, es práctica común la adición de alcohol al medio de reacción para disminuir la solubilidad del precipitado. Se ha demostrado que el BaSO4 es 39 500 veces más insoluble en etanol que en agua, ya que los valores de Kps varían desde 1,11. 10-10 en agua pura hasta 2,81. 10-15 en alcohol deshidratado [8]. Por microscopía electrónica se ha verificado que las partículas de BaSO4 precipitadas en soluciones hidroalcohólicas son más pequeñas a medida que se incrementa la concentración de etanol en el medio donde se forman [9], por tanto un exceso de alcohol al medio de reacción puede provocar un incremento de la coprecipitación por aumento del área superficial por unidad de masa [6] y afectaciones al valor de conductividad por la disminución de la solubilidad de otras sales solubles presentes en las muestras de salmuera (NaCl, KCl, MgCl2 y otras) [10].
MATERIALES Y MÉTODOS
Reactivos, equipos y muestras
Todos los reactivos utilizados fueron de grado analítico (AR) de la firma Merck. Como valorante se utilizó una solución de BaCl2 preparada a partir de una ampolleta fixanal. Se usaron equipos de laboratorio marca Sartorius (balanza analítica, estufa, horno mufla y conductímetro). Las muestras fueron suministradas por especialistas de la Empresa Salinera "Frank País", provincia Guantánamo en Cuba y consistieron en una muestra de agua de mar, dos salmueras tomadas en diferentes lagunas del proceso tecnológico y una muestra de la salmuera residual, las cuales fueron etiquetadas como AM, S1, S2 y SR respectivamente.
Análisis semi-cuantitativo de ion sulfato en las muestras
Este análisis debe realizarse previamente a cada una de las muestras para definir los niveles aproximados de concentración de sulfato en las mismas y poder seleccionar las alícuotas acorde al procedimiento que se aplica. El análisis de esta operación preliminar se basa en la comparación visual de la turbidez de un patrón de BaSO4 con soluciones que contienen porciones de las muestras, preparadas todas en las mismas condiciones y en un breve período de tiempo. El método consiste en lo siguiente:
- Se prepara una solución patrón primario de K2SO4 que contiene 100 mg.L-1 de ion sulfato, se toma 1 mL de la misma y se lleva a un tubo de ensayo graduado. Se añaden 5 mL de agua, 1 mL de HCl2 mol.L-1, 1 mL de solución de BaCl2 al 10 %, se completa con agua a 10 mL y se agita vigorosamente. Aparecerá una ligera turbidez por la formación de BaSO4. A continuación se toma 1 mL de la muestra en otro tubo de ensayos y se prepara siguiendo el mismo procedimiento.
- Si por apreciación visual, la turbidez de la muestra coincide con la turbidez del patrón, la misma contiene aproximadamente 100 mg.L-1 de ion sulfato. Si no aparece turbidez, se toma una alícuota mayor de la muestra. Si la turbidez es mayor que el patrón, la muestra se diluye según aparece descrito en la tabla 1.
TABLA 1. ESTIMACIÓN APROXIMADA DE LA CONCENTRACIÓN DE ION SULFATO EN SALMUERAS
| Volumen de muestra (mL) | Dilución de la muestra | Volumen a medir en | Contenido aproximado de ion |
| 1 | No se diluye | 1 | 100 |
| 2 | 2 | 50 | |
| 5 | 5 | 20 | |
| 1 | 1:10 | 1 | 1 000 |
| 2 | 500 | ||
| 5 | 200 | ||
| 1 | 1:100 | 1 | 10 000 |
| 2 | 5 000 | ||
| 5 | 2 000 | ||
| 1 | 1:1000 | 1 | 100 000 |
| 2 | 50 000 | ||
| 5 | 20 000 |
Métodos analíticos
Análisis gravimétrico (AG): Una alícuota de la muestra que contenga de 0,1 a 0,2 g de ion sulfato (para generar de 0,3 g a 0,5 g de BaSO4) se acidifica ligeramente con HCl diluido, se calienta hasta una temperatura cercana a la ebullición y se añade solución de BaCl2 al 10 % bajo agitación. El precipitado formado se deja reposar 24 h. Posteriormente se filtra y lava con agua hasta ausencia de iones cloruro. El precipitado se seca e incinera a 850 0C y se pesa. El sulfato se determina a partir de la masa de BaSO4 pesada según la ecuación (1):
Análisis volumétrico (AV): Se toma una alícuota de la muestra que contenga de 0,3 a 0,4 mmoles de ion sulfato y se transfiere a un vaso de precipitados de 250 mL, se añade agua suficiente hasta completar 100 mL y se homogeniza con agitación magnética.
Se introduce la celda del conductímetro y se valora con solución patrón de BaCl2 0,05 mol/L, realizando adiciones de 0,5 mL y midiendo a los 10 s después de cada adición.
Previo al análisis de los resultados se realizó la corrección de los valores de conductividad debido a la dilución de la muestra según la ecuación (2):
Posteriormente con los datos de Va en las abscisas y Lcorr en las ordenadas, se construye el gráfico de valoración conductimétrica.
En este trabajo el punto final de la valoración conductimétrica se determina combinando el método propuesto por Grunwald [11] con el procedimiento presentado por García y Schultz [12]. El primero utiliza 4 proporciones de equivalentes entre el valorante y el sustrato, 2 antes (e1 y e2) y 2 después del punto de equivalencia (e3 y e4). En el segundo se determina la combinación óptima de rectas a ambos lados del punto de equivalencia a partir de sus valores máximos de R2.
La aplicación armonizada de ambas herramientas permite la determinación precisa del punto final en una valoración conductimétrica. La metodología es simple y se basa en utilizar más de 2 proporciones de equivalentes en ambas zonas lineales de la curva de valoración con los mejores valores de R2 para ambas, posteriormente se evalúa por aproximaciones sucesivas diferentes volúmenes del punto final hasta que el error en la estimación del mismo sea mínima, es decir cuando el valor de e =1. Con el valor del volumen en el punto final de la valoración se determina la concentración de ion sulfato por la ecuación (3):
Análisis de los datos
Los cálculos de volumen del punto final se realizaron en hojas de cálculo de Microsoft Office (Excel). Para el tratamiento matemático de los resultados se aplicaron métodos estadísticos con un nivel de significación p < 0,05 utilizando el software Statgraphics [13].
RESULTADOS Y DISCUSIÓN
Se realizaron los análisis semi-cuantitativos para cada una de las muestras de salmuera. A partir de estos resultados se efectuaron las diluciones correspondientes para cada uno de los análisis realizados. En la tabla 2 se resumen las alícuotas seleccionadas.
TABLA 2. DILUCIONES DE LAS MUESTRAS (en mL) SEGÚN
EL CONTENIDO APROXIMADO DE ION SULFATO
| Muestra | Análisis gravimétrico | Análisis volumétrico |
| AM | 50 | 10 |
| S1 | 50/100/10 | 50/100/3 |
| S2 | 20/100/20 | 25/100/3 |
| SR | 20/100/10 | 12,5/100/3 |
Se realizaron 5 réplicas para cada muestra por cada uno de los métodos. En la tabla 3 se resumen los resultados obtenidos, sus estadígrafos correspondientes y las probabilidades de las pruebas de Fisher y Student para la comparación de la precisión y la veracidad respectivamente entre ambos métodos [14]. Se incluye además la desviación estándar relativa calculada por la ecuación de Horwitz [15] para estudios de repetibilidad [16].
TABLA 3. ANÁLISIS ESTADÍSTICO DE LOS RESULTADOS DE LA DETERMINACIÓN DE SULFATO EN SALMUERAS
| Muestra | AM | S1 | S2 | SR | ||||
| Método | AG | AV | AG | AV | AG | AV | AG | AV |
| Media (g.L-1) | 2,66 | 2,82 | 19,20 | 20,65 | 37,87 | 40,46 | 80,37 | 83,81 |
| Desviación estándar (±) | 0,007 | 0,041 | 0,077 | 0,311 | 0,082 | 0,438 | 0,099 | 0,458 |
| Coeficiente de Variación (%) | 0,26 | 1,31 | 0,40 | 1,46 | 0,22 | 0,95 | 0,12 | 0,49 |
| p (Fisher) | 0,004 7 | 0,019 2 | 0,006 7 | 0,011 6 | ||||
| ½ RSD (Horwitz) * | 2,44 | 1,81 | 1,64 | 1,46 | ||||
| p (Student) | 0,000 0 | 0,000 3 | 0,000 1 | 0,000 0 | ||||
| Sesgo | 0,16 | 1,45 | 2,59 | 3,44 | ||||
| Proporción AG/AV | 0,94 | 0,93 | 0,94 | 0,96 | ||||
| Media del AV (corregida) | 2,65 | 19,41 | 38,03 | 78,78 | ||||
* Valores calculados a partir de los resultados del análisis gravimétrico utilizado como referencia
En la tabla 3 se observa que todos los valores de probabilidad para la prueba Fisher son menores que 0,05, demostrando que las precisiones de ambos métodos son estadísticamente diferentes en todos los niveles de concentración estudiados y que el método volumétrico es menos preciso que el de referencia. Para verificar la posibilidad de aplicación del método volumétrico con una precisión menor que la gravimetría, se determinó (para cada uno de los niveles de concentración estudiados) la magnitud del valor límite establecido por la ecuación de Horwitz relativa a la repetibilidad, observándose que los coeficientes de variación experimentales obtenidos son menores que los valores de ½ RSD (Horwitz) calculados, por tanto, es posible determinar el ion sulfato con el método de valoración conductimétrica con una precisión aceptable [16].
Como se aprecia en la tabla 3, todos los valores de probabilidad para la prueba Student son menores que 0,05, indicando que las medias de la valoración conductimétrica difieren significativamente de las mediciones realizadas con el método de referencia (gravimétrico). Esto demuestra la presencia de un sesgo significativo entre ambos métodos y cuya magnitud crece a medida que aumenta la concentración de ion sulfato en las muestras. Una forma común de evaluar si el sesgo es constante en todo el intervalo de concentraciones del analito estudiado, es calcular la magnitud de la relación entre la media de referencia y la media investigada (proporción AG/AV), de forma que se pueda identificar una posible proporción constante entre ellas.
En la tabla 3 aparecen reportados los valores de esta proporción para las distintas concentraciones, observándose que se encuentran entre 0,93 y 0,96, cifras que indican un sesgo promedio de + 6 % en todo el intervalo de concentraciones evaluado. Esto indica que es posible realizar la corrección del sesgo para la valoración conductimétrica multiplicando el resultado del análisis por 0,94 para cualquier muestra. En la última fila de esta tabla se presentan los resultados de este cálculo, apreciándose que no existen diferencias significativas entre las medias de ambos métodos después de la corrección.
Uno de los problemas más complejos de la química analítica es la identificación y erradicación de errores sistemáticos. En este trabajo el sesgo puede ser corregido, cuestión que no siempre es posible, por lo que es necesario identificar las causas que lo provocaron y tratar de eliminarlo. Una explicación del fenómeno observado es la presencia de cantidades significativas de sales solubles en el medio de reacción provenientes del agua de mar y sus salmueras, las cuales ejercen un considerable efecto salino sobre el precipitado aumentando la solubilidad del BaSO4 y manteniendo iones SO42- y Ba2+ en solución después del punto de equivalencia de la reacción.
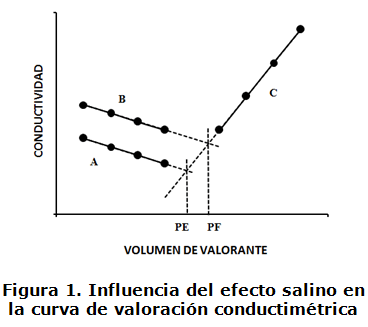
En la figura 1 se grafica la influencia del efecto salino sobre la curva de valoración conductimétrica. Las rectas A y B representan las adiciones de valorante (Ba2+) antes del punto de equivalencia y la C después del mismo. La rama A corresponde a la precipitación de BaSO4 en una solución ideal que permite determinar el volumen en el punto de equivalencia de la reacción (PE). La rama B corresponde a la precipitación de BaSO4 en una solución influenciada por el efecto salino que provoca la solubilidad del precipitado y un aumento de la conductividad que desplaza el punto final de la valoración (PF) hacia la derecha del PE determinando un sesgo positivo en el resultado del análisis.
De acuerdo con esta hipótesis y basado en el conocimiento de la literatura [7, 8], la adición de etanol reduciría la solubilidad del BaSO4, por lo que sería posible corregir el sesgo encontrado. La cantidad de alcohol debe evaluarse cuidadosamente y no agregar una cantidad excesiva puesto que pueden precipitar otras sales contenidas en la muestra [10] y provocar turbidez en la solución antes de comenzar la valoración.
Las alícuotas de las salmueras empleadas directamente para la valoración (tabla 2) contienen entre 0,2 y 0,3 g de sales totales disueltas en 100 mL, por tanto es posible calcular a partir de los datos de Farelo et al. [17], que se puede añadir de 10 a 15 % de alcohol sin riesgo de cristalización de las mismas, principalmente NaCl y MgCl2 que son mayoritarias [2].
La bibliografía establece que el BaSO4 es 1,3, 1,7 y 2,2 veces más insoluble en mezclas etanol-agua de 5, 10 y 15 % respectivamente que en agua pura [8], por lo que se repitieron las determinaciones volumétricas adicionando 5, 10 y 15 mL de etanol al medio de reacción antes de completar con agua a 100 mL. Experimentalmente se observó que la adición de 15 % de alcohol provocaba turbidez en la solución antes de realizar la valoración y se modificaban sensiblemente los valores de conductividad, por lo que no se realizaron esos análisis. En la tabla 4 se resumen los resultados promedio de 5 réplicas obtenidos del análisis de las muestras con las diferentes proporciones de alcohol.
TABLA 4. INFLUENCIA DEL ETANOL EN LOS RESULTADOS DE LA
VALORACIÓN CONDUCTIMÉTRICA
| % etanol (v/v) | Media del análisis (en g.L-1) | |||
| AM | S1 | S2 | SR | |
| 5 | 2,68 | 19,33 | 37,96 | 79,98 |
| 10 | 2,66 | 19,21 | 38,03 | 80,45 |
| 15 | Análisis no ejecutados | |||
* Turbidez antes de la titulación
Como se puede apreciar de la tabla 4, con la adición de 5 % o 10 % de etanol al medio de reacción se garantiza que los contenidos medios de ion sulfato en las muestras coincidan con los resultados reportados por el análisis gravimétrico (tabla 3), eliminándose de esa forma el sesgo encontrado cuando se realiza el análisis volumétrico en medio acuoso y demostrándose que el efecto salino es la causa que provocaba el desplazamiento del punto final de la valoración hacia mayores valores. La selección de 5 % resulta mucho más adecuada desde el punto de vista analítico porque se evitan posibles cristalizaciones en salmueras más concentradas y al mismo tiempo se reduce el coste del análisis.
Se evaluaron las condiciones óptimas que permitieron realizar de forma rápida, fiable y con mínimo coste, la valoración conductimétrica de ion sulfato en salmueras de la industria salinera marina garantizando los requisitos metrológicos veracidad y precisión del procedimiento propuesto los cuales se cumplen cuando se realiza la valoración en un medio hidroalcohólico con 5 % de etanol o multiplicando el resultado del análisis por 0,94 cuando se efectúa en medio acuoso.
REFERENCIAS BIBLIOGRÁFICAS
1. HORNE R. A. "The Physical Chemistry and Structure of Sea Water". Water Resources Research. 1965, 1(2), 263–276. ISSN 1944 -7973.
2. McCAFFREY M. A., LAZAR B.; HOLLAND H. D. "The evaporation path of seawater and the coprecipitation of Br- and K+ with halite". Journal of Sedimentary Petrology. 1987, 57(5), 928–937. ISSN 0022-4472
3. SAYI Y. S.; SHANKARAN P. S.; YADAV C. S.;CHHAPRU G. C. "Determination of total sulphur in inorganic compounds–An overview". Indian Journal of Chemical Technology. 2003, 10 (July), 373–381. ISSN 0975-0991
4. AMERICAN PUBLIC HEALTH ASSOCIATION American Water Works Association & Water Environment Federation. (Publishers) Rice E.W., Baird R.B., Eaton A.D. and Clesceri L.S. (Editors). Standard Methods for the Examination of Waters and Wastewater. 22 nd Edition. USA, 2012.
5. HERNÁNDEZ CAÑAVATE, J. "La determinación volumétrica de sulfatos en la bibliografía". Anales de la Universidad de Murcia. Ciencias. 1962, 21(3-4), C205-C227. ISSN 2171-7664.
6. SKOOG DOUGLAS, W. D.; HOLLER, J.; STANLEY, C. Fundamentos de Química Analítica. 8 va Edición. México: Thompson Editores, S.A., 2005.
7. KOLTHOFF, I. M.; KAMEDA, T. "Conductometric Titration of Sulfate and Barium". Industrial and Engineering Chemistry, Analytical Edition. 1931, 3(2), 129–133. DOI: 10.1021/ac50074a005
8. GOMAA ESAM, A. " Solubility and Solvation Parameters of Barium Sulphate in Mixed Ethanol-Water Mixtures at 301.15 K". International Journal of Materials and Chemistry. 2012, 2(1), 16–18. ISSN 2166-5354. DOI: 10.5923/j.ijmc.20120201.03
9. SUITO, E.; KAZUYOSHI, T. "Formation and Aging of Precipitates. III. Electron Microscopic Studies on Barium Sulfate Precipitates in Aqueous Ethanol". Bulletin of the Chemical Society of Japan. 1955, 28 (4), 305 – 307. ISSN 1348-0634. DOI: 10.1246/bcsj.27.121
10. KOLTHOFF, I. M.; SANDELL, E. B. Tratado de Química Analítica Cuantitativa. 3ra Edición. Buenos Aires: Editorial Niger, 1968.
11. GRUNWALD, E. " End Point Calculation in Conductometric and Photometric Titrations". Analytical Chemistry. 1956, 28(7), 1112–1116. DOI: 10.1021/ac60115a014
12. GARCIA, J.; SCHULTZ, L. D. "Determination of Sulfate by Conductometric Titration: An Undergraduate Laboratory Experiment". Journal of Chemical Education. 2016, 93(5), 910–914. DOI: 10.1021/acs.jchemed.5b00941
13. STATGRAPHICS PLUS FOR WINDOWS. Statistical Graphics Corp. USA. Version 5.1, 2001
14. MILLER J. C.; MILLER, J. N. Estadística para Química Analítica. 2da Edición. Estados Unidos de América: Addison-Wesley Iberoamerican, S.A., 1993.
15. HORWITZ, W.; KAMPS, L. R.; BOYER, K. W. "Quality assurance in the analysis of foods and trace constituents". Journal of the Association Official of Analytical Chemistry. 1980, 63(6), 1344–1354. ISSN 0004-5756
16. OFICINA NACIONAL DE NORMALIZACIÓN DE CUBA. Guía para la validación de métodos de ensayos químicos para alimentos. Norma Cubana NC-TS 368:2010. Mayo 2010.
17. FARELO, F.; LOPES, A. M. C.; FERRA, M. I. " Solubilities of Sodium Chloride and Potassium Chloride in Water + Ethanol Mixtures from (298 to 323) K". Journal of Chemical & Engineering Data. 2004, 49(6), 1782–1788. DOI: 10.1021/je049782s
Recibido: 5/09/2017
Aceptado: 15/01/2018
MSc. Roberto Machado-García, Departamento de Química, Facultad de Ciencias Naturales y Exactas, Universidad de Oriente, Santiago de Cuba, Cuba, robertomg@uo.edu.cu