Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Química
versão On-line ISSN 2224-5421
Rev Cub Quim vol.30 no.3 Santiago de Cuba set.-dez. 2018
ARTICULOS
Aislamiento y selección de hongos lipolíticos de materiales contaminadas con desechos de aceite vegetal
Isolation and selection of lipolytic fungi from materials contaminated with vegetable oil wastes
Lic. Andrea Alfonseca-Ladrón de GuevaraI, Dr. C Manuel Serrat-DíazII
IDepartamento de Biología, Facultad de Ciencias Naturales y Exactas, Universidad de Oriente
IICentro de Estudios de Biotecnología Industrial, Facultad de Ciencias Naturales y Exactas, Universidad de Oriente, mserrat@uo.edu.cu
RESUMEN
Las lipasas constituyen una alternativa promisoria para el reemplazo de la catálisis química en la síntesis del biodiesel. En particular, las lipasas fúngicas son las más utilizadas debido a su menor costo y a su mayor estabilidad operacional. El presente trabajo estuvo dirigido hacia la búsqueda de nuevas cepas fúngicas productoras de lipasas, asociadas a sitios contaminados con residuos del procesamiento de aceites vegetales. Se aislaron 40 cepas capaces de crecer en aceite de soya como única fuente de carbono y energía, observándose predominio de los hongos filamentosos sobre las levaduras. Se seleccionaron 12 cepas de hongos filamentosos en virtud de sus resultados superiores en los ensayos cualitativos de actividad lipolítica, de las cuales cuatro acumularon más de 200 U/l de lipasa extracelular en siete días. Estos resultados sirven de base para estudios futuros encaminados a la obtención y aplicación de las lipasas en la síntesis del biodiesel.
Palabras clave: hongos filamentos, levaduras, lipasas, biodiesel, aceite de soya.
ABSTRACT
Lipases are a promising alternative for the replacement of chemical catalysis in the biodiesel synthesis. In particular, fungal lipases are the most used because of their lower cost and greater operational stability. The present work was aimed towards the search for new lipase-producing fungal strains, associated with sites contaminated with residues from the processing of vegetable oils. It was isolated forty strains capable of growing in soybean oil as the sole carbon and energy source, with filamentous fungi being predominant over yeasts. Twelve strains of filamentous fungi were selected due to their superior results in the qualitative tests for lipolytic activity, of which four accumulated more than 200 U/l of extracellular lipase in seven days. These results are the basis to future studies aimed at obtaining and applying lipases in the biodiesel synthesis.
Keywords: filamentous fungi, yeasts, lipases, biodiesel, soybean oil.
INTRODUCCIÓN
El biodiesel es combustible líquido renovable, formado por ésteres mono alquílicos de ácidos grasos de cadena larga derivados de aceites vegetales o grasas animales [1], cuyo consumo crece aceleradamente debido a sus múltiples ventajas frente a otros biocombustibles. Por ejemplo, el biodiesel no requiere ninguna modificación ni ajustes de los componentes del sistema de alimentación de los motores o del sistema de almacenamiento de combustible [2] y puede usarse puro o como combustible mixto, en proporciones apropiadas con el diesel de petróleo. Además, el biodiesel permite la reducción de emisiones de partículas finas y de contaminantes como el monóxido de carbono, el dióxido de azufre y los óxidos de nitrógeno [3, 4].
El biodiesel se produce tradicionalmente mediante la reacción de transesterificación de los triglicéridos con metanol o, en menor medida, etanol. Esta reacción tiene lugar en presencia de un exceso considerable del alcohol y es catalizada industrialmente mediante la adición de carbonato o hidróxido de sodio. Como subproducto de la síntesis se forma glicerol, compuesto este fatal para los motores de combustión interna. Para eliminarlo del biocombustible se usan grandes cantidades de agua, la cual se recupera contaminada con el hidróxido o carbonato sódico usados para la catálisis [1]. Debido a las legislaciones de protección ambiental, estos desechos deben tratarse antes de su remoción de la planta industrial, aumentando así de manera significativa los costos de producción del biocombustible [5].
Una alternativa prometedora al uso de esta catálisis en ambiente básico consiste en el uso de biocatalizadores enzimáticos como las lipasas. Estas (EC.3.1.1.3) son una clase de serina hidrolasas que pertenecen a la superfamilia a/ß hidrolasas [6]. Estas enzimas están ampliamente distribuidas en la naturaleza [7] y desde un punto de vista fisiológico su función es catalizar las reacciones del catabolismo de triglicéridos en ácidos grasos y glicerol, ocupando un lugar central en el metabolismo de los lípidos [7, 8].
In vitro, las lipasas pueden actuar como modificadores de triacilglicéridos catalizando, además de la hidrólisis, diferentes reacciones sintéticas como son las de esterificación y transesterificación, acidólisis y alcohólisis, obteniéndose así nuevos triglicéridos con excelentes rendimientos, mediante procesos más económicos [6, 9, 10]. El empleo de la catálisis enzimática en la obtención de biodiesel, además de las ventajas inherentes a cualquier biocatalizador, evita el uso del carbonato o hidróxido de sodio, reduce drásticamente el consumo de agua y puede suprimirse completamente la formación de glicerol como producto de la reacción [6].
Las lipasas obtenidas a partir de microrganismos, principalmente hongos, son más utilizadas que las aisladas de plantas o de origen animal debido a sus menores costos de producción y a que presentan una mayor estabilidad, selectividad y amplitud de especificidad de sustrato [11]. Sin embargo, a pesar de las grandes ventajas que tiene la aplicación de las lipasas en diferentes tipos de industrias, incluida la del biodiesel, sus altos costos de producción limitan su uso [12]. En este sentido la exploración de nuevos microorganismos productores de estas enzimas constituye un tema de intensa actividad en la actualidad.
Se han aislado microrganismos productores de lipasa de hábitats diversos como desechos industriales, fábricas procesadoras de aceite vegetal, lecherías, suelos contaminados con petróleo, semillas oleaginosas, alimentos en descomposición, etc. [13, 14, 15]. También se ha informado el aislamiento de levaduras productoras de lipasas de ambientes naturales como flores, frutas y tallos de plantas y suelos de diversos biomas de Brasil [16].
MATERIALES Y MÉTODOS
Recolección y naturaleza de las muestras
Las colectas se realizaron en la Empresa Productora y Refinadora de Aceites Ecasol, situada en Carretera de Mar Verde, Km 4½, Santiago de Cuba. Las muestras colectadas consistieron de material sólido (suelo o sedimento) o líquido (aguas residuales), contaminados con residuos del procesamiento del aceite vegetal. Estas se tomaron con material estéril (vasos de precipitados, para las muestras líquidas y espátulas para las sólidas) y se trasvasaron inmediatamente a tubos plásticos estériles de 50 ml de capacidad, provistos de tapa. Se tomaron siete muestras, cuyas características se describen a continuación:
Muestras sólidas:
- Muestra 1 (M1): sedimento depositado en las paredes de una de las cunetas de desagüe del punto de recepción del aceite crudo.
- Muestra 2 (M2): suelo superficial perteneciente a un área contaminada con residuales oleosos, provenientes de las tuberías del punto de recepción del crudo.
- Muestra 3 (M3): sedimento depositado en las paredes de una trampa de vapor, situada próxima al punto de recepción del crudo y con signos evidentes de contaminación con grasas.
- Muestra 4 (M4): sedimento depositado en la canaleta donde se vierte el jaboncillo, residual líquido generado por la fábrica, con alto contenido de aceite, jabón y gomas.
Muestras líquidas:
- Muestra 5 (M5): agua residual con alto contenido de grasas, la cual circula por una de las cunetas de desagüe situadas en las proximidades del punto de recepción del crudo.
- Muestra 6 (M6): agua residual con bajo contenido de grasas, la cual circula por una de las cunetas de desagüe situadas en las proximidades del punto de recepción del crudo.
- Muestra 7 (M7): residual líquido industrial jaboncillo, tomado directamente a la salida de la tubería de descarga.
Las muestras se trasladaron al laboratorio de Tecnología Enzimática del Centro de Estudios de Biotecnología Industrial de la Facultad de Ciencias Naturales y Exactas de la Universidad de Oriente y se conservaron a 4 ºC.
Medios de Cultivo
Como medio general para la conservación y propagación de los cultivos de hongos filamentosos y levaduras se utilizó el medio Extracto de levadura – Peptona – Glucosa (YPD), el cual presentó la siguiente composición (en g/l): extracto de levadura 10, peptona 20, glucosa 20. La variante sólida (agarizada) de este medio (YPDA) se preparó adicionando agar bacteriológico a 15 g/l.
El medio selectivo utilizado para el enriquecimiento y posterior aislamiento de hongos filamentosos y levaduras se conformó tomando como referencia el trabajo de Pakevicius [17], conteniendo una emulsión de aceite de soya en Tween 80 como única fuente de carbono y energía y el antibiótico tetraciclina para prevenir el crecimiento bacteriano. Su composición (en g/l, a menos que se indique otra cosa ) fue la que sigue: K2HPO4 2,5, (NH4)2SO4 1,3, urea 1,3, MgSO4·7H2O 0,5, extracto de levadura 0,5, emulsión de aceite de soya 20 % (v/v) y tetraciclina 50 mg/l. El pH se ajustó 6 con NaOH 1 mol/l. Para la variante sólida del medio se adicionó agar bacteriológico 15 g/l. La urea y la tetracicilina se adicionaron al medio estéril a partir de soluciones stock 50X y 1000X, respectivamente. Ambas se esterilizaron por filtración a través de filtros bacteriológicos (0,22 µm) y se conservaron en frascos ámbar en congelación (-20 ºC). La emulsión de aceite de soya se preparó mezclando vigorosamente aceite de soya comercial con una solución acuosa de Tween 80 0,1% (v/v) a razón de 1:19 (v/v) y se esterilizó en autoclave a 121 ºC (1 atm) durante 20 min. Se añadió al medio mineral en el momento de la inoculación de la muestra.
Para el ensayo cualitativo de la actividad lipolítica se emplearon los siguientes medios, cuya composición (en g/l, a menos que se indique otra cosa) fue:
- Medio conteniendo Tween 80 y CaCl2: K2HPO4 2,5, (NH4)2SO4 1,3, urea 1,3, MgSO4·7H2O 0,5, extracto de levadura 0,5, Tween 80 1 % (v/v), CaCl20,5, agar bacteriológico 15. El pH se ajustó a 6 con NaOH 1 mol/l.
- Medio conteniendo aceite de soya y rodamina B: K2HPO4 2,5, (NH4)2SO4 1,3, urea 1,3, MgSO4·7H2O 0,5, extracto de levadura 0,5, emulsión de aceite de soya 20 % (v/v), rodamina B 10 mg/l y agar bacteriológico 15. El pH se ajustó a 6 con NaOH 1 mol/l. La rodamina B se adicionó a partir de una solución stock a 1mg/ml (100X), la cual se esterilizó por filtración y se añadió al medio mineral en el momento de la inoculación de la muestra.
Todos los medios de cultivo se esterilizaron en autoclave a 121 0C (1 atm) durante 20 min.
Aislamiento de microorganismos con presunta actividad lipolítica
Para las muestras sólidas se tomaron con ayuda de una cucharilla estéril, bajo condiciones asépticas, porciones de aproximadamente 1 g y se llevaron a matraces que contenían 40 ml de Tween 80 0,1 % (v/v). Los matraces se agitaron en zaranda durante 2 h a 150 rpm. Posteriormente se tomaron 2,5 ml de cada una de las suspensiones en Tween 80, así como de cada una de las muestras líquidas y se añadieron a matraces de 250 ml que contenían 40 ml del medio selectivo a base de aceite de soya como única fuente carbono y energía, para favorecer el crecimiento de microorganismos lipolíticos. Los matraces se incubaron en agitación en zaranda durante 72 h. Transcurrido este tiempo, se realizaron diluciones seriadas de cada uno de los cultivos y se efectuó la siembra por diseminación en placas Petri conteniendo la variante sólida del mismo medio de cultivo. La siembra se realizó por duplicado. Las placas se incubaron a 32 ºC durante 7 días, excepto para el caso de la muestra M4, la cual se incubó a 42 ºC por proceder de un sitio expuesto a temperaturas elevadas (trampa de vapor). Se realizaron observaciones del crecimiento cada 24 h.
Se seleccionaron colonias pertenecientes a los diferentes tipos morfológicos presentes y cuya morfología se correspondió con la típica de hongos filamentosos y levaduras, verificándose mediante observación al microscopio la correspondencia con el grupo microbiano esperado. Las colonias seleccionadas se purificaron mediante la técnica de agotamiento en placas. A los cultivos purificados se les comprobó la pureza mediante examen al microscopio. Los cultivos purificados se conservaron en cuñas de medio YPDA a 4 ºC.
Evaluación cualitativa de la presencia de actividad lipolítica en los aislados
Para este ensayo se utilizaron dos medios, uno a base de Tween 80 y CaCl2 y otro a base de aceite de soya y rodamina B, cuya composición se describió anteriormente. Los microorganismos purificados se sembraron con palillos estériles en placas Petri conteniendo los medios correspondientes y se incubaron a 32 ºC durante 4-7 días. En el medio que contenía Tween 80 y CaCl2 se consideró como respuesta positiva al ensayo de actividad lipolítica la presencia de un halo opaco (debido a la precipitación de la sal cálcica del ácido graso) o transparente (como consecuencia de su consumo) alrededor de la colonia. En tanto, en el medio conteniendo aceite de soya y rodamina B se consideró como respuesta positiva la presencia de un halo fluorescente anaranjado alrededor de la colonia cuando las placas se expusieron a luz ultravioleta (350 nm) [18].
Evaluación cuantitativa de la actividad lipolítica
A las cepas que mostraron los mejores resultados en los ensayos cualitativos de actividad enzimática se les realizó una evaluación cuantitativa de la actividad lipolítica extracelular en medio líquido. Para ello, los hongos se sembraron en cuñas de YPDA hasta obtenerse una esporulación abundante. Con el asa de siembra se tomó una carga abundante de esporas y se procedió a inocular matraces de 200 ml conteniendo 40 ml del medio YPD. Los matraces se incubaron en zaranda a una velocidad de agitación de 150 rpm, a 32 ºC durante 48 h. Se tomaron entonces 2 ml de estos cultivos (suspensiones de micelio) y se inocularon matraces de 200 ml conteniendo 40 ml del medio selectivo (el mismo medio usado para el aislamiento, pero sin la adición del antibiótico), formulado a base de aceite de soya como fuente de carbono y energía. Lo matraces se incubaron en zaranda, a una velocidad de agitación de 150 rpm, a 32 ºC durante 7 días. Se tomaron muestras a los 2, 4 y 7 días para la determinación de la actividad enzimática lipasa extracelular. Previo al ensayo enzimático, las muestras de los cultivos fúngicos se centrifugaron a 6 000× g durante 15 min para separar el micelio del medio de cultivo.
La actividad lipolítica se evaluó de acuerdo al método propuesto por Marseno et al . [19], basado en la determinación colorimétrica de los ácidos grasos liberados, los cuales forman con los iones cobre un complejo de color azul, soluble en isooctano. Se utilizó como sustrato una solución de aceite de soya al 40 % (v/v) en isooctano. La mezcla de reacción estuvo conformada por 2 ml del sustrato y 500 µl del crudo enzimático (sobrenadante de los cultivos), situados en tubos de ensayo de vidrio, provistos de tapa de rosca. La mezcla se agitó vigorosamente en zaranda (250 rpm) durante 1 h a 30 ºC y la reacción se detuvo añadiendo 100 µl de HCl 6 mol/l. Posteriormente se tomó un 1 ml de la fase orgánica (superior) y se añadió a un tubo de ensayos que contenía 1 ml de isooctano y 400 µl del buffer acetato de cobre – piridina [se preparó disolviendo 5 g de acetato de cobre en 80 ml de agua destilada; luego se ajustó a pH 6 con piridina y se llevó a 100 ml con agua destilada], se mezcló durante 5 s en vortex y se dejó en reposo por 10 min. Finalmente se midió la absorbancia de la fase orgánica (superior) en un espectrofotómetro a 715 nm contra un blanco de isooctano.
RESULTADOS Y DISCUSIÓN
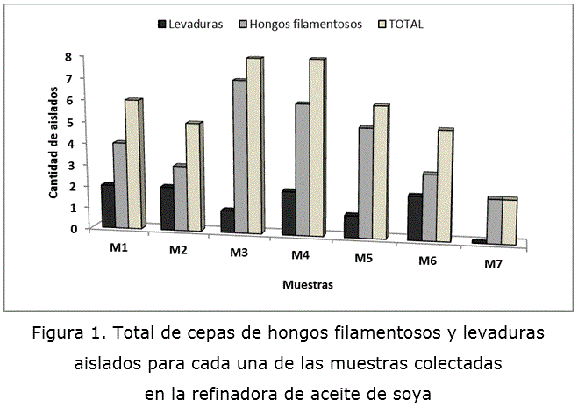
Durante el crecimiento de los microorganismos presentes en las distintas muestras colectadas en la fábrica refinadora de aceite de soya en el medio de cultivo selectivo utilizado, a base de aceite de soya como única fuente de carbono y energía, se apreciaron cambios cualitativos en el aspecto del medio, que evidenciaron el crecimiento microbiano y las transformaciones operadas en el sustrato. En particular, para el caso de las muestras M2 y M3, el medio de cultivo se tornó a las 72 h de aspecto transparente, desapareciendo completamente el aspecto lechoso de la emulsión del aceite en agua, lo cual indicó la ocurrencia de una degradación extensa del sustrato incorporado al medio. En todos los casos se observó un crecimiento microbiano abundante, predominado la existencia de biomasa filamentosa, de estructura difusa y compacta (pellets).
De las 7 muestras colectadas se aislaron un total de 40 cepas de microorganismos presuntamente lipolíticos, caracterizados por su capacidad de crecer utilizando aceite de soya como única fuente de carbono y energía. De ellos, 30 presentaron colonias con características morfológicas que se corresponden con las de los hongos filamentosos y 10 con características levaduriformes, lo cual se comprobó con la observación al microscopio de cada uno de los aislados. En las observaciones microscópicas se evidenció la presencia generalizada de hifas septadas en los hongos filamentosos; en tanto, las levaduras presentaron células ovoides y globosas, con gemación abundante.
En la figura 1 se presenta la distribución de aislados para cada una de las muestras. Se destacaron con el mayor número de aislados las muestras sólidas M3 y M4, con un predominio de los hongos filamentosos sobre las levaduras.
Los resultados de los aislamientos obtenidos coinciden con los referidos por Aceves y Castañeda en 2012 [12]. Estos autores plantearon que los microorganismos con un alto potencial para producir lipasas pueden ser encontrados en diferentes hábitats naturales, principalmente en desechos o residuos de aceites vegetales, industrias de productos lácteos y en suelos contaminados con aceites y alimentos deteriorados. Esto indica que el ambiente natural ofrece amplias posibilidades para aislar nuevos microorganismos productores de lipasas con propiedades novedosas. A partir de estos ambientes se han aislado bacterias, hongos filamentosos, levaduras y actinomicetos, entre los que sobresalen los géneros Pseudomonas, Bacillus, Rhodococcus, Staphylococcus, Rhizopus, Mucor, Candida, Aspergillus y Geotrichum por su capacidad para producir lipasas extracelulares [12].
La estrategia de aislamiento utilizada en este trabajo se centró en la búsqueda de hongos (hongos filamentosos o levaduras), por lo que durante el aislamiento se añadió al medio de cultivo el antibiótico de amplio espectro tetraciclina. El uso de este antibiótico limitó de forma casi absoluta la presencia de bacterias en los aislados, facilitando así el aislamiento de hongos filamentosos y organismo levaduriformes.
Las lipasas de origen fúngico se prefieren, en lugar de las bacterianas, por su capacidad de actuar en rangos más amplios de temperatura durante el proceso catalítico y, sobre todo, debido a que su producción generalmente se efectúa en el medio extracelular. El mayor uso industrial de estas enzimas obedece, principalmente, a que permiten reducir los costos de producción [20].
La temperatura es una variable de máxima importancia a considerar en las reacciones enzimáticas, debido a su impacto sobre la estabilidad de las enzimas. Así, para el caso de las lipasas fúngicas, la temperatura óptima de acción catalítica suele estar entre los 40-60 °C, siendo capaces de conservar el 100 % de actividad incluso después de 4 h, permitiéndoles su gran versatilidad en aplicaciones dentro de diferentes áreas industriales [20].
A las 40 cepas aisladas se le realizó la evaluación cualitativa de actividad lipolítica en placas Petri, utilizando las técnicas de crecimiento en medios de cultivo con Rodamina B y Tween 80+CaCl2. En la tabla 1 se presentan un resumen de los resultados de estos ensayos y en la figura 2 se muestra un ejemplo de cepas productoras de lipasa sometidas al ensayo con el fluorocromo Rodamina B.
TABLA 1. RESULTADO DE LOS ENSAYOS CUALITATIVOS DE ACTIVIDAD LIPOLÍTICA.
Se informa el número de aislados para cada respuesta
| Respuesta a Rod/Tw* | M1 | M2 | M3 | M4 | M5 | M6 | M7 | Total |
| d/d | 3 | 2 | 5 | 8 | 5 | 3 | 2 | 28 |
| m/m | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 |
| i/m | 3 | 1 | 1 | 0 | 0 | 0 | 0 | 5 |
| m/i | 0 | 1 | 2 | 0 | 0 | 1 | 0 | 4 |
| i/i | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 2 |
| Total | 6 | 5 | 8 | 8 | 6 | 5 | 2 | 40 |
* Respuesta a los ensayos en medios de cultivo con Rodamina B (Rod)/ Tween 80+ CaCl2 (Tw); Leyenda: d, respuesta débil o poco definida; m, respuesta de mediana intensidad; i, respuesta intensa y bien definida.
Se observó que la actividad enzimática varió considerablemente entre las cepas aisladas, aunque en general una misma cepa mostró respuestas similares en ambos ensayos, lo cual sugiere la factibilidad de emplear indistintamente uno u otro. Hubo predominio de cepas con respuestas débiles (28 de 40 aislados examinados), seguido de cepas que mostraron respuestas intensas en uno de los ensayos y de mediana intensidad en el otro (9 cepas). Solo se obtuvieron 2 aislados cuyas respuestas resultaron intensas en ambos ensayos, procedentes estas de las muestras M5 y M6, ambas muestras correspondientes a aguas residuales contaminadas con los residuos oleosos.
Sin embargo, la mayoría de los aislados con mayor actividad lipolítica procedieron principalmente de muestras sólidas. La adsorción de las grasas sobre la superficie de las partículas sólidas del polvo constituye un elemento que facilita la posterior instalación y colonización por los hongos, organismos estos naturalmente adaptados para el crecimiento sobre superficies sólidas. Al tratarse de un medio rico en grasas, se ve favorecido el crecimiento de aquellas estirpes lipolíticas. Por otro lado, la hidrólisis de las grasas conduce a la acidificación del medio de cultivo, lo que unido a la baja actividad de agua característica de materiales sólidos ricos en grasas, crea un ambiente propicio para el desarrollo preponderante de hongos filamentosos con respecto a otros grupos microbianos. De este modo, el medio natural actúa como medio selectivo [21].
En diversos estudios [18, 22, 23] se ha planteado que la actividad lipolítica puede ser determinada por diferentes métodos, pero que los ensayos visuales como los colorimétricos y los fluorimétricos pueden ser usados en experimentos preliminares cuando aún no es necesaria la cuantificación. Estos mismos autores hacen referencia al uso de la rodamina B y el Tween 80 en este tipo de ensayos, evidenciando que los Tweens han sido probados como substrato para lipasas de diferentes microorganismos y que estos son muy estables en diluciones alcalinas y soluciones ácidas minerales, de ahí que en la presente investigación se haya utilizado un medio de cultivo mineral (ajustado a pH 6) para los ensayos cualitativos de actividad lipolítica. De igual modo la literatura hace referencia a que si los microorganismos son probados con los Tweens como substrato y tienen actividad lipolítica, entonces un halo opaco puede ser observado alrededor de la colonia, lo que coincide con las observaciones efectuadas en este trabajo para las cepas evaluadas.
Por otra parte, la detección de actividad lipolítica usando rodamina B tiene la ventaja de ser insensible a los cambios de pH del medio de cultivo. Este ensayo se basa en la interacción de la forma catiónica de la rodamina B con la forma aniónica de los ácidos grasos, conducente a la formación de complejos cuya estabilidad e intensidad de la fluorescencia es proporcionalmente inversa a la longitud de la cadena de los ácidos grasos. Carissimi et al. [18] recomiendan el uso de este fluorocromo y no el Azul Victoria, que es otro indicador de lipólisis, dado que este último puede ofrecer falsos positivos debido a la producción de ácidos durante el consumo de los carbohidratos por los microorganismos. Entre los hongos lipolíticos evaluados por este método se encuentran Rhizopus delemar, Mucor lipolyticus, M. hiemalis, M. javanicus, Geotrichum candidum, Penicillium cyclopium, Fusarium oxysporum, Rhizopus oryzae, Aspergillus japonicus, A. oryzae y A. niger [18, 22, 23].
De los resultados obtenidos en la evaluación cualitativa de la actividad lipolítica, se seleccionaron las 12 cepas que mostraron mayor intensidad de fluorescencia en el ensayo con la Rodamina B y halos de precipitación mejor definidos y de mayor tamaño en el ensayo con Tween 80 + CaCl2. De las cepas seleccionadas 9 procedieron de muestras sólidas (MS) y 3 de muestras líquidas (ML). Estas cepas se sometieron a la evaluación cuantitativa de la actividad enzimática lipolítica por el método espectrofotométrico, usando como sustrato aceite de soya.
En la figura 3 se muestran los resultados de la cuantificación de la actividad enzimática lipolítica extracelular, la cual se evaluó en tres momentos del cultivo (2, 4 y 7 días) para las cepas que presentaron mayor actividad lipolítica en los ensayos cualitativos. En todas las cepas se observó un comportamiento semejante, que sugiere la presencia de dos tipos de lipasas predominantes, cuyos acumulados máximos se presentaron al segundo y séptimo día, excepto en las cepas MS3-12, ML5-32 y ML6-37 en las que se observó la existencia de un solo máximo de producción de lipasa. Las cepas con mayor actividad lipolítica fueron MS1-5, MS2-8, MS2-11y MS2-10 con valores de 240, 225, 217 y 202 U/l, respectivamente. El hallazgo de que tres de las cuatro cepas con mayor actividad lipolítica procedan de la muestra M2, se corresponde con los cambios observados en el medio de cultivo durante la etapa de enriquecimiento en el medio a base de aceite de soya como única fuente de carbono y energía, caracterizados por la desaparición de la emulsión y el aspecto transparente del medio a las 72 h de cultivo.
La presencia de diferentes isoenzimas lipasas, cuya síntesis está regulada de modo diferente, es un hecho frecuente en la fisiología de los microorganismos. En este caso particular, la presencia de un máximo de actividad lipolítica a los dos días de cultivo debe corresponder a una función trófica, ya que el medio de cultivo solo contiene como fuente de carbono y energía al aceite vegetal. La aparición tardía de otra isoenzima, podría obedecer a procesos relacionados con el metabolismo secundario de los hongos, una vez agotado el sustrato.
Existen en la literatura diversos informes de hongos filamentosos del género Penicillium como productores de lipasas. Miranda et al. [24] aislaron una cepa de Penicillium citrinum encontrado como contaminante en aceite de oliva. P. citrinum presentó dos picos de actividad lipolítica, a las 25 y 120 h, concluyendo que este microorganismo produce dos tipos enzimas lipolíticas. Lima et al. [25] hacen alusión también al género Penicillium como productor de varias lipasas; en el caso de la especie P. aurantiogriseum (P. cyclopium) se ha mencionado por varios autores la existencia de tres tipos de lipasas. Todos estos informes se corresponden con los resultados obtenidos en este trabajo. Los caracteres morfológicos observados (coloración verde-azulada en el centro de de la colonia, hifas septadas, conidios dispuestos sobre una estructura reproductiva en forma de pincel) sugieren que algunos de los hongos filamentosos seleccionados en este trabajo podrían pertenecer al género Penicillium.
En otros estudios con cepas lipolíticas de hongos filamentosos se han obtenido valores de actividad enzimática similares a los obtenidos en la presente investigación. Por ejemplo, Coca et al. refieren en su trabajo [26] que las mejores cepas correspondieron a especies del género Aspergillus (A. niger y A. fumigatus), las que presentaron actividades enzimáticas de 260 y 210 UI/l, respectivamente.
CONCLUSIONES
En esta investigación se demostró la factibilidad de la estrategia de aislamiento y selección utilizada para la obtención de nuevos aislados de hongos filamentosos productores de lipasa extracelular, a partir de muestras sólidas y líquidas contaminadas con residuos oleosos procedentes de una refinadora de aceite vegetal. Se comparó la eficacia y similitud de los resultados aportados por los dos métodos de evaluación cualitativa de la actividad lipolítica, basados en la formación de halo de precipitación en el medio con Tween 80 más CaCl2 y de un halo fluorescente, en el medio con el fluorocromo rodamina B. La evaluación cuantitativa de la actividad lipolítica extracelular permitió seleccionar cuatro cepas de hongos filamentosos capaces de acumular más de 200 U/l de la enzima. Estos resultados sirven de base para estudios futuros encaminados a la optimización del proceso fermentativo para la obtención de lipasas, así como a la caracterización cinética de las enzimas en la reacción de transesterificación implicada en la síntesis del biodiesel.
REFERENCIAS BIBLIOGRÁFICAS
1. BORGES, M. E.; DÍAZ, L. "Recent developments on heterogeneous catalysts for biodiesel production by oil esterification and transesterification reactions: A review". Renewable and Sustainable Energy Reviews. 2012, 16, 2839-2849. ISSN: 1364-0321.
2. GERHARD, K.; VAN GERPEN, J.; KRAHL, J. The Biodiesel Handobook. AOCS Press ed. 2005, Champaign, Illinois.
3. DINCER, K. "Lower emissions from biodiesel combustion". Energy Sources, Part A: Recovery, Utilization, and Environmental Effects. 2008, 30(10), 963-968. ISSN: 1556-7230.
4. SIGAR, C. P. et al. "Performance and emission characteristics of vegetable oil as diesel fuel extender". Energy Sources, Part A: Recovery, Utilization, and Environmental Effects. 2008, 31(2), 139-148. ISSN: 1556-7230.
5. BORUGADDA, V. B.; GOUD, V. V. "Biodiesel production from renewable feedstocks: Status and opportunities". Renewable and Sustainable Energy Reviews. 2012, 16, 4763-4784. ISSN: 1364-0321.
6. GONZÁLEZ, J.; RODRÍGUEZ, J.; DEL MONTE, A. "Lipases: enzymes having the potential for developing immobilised biocatalysts by interfacial adsorption". Rev. Colomb. Biotecnol. 2010, 12(1), 124-140. ISSN : 0123-3475.
7. BURKET, J. F. M. Optimization of production conditions of lipase from Geotrichum candidum NRRL Y-552. Tesis doctoral, Universidad de Campinas, Barão Geraldo, São Paulo, Brazil, 2003.
8. FEVRIER, P. et al. "Evaluation of regioselectivity of lipases based on synthesis reaction conducted with propyl alcohol, isopropyl alcohol, and propylene glycol". J. Mol. Catal. B-Enzym. 2001, 11, 445-453. ISSN: 1381-1177.
9. HASAN, F.; AHAH, A. A.; HAMEED, A. "Industrial applications of microbial lipases". Enzyme Microb. Tech. 2006, 39, 235-251. ISSN: 0141-0229.
10. CASA, R. M.; JSINISTERRA, J. V.; MONTERO, J. M. S. "Characterization and catalytic properties of a new crude lipase from C. rugosa". Enzyme Microb. Tech. 2006, 38, 599-609. ISSN: 0141-0229.
11. SRIMHAN, P. et al. "Selection of lipase producing yeasts for methanol-tolerant biocatalyst as whole cell application for palm-oil transesterification". Enzyme and Microbial Technology. 2011, 48, 293–298. ISSN: 0141-0229.
12. ACEVES, A. E.; CASTAÑEDA, L. M. "Producción biotecnológica de lipasas microbianas, una alternativa sostenible para la utilizació n de residuos agroindustriales". Vitae. 2012, 19(3). ISSN 0121-4004.
13. SZTAJER, H.; MALISZEWSKA, I.; WIECZOREK, J. "Production of exogenous lipase by bacteria, fungi and actinomycetes". Enzyme Microb Technol. 1988, 10, 492–497. ISSN: 0141-0229.
14. WANG, Y. et al. "Thermostable alkaline lipase from a newly isolated thermophilic Bacillus strain, A30-1 (ATCC 53841)". J Ferment Bioeng. 1995, 79, 433-438. ISSN: 0922-338X.
15. NWUCHE, C. O.; OGBONNA, J. C. "Isolation of lipase producing fungi from palm oil mill effluent (POME) dump sites at Nsukka". Brazilian Archives of Biology and Technology. 2011, 54(1), 113-116. ISSN 1678-4324.
16. GOLDBECK, R.; MAUGERI FILHO, F. "Screening, characterization, and biocatalytic capacity of lipases producing wild yeasts from Brazil biomes". Food Sci. Biotechnol. 2013, 2 (S), 79-87. ISSN: 2092-6456.
17. PAKEVICIUS, A. "Lipase activity of yeasts and yeast-like fungi functioning under natural conditions". Biologija. 2001, 4, 16-18. ISSN 2029-0578.
18. CARISSIMI, M. et al. "Comparison of lipolytic activity of Sporothrix schenckii strains utilizing olive oil-rhodamine B and Tween 80". TECNO-LÓGICA. 2007, 11(1-2), 33-36. ISSN: 1982-6753.
19. MARSENO, D.; INDRATI, R.; OHTA, Y. "A simple method for determination of free fatty acids for soluble and immobilized lipase assay". Indonesian Food and Nutrition Progress. 1998, 5(2). ISSN: 2597-9388.
20. REINEHR, C.O. et al. "Produção de lipases de Aspergillus niger e Aspergillus fumigatus a través de fermentação em estado sólido, avaliação da especificidade do substrato e seu uso em reações de esterificação e alcoólise". Quim. Nova. 2014, 37(3), 454-460. ISSN 1678-7064.
21. NWUCHE, C. O.; OGBONNA, J. C. "Isolation of lipase producing fungi from palm oil mill effluent (POME) dump sites at Nsukka". Braz. Arch. Biol. Technol. 2011, 54(1), 113-116. ISSN 1678-4324.
22. ERTUGRUL, S.; DÖNMEZ, G.; TAKAÇ, S. "Isolation of lipase producing Bacillus sp. from olive mil wastewater and improving its enzyme activity". Jourmal of Hazardous Materials. 2009, 149, 720–724. ISSN: 0304-3894.
23. HASSAN, F.; SHAH, A.A.; HAMEED, A. "Methods for detection and characterization of lipases: A comprehensive review". Biotechnology Advances. 2009, l(27), 782-798. ISSN: 0734-9750.
24. MIRANDA, O. A. et al. "Lipase production by a Brazilian strain of Penicillium citrinum using industrial residue". Biores. Technol. 1999, 69, 145-147. ISSN: 0960-8524.
25. LIMA, V. et al. "Effect of nitrogen and carbon sources on lipase production by Penicillium aurantiogriseum". Food Technol. Biotechnol. 2003, 1(2), 105-110. ISSN 1334-2606.
26. COCA, J. et al. "Producción y caracterización de las lipasas de Aspergillus niger y A. fumigatus". Biotecnología Aplicada. 2001, 18, 216-220. ISSN 1027-2852.
Recibido: 2/02/2018
Aceptado: 30/04/2018
Dr. C Manuel Serrat-Díaz, Centro de Estudios de Biotecnología Industrial, Facultad de Ciencias Naturales y Exactas, Universidad de Oriente, mserrat@uo.edu.cu