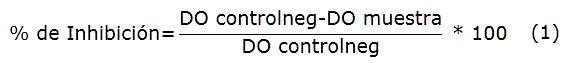Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.30 no.3 Santiago de Cuba set.-dic. 2018
ARTICULOS
Actividad antiinflamatoria y antioxidante in vitro de extractos etanólicos de Jatropha aethiopica Müell Arg var inermis
In vitro antioxidant and anti-inflammatory activities of ethanolic extracts of Jatropha aethiopica Müell Arg var inermis
Lic. Lázaro Eduardo Valdés-IzaguirreI; Dr. C. Quirino Arias-CedeñoII; MSc. Jorge Ramírez-ArzuagaII; Dr. C. Dilver Peña-FuentesII
IDepartamento de Medicina Veterinaria, Facultad de Ciencias Agropecuarias, Universidad de Granma, Cuba
IICentro de Estudios de Química Aplicada, Facultad de Ciencias Técnicas, Universidad de Granma, Cuba, qariasc@udg.co.cu
RESUMEN
Fue evaluada la actividad antiinflamatoria in vitro de los extractos etanólicos obtenidos a partir de las raíces, hojas y corteza de Jatrophaa ethiopica, mediante el método de estabilización de la membrana eritrocitaria; así como la actividad antioxidante por tres métodos diferentes: poder reductor férrico, inhibición de la peroxidación lipídica y la capacidad antioxidante total. Se determinó la composición fitoquímica cualitativa de los extractos vegetales mediante tamizaje fitoquímico. Los extractos de las hojas y raíces de J. aethiopica presentaron actividad antinflamatoria superior a la del diclofenaco sódico. La actividad antioxidante detectada para los extractos etanólicos de las hojas, corteza y raíz resultó comparable a la del ácido ascórbico,en los tres métodos evaluados. Los resultados del tamizaje fitoquímico sugieren que la actividad biológica mostrada por los extractos de esta planta podría estar relacionada con el contenido de polifenoles, saponinas, glucósidos cardiotónicos, terpenos y esteroides.
Palabras clave: actividad antinflamatoria, actividad antioxidante, tamizaje fitoquímico, Jatropha aethiopica.
ABSTRACT
The in vitro anti-inflammatory activity by membrane stabilization method and the anti-oxidant activity by three different methods: ferric reducing power, inhibition of lipid peroxidation and total antioxidant capacity of the ethanolic extracts prepared from roots, leaves and stem bark of Jatropha aethiopica was evaluated. The qualitative phytochemical composition of the vegetal extracts was determined by phytochemical screening. The extracts from roots and leaves of J. aethiopica have shown anti-inflammatory activity that was higher than sodium diclofenac. The anti-oxidant activity found for the ethanolic extracts of leaves, stem bark and roots was comparable with the activity of ascorbic acid, in all the evaluated methods. The results of the phytochemical screening suggest that the biological activity shown by the extracts of this plant could be related with the presence of polyphenols, saponins, cardiotonic glycosides, terpenes and steroids.
Keywords: anti-inflammatory activity, antioxidant activity, phytochemical screening, Jatropha aethiopica.
INTRODUCCIÓN
El estrés oxidativo y los fenómenos inflamatorios se relacionan fisiopatológicamente en varias afecciones animales y humanas, entre las cuales se incluyen el cáncer, la aterosclerosis y la diabetes, así como en condiciones fisiológicas como el envejecimiento [1]. Durante el curso del estrés oxidativo se liberan múltiples especies reactivas del oxígeno (EROs) que juegan un importante papel en la patogénesis de las enfermedades inflamatorias [2].
La liberación de EROs por parte de las células inflamatorias activadas, como los neutrófilos y los macrófagos, conduce al daño tisular por modificación de la estructura química de macromoléculas como el ADN y las proteínas, así como por peroxidación de los lípidos de membrana [3]. Las EROs estimulan además la liberación de citocinas pro inflamatorias (interleucina-1, interferón-γ y factor de necrosis tumoral-α), las que producen el reclutamiento adicional de macrófagos y neutrófilos. Por tanto, el estrés oxidativo es un factor importante en la aparición y mantenimiento de los procesos inflamatorios y su control por medio de los antioxidantes puede reducir los efectos de la inflamación [4]. Diversos compuestos utilizados como fármacos, entre ellos el ácido ascórbico, los tocoferoles, la ficocianina y la N-acetilcisteína han mostrado efecto antinflamatorio por medio de un mecanismo antioxidante [5, 6].
Varios antioxidantes sintéticos se encuentran comercialmente disponibles hoy en día, pero su alto costo y la alta frecuencia de aparición de efectos secundarios los hace poco prácticos para el tratamiento del estrés oxidativo y las complicaciones asociadas a este. En este sentido, los antioxidantes naturales han recibido mucha atención debido a su bajo costo, gran abundancia en fuentes como las plantas y al hecho de que frecuentemente no presentan efectos secundarios indeseables [7].
Los mecanismos de acción de los antioxidantes naturales incluyen la donación de átomos de hidrógeno, el atrapamiento o estabilización de radicales libres, la quelación de iones metálicos, entre otros [8]. Por tanto, la investigación de la actividad antioxidante de un compuesto o extracto natural debe llevarse a cabo explorando diversos métodos que abarquen varios de estos posibles mecanismos [9].
Jatropha aethiopica, nativa del África tropical, conocida comúnmente como "chaya" o "mata diabetes", es un árbol de la familia de las Euforbiáceas de varios metros de altura y más de 20 cm de diámetro en la base, muy ramificado, lechoso y de muy hermosa apariencia. Esta especie, introducida en Cuba con fecha y origen desconocidos [10], es utilizada como alimento en ensaladas y como forraje en la alimentación del ganado [11, 12]. La medicina popular le atribuye propiedades no solo para controlar, sino para curar totalmente la diabetes mellitus [13].
MATERIALES Y MÉTODOS
El trabajo experimental se desarrolló en el Laboratorio de Productos Naturales del Centro de Estudio de Química Aplicada de la Universidad de Granma, Cuba. Los reactivos y disolventes empleados en los análisis fueron de calidad "puros" o "analíticos" provenientes de las firmas Merck y Sigma-Aldrich. Las determinaciones espectrofotométricas fueron realizadas en un equipo UV-vis, Rayleigh UV-2100 y la centrifugación en una HettichEBA20.
Material vegetal
Las muestras de hojas, cortezas y raíces de plantas adultas de J. aethiopica fueron recolectadas en la zona este de la ciudad de Bayamo, provincia Granma, Cuba, en enero de 2017 y procesadas según la norma ramal de salud pública NRSP 309 [14]. La planta fue identificada y autenticada como Jatropha aethiopica Müell Arg var inermis, por el Dr. C. Luis Catasús Guerra, especialista del Jardín Botánico Cupaynicú de la provincia Granma. Un ejemplar de la especie fue depositado con el registro 2595, Serie Catasús.
Preparación de las muestras
El material vegetal fue lavado con hipoclorito de sodio al 2 %, secado a la sombra durante 7 días y luego en estufa con recirculación de aire a 40 ºC durante 6 h. La droga seca se trituró en un molino IKA Basic con cabezal de molienda MF 10.1 hasta obtener un tamaño de partícula de 1 mm. Fueron utilizados 15 g de polvo vegetal para preparar 100 mL de extracto etanólico sometiéndolo a ultrasonido por 2 h a una frecuencia 40 KHz y una temperatura de 40 ºC. Los extractos fueron concentrados en un rotoevaporador IKA RV10 con una temperatura de 40 ºC, hasta obtener un residuo consistente que fue conservado a 4 ºC para la realización de los ensayos.
Determinación de la actividad antinflamatoria in vitro
La actividad antinflamatoria in vitro se determinó usando el método descrito por Shinde et al. [15]. Un mL de solución de concentración 1 mg/mL del extracto vegetal o del control positivo (diclofenaco de sodio) fue mezclado con 0,5 mL de suspensión de eritrocitos en solución isosalina (NaCl 0,9 %), 1 mL de buffer fosfato (pH 7,4) y 2 mL de solución hiposalina (NaCl 0,45 %). La mezcla fue incubada por 30 min a 37 ºC y luego centrifugada a 3 000 rpm por 10 min. El contenido de hemoglobina del sobrenadante fue estimado espectrofotométricamente a 560 nm. La actividad antinflamatoria se determinó como porcentaje de inhibición de la lisis osmótica eritrocitaria, y se calculó según la fórmula (1). Como control negativo se usó un ensayo con 1 mL de tampón de fosfato en lugar de muestra.
Determinación de la actividad antioxidante
La actividad antioxidante fue evaluada por tres métodos diferentes, utilizando concentracionesde los extractos de 5, 10 y 50 mg/mL, y se expresó como el valor medio de tres réplicas.
Poder reductor férrico
El poder reductor férrico (FRP) se determinó a través del método descrito por Oyaizu [16]. Fue mezclado 1 mL de cada muestra con 2,5 mL de tampón fosfato (0,5 mol/L, pH7) y 2,5 mL de una disolución de ferricianuro de potasio al 1 %. La mezcla se incubó a 50 ºC durante 20 min. Posteriormente se adicionaron 2,5 mL de ácido tricloroacético (TCA) al 10 % y se centrifugó por 10 min a 3 000 rpm. Parte de la solución sobrenadante (2,5 mL) fue mezclada con 2,5 mL de agua destilada y 0,5 mL de cloruro de hierro (III) al 0,1 %. Finalmente se determinó la absorbancia a 700 nm. Los resultados se expresaron en µmol/mL como equivalentes de Fe(II).
Inhibición de la peroxidación lipídica
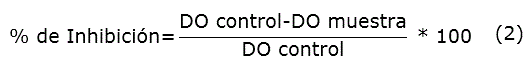
La capacidad de los extractos de inhibir la peroxidación lipídica (% de IPL) se evaluó por el método descrito por Ruberto et al. [17]. Fueron mezcladas 1,5 mL de muestra de los extractos vegetales o una disolución de ácido ascórbico (control positivo) de concentración 10 mg/mL con 2,5 mL de homogenado de huevo de gallina (10 % v/v en tampón fosfato salino pH 7,4) y 1 mL de agua destilada. Se añadieron 250 µL de una disolución de FeSO4 (0,075 mol/L) en ácido ascórbico (0,04 mol/L) para inducir la peroxidación. La mezcla se incubó por 1 h a 37 °C, se añadió 1 mL de ácido etilendiaminotetraacético (0,1 mol/L) para detener la reacción de oxidación y se tomaron 2,5 mL para la determinación de lipoperóxidos. Seguidamente se añadieron 5 mL de solución reactiva (0,937 5 g de ácido tiobarbitúrico (TBA), 37,5 g de TCA en 250 mL deHCl (25 mol/L))y se incubó por 15 min a 80 °C. Se centrifugó por 10 min a 3 000 rpm y se midió la absorbancia del sobrenadante a 532 nm. Como control negativo se usó una mezcla con todos los componentes a excepción del extracto vegetal. El por ciento de inhibición de la peroxidación lipídica se calculó por la fórmula (2).
Capacidad antioxidante total
Para la determinación de la capacidad antioxidante total (CAT) se usó el método descrito por Prieto et al. [18]. Se mezclaron 0,5 mL del extracto vegetal o del blanco (disolvente), 5 mL de disolución reactiva (0,6 mol/L de ácido sulfúrico, 28 mmol/L de fosfato sódico y 4 mmol/L de heptamolibdato de amonio) y se incubaron por 90 minutos a 95 °C. Se centrifugó por 3 min a 60 000 rpm y se determinó la absorbancia del sobrenadante a 695 nm contra el blanco. Los resultados se expresaron en equivalentes de ácido ascórbico.
Análisis de la composición fitoquímica
Para la determinación de la composición fitoquímica de los grupos de metabolitos secundarios presentes en los extractos etanólicos fue aplicado un conjunto de métodos específicos, rápidos y sencillos estandarizados para el tamizaje fitoquímico [19].
Análisis estadístico
RESULTADOS Y DISCUSIÓN
Actividad antinflamatoria in vitro
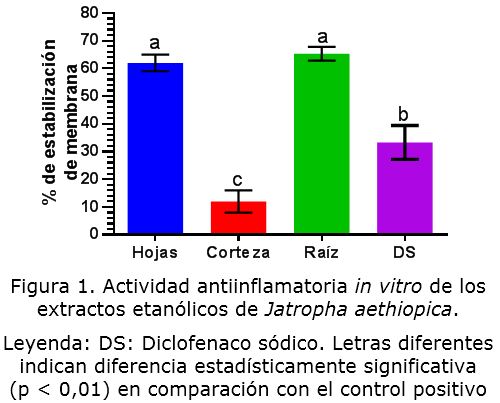
Los resultados de la actividad antinflamatoria in vitro de los extractos etanólicos de las diferentes partes de la J. aethiopica muestran que los extractos de hojas y raíces produjeron una estabilización de la membrana eritrocitaria de un 62 y 65,3 % respectivamente, sin diferencias estadísticamente significativas entre ellos, ambos también significativamente superiores a la actividad del diclofenaco sódico (figura 1). Los extractos de corteza, por su parte, no mostraron una actividad antinflamatoria significativa (12 % de estabilización).
La estabilización de membranas ha sido propuesta como mecanismo clave en la actividad antinflamatoria de diversas plantas medicinales [20]. La membrana eritrocitaria resulta análoga a la membrana lisosomal, y su estabilización por los extractos vegetales se considera como un buen indicador de la actividad antinflamatoria de estos [15]. Al estabilizar las membranas lisosomales se limita la liberación de mediadores de la inflamación por los macrófagos y neutrófilos, controlando así la intensidad del proceso inflamatorio [20]. Los detalles del mecanismo por el cual los extractos vegetales inducen la resistencia a la lisis osmótica eritrocitaria no han sido totalmente esclarecidos. Una posible explicación pudiera ser el aumento de la retención de los solutos intracelulares o a la interacción con proteínas de membrana [21].
Los extractos alcohólicos de las hojas, tallos y raíces de otras especies del género Jatropha han mostrado actividad antinflamatoria in vivo por diferentes métodos [22, 23], lo que concuerda con los resultados del presente estudio y podría contribuir a aclarar el mecanismo de acción de los compuestos antiinflamatorios presentes en este género. Los resultados obtenidos en el presente trabajo muestran el potencial antiinflamatorio de los extractos etanólicos de hojas y raíces J. aethiopica.
Actividad antioxidante in vitro
Los resultados de la actividad antioxidante señalan que todos los extractos evaluados mostraron actividad antioxidante (Tabla 1). Con respecto a la actividad determinada por el método FRP, esta se incrementa con el aumento de la concentración para los tres órganos explorados. Los mejores valores del poder reductor se encontraron para los extractos de raíz y de hojas a una concentración de 50 mg/mL (55,58 ± 3,89 y 47,38 ± 3,32 equivalentes de Fe (II), respectivamente). Los extractos de la corteza fueron los de menor actividad para las tres concentraciones ensayadas.
TABLA 1. ACTIVIDAD ANTIOXIDANTE DE LOS EXTRACTOS ETANÓLICOS DE JATROPHA AETHIOPICA
| Muestra | Concentración (mg/mL) | FRP | % de IPL | CAT (mg/mL de AA) |
| Hojas | 5 | 36,30 ± 2,54A | 65,79 ± 4,30A | 0,36 ± 2,2E-02A |
| 10 | 37,86 ± 2,65A | 61,59 ± 4,02A | 0,50 ± 3,3E-02B | |
| 50 | 47,38 ± 3,32B | 64,79 ± 4,23A | 1,53 ± 0,1C | |
| Corteza | 5 | 25,84 ± 1,81A | 17,10 ± 1,11A | 0,23 ± 1,5E-02A |
| 10 | 35,05 ± 2,45B | 44,51 ± 2,90B | 0,35 ± 2,3E-02A | |
| 50 | 42,97 ± 3,01C | 36,54 ± 2,38C | 1,03 ± 0,1 B | |
| Raíz | 5 | 33,92 ± 2,37A | 30,62 ± 2,00A | 0,23 ± 1,5E-02A |
| 10 | 39,43 ± 2,76B | 41,75 ± 2,74B | 0,35 ± 2,3E-02A | |
| 50 | 55,58 ± 3,89C | 60,99 ± 3,99C | 0,88 ± 0,1B | |
| AA | 10 | - | 77,01 ± 6,16 | - |
Leyenda: Los valores se expresan como la media ± DS. Letras distintas para un mismo órgano
indican deferencias estadísticamente significativas (p < 0,01). AA: Ácido ascórbico.
En los ensayos de inhibición de la peroxidación lipídica, el aumento de la concentración de los extractos influyó significativa y positivamente para la actividad del extracto de raíz, pero no en el de las hojas. No obstante, los mayores valores de inhibición de la peroxidación lipídica corresponden al extracto de las hojas (65,79 ± 4,30 % de IPL) y al extracto de raíz a 50 mg/mL (60,99 ± 3,99 % de IPL), pero ambos resultan menores que los valores del ácido ascórbico a 10 mg/mL (tabla 1). Para el extracto de la corteza, cuando aumenta la concentración de 5 a 10 mg/mL se incrementa la actividad detectada por este método. Sin embargo, a 50 mg/mL se observó un descenso de la inhibición de la peroxidación lipídica. Esto podría deberse a que los metabolitos presentes en dicho órgano tengan actividad antioxidante solo a bajas concentraciones, revirtiéndose este efecto cuando aumenta la concentración. El fenómeno de reversión de la actividad antioxidante de varios compuestos ha sido atribuido a la generación adicional de especies radicálicas por los antioxidantes, cuando estos están en altas concentraciones [24].
Los resultados de la evaluación de la capacidad antioxidante total, al igual que para el FRP, mostraron un aumento de la actividad con el incremento de la concentración, para todos los extractos (tabla 1). El mayor valor de equivalentes de ácido ascórbico se obtuvo para el extracto de las hojas a 50 mg/mL (1,53 ± 0,1 mg/mL de ácido ascórbico).
Los extractos de las hojas y la raíz resultaron, de manera general, los de mayor actividad, al mostrar los valores más altos de CAT y FRP respectivamente. Estos resultados señalan que los compuestos presentes en estos órganos de la J. aethiopica ejercen un efecto antioxidante mediante la donación de electrones a las especies oxidadas [25]. Ambos extractos presentaron además un alto por ciento de IPL, lo que sugiere la estabilización de las especies radicálicas producidas como intermediarios de las reacciones de descomposición oxidativa de los lípidos [26].
Otras especies del género han mostrado una gran capacidad antioxidante, la cual ha sido relacionada con el contenido de flavonoides y terpenos [22, 27]. Henriques Marcondes et al. [28] mostraron que el extracto de las hojas de esta planta en n-butanol posee una alta capacidad para atrapar radicales, efectoatribuido a la alta concentración de flavonoides.
Composición fitoquímica
Con el objetivo de identificar los metabolitos responsables de la actividad antioxidante de los extractos de la J. aethiopica, se evaluó la composición fitoquímica de los extractos etanólicos de las diferentes partes de la planta (tabla 2).
TABLA 2. COMPOSICIÓN FITOQUÍMICA DE LOS EXTRACTOS ETANÓLICOS DE JATROPHA AETHIOPICA
| Metabolitos | Raíz | Corteza | Hojas |
| Cumarinas | + | ++ | ++ |
| Glicósidos cardiotónicos | + | - | + |
| Saponinas | ++ | - | + |
| Triterpenos | + | + | - |
| Esteroides | - | - | + |
| Carbohidratos reductores | ++ | + | ++ |
| Alcaloides | + | - | ++ |
| Aminoácidos libres | + | ++ | ++ |
| Flavonoides | + | + | + |
| Antocianidinas | + | + | - |
| Quinonas | - | + | + |
| Catequinas | + | + | + |
| Fenoles | + | + | + |
| Taninos | - | - | + |
Leyenda: (+) Presente; (++) Abundante; (-) Ausente
En todos los extractos se detectó presencia de cumarinas, terpenos y esteroides; metabolitos que han sido relacionados con la actividad antiinflamatoria de diversas plantas [22, 23, 29]. Es de destacar, además, la presencia en todos los extractos de polifenoles (quinonas, antocianidinas, flavonoides y taninos) que en varios estudios han mostrado estar relacionados con la capacidad antioxidante [17, 25, 28].
Estos resultados son coincidentes con los de Ocaña [30], quien encontró alcaloides, taninos, triterpenos y esteroides, antocianidinas, entre otros, en el extracto etanólico de las hojas de J. aethiopica; pero difieren en cuanto a la abundancia de polifenoles. Gimotea-Turro et al. [31] hallaron alcaloides, quercetina y varios glicósidos en el extracto de las hojas, resultados estos que son similares a los de la presente investigación. La diferencia en el perfil de metabolitos secundarios de estos extractos pudiera deberse a factores geoclimáticos que influyen cualitativa y cuantitativamente en la composición fitoquímica, fenómeno reportado para varias especies de plantas [32].
La composición fitoquímica de los extractos de la corteza y las raíces constituye el primer reporte para la especie en Cuba. Estudios de la corteza y tallos de otras especies del género Jatropha han encontrado la presencia de terpenos y las cumarinas [33], metabolitos presentes en J. aethiopica. Por su parte, análisis de la composición de las raíces de varios miembros del género han evidenciado la presencia de compuestos con notable actividad antiinflamatoria y antioxidante como los terpenos, flavonoides y esteroles [22, 26, 34].
CONCLUSIONES
Los extractos de las hojas y raíces J. aethiopica presentan actividad antinflamatoria in vitro superior a la del diclofenaco sódico. Los extractos etanólicos de las hojas, corteza y raíz muestran actividad antioxidante por los tres métodos evaluados, la cual resulta comparable a la del ácido ascórbico. Los resultados del tamizaje fitoquímico sugieren que la actividad biológica mostrada por los extractos de esta planta podría estar relacionada con el contenido de polifenoles, saponinas, glucósidos cardiotónicos, terpenos y esteroides.
AGRADECIMIENTOS
Agradecemos al Servicio Alemán de Intercambio Académico (DAAD) por el apoyo técnico-material brindado para la realización de esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. BAIERLE, M. et al. "Relationship between inflammation and oxidative stress and cognitive decline in the institutionalized elderly". Oxidative Medicine and Cellular Longevity. 2015, Article ID 804198, 12. ISSN: 1942-0994.
2. MAHENDRAN, G.; NARMATHA BAI, V. "Antioxidant and anti-proliferative activity of Swertia corymbosa (Griseb.) Wight ex C.B. Clarke". Int. J. Pharm. Pharm. Sci. 2013, 5, 551–558. ISSN: 2320-1215
3. ARULSELVAN, P. et al. "Role of Antioxidants and Natural Products in Inflammation". Oxidative Medicine and Cellular Longevity. 2016, Article ID 5276130, 15 pages. ISSN: 1942-0994.
4. DJURIC, Z. et al. "Targeting activation of specific NF-kB subunits prevents stress-dependent atherothrombotic gene expression". Molecular Medicine. 2012, 18, 1375–1386. ISSN: 1432-1440
5. DHARAJIYA, N. et al. "Inhibiting pollen reduced nicotinamide adenine dinucleotide phosphate oxidase–induced signal by intrapulmonary administration of antioxidants blocks allergic airway inflammation". J Allergy Clin Immunol. 2007, 119(3), 646–653. ISSN: 2213-2201
6. ROMAY, C. et al. "C-Phycocyanin: A Biliprotein with Antioxidant, Anti-Inflammatory and Neuroprotective Effects". Current Protein and Peptide Science. 2003, 4, 207–216. ISSN: 1875-5550
7. RAVIPATI, A. S. et al. "Antioxidant and anti-inflammatory activities of selected Chinese medicinal plants and their relation with antioxidant content". BMC Complementary and Alternative Medicine. 2012, 12, article 173. ISSN: 1472-6882.
8. HUANG, D.; BOXIN, O. U.; PRIOR, R. L. "The chemistry behind antioxidant capacity assays". J. Agric. Food Chem. 2005, 53, 1841–1856. ISSN: 1520-5118
9. DUDONNEÌ, S. et al. "Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH, ABTS, FRAP, SOD, and ORAC assays". J Agric Food Chem. 2009, 57, 1768–1774. ISSN: 1520-5118
10. FUENTES FIALLO, V. R. et al. "Estudios fenológicos en plantas medicinales XII". Rev. Cubana Plant. Med. 2001, 46(3), 87–92. ISSN: 1028-4796
11. HERNÁNDEZ MONZÓN, A. et al. La chaya cubana como alimento alternativo. La Habana: Editorial Universitaria, 2011. ISBN 978-959-16-1402-5.
12. MARTÍNEZ, S. J.; PEDRAZA, R. M.; GARCÍA, Y. "Influencia del método de secado del follaje y el solvente de extracción en la cuantificación de polifenoles extractables totales". Pastos y Forrajes. 2001, 24(1), 353–356. ISSN: 2078-8452
13. ROIG MESA, J. T. Plantas Medicinales, Aromáticas o Venenosas de Cuba, 2nda Edición. La Habana: Ed. Ciencia y Técnica, 1974 [en línea] [fecha de consulta: 10/12/2017] Disponible en: http://repositorio.geotech.cu/jspui/handle/1234/1151.
14. MINISTERIO DE SALUD PÚBLICA. NRSP No. 309. Medicamentos de origen vegetal: droga cruda. Métodos de ensayos. La Habana: MINSAP, 1992.
15. SHINDE, U. A. et al. "Membrane stabilizing activity–a possible mechanism of action for the anti-inflammatory activity of Cedrus deodara wood oil". Fitoterapia. 1999, 70, 251–257. ISSN: 1873-6971
16. OYAIZU, M. "Studies on products of browning reactions: antioxidative activities of products of browning reaction prepared from glucoamine". Jpn J Nutr. 1986, 4, 307–315. ISSN: 1883-7921.
17. RUBERTO, G.; BARATTA, M. T. "Antioxidant activity of selected essential oil components in two lipid model systems". Food Chemistry. 2000, 69, 167–174. ISSN: 1520-5118
18. PRIETO, P.; PINEDA, M.; AGUILAR, M. "Spectrophotometric Quantitation of Antioxidant Capacity through the Formation of a Phosphomolybdenum Complex: Specific Application to the Determination of Vitamin E". Analytical Biochemistry. 1999, 269, 337–341. ISSN: 1096-0309
19. THANGARAJ, P. "Extraction of Bioactive Compounds". En: Pharmacological Assays of Plant-Based Natural Products. Switzerland: Springer International Publishing, 2016. vol. 71, pp. 11-13. ISBN 978-3-319-26810-1.
20. VADIVU, R.; LAKSHMI, K. S. "In vitro and in vivo anti-inflammatory activity of leaves of Symplocos cochinchinensis (Lour) Moore ssp. Laurina". Bangladesh J. Pharmacol. 2008, 3, 121–124. ISSN: 1991-0088
21. MURUGASAN, N.; VEMBER, S.; DAMODHARAN, C. "Studies on erythrocyte membrane IV. In vitro haemolytic activity of oleander extract". Toxicol. Lett. 1981, 8, 33–38. ISSN: 1879-3169
22. CAN AKÉ, R. et al. "Bioactive Terpenoids from Roots and Leaves of Jatropha gaumeri". Rev. Soc. Quím. Méx. 2004, 48, 11–14. ISSN: 0583-7693
23. MUJUMDAR, A. M.; MISAR, A. V. "Anti-inflammatory activity of Jatropha curcas roots in mice and rats". Journal of Ethnopharmacology. 2004, 90(1), 11–15. ISSN: 1872-7573
24. CAO, G.; CUTLER, R. G. "High concentrations of antioxidants may not improve defense against oxidative stress". Arch. Gerontol. Geriatr. 1993, 17, 189–201. ISSN: 1872-6976
25. TABART, J. et al. "Comparative antioxidant capacities of phenolic compounds measured by various tests". Food Chem. 2009, 113, 1226–1233. ISSN: 1520-5118
26. ADEGBOLA, P. et al. "Antioxidant and anti-inflammatory medicinal plants have potential role in the treatment of cardiovascular disease: a review". Am. J. Cardiovasc. Dis. 2017, 7(2), 19–32. ISSN: 2160-200X
27. MARTÍNEZ, N. et al. "Ánálisis fitoquímico de Jatropha dioica y determinación de su efecto antioxidante y quimioprotector sobre el potencial genotóxico de ciclofosfamida, daunorrubicina y metilmetanosulfonato evaluado mediante el ensayo cometa". Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas. 2014, 13(5), 437–457. ISSN: 0717 7917
28. HENRIQUES MARCONDES, T. et al. "Avaliação do potencial antirradicalar e determinação do teor de flavonoides totais das frações acetato de etila e n-butanol das folhas de Jatropha aethiopica (Euphorbiaceae) coletadas em Havana, Cuba". Ver Ciên Farm Básica Apl. 2016, 37(1), Suplemento 1-QM-Química, ISSN: 1808-4532.
29. FYLAKTAKIDOU, K. C. et al. "Natural and synthetic coumarin derivatives with anti-inflammatory/antioxidant activities". Current pharmaceutical design. 2004, 10(30), 3813–3833. ISSN: 1873-4286
30. OCAÑA RAMÍREZ, J. "Evaluación de la actividad antimicrobiana de los extractos de las hojas de Jatropha aethiopica (Chaya)". Tesis en opción al título académico de Máster en Química Biológica, Bayamo, Cuba. Universidad de Granma, 2011. Disponible en: http://www.udg.co.cu
31. GAMIOTEA TURRO, D. et al. "Qualitative and quantitative analysis of ethanolic extract and phenolic fraction of Jatropha aethiopica (Euphorbiaceae) leaves and their hypoglycemic potential". J Agric Food Chem. 2018, 66(6), 1419–1427. ISSN: 1520-5118
32. TORRES, S. et al. "Changes in secondary metabolites profiles and biological activity of the fresh fruiting bodies of Stereum hirsutum exposed to high-dose UV-B radiation". J. Chil. Chem. Soc. 2016, 61(4), 3224–3227. ISSN: 0717-9707
33. GUBITZ, G.; MITTELBACH, M.; TRABI, M. "Exploitation of the tropical oil seed plant Jatropha curcas L". Bioresource Technol. 1999, 67(1), 37–42. ISSN: 1873-2976
Recibido: 1/03/2018
Aceptado: 2/05/2018
Dr. C. Quirino Arias-Cedeño, Centro de Estudios de Química Aplicada, Facultad de Ciencias Técnicas, Universidad de Granma, Cuba, qariasc@udg.co.cu