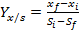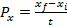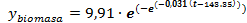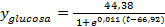Introducción
Los hongos son bioreactores naturales para la producción de compuestos con aplicaciones biotecnológicas de interés humano.1 Disímiles trabajos se han llevado a cabo en relación al cultivo del hongo Pleurotus ostreatus, para la producción de biomasa mediante la fermentación en estado sólido y en estado líquido. Desde el punto de vista ingenieril, la fermentación en estado sólido no es usualmente empleada en procesos de gran volumen, debido a problemas con el escalado.2
La fermentación sumergida (o en estado líquido) por su parte, permite una producción eficiente de biomasa fúngica, rica en compuestos bioactivos y también la obtención de metabolitos secundarios extracelulares con grandes aplicaciones prácticas. Todo esto se desarrolla en condiciones controladas, espacio y tiempo reducidos, lo que disminuye las probabilidades de contaminación.3
Al respecto, en el Centro de Estudios de Biotecnología Industrial (CEBI) de la Universidad de Oriente, se encuentran depositadas en la colección de cultivos, cepas del género Pleurotus, con diversas aplicaciones biotecnológicas. En particular la caracterización fitoquímica y los estudios realizados in silico, in vitro e in vivo con la cepa de Pleurotus ostreatus CCEBI 3024, sugieren la presencia de importantes metabolitos bioactivos, referidos a su potencial actividad inmunomoduladora, antioxidante y antitumoral.1
En este sentido, se hace necesario realizar estudios que permitan determinar los parámetros cinéticos del crecimiento y la producción de metabolitos bioactivos, como los compuestos fenólicos, por Pleurotus ostreatus CCEBI 3024 mediante fermentación en estado sumergido, así como los parámetros de eficiencia del proceso. Ello posibilitará la proyección de un proceso de obtención de biomasa y metabolitos de interés farmacológicos a escala piloto.
Materiales y métodos
Microorganismo empleado
Se empleó la cepa de Pleurotus ostreatus CCEBI 3024 perteneciente a la colección de cultivos del CEBI. Las cepas se conservaron en un medio de agar papa dextrosa a 6 °C.
Preparación del inóculo
La siembra se realizó en 10 placas Petri con 6 mL de medio de cultivo (Agar-Malta), las cuales fueron incubadas en oscuridad y a temperatura de 27-30°C hasta lograr un crecimiento micelial total a los 10 días.
Medio de cultivo
Se utilizó medio YPG (Yeast Peptone Glucose), que contiene glucosa (28,4 g·L-1); peptona (2,3 g·L-1); extracto de levadura (5,7 g·L-1); KH2PO4 (1 g·L-1) y Na2SO4·7H2O (1 g·L-1).
Estudio cinético de Pleurotus ostreatus en fase sumergida
Luego de logrado el crecimiento micelial total de los inóculos, se añadió el micelio a un Erlenmeyer de 500 mL con 250 mL de solución salina y se homogenizó la solución a 3200 rpm, con un dispersador de laboratorio (T50 digital ULTRA-TURRAX® - IKA, China). Se añadieron 5 mL de inóculo líquido de concentración igual a 0,74 g de biomasa seca por litro de inóculo a Erlenmeyers de 250 mL con 50 mL de medio YPG suplementado con cloranfenicol, para prevenir el crecimiento de bacterias. Para la agitación se empleó una zaranda (HDL, China) a 120 rpm. Los cultivos permanecieron entre 19-22°C hasta alcanzar una biomasa celular adecuada transcurridos los 7 días. El estudio cinético duró 218 h, se realizaron 11 muestreos cada uno por triplicado. La toma de muestras se efectuó diariamente a partir de las 48 h y al cuarto día se tomaron dos muestras diarias.
Obtención de los extractos
La biomasa colectada se lavó exhaustivamente con agua destilada, se filtró al vacío el micelio resultante y se pesó en una balanza analítica (Sartorius BS 124 S, China). Se tomó 1 g de biomasa húmeda de cada muestra y se colocaron en tubos de ensayos. Se adicionaron 5 mL de agua destilada. Se obtuvieron los extractos acuosos mediante lixiviación a una temperatura entre 93-95 °C en un baño termostático (Ningbo Scientz SC-15, China) durante 6 h. Los extractos se centrifugaron a 5000 rpm (centrífuga Heal Force Neofuge 15, China) durante 10 min y se filtró a través de una membrana de tamaño de poros igual a 0,22 μm, luego se conservó a 4 °C para su posterior análisis.
Cuantificación de fenoles totales
La determinación del contenido de fenoles totales en los extractos de Pleurotus ostreatus CCEBI 3024, se llevó a cabo según el procedimiento de Slinkard y Singleton. 4 Se determinó la absorbancia a 750 nm en un espectrofotómetro (Rayleigh VIS-723G, China) y se refirió a una curva de calibración de ácido gálico; (18-138 µg·mL-1; Yab = 0,0066Xc; R² = 0,9922); donde Yab es la absorbancia medida por espectrofotometría visible y Xc es la concentración de ácido gálico, en μg equivalentes de ácido gálico por mL de los extractos.
Cuantificación de los azúcares reductores
Para determinar la concentración de glucosa en el medio de cultivo durante el estudio cinético, se empleó el método colorimétrico del ácido 3,5-dinitrosalicílico (DNS).5 Para el ensayo se utilizó una curva de calibración empleando glucosa como estándar en concentraciones de 0,1-1,0 g·L-1; (Yab = 1,0619Xg - 0,0181; R² = 0,9994), donde Yab es la absorbancia medida por espectrofotometría visible y Xg es la concentración de glucosa, en gramos de glucosa por litro de medio de cultivo agotado.
Cuantificación de la biomasa
El peso de la biomasa micelial fue determinada por gravimetría, centrifugando el cultivo a 5000 rpm, luego se lavó el micelio con agua destilada 3 veces y posteriormente se secó en estufa a 100°C hasta peso constante por 12 hy posterior cuantificación.
Determinación de los factores de conversión de sustrato a biomasa, sustrato a producto, y productividad
La determinación de los factores de conversión de sustrato a biomasa y de sustrato a producto, así como la productividad de biomasa y producto se calculó según las ecuaciones (1) - (4) respectivamente.6
Los factores de conversión de sustrato a biomasa y de sustrato a producto, fueron expresados como gramos de biomasa micelial producida por gramo de glucosa consumida y microgramos de polifenoles producidos por gramo de glucosa consumida, respectivamente.
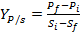 () Donde x y xson las concentraciones inicial y final de biomasa, S y S son las concentraciones inicial y final de glucosa, y P y Pson las concentraciones inicial y final de polifenoles totales. La productividad de biomasa y de producto se calculó utilizando las ecuaciones propuestas por , expresando su valor en [g·L·h]: 2
() Donde x y xson las concentraciones inicial y final de biomasa, S y S son las concentraciones inicial y final de glucosa, y P y Pson las concentraciones inicial y final de polifenoles totales. La productividad de biomasa y de producto se calculó utilizando las ecuaciones propuestas por , expresando su valor en [g·L·h]: 2
Modelos matemáticos usados para el estudio cinético en fase sumergida
Para el ajuste de las curvas de crecimiento de biomasa y azúcares reductores totales (ART) se empleó el programa OriginPro (OriginLab Inc.) versión 9.4 (2017). Se evaluaron los modelos Logístico y modelo de Gompertz para el ajuste de los datos de crecimiento y consumo de sustrato. Las ecuaciones evaluadas para el ajuste de los datos del crecimiento micelial y consumo de sustrato se muestran en la tabla 1.
Tabla 1 Ecuaciones de los modelos matemáticos aplicados para la estimación del crecimiento de Pleurotus ostreatus en fermentación líquida
donde:
 es la variable dependiente, equivalente al número de células contadas expresada en términos de biomasa producida [g de biomasa L-1]
es la variable dependiente, equivalente al número de células contadas expresada en términos de biomasa producida [g de biomasa L-1]
 es la variable independiente, equivalente al tiempo de fermentación, t [h]
es la variable independiente, equivalente al tiempo de fermentación, t [h]
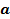 es el valor asintótico cuando el tiempo crece indefinidamente (aproximadamente equivalente a la concentración final de microorganismos)
es el valor asintótico cuando el tiempo crece indefinidamente (aproximadamente equivalente a la concentración final de microorganismos)
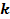 es la tangente en el punto de inflexión de la curva de crecimiento, equivalente a la velocidad específica µ [h-1]
es la tangente en el punto de inflexión de la curva de crecimiento, equivalente a la velocidad específica µ [h-1]
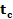 es el tiempo en que se alcanza el punto de inflexión o de máxima velocidad de crecimiento [h].
es el tiempo en que se alcanza el punto de inflexión o de máxima velocidad de crecimiento [h].
Resultados y discusión
Análisis de la cinética de crecimiento y consumo de sustrato
En la figura 1 se observan las cinco fases distintivas del crecimiento microbiano. Se aprecia que la fase de latencia culmina al cabo de las 48 h; en esta etapa el hongo se va adaptando a las nuevas condiciones ambientales. El mismo se inocula en medio líquido con características físicas y químicas distintas al medio de cultivo de mantenimiento (Agar-Malta), por lo que debe ajustar su metabolismo.7
Luego de esta fase, se inicia la de aceleración positiva, en la cual el hongo comienza a expandir su volumen y a dividirse; sin embargo, el cultivo aún no es sincrónico. Esta fase terminó a las 129 h aproximadamente y se origina la fase de crecimiento exponencial, en la cual la velocidad de crecimiento es máxima y no hay limitación del crecimiento, ni por sustrato, ni por la presencia de inhibidores.8 Durante la etapa de crecimiento en el presente estudio, se pudo observar la formación de masas filamentosas de micelio de color blanco en forma de pellets, favoreciéndose la transparencia del medio de cultivo.
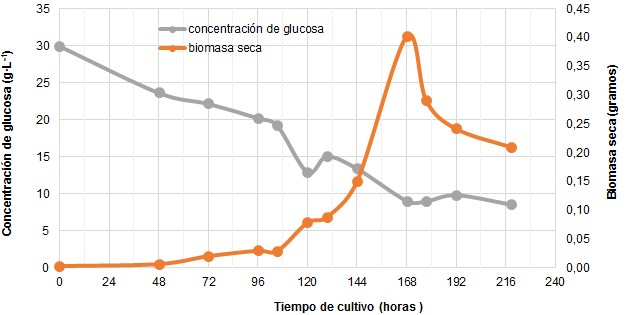
Fig. 1 Cinética de crecimiento de Pleurotus ostreatus CCEBI 3024 y consumo de glucosa en fermentación en fase sumergida
A las 168 h se observó la fase estacionaria en la cual se alcanzó la máxima concentración de biomasa con un valor de 8,04 g·L-1. En estafase, la velocidad específica de crecimiento es cero debido a que no hay aumento en la concentración de biomasa. Esto no significa que las funciones biosintéticas hayan cesado6, sino que la mayor parte de la energía proporcionada por el sustrato se destina hacia el mantenimiento celular.
Al cabo las 177 h, comenzó un descenso brusco de la concentración celular hasta un 69 %. Esto se asocia a fenómenos de autólisis del micelio, lo cual ha sido reportado en un cultivo de Pleurotus ostreatus en fase sumergida. 9 Se destaca que después del sexto día se evidenció una disminución de la concentración micelial y en el día 7 se observó una disminución de un 50% respecto a la concentración de biomasa máxima obtenida.
Entre los factores que pudieron causar el descenso brusco de la concentración de biomasa se puede mencionar que, durante el crecimiento del hongo se notó a partir del día 5 aumentos en la viscosidad del medio de cultivo y en el tamaño de los pellets, resultando más difícil la homogeneización del cultivo. El cultivo de setas comestibles en medio sumergido está caracterizado por el incremento de la viscosidad, debido a dos factores fundamentales: el primero es el aumento de la concentración micelial lo que provoca cambios en la morfología del hongo, y el segundo, la producción de compuestos extracelulares.10 Entre estos se encuentran polisacáridos que alteran la reología y características del fluido afectando la transferencia de oxígeno y la remoción del dióxido de carbono. Por lo que se sugiere garantizar un mezclado eficiente del cultivo, y de este modo, favorecer la transferencia de masa y la disipación del calor metabólico generado.
En estudios cinéticos en medio líquido con Lentinula edodes se reportó que el tamaño del pellet se incrementó al reducir la intensidad de agitación. Luego de los 10 días de cultivo se observó el descenso gradual de la biomasa causado por el déficit de oxígeno disuelto en el interior de los pellets formados. Ello condujo a la autólisis del micelio, observándose flóculos y fragmentos de hifas debido a este fenómeno.11
La morfología de aglomerados generalmente conduce a un comportamiento newtoniano del caldo.12 La formación de aglomerados celulares (pellets) determina la existencia de restricciones difusionales externas e internas. Las últimas dan lugar a condiciones de anoxia, restricción severa de nutrientes, intoxicación por productos y lisis celular. En el interior del núcleo del pellet, el transporte de nutrientes se rige por difusión, por lo tanto, está relacionado con el diámetro del pellet y es significativamente más lento que la transferencia convectiva en el seno de la fase líquida.13 En cultivos de Aspergillus terreus se evidenciaron procesos de muerte celular en el interior de aglomerados, debido a que el oxígeno solamente penetró hasta el interior de aquellos con diámetros menores de 1400μm.14
La reología del caldo puede manipularse mediante la modificación de la intensidad de la agitación, la concentración de oxígeno disuelto y el tipo de morfología micelial. En el estudio referido anteriormente con Aspergillus terreus en cultivo sumergido, se controló la formación de aglomerados en la producción de lovastatina (fármaco anti hipercolesterolemia) mediante la adición de micropartículas: talco y óxido de aluminio.15
En relación al consumo de glucosa, la figura 1 ilustra cómo ésta comienza a consumirse linealmente hasta las 105 h, momento en el cual ocurre un descenso en su consumo, desde 19 g·L-1 hasta 13 g·L-1. A partir de las 120 h se favorecen las condiciones para que el hongo crezca de forma exponencial.
En la curva de consumo de glucosa se observó que ocurre un aumento en su concentración a las 130 h, lo cual se puede asociar a la secreción de exopolisacáridos al medio de cultivo, los cuales pueden contener a su vez residuos de monosacáridos.16
Todos los monosacáridos son azúcares reductores ya que al menos tienen un grupo -OH hemiacetálico libre. Los monosacáridos son los elementos más sencillos, a partir de los cuales se forman las moléculas más complejas dentro de los glúcidos. Los extractos de polisacáridos contienen glucosa como el componente monosacarídico mayoritario en la cadena principal y en una proporción variable con respecto a otros azúcares.16 De igual forma otras moléculas de azúcares pueden encontrarse unidas lateralmente a polisacáridos del tipo (-D-glucanos, tales como manosa, xilosa y galactosa.17
En investigación realizada con Pleurotus ostreatus en fase sumergida, utilizando glucosa como fuente carbono y extracto de levadura como fuente de nitrógeno, se determinó la presencia de residuos de monosacáridos en los polisacáridos del micelio, tales comoglucosa, manosa, galactosa y glucosamina. La presencia de los monosacáridos es mayor cuando las relaciones C/N disminuyen en el cultivo.18
Por otra parte, se obtuvieron los coeficientes del modelo de Gompertz y Logístico que describen los datos de la concentración de biomasa de Pleurotus ostreatus CCEBI 3024 y consumo de glucosa, en fermentación en fase sumergida respectivamente. El modelo de Gompertz (ecuación 7) ajustó más adecuadamente los datos experimentales, por describir mejor la dinámica de crecimiento del hongo en fase sumergida.
Mediante el modelo de Gompertz se obtuvo un valor de μ igual a 0,031 h-1.Díaz 19 realizó estudios de producción de Pleurotus ostreatus por fermentación sumergida reportando los parámetros del desarrollo del hongo con μ igual a 0,034 h-1 y la concentración máxima de biomasa de 8,3 g·L-1.Losparámetros obtenidos en el presente trabajo son similares a los descritos por dicho autor.
Para el consumo de glucosa el modelo que mejor ajustó los datos fue el modelo Logístico (ecuación 8). El coeficiente de determinación (R2) para el modelo que describe la formación de biomasa y consumo de glucosa es de 0,88 y 0,95, respectivamente. Por ello, se considera que los modelos ajustan el 88% y 95 % de la variabilidad de los datos.
Estos modelos sirven para describir la dinámica del crecimiento del hongo y el consumo de sustrato en las condiciones de cultivo empleadas en esta investigación, y ambas variables dependientes de los modelos se expresan en g·L-1.
Determinación de los factores de conversión de sustrato a biomasa y fenoles. Cálculo de la productividad de biomasa y fenoles totales
Se calcularon los factores de conversión de sustrato a biomasa, sustrato a producto y la productividad de biomasa y producto. Los resultados de Yx/s ,Yp/s ,Px , y Pp fueron de: 0,39 g de biomasa·g de glucosa-1, 0,1 g de fenoles totales·g de glucosa-1, 0,047 g de biomasa L-1·h-1 y 0,0006 g de fenoles L-1·h-1respectivamente.
En la literatura se describen valores deYx/s y Pxiguales a 0,59 g de biomasag de glucosa-1 y 0,036 g de biomasa·L-1·h-1 con una cepa de Pleurotus ostreatus, durante un tiempo de fermentación de 75 h; en este caso un medio con una concentración de glucosa y extracto de levadura de 5 g·L-1 cada uno.20 Es interesante como se obtuvo un rendimiento de biomasa 1,5 veces mayor al alcanzado en la presente investigación. Ello podría atribuirse al hecho de que Pleurotus ostreatus CCEBI 3024 es un híbrido intra-especíe. Al respecto, se plantea que con las cepas híbridas se obtienen menores rendimientos en comparación con las cepas subtropicales de P. ostreatus o P. pulmonarius debido a su menor producción de polifenoloxidasas y a su menor crecimiento micelial.21
Si se compara la productividad obtenida por MárquezRochaet al.20 se puede observar que su valor es menor que el obtenido en el presente trabajo. Esto se debe a que el crecimiento estuvo limitado por la fuente de carbono, no siendo así en la presente investigación. El crecimiento de los hongos comestibles está estrechamente relacionado con la fuente de nutrientes disponible, fundamentalmente en lo concerniente a macronutrientes como el carbono y el nitrógeno.18
Al evaluar los rendimientos de sustancias bioactivas y biomasa de Pleurotus, utilizando en paralelo dos fermentadores: en modo discontinuo alimentado y en modo semi-continuo, en la literatura se informan valores de rendimientos y productividad de biomasa de 0,43 g de biomasa·g de glucosa-1 y 0,06 g·L-1·h-1 respectivamente.22 Estos resultados son superiores a los obtenidos en fermentaciones en modo discontinuo, debido a que en modo semi-continuo el medio de cultivo agotado se purga y al mismo tiempo se incorpora el mismo volumen de medio fresco. Se garantiza, de esta forma, que el sustrato limitante no llegue a las condiciones críticas de cultivo, garantizando un estado fisiológico óptimo en el crecimiento celular y síntesis del producto de interés, debido a que no hay inhibición ni por productos ni por sustrato.6
Souza et al.23, al evaluar diferentes fuentes de carbono y nitrógeno y su efecto en el factor de conversión de sustrato a biomasa y productividad de biomasa micelial, mediante fermentación sumergida durante cinco días, obtuvieron valores de 0,43 g de biomasa g de glucosa-1 y una productividad de biomasa igual a 0,055 g de biomasa·L-1·h-1 respectivamente. Estos valores muestran un comportamiento cercano a los obtenidos en el presente trabajo.
Vamanu 24 al realizar un estudio por 10 días sobre la acumulación de compuestos fenólicos en cultivo sumergido, con reactor de tanque agitado, utilizando cuatro cepas de Pleurotus ostreatus, obtuvo rendimientos de polifenoles comprendidos entre 7,1-19,8 mg·mL-1, aunque cabe señalar que en dicha investigación fue utilizado un extractor de cama fluidizada.
Análisis de la cinética de producción de compuestos fenólicos en fase sumergida
La figura 2 muestra la cinética de producción de compuestos fenólicos totales. Se aprecia una zona de latencia de producción hasta las 72 h manteniéndose constante y con un valor promedio igual a 20 μg·mL-1.Transcurridas las 72 h comienza a aumentar la producción de los polifenoles de forma exponencial, momento en el cual se crea una meseta de máxima producción en un tiempo comprendido de 105 a 130 h. Ello se puede explicar a partir del descenso de la concentración de glucosa en el medio de cultivo.

Fig. 2 Cinética de producción de compuestos fenólicos totales por Pleurotus ostreatus CCEBI 3024 y consumo de glucosa en fermentación en fase sumergida, con el medio de cultivo optimizado
Luego de las 130 h se observó una disminución brusca en la concentración de fenoles totales y un ligero aumento en la concentración de azúcares reductores. Esto pudiera estar asociado a la actividad de enzimas hidrolíticas sobre polisacáridos complejos excretados tales como los (-glucanos los cuales tienen en su estructura residuos de glucosa.19 Este fenómeno, a su vez, podría estar implicado en el descenso en la concentración de fenoles ya que el estrés por limitación de la fuente de carbono ha disminuido.
A partir de las 144 h la producción de compuestos fenólicos comienza a incrementar linealmente hasta obtenerse un pico de producción máxima, alcanzándose una concentración igual a 98,88 μg·mL-1.En este momento, la concentración de glucosa es crítica y ha maximizado la producción de estos compuestos. En el presente estudio cinético se puede observar como la concentración de glucosa a la cual se obtiene la máxima concentración de fenoles es igual a 9,48 g·L-1.
Los compuestos fenólicos son metabolitos secundarios, los cuales no están asociados al crecimiento.24 Como la producción de los compuestos del metabolismo secundario se realiza después del crecimiento, se deben favorecer las condiciones para hacer máximos los rendimientos del producto final. Por ello, la premisa sería hacer más larga la fase estacionaria; por tal motivo, se propone utilizar en la fermentación un reactor que opere en estado continuo en la etapa de mayor producción de compuestos fenólicos. De este modo, se puede controlar el medio de cultivo, ya que el mismo debe satisfacer simultáneamente las necesidades para el crecimiento micelial y para la formación de los compuestos fenólicos de forma óptima además de regular las condiciones medioambientales del sistema fermentativo.
Conclusiones
La cinética del crecimiento de Pleurotus ostreatus, permitió obtener los indicadores de rendimiento y productividad para la producción de biomasa y fenoles totales. A partir de los modelos matemáticos de Gompertz y Logístico, se obtuvieron los parámetros cinéticos del proceso fermentativo. Se concluye a partir del estudio cinético que la viscosidad del cultivo es un factor a controlar ya que limita la oxigenación del medio, provocando la muerte del micelio, por otra parte la producción de fenoles totales se maximiza cuando la concentración de glucosa decrece a lo largo del tiempo, característica esta del metabolismo secundario