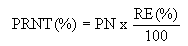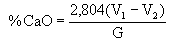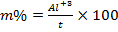Introdução
A análise do solo permite avaliar o grau de deficiência dos seus nutrientes e a quantidade certa de adubação e calagem a ser aplicada. Ela tem um papel fundamental para uma alta produtividade na agricultura concernente as informações dadas aos agricultores.1,2 A interpretação correcta das propriedades físicas e químicas é de suma importância para a manutenção da produtividade e fertilidade do solo e para a orientação de futuros trabalhos de investigação e pesquisa, pois, o maior e melhor rendimento são obtidos da interacção dessas propriedades, além das alterações climáticas.3,4
A aplicação de calcário em solos quimicamente ácidos e com deficiência em um ou mais nutrientes essenciais às plantas, juntamente com outras práticas agrícolas para melhorar a fertilidade e o manuseamento do solo, têm o objectivo de elevar a capacidade produtiva do solo através do aumento da capacidade de troca catiónica, aumento da disponibilidade de nutrientes e insolubilização de elementos tóxicos às plantas, o que permite um aumento de rendimento das culturas, de modo a viabilizar economicamente a demanda actual de produção de alimentos e melhorar a sustentabilidade económica da actividade agrícola.5
O sistema solo é bastante complexo e composto por três fases bem distintas: sólida líquida e gasosa. As interações entrefase sólida e líquida constituem a fonte imediata e reservatório dos nutrientes para o suprimento às plantas.6
A acidez é o principal factor que afecta a disponibilidade dos nutrientes.7) Os elementos tóxicos, como o alumínio em solos ácidos, em função do pH da solução, apresenta-se nas formas solúveis Al+3, Al(OH)+2 ou Al(OH)2 +. E ainda em solos salinos o sódio pode apresentar-se em elevados teores na solução na forma Na+.8
Os fenόmenos físico-químicos do solo ocorrem basicamente na fracção coloidal que é bastante heterogénia, sendo constituída por espécies de diferentes minerais e partículas orgânicas.
Este fenόmeno, conhecido como adsorção iόnica, é um processo reversível e estequiométrico de grande importância no solo que faz permanecer os nutrientes disponíveis às plantas através das cargas eléctricas apresentadas pelos colόides.
A adsorção dos catiões Al+3, Ca+2, Mg+2, K+, NH4 + e Na+ pelas cargas negativas é directa, ocorrendo apenas ligação eletrostática, ou seja, esses catiões são trocáveis com os da solução do solo num processo denominado capacidade de troca catiónica (CTC) do solo. O catião H+ liga-se fortemente à superfície do colóide através de ligação covalente, porém, não é trocável e apenas liberta a carga negativa ocupada de forma indirecta, ou seja, através da neutralização com OH-- adicionada na solução.
Neste mesmo processo acontece com os aniões SO4 -2, NO3 - e Cl- denominado capacidade de troca aniónica (CTA) do solo, porém em função da pouca existência de cargas positivas no solo torna-se quase irrelevante falar-se em troca de aniões no solo, da forma dinâmica como ocorre para os catiões.
O solo possui uma propriedade muito importante que é a capacidade de reter e ceder, sob a forma iónica, determinados elementos químicos que são vitais para o desenvolvimento não só do solo, mas também das plantas. Esta característica é, basicamente, exercida pelos colóides do solo, sejam eles de natureza orgânica (“humus”) ou mineral (“argila”), em virtude da presença de cargas superficiais, normalmente negativas, conferindo aos solos, então, a capacidade de adsorver catiões.
Daí, uma das formas de medir essas cargas é a partir da sua capacidade de troca catiónica (CTC). A CTC mostra o número de catiões trocáveis que um solo pode adsorver em determinadas condições, e sendo ela uma característica física química fundamental no estudo da fertilidade dos solos, quanto maior for, maior será a capacidade de reter os catiões.
Em solos arenosos, cujo teor de matéria orgânica é baixo, e, portanto, baixa CTC, é adsorvida somente pequenas quantidades catiões, tornando-se mais susceptíveis a perda de nutrientes devido a lixiviação.9,10
O objetivo do trabalho é Estimar as quantidades ideais de calcário para o aumento do pH e enriquecimento dos solos com os nutrientes essenciais na área experimental da Chianga - Huambo.
Materiais e métodos
A parte experimental deste trabalho foi realizada no Laboratόrio de Análises de Solos e Plantas do Instituto de Investigação Agronόmica, localizado no Huambo, na Estação Experimental Agrícola da Chianga.
As amostras foram retiradas da camada superficial do solo, até a profundidade de 20 cm, em uma área sem antecedentes de cultivo, com o cuidado de limpar a superfície das áreas escolhidas, removendo as folhas e outros detritos. Elas foram recolhidas em forma de ziguezague por um trado, em 15 a 30 pontos diferentes, que foram colocadas juntas em balde plásticas limpas e secas.
Determinação da umidade na capacidade de campo (Ug)
Utilizou-se 9 vasos de polietileno com capacidade de 5 L para a determinação da umidade na capacidade de campo em vasos, estes foram preenchidos com solo peneirado e posteriormente saturados. As amostras foram coletadas com 0, 24 e 48 h depois da saturação em baldes diferentes. Após cada coleta as amostras eram pesadas para a obtenção da massa úmida (MU) e depois levadas para a estufa de esterilização e secagem a uma temperatura de 105 ºC onde permaneceram por 24 h para a obtenção da massa constante e em seguida obter a massa seca (MS) pesando as amostras, podendo-se calcular a umidade gravimétrica através da seguinte equação:
Determina-se sua composição granulométrica empregando-se as peneiras nº 10, 20 e 50, segundo a Associação Brasileira de Normas Técnicas - ABNT. Para os calcários, a partir dos resultados da composição granulométrica calcula-se a reatividade (RE) do produto pela expressão;
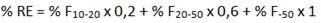 () sendo: %F= percentual de produto que passa pela peneira nº10 e fica retido na peneira nº20; % F = percentual de produto que passa pela peneira nº20 e fica retido na peneira nº50; e F = percentual de produto que passa pela peneira nº50. Com o valor do PN e o valor da RE calcula-se o Poder Relativo de Neutralização Total (PRNT) do corretivo pela expressão: 2
() sendo: %F= percentual de produto que passa pela peneira nº10 e fica retido na peneira nº20; % F = percentual de produto que passa pela peneira nº20 e fica retido na peneira nº50; e F = percentual de produto que passa pela peneira nº50. Com o valor do PN e o valor da RE calcula-se o Poder Relativo de Neutralização Total (PRNT) do corretivo pela expressão: 2
Preparo do extrato de calcáreo para as determinações do poder de neutralizaçâo (PN), cálcio e magnésio:
Procedimento - (a) Pesar 1 g da amostra (se calcário) ou 0,5 g (se calcário calcinado, cal virgem ou cal hidratada) com aproximação de 0,1 mg e transferir para copo de 250 ml; (b) Adicionar exatamente 50 ml de solução 0,5 N HCl padronizada, cobrir com vidro de relógio e ferver suavemente por 5 min, e (c) Transferir a suspensão para balão volumétrico de 250 ml já contendo aproximadamente 150 ml de água destilada, esfriar, completar o volume e filtrar (ou ainda centrifugar ou deixar decantar).
Determinação do PN:
Procedimento - (a) Transferir uma alíquota de 50 ml do extrato para erlenmeyer de 250 ml, acrescentar 50 ml de água destilada e 3 gotas de solução de fenolftaleína a 0,5%; (b) Titular com solução de NaOH 0,1 N padronizada até o aparecimento de uma leve cor rosada. Anotar o volume gasto; (c) Calcular o PN do material, em % CaCO3 equivalente, pela expressão:
Determinação do cálcio:
Procedimento - a) Transferir uma alíquota de 5 ml do extrato para erlenmeyer de 250 ml; (b) Adicionar 100 ml de água destilada, 5 ml da solução de KOH-KCN e 6 gotas do indicador calcon, agitando após a adição de cada reagente; (c) Titular o cálcio com a solução padrão de EDTA 0,010 M até a viragem do indicador da cor vinho para azul puro estável. Anotar o volume (V1) gasto; (d) Desenvolver uma prova em branco e anotar o volume (V2) gasto; (e) Calcular a porcentagem de CaO no material pela expressão:
Determinação do magnésio:
Procedimento - (a) Transferir uma alíquota de 5 ml do extrato para erlenmeyer de 250 ml; (b) Adicionar 100 ml de água destilada, 5 ml da solução tampão pH = 10 e 10 gotas da solução de eriocromo negro T, agitando após a adição de cada reagente; (c) Titular o cálcio mais o magnésio com a solução padrão de EDTA 0,010 M até a viragem do indicador da cor vinho para azul puro estável. Anotar o volume (V3) gasto; (d) Desenvolver uma prova em branco e anotar o volume (V4) gasto; e (e) Calcular a porcentagem de MgO no material pela expressão:
 () onde, V = Volume (ml) da solução de EDTA gasto na titulação do cálcio da amostra V = Volume (ml) da solução de EDTA gasto na titulação da prova em branco do cálcio V = Volume (ml) da solução de EDTA gasto na titulação do cálcio mais magnésio da amostra V = Volume (ml) da solução de EDTA gasto na titulação da prova em branco do cálcio mais magnésio G = Massa (g) da amostra. 6
() onde, V = Volume (ml) da solução de EDTA gasto na titulação do cálcio da amostra V = Volume (ml) da solução de EDTA gasto na titulação da prova em branco do cálcio V = Volume (ml) da solução de EDTA gasto na titulação do cálcio mais magnésio da amostra V = Volume (ml) da solução de EDTA gasto na titulação da prova em branco do cálcio mais magnésio G = Massa (g) da amostra. 6
Preparação da Amostra para o Laboratório
A parcela da unidade da incubação do solo foi feita num saco plástico com capacidade de 5,0 dm3, contendo 1kg de solo, mantendo uma umidade de capacidade de campo de 80 %. O solo foi incubado com um calcário fino, passado em peneira de 0,3 mm, cujo poder de neutralização (PN) é de 83 % e o poder relativo de neutralização (PRNT) de 58,56 %.
Todas as amostras individuais de uma mesma área uniforme foram bem misturadas num único recipente. Estas foram secas a temperatura ambiente, trituradas em Argamassa de ágata com mão e peneiradas numa peneira de 2,0 mm.
Apois o pre-tratamento a amostra foi triturada em argamassa de ágata feita à mão várias vezes e, posteriormente colocou-se no esquartilhador para evitar perca do solo até obter o tamanho desejado, de seguida peneirada de 2,0 mm.
Pesou-se 1,00 g de solo em um cadinho de porcelana e muisturou-se com 6 g de mistura fundente(carbonato de sódio, tetraborato de sódio, em relaçâo 1:3) e homogeinizado, cuidadosamente a seguir o caminhado levou-se a mulfa de modo a elevar a sua temperatura à 950 ºC durante 45 min. Deu-se por terminada a fusão, quando a massa fundida apresentou transparência e não continha partículas insolúveis da amostra.
Retirou-se o cadinho da mufla, deixou-se arrefecer e colocou-se num copo de 250 ml, juntou-se 50 mL de HCl 1:1, tapou-se o copo com vidro de relógio, observou-se uma efervescência.
Depois de se decompor e separar a massa fundente do cadinho, esta foi retirada cuidadosamente com uma vareta de vidro e lavou-se com o mínimo de água destilada quente.
Ao cadinho juntou-se depois 2 à 5 ml de HCl 1:1, aqueceu-se durante 1 min e juntou-se a este conteúdo a solução contida no copo, a solução foi transferida para balão volumétrico de 500 ml perfez-se o volume até o traço de referência, seguido de homogeneização.
Precipitação de Ferro, Alumínio e Manganês(R2O3)
Do balão volumétrico de 500 ml que continha o filtrado resultante da determinação da sílica, pipetou-se 100 ml, transferidos para um copo de 250 ml e precipitou-se os hidróxidos da seguinte maneira:
Juntou-se 3 gotas de ácido nítrico concentrado (HNO3) e aqueceu-se até a ebulição suave, adicionou-se lentamente amoníaco 1:1 gota a gota, até a precipitação total (formação de um precipitado castanho).
Pôs-se a ferver durante 2 min, agitando para expulsar o excesso de amoníaco. Deixou-se repousar o precipitado, filtrou-se com papel de filtro de porosidade média, e lavou-se 5 vezes com nitrato de amónio (NH4NO3) a 2 % quente.
O filtrado foi recolhido num balão volumétrico de 250 ml. Após perfazer seu volume até o traço de referencia, este é guardado para a determinação de cálcio, magnésio.
Preparação da solução amostra para a determinação do calcio e magnesio.
Pesou-se 10 g de solo e transferiu-se num copo de precipitação de 250 mL, e adicionou-se 100 mL de HNO3 0,05N, com agitação durante 15 min.
A solução foi filtrada e retirada uma alíquota de 50 mL, que foram transferidos para Erlenmeyer de 250 ml. A seguir acrescentou-se 2 gotas de solução alcoólica de vermelho de metilo a 0,1 % e NH4OH (1:3) até a viragem do indicador. A solução assim preparada foi aquecida até permanecer em ebulição durante 5 min.
À solução, depois de fria, adicionou-se 1 ml de solução de sulfeto de amônio 6 N e passados 10 min da adição desse reagente, a solução foi filtrada para balão volumétrico de 100 mL., através de papel de filtro Whatman n.º 1, sendo o Erlenmeyer e o filtro, lavados com água destilada. Completou-se o volume com água destilada, e após homogeneização da solução, e conservou-se para posterir análise.
Da solução amostra, pipetou-se uma alíquota de 50 mL transferida para outro Erlenmeyer de 250 mL.
A seguir adicionou-se água destilada até obter-se um volume aproximado de 100 mL e foram acrescentados pela ordem e seguidos de agitação os seguintes reagentes: 2 ml de solução de NaOH a 20 %, 10 gotas de trietanolamina, 2 ml de solução de KCN a 5 % e 5 gotas de solução de calcon a 1 %.
A seguir foi feita a titulação com solução de EDTA disódico 0,01 M até obtenção de uma cor azul pura estável.
O volume de solução de EDTA gasto na titulação, quando multiplicado pelo fator 0,8, fornece o número de equivalentes miligramas de cálcio por 100 g de solo.
Outros 50 mL do filtrado da solução tratada com NH4OH e (NH4)2S, foram transferidos para Erlenmeyer de 250 ml, adicionados mais ou menos 50 mL de água destilada e mais os seguintes reagentes, pela ordem: 0,5 ml de solução de NaOH a 20 %, 10 gotas de trietanolamina, 5 ml de solução tampão pH 10, 2 ml de solução de KCN a 5 % e 6-7 gotas de solução de Negro de Eriocromo T a 0,5 %. A titulação foi também realizada com solução de EDTA disódico, 0,01 M até a obtenção de cor azul pura estável.
O volume gasto nessa titulação menos o volume gasto na titulação do cálcio, multiplicado pelo fator 0,8, fornece o número de equivalentes miligramas de magnésio por 100 g de solo.
Avaliou-se o pH em H2O e em CaCl2 0,01M ( pHmetro Metter Toledo Inlab Expert Pro, Suíça). As bases de troca foram extraídas com acetato de amónio pH 7,0 e determinadas por espectrofotometria de absorção atómica (bases Ca2+ e Mg+2 ) (Espectrofotómetro de absorção atómica (EAA) PGI-990, Londres) e por fotometria de chama (bases K+ e Na+)(Fotómetro de chamas Modelo 2655-00, Estados Unidos da América).
O Al trocável foi extraído com KCl 1N e determinado por titulação com NaOH 0,1N. Com os valores obtidos foi possível determinar outros parâmetros como a capacidade de troca efectiva (CTCefectiva), soma de bases (SB) e saturação por alumínio (m %) nas épocas avaliadas.
Determinação dos bases de troca Ca+2 e Mg2+ pelo espectrofotómetro de chama
Pesou-se 5 g de TFSA em erlenmeyer de 125 ml e adicionou-se 50 ml da solução de acetato de amônio 1 N pH 7,0 para a extracção dos catiões trocáveis Ca+2 e Mg2+ no solo;
Agitou-se mecanicamente por dez minutos deixando-a decantar por 16 h. Transferiu-se (com micropipeta) 0,5 ml desse extracto para frasco de 15 ml e adicionou-se com repipetador 4,5 ml da solução de óxido de lantânio a 0,177 % de lantânio.
Com auxílio do espectrofotómetro de absorção atómica (figura 5), efectuou-se as leituras para determinação dos catiões Ca+2 ( λ= 422,7) e Mg+2( λ= 285,2). Os dados obtidos pela leitura foram anotados e traçados os gráficos da variação da base de troca Ca2+ e da soma de bases (SB).
Determinação das bases de troca K e Na pelo fotómetro de chama
Pesou-se 5 g de TFSA em erlenmeyer de 125 ml e adicionou-se 50 ml da solução de acetato de amônio 1 N pH 7,0 para a extração das bases de troca K+ e Na+;
Agitou-se mecanicamente por dez minutos deixando-a decantar por 16 horas. Transferiu-se 2 ml desse extrato para frasco de 10 ml;
Com auxílio do fotómetro de chama (figura 7), efectuou-se as leituras para determinação dos catiões K+ e Na+. Os dados obtidos pela leitura foram anotados e traçado o gráfico da variação da soma de bases (SB).
Determinação da acidez activa pela H2O
A determinação do pH em H2O foi efectuada de acordo com o seguinte procedimento:
Pesou-se 10g de terra fina seca ao ar (TFSA) de cada um dos tratamentos, para erlenmeyers de 125 ml devidamente numerados;
Adicionou-se 25 ml de água destilada. As soluções foram submetidas a agitador circular por período de 15 minutos, a 220rpm, e deixadas em repouso por mais meia hora;
Foi usado soluções padrão de pH 4,0 e pH 7,0 para calibrar o potenciómetro o qual foi ligado 30 minutos antes de começar a ser usado.
Mergulhou-se o eletrodo na suspensão homogeneizada e foi feita a leitura do pH. Entre uma e outra leitura lavou-se o electrodo com água destilada com auxilio de um esguicho, e enxugada levemente com papel de filtro.
Os dados obtidos pela leitura foram anotados permitindo traçar um gráfico que mostra a sua variação.
Determinação da acidez pelo CaCl2 0,01M
O pH em CaCl2 0,01M apresenta valores menores do que os determinados em H2O por ser feito em solução alcalina. As vantagens deste método são:
O pH é pouco afectado pela relação entre a TFSA e a solução;
A concentração salina de 0,01 M é suficiente para padronizar as variações de sais entre amostras, evitando-se assim as variações estacionais de pH;
A suspensão de solo em CaCl2 é floculada, o que minimiza os erros provenientes do potencial de junção líquida, uma vez que o eléctrodo de referencia permanece num sobrenadante isento de partículas de solo;
A concentração salina utilizada é semelhante à concentração de sais observada em solução de solo de boa fertilidade. E o Ca2+ é normalmente o ião mais abundante em solos, por essas razões, o pH em CaCl2 representa a actividade do ião H+, mais próxima daquela que existe no ambiente radicular das plantas.
A precisão e estabilidade do aparelho de leitura.
A determinação do pH em CaCl2 0,01M teve a seguinte metodologia:
Pesou-se 10g de TFSA de cada um dos tratamentos, para erlenmeyers de 125 ml devidamente numerados;
Adicionou-se 25ml de CaCl2 0,01M, em uma relação 1:2,5 (proporção de terra e CaCl2). As soluções foram submetidas num agitador circular por um período de 15 min, a 220rpm, e deixadas em repouso durante 40 min.
Foi efetuado leitura após calibração do pHmetro com solução padrão de pH 7,0 e pH 4,0. A calibração foi feita após aquecimento prévio do pHmetro de 15 min e as soluções padrão foram retiradas da geladeira com antecedência de forma a estarem à temperatura ambiente no instante da calibração. Entre cada leitura, foi lavado o eletrodo com água destilada, com auxílio de esguicho, e enxugado levemente com papel de filtro.
Os dados obtidos pela leitura foram anotados e traçados em gráfico.
Determinação do Al por titulação com NaOH 0,1N
A acidez trocável compreende aquela causada pela hidrólise do Al em solução e pelo ião H+ trocável. Este último valor é extremamente pequeno a pH normalmente encontrado no solo, sendo assim, o que se determina é o alumínio trocável. Mostrou-se que uma solução de KCl 1N extrai somente Al3+, com excepção de solos orgânicos ou solos com pH muito baixo (<4,0). Em concentrações relativamente altas, o K desloca principalmente iões Al3+ do solo para a solução, os quais se hidrolisam libertando iões H+ que podem ser titulados com uma base, normalmente, NaOH.
A determinação do Al foi efectuada pesando-se 10g de TFSA de cada um dos tratamentos, para um erlenmeyer de 125 ml devidamente numerados, e adicionou-se 50 ml da solução KCl 0,1N. As soluções foram submetidas a agitação mecânica e deixadas em repouso por um período de 30 minutos. Filtrou-se a solução com 20 ml de KCl e titulou-se com NaOH 0,1N usando 6 gotas do indicador fenolftaleína 3 %. Os dados obtidos pela leitura eram anotados e lançou-se em gráfico.
Percentagem de saturação de alumínio
Esta propriedade (m) expressa a fracção da CTC efectiva que é ocupada pel concentração de alumínio trocável:
O teor de alumínio trocável é um dos parâmetros muito importante ao avaliar-se um determinado solo porque expressa o seu potencial fitotóxico, e quando o seu valor está acima de 60 % provoca um grande aumento na actividade de alumínio em solução. Nestas condições, para a grande maioria das espécies vegetais, o crescimento das raízes é praticamente paralisado.
Percentagem de saturação de bases da CTC a ph 7,0
A saturação de bases (V) representa o valor da percentagem da CTC a pH 7,0 que estão ocupados pelas bases existentes no solo:
Contudo, a nível de manuseio da fertilidade do solo, como o aumento do pH, deve-se usar correctivos que adicionem bases ao solo, de tal forma que eleve também a saturação de bases, razão pela qual utiliza-se calcário, pois este correctivo adicionará cálcio e magnésio ao solo.
A CTC efectiva demonstra a capacidade do solo em reter os catiões em seu pH natural. Isto quer dizer que, qualquer que seja o valor de pH do solo, as cargas negativas ocupadas pelos iões H+ não estão disponíveis para retenção de outro catião por troca. A CTC efectiva é dada pelas concentrações dos catiões:
A boa interpretação do valor da CTC efectiva para o cultivo do solo ao valor do pH natural, fornece uma idéia das possibilidades de perdas de catiões por lixiviação, do potencial de salinidade e necessidade das adubações. Por exemplo, um valor de t menor que 2,5 cmolc/dm3 é indicativo de solo arenoso, com baixo teor de matéria orgânica, ou de um solomais argiloso, com predomínio de argilas de baixa actividade. Nesta condição, se for feita uma adubação pesada poderá ocorrer perdas de catiões por lixiviação e elevada salinidade para as sementes.8
Muitas vezes o solo não será cultivado em seu pH natural, sendo necessário uma calagem, o que leva a alteração da sua CTC.
A CTC potencial representa o valor da CTC de um solo, caso a calagem deste fosse feita para elevar o pH a 7,0. Num solo ácido a elevação do pH para 7,0 promove a neutralização de catiões H+ que se encontram em ligações covalentes com o oxigénio de colóides orgânicos e de óxidos de ferro e de alumínio. Com isto, são desenvolvidas cargas negativas que existiam apenas em potencial.9
Na análise química do solo, obtém-se o valor de T a partir da extracção de H+ + Al+3 com solução salina tamponada a pH 7,0:
O ganho em CTC pela neutralização de H+ adsorvidos será tanto maior quanto mais baixo for o pH natural do solo e quanto maior for o teor de matéria orgânica e de óxidos de ferro e de alumínio do solo. 9
Resultados e discussões
Para o conhecimento das condições do solo antes da incubação tabela 1 foram feitas análises físico - químicas. O calcário utilizado foi calcítico (CaO de 98 % e de MgO 1,83 %).
Tabela 1 Características fisico-químicas do solo antes da incubação com CaCO3
| Bases de Troca (Cmolc/l) | ||||
| K | Na | Ca | Mg | |
| 0.297 | 0.333 | 0.523 | 0 | |
| Análise granulométrica | ||||
| Profundidade (cm) | Argila | Limo | Areia | |
| 0-20 | 34 | 23.5 | 42.5 | |
| pH | ||||
| H2O | KCl | CaCl2 | ||
| 4.54 | 4.14 | 4.05 | ||
La tabela 1, mostra os resultados do analise do solo antes da incubação, demostrando que trata-se de solo fraco para a produção de alimentos.
Tabela 2 Análise química do solo aos 30, 60 e 90 dias após a incubação com CaCO3
| Épocas | Amostras | pH | Al3+ (cmolc/l) | m% | Ca2+ (cmolc/l) | SB (cmolc/l) | |
| H2O | CaCl2 | ||||||
| 30 | 0 | 4.54 | 4.13 | 1.3 | - | - | - |
| 1 | 4.64 | 4.33 | 0.6 | - | - | - | |
| 2 | 4.76 | 4.49 | 0.5 | - | - | - | |
| 3 | 4.82 | 4.63 | 0.4 | - | - | - | |
| 4 | 5.13 | 4.82 | 0.4 | - | - | - | |
| 5 | 5.20 | 5.01 | 0.3 | - | - | - | |
| 6 | 5.36 | 5.18 | 0.3 | - | - | - | |
| 7 | 5.46 | 5.18 | 0.2 | - | - | - | |
| 8 | 5.77 | 5.27 | 0.2 | - | - | - | |
| 60 | 0 | 4.54 | 4.13 | 1.3 | 46.63 | 0.698 | 1.090 |
| 1 | 4.80 | 4.52 | 0.5 | 21.22 | 1.457 | 1.856 | |
| 2 | 4.91 | 4.64 | 0.4 | 14.94 | 2.653 | 3.067 | |
| 3 | 5.14 | 4.8 | 0.3 | 10.97 | 2.947 | 3.361 | |
| 4 | 5.31 | 4.99 | 0.2 | 9.45 | 3.740 | 4.154 | |
| 5 | 5.43 | 5.05 | 0.2 | 5.72 | 4.312 | 4.682 | |
| 6 | 5.58 | 5.19 | 0.2 | 5.32 | 5.464 | 5.873 | |
| 7 | 5.65 | 5.27 | 0.2 | 5.02 | 6.097 | 6.495 | |
| 8 | 5.79 | 5.38 | 0.2 | 3.73 | 7.368 | 7.799 | |
| 90 | 0 | 4.54 | 4.13 | 1.3 | 46.63 | 0.698 | 1.102 |
| 1 | 4.78 | 4.38 | 0.4 | 17.49 | 2.056 | 2.513 | |
| 2 | 4.97 | 4.59 | 0.4 | 13.20 | 2.901 | 3.329 | |
| 3 | 5.19 | 4.68 | 0.3 | 9.44 | 3.054 | 3.485 | |
| 4 | 5.31 | 4.83 | 0.2 | 6.95 | 4.012 | 4.482 | |
| 5 | 5.38 | 5.02 | 0.2 | 4.74 | 4.849 | 5.188 | |
| 6 | 5.57 | 5.20 | 0.2 | 4.68 | 5.913 | 6.246 | |
| 7 | 5.65 | 5.34 | 0.2 | 4.50 | 6.187 | 6.607 | |
| 8 | 5.79 | 5.44 | 0.2 | 4.37 | 7.528 | 7.856 | |
Contudo, as análises química do solo nas épocas estudadas na tabela 2, demonstram que a aplicação de doses crescentes de calcário influenciam de forma significativa nos índices de acidez do solo, pH, Al3+, nas bases de troca Ca2+, saturação por alumínio (m%), soma de bases (SB), e CTCefectiva, porém as bases de troca Na+, K+ e Mg2+ não sofreram influência significativa, devido a carência do mesmo no solo e a pobreza no tipo de calcário utilizado para a incubação respectivamente.
Estes resultados estão de acordo com 4, no qual os autores relatam que após a calagem, as modificações químicas proporcionam um aumento nos valores de pH do solo, nos teores de Ca2+, na saturação de bases, e uma diminuição no alumínio trocável até valores não tóxicos para as plantas, acarretando melhorias significativas na fertilidade do solo, o que provoca um melhor rendimento na maior parte das culturas.
Nos valores de pH e do teor de Ca2+, ocorreu uma significativa interacção entre as doses aplicadas no solo e as épocas de avaliação estudadas, devido ao tempo residual do CaCO3 no solo e do seu poder de neutralização. O alumínio trocável foi apenas influenciado pelas doses crescentes de calcário. As alterações químicas nas duas épocas posteriormente estudadas não sofreram mudanças significativas.
Os valores de pH definem a acidez activa ou actual do solo e dadas as limitações inerentes a sua medição, considera-se neutro o solo com valor de pH entre 6,6 - 7,3. Abaixo de 6,6, diz-se que o solo é ácido, e acima de 7,3 considera-se alcalino.
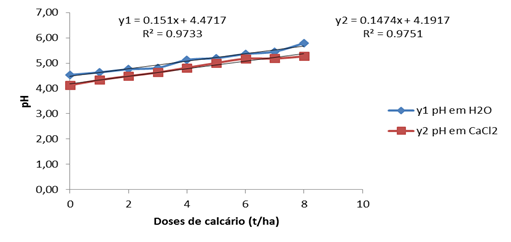
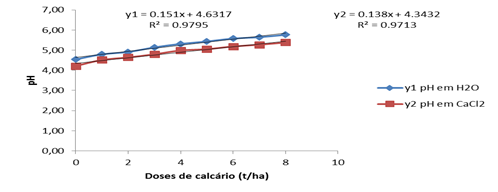
Segundo o grafico, observa-se que o poder tampão do solo actua de tal modo que o pH aos 30 dias na dose máxima de 8t/ha atinge o valor de 5,77 e nas épocas restantes este valor sofre muito pouca variação atingindo o valor máximo de 5,79 quando o pH é determinado em H2O.
O gráfico confirma os resultados onde observa-se que o pH não varia de modo linear com o aumento das doses de calcário evidenciado pelos valores dos coeficientes de regressão 0,973 3 em H2O e de 0,975 1 em CaCl2 aos 30 dias após a incubação.
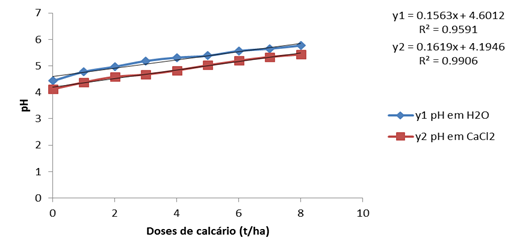
O pH em H2O e em CaCl2 não teve mudanças significativas em relação ao determinado nos 60 dias após a incubação. Houve um decrécimo nas doses nas doses iniciais em CaCl2 0,01M, porém o valor máximo de pH em água foi de 5,79 igual ao dos 60 dias.
Há uma variação linear das doses crescentes de calcário com o pH determinado. Os coefecientes de regressão foram satisfatório, com os valores de 0,9591 para o pH em H2O e de 0,9906 para o
pH em CaCl2.
Os valores máximos de pH em H2O são encontrados aos 60 dias após a incubação. Podemos então dizer que o tempo residual do calcário no solo para elevar a acidez do solo a zonas de mair assimilação de nutrientes é de 60 dias. O pH aos 90 dias não sofreu alterações relativas, mantendo-se constante em algumas doses como do pH determinado aos 60 dias. Mostrando que já não estava a ocorrer a reacção entre o calcário com o solo. A patir da dose de 4t/ha atingiu-se o valor de 5,31 aos 60 e 90 dias, que é o limite da zona de maior adsorção de nutrientes.
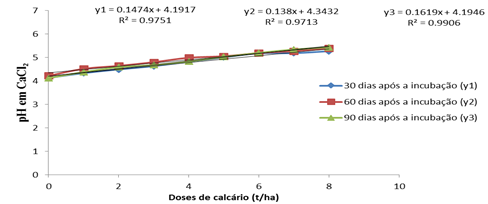
Na figura 4 mostra que pH em H2O dos 60 aos 90 dias praticamente não sofre variação onde y2 e y3 sobrepõem-se sendo desnecessário o aumento de doses de calcário no solo depois dos 60 dias de incubação. O coeficiente de regressão aos 60 dias apresenta um valor superior em relação a outras épocas avaliadas demonstrando que a partir desta época o solo esteja preparado para a implementação de uma determinada cultura.
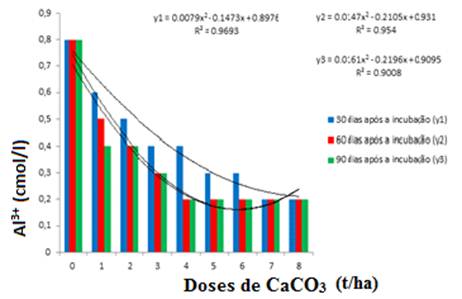
A dose de 5t/ha de CaCO3, utilizada na incubação foi suficiente para neutralizar a concentração de alumínio trocável, de um valor inicial de 1,30 cmolc/l para 0,2 cmolc/l aos 30 dias e o valor mantém-se constante nas doses acima e nas demais épocas avaliadas figura 5, estando de acordo com Morelli et al (1992) que em seu ensaio obteve as concentrações de 0,17 e 0,13 cmolc para as doses de 4,0 e 6,0 t/ha respectivamente.
É importante realçar que a qualidade do calcário a ser utilizado joga um papel de suma importância no efeito das variáveis de acidez do solo. Estima-se que a quantidade de calcário para o aumento do pH e consequentemente enriquecimento do solo com mais nutrientes e eleimanaão da toxicidade do alumínios às plantas ocorre a partir da amostra 5, ou seja, 4t/ha.
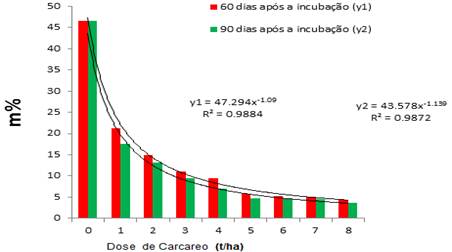
A saturação de alumínio teve um decréscimo significativo nas doses a partir de 3 t/ha onde tanto aos 60 como aos 90 dias esteve abaixo de 20 % figura 6. Nos valores abaixo de 3t/ha, a saturação por alumínio ficou acima de 20 %, que causa limitações ao desenvolvimento da maioria das culturas.
O teor de alumínio trocável é um dos parâmetros muito importante ao avaliar-se um determinado solo porque expressa o seu potencial fitotóxico, e quando o seu valor está acima de 60 % provoca um grande aumento na actividade de alumínio em solução. Nestas condições, para a grande maioria das espécies vegetais, o crescimento das raízes é praticamente paralisado. Na figura 7 mostra-se que despois dos 60 dias e 5 t/ha de calcareo nâo precissa-se de mais incubação por que ja o solo trocou tudo o alumino disponivel, o seja, disminui de 47 % ate 3 %
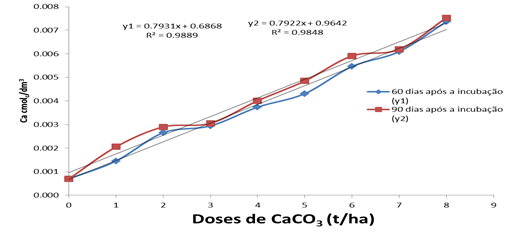
Os valores da concentração de Ca2+ aumentaram de forma linear atingindo o valor máximo na dose de 8 t/ha Fig 5 de 7,368 e 7,528 cmolc/l nas épocas avaliadas. Estes resultados são concordantes com Santos (2010) 4, onde os autores relatam que para um bom desenvolvimento de uma cultura o teor de Ca2+ deve ser maior que 3,0 cmolc/l. Na nossa incubação obtivemos estes valores a partir da dose 3 t/ha que atingiu o valor de 2,947 cmolc/l aos 60 dias e 3,054 cmolc/l aos 90 dias.
Com o aumento da concentração da base de troca Ca2+, a SB aumentou significativamente de forma linear com o aumento das doses de calcário com coeficientes de regressão de 0,9889 e 0,984 8 nas duas épocas estudadas, respectivamente. Portanto, a calagem apresentou um efeito positivo sobre esta variável alcançando os valores de 0,987 7 e de 0,985 2, tendo uma participação de mais de 70 % na capacidade de troca catiônica do solo nas duas épocas avaliadas.
É de salientar que a pobreza do calcário utilizado na incubação, fez com que a soma de bases tivesse uma maior influência da base de troca Ca2+com uma contribuição de 96 %, enquanto que o Mg não teve alguma influência. As bases K+ e Na+ contribuíram com menos de 5 % da sua concentração que já existia no solo antes da aplicação do CaCO3.
O calcareo usado é de modo a melhorar a nutrição das plantas de forma indirecta, ou seja, aumenta a fertilidade dos solos através da criação de condições mais favoráveis em termos de reacção, propriedades físicas e químicas, teor de matéria orgânica, etc. Podendo também actuar de forma directa, já que, apresenta teores muito elevados de nutrientes susceptíveis de conferir um efeito directo na alimentação das plantas.
Viso que tanto o Ca como o Mg são essenciais para as plantas e normalmente encontram-se em baixa disponibilidade nos solos ácidos, então para a correção da acidez são comumente usados os carbonatos, óxidos, hidróxidos ou silicatos de Ca e/ou Mg. Estes diminuem a actividade dos iões H+ e Al3+ na solução do solo, o que torna benéfico para as plantas e microorganismos. As condições fisiológicas que acompanham a acidez dos solos resultam em grande parte de uma deficiência de catiões metálicos adsorvidos, conhecidas por bases, em relação ao H+, e para diminuir esta acidez ou melhorar estas condições, o H+ e o Al3+ devem ser substituídos por estes catiões metálicos.
É composto essencialmente de CaCO3 que são transformados no solo de acordo:
Nota-se que em solos ácidos a acção do calcário é muito eficaz devido o excesso dos iões H3O+(H+) que são neuralizados pelo OH-, favorecendo as reacções directa, ou seja, aquelas em que o calcário se decompõe.
Sendo uma substância pouco solúvel, o poder neutralizante não deve ser suficiente para avaliar a sua eficácia como correctivo de acidez, visto que, a sua velocidade de actuação vai depender do estado de subdivisão das partículas. Assim, um calcário vai actuar mais rapidamente quanto mais íntimo for o contacto entre as suas partículas e o solo, ou seja, quanto mais finamente ele se apresentar.
Porém, é de salientar que uma granulometria bastante fina poderá causar um menor efeito residual, no entanto, o calcário deve dispor de fracções suficientes finas para reagir rapidamente e de fracçoes grosseiras para ir actuar como reserva.
Estabeleceu-se então que o calcário para ser eficaz, do ponto de vista da granulometria, deve passar numa malha de abertura de 2 mm, e pelo menos 60 % deve passar numa malha de 0,71 mm de abertura.
Conclusões
O solo foi incubado com um calcário fino, com poder de neutralização (PN) de 83 % e poder relativo de neutralização (PRNT) de 58,56 %, é calcítico (CaO de 98 % e de MgO 1,83 %). As determinações das fracções de argila (34 %), limo (23,5 %), areia total (42,5 %), caracterizavam um solo franco- argiloso com pH inicial de 4,54 (em H2O), 4,14 (em KCl) e 4,05 (em CaCl2) . A pobreza de bases de troca confere ao solo baixa acidez, apresentando um valor de 4,54; fazendo com que o alumínio tóxico, mesmo em pequenas concentrações, seja adsorvido pelas plantações, a aplicação de doses de calcário neutraliza o alumínio para uma concentração de 0,2 cmolc/l na dose de 7t/ha aos 30 dias de avaliação e 4t/ha aos 60 dias após a incubação. Entretando, aos 90 dias após a incubação, as concentrações permanecem idênticas às dos 60 dias.
Todas as doses elevaram o pH do solo, porém, só a partir de 5t/ha à 8t/ha é que os valores de pH apresentam valores onde há uma maior disponibilidade de nutrientes no solo para as plantas, após 60 dias de incubação, o pH não sofreu qualquer elevaçao significativa devido ao poder tampão do solo, que não permite uma variação alta em relação ao pH natural do solo e mostra que a solução do solo só retira os nutrientes da fase sólida quando estiver carente ou quando a planta exigir. O pH máximo atingido é de 5,79 na última dose de 8t/ha aos 60 dias após a incubação