Introducción
El cáncer es una de las principales causas de mortalidad en todo el mundo y se estima que hay más de 11 millones de casos nuevos y cerca de 6,7 millones de muertes anuales en todo el mundo. Aproximadamente el 70 % de las muertes por cáncer, ocurren en países de ingresos medios y bajos.1 Otro aspecto preocupante es el aumento progresivo en el número de personas sometidas a tratamientos contra el cáncer, con posibilidades de recurrencia de la enfermedad. Por otro lado, se sabe que aproximadamente un tercio de los cánceres se pueden prevenir, siendo la estrategia más rentable para su control a largo plazo.1 También se conoce la existencia de algunos factores que pueden aumentar el riesgo para que una persona desarrolle la enfermedad, tales como el consumo de tabaco, alcohol, tipo de dieta, la obesidad, algunas infecciones, agentes ambientales, carcinógenos ocupacionales y algunos tipos de radiación.1-3
Se estima que en el año 2018 fueron diagnosticados 3,91 millones de nuevos casos (excluyendo el cáncer de piel no melanoma) y alrededor de 1,93 millones de muertes sólo en Europa.2 En la Unión Europea, el número estimado de nuevos casos de cáncer fue de aproximadamente 1.6 millones en hombres y 1,4 millones en mujeres, con 790 000 fallecimientos en hombres y 620 000 en mujeres en el mismo año.2 Los tipos de cánceres más comunes son los de mama, colorrectal, pulmón y próstata, que contribuyen a la mitad de los tipos de cáncer en general. Al respecto, los tres primeros son los causantes de las muertes más comunes por esta enfermedad, seguidos del cáncer de páncreas.2,3 Se prevé que la incidencia de cáncer aumentará en un porcentaje cercano al 10% en el 2035 debido al envejecimiento de la población. Como resultado del aumento de la supervivencia a largo plazo, se considera que más de 12 millones de ciudadanos europeos sobrevivirán a la enfermedad y necesitarán apoyo profesional y social, así como de un esfuerzo continuo de investigación para reducir los efectos a largo plazo de los tratamientos y evitar la aparición de algún cáncer secundario.2 El costo económico del cáncer en Estados Unidos para 2018 fue de 150 billones de dólares y en este país se considera que hay más de 20 millones de personas con la enfermedad y que estos irán aumentando a medida que envejezca la población.4
Por lo anterior, es necesario buscar nuevas alternativas para tratar esta enfermedad. Hoy en día hay avances en la quimioterapia y radioterapia, así como novedades en la inmunoterapia, trasplante de células madre, terapia dirigida, terapia hormonal y en general la terapia biológica.5 Esta última, se refiere al uso sustancias derivadas de organismos vivos similares a las obtenidas en el laboratorio, para tratar diversas enfermedades. Se destacan varias formas de llevar a cabo una terapia biológica; los inhibidores de puntos de control inmunitario, terapia de células inmunitarias (llamada también terapia celular adoptiva o inmunoterapia adoptiva), anticuerpos terapéuticos, sustancias moduladoras inmunitarias y las vacunas terapéuticas.6-8
En general, las vacunas han supuesto una gran contribución a la salud mundial y condujeron a la eliminación de la viruela y prácticamente, a la erradicación de la poliomielitis y la difteria. Las vacunas tradicionales están basadas en patógenos contra enfermedades infecciosas a tratar y han demostrado ser exitosas. Sin embargo, la mayoría de las aplicadas contra el cáncer han demostrado resultados clínicos ineficientes.9 Esto se debe probablemente, a varios factores, entre los que se incluyen: algunas barreras biológicas 10, la inmunogenicidad del antígeno tumoral intrínsecamente baja y el microentorno inmunosupresor del tumor.11 El uso de vacunas en el tratamiento de varios cánceres parece ser prometedor, pero sólo una de ellas desarrollada contra esta enfermedad, ha sido aprobada por la Administración de Medicamentos y Alimentos de los Estados Unidos (siglas FDA del inglés Food and Drug Administration), después de varias décadas de investigación.12 Una de las principales razones de los fallos, es la liberación ineficiente in vivo cuando se administran las vacunas, ya que no se pueden alcanzar con éxito las dianas celulares.13
Recientemente, investigadores en el área de la inmunología, biotecnología, ingenieros y científicos en general, se han centrado en desarrollar nuevos materiales de administración para la próxima generación de vacunas contra el cáncer.13 Como resultado, se ha presentado un amplio crecimiento en los estudios relacionados con la aplicación de biomateriales en la administración de fármacos, y específicamente en vacunas contra el cáncer.6-8,14 Varios métodos de administración, como las nanopartículas,15) las micropartículas, los materiales autoensamblados 16 y los soportes de biomateriales conocidos popularmente como scaffolds,17 se han utilizado en combinación con diversas formas de vacunas contra el cáncer, por ejemplo, basadas en subunidades de ADN, ARNm, péptido/proteína, o basadas en células, donde se han observado resultados preclínicos prometedores. Las investigaciones han demostrado que, las vacunas contra el cáncer formuladas con biomateriales tienen ciertas ventajas con relación a las vacunas convencionales.18 Ello obedece a que, las basadas en biomateriales, pueden administrarse al organismo de una manera controlada y las propiedades físicas de la vacuna, como el tamaño, la forma, la carga o la porosidad (ya sea del biomaterial, los agregados o el conjunto de estos) se pueden ajustar de forma selectiva a tejidos específicos con una farmacocinética de liberación apropiada.19,20
Bajo estas consideraciones, en este artículo se presentan algunas clases de vacunas, su estado clínico y los evidentes avances con el uso de biomateriales y vacunas contra el cáncer. Se resumen, además, los aspectos de diseño para las plataformas de administración basadas en biomateriales y se proporciona una visión futura sobre el desarrollo de estas.
Desarrollo del tema
En esta revisión, se consultaron diversas publicaciones acerca del uso de algunos biomateriales en el desarrollo de vacunas contra el cáncer. Se empleó como buscador Science Direct, a partir de las palabras claves reportadas en la tabla 1 y combinaciones de éstas. A partir de los resultados de la búsqueda se tomaron los reportes de relevancia en su contenido, analizando las secciones de resumen, introducción y conclusiones para ser tomados en cuenta durante el desarrollo de la revisión. En general, en una primera etapa se revisaron alrededor de 150 publicaciones de artículos científicos, así como comunicaciones y carteles oficiales de la organización mundial de la salud (OMS) y el instituto nacional de salud de estados unidos (NHI, del inglés National Institutes of Health). En una segunda etapa se redujeron estos ejemplares en 70 artículos, los cuales respondían al interés de esta publicación y el tema se delimitó al desarrollo de vacunas para el tratamiento de cáncer con liberación mediante los biomateriales más relevantes y con mayores aplicaciones clínicas.
Tabla 1 Búsqueda de artículos a partir de palabras claves, relacionadas con el desarrollo de vacunas formuladas con biomateriales para tratar el cáncer
| Biomateriales | Vacunas Cáncer | Vacunas Cáncer Biomateriales | Scaffolds | Scaffolds Cáncer | |
| Año de publicación | |||||
| Año 2019 | 1,715 | 536 | 44 | 2,346 | 746 |
| Año 2018 | 10,018 | 4,817 | 277 | 16,449 | 5,428 |
| Año 2017 | 9,592 | 4,181 | 277 | 15,106 | 4,838 |
| Tipo de Artículo | |||||
| Revisión | 7,953 | 11,659 | 494 | 23,369 | 10,642 |
| Investigación | 76,032 | 27,848 | 576 | 85,398 | 19,231 |
| Capítulo de Libro | 7,232 | 7,563 | 380 | 11,426 | 4,348 |
| Tipo de Publicación | |||||
| Biomateriales | 17,143 | - | 271 | 4,894 | 862 |
| Ciencias de Materiales e Ingeniería | 3,506 | - | - | - | - |
| Vacunas | - | 4,198 | - | - | - |
Aspectos generales sobre las vacunas contra el cáncer
La inmunoterapia tiene sus orígenes hacia el año 1891 cuando el científico William Coley hizo el primer intento de estimular el sistema inmunológico, para mejorar la condición de un paciente con cáncer estimulándolo con inyecciones intratumorales de Streptococcus pyogenes y Serratia marcescens inactivados, componente conocido como la toxina de Coley.21 La idea surgió de la observación de remisiones espontáneas de sarcomas en pacientes con tipos extraños de cáncer, que habían desarrollado erisipela, que al ser inoculadas con las inyecciones presentaban una reacción inmunológica con efectos destructivos sobre las células malignas. Ello producía una regresión de ciertos tipos de tumores. Sin embargo, a pesar de las respuestas efectivas en sus pacientes, el trabajo de Coley fue visto con cierto escepticismo por la comunidad científica. No obstante, hoy en día, la ciencia moderna ha demostrado que los principios de Coley eran correctos. De hecho, el bacilo Calmette-Guérin [BCG, vacuna contra la tuberculosis], que es un ejemplo similar a la toxina de Coley, todavía se usa por vía intravesical para tratar el cáncer vesical superficial.22
Las vacunas profilácticas generalmente se administran a individuos sanos para prevenir una infección o ataque de algún microorganismo. De forma opuesta, las vacunas terapéuticas se administran a pacientes que ya padecen la enfermedad y se diseñan para erradicar las células cancerosas mediante la potenciación de la respuesta inmunitaria del paciente.23 Los diversos mecanismos efectores inmovilizados por la vacunación terapéutica atacan y destruyen específicamente las células. De esta manera, las vacunas terapéuticas contra esta enfermedad, en principio, pueden utilizarse para inhibir el crecimiento de cánceres avanzados y/o tumores recidivantes que son resistentes a las terapias convencionales, como la cirugía, la radioterapia y la quimioterapia.23
Las vacunas se constituyen normalmente de tres componentes: El primero de estos está representado por uno o más antígenos específicos que pueden estar codificados por ADN, o son péptidos, proteínas, o carbohidratos, derivados de epítopos inmuno-dominantes identificados en patógenos o células cancerosas.24) Tras la vacunación, estos antígenos específicos pueden generar respuestas inmunitarias específicas y duraderas contra las células del huésped, por lo que destruyen patógenos o células cancerosas. El segundo componente de las vacunas, que no siempre es necesario, es un portador.24) Este podría ser un scaffold, que puede ser inmunogénico por sí solo y que se utiliza para administrar el antígeno a las células apropiadas in vivo o retenerlo en un sitio. El tercer componente importante de algunas vacunas es el adyuvante, que se requiere para la administración efectiva de la vacuna y para inducir respuestas inflamatorias robustas.24
Los adyuvantes eficaces actúan a través de múltiples mecanismos, como la generación de depósitos de antígenos, la activación de las células presentadoras de antígenos (APC, del inglés Antigen Presenting Cell) a través de receptores de reconocimiento de patrones (PRR) -como los receptores tipo toll (TLR del inglés Toll-Like Receptor), y la mejora de la presentación de antígenos por las APC.25 Además de los adyuvantes con funciones biológicas, la administración de sistemas de liberación incluidos en la formulación de la vacuna, también pueden contribuir a lograr la capacidad de localización deseada, el depósito y la inflamación.26) Los adyuvantes generalmente se pueden dividir en dos categorías: moléculas inmunoestimulantes y vehículos de administración de antígenos. Sin embargo, pueden exhibir ambas características simultáneamente. Las vacunas y los adyuvantes utilizados en varios estudios pueden ser patógenos atenuados (por ejemplo: toxinas de Coley) o adyuvantes que son mezclas de paredes bacterianas y aceite mineral, como los Adyuvantes Completo e Incompleto de Freund. Aunque había sido una práctica generalizada para los inmunólogos el uso de adyuvantes junto con vacunas específicas para generar respuestas inmunitarias efectivas, los mecanismos de su acción eran poco conocidos.26 El descubrimiento de los TLR en la década de 1990 aumentó significativamente la comprensión de cómo los adyuvantes estimulan la inmunidad innata y la conectan con la inmunidad adaptativa. Los recientes avances en nanotecnología también han hecho posible la administración específica, efectiva y controlada de las vacunas al sistema inmunitario.26
A pesar de los considerables esfuerzos para desarrollar vacunas contra el cáncer, la traducción clínica de estas en terapias eficaces, ha sido un desafío durante décadas. Es así que la FDA, sólo ha aprobado algunas vacunas profilácticas, incluida una para el virus de la hepatitis B que es uno de los causantes principales de cáncer de hígado, y otra para el virus del papiloma humano, que es el desencadenante de aproximadamente el 70 % de los cánceres de cuello uterino.9 El resultado más alentador en los avances recientes en la inmunología del cáncer, ha sido lograr por primera vez un ensayo clínico de una vacuna terapéutica basada en células inmunitarias, en el que se evidenció un aumento en la supervivencia general en pacientes con cáncer de próstata refractario a las hormonas. Esto llevó a la aprobación de dicha vacuna conocida como Sipuleucel-T y denominada por parte de la FDA con el nombre comercial de Provenge y desarrollada por la corporación Dendreon (Estados Unidos) en 2010.9
En términos generales, para que una vacuna contra esta enfermedad sea efectiva, se deben cumplir una serie de requerimientos relevantes para lograr inducir la respuesta inmune deseada. Primero, los antígenos deben administrarse a las células presentadoras de antígenos (APC), que incluyen principalmente las células dendríticas (CD), 9 y en menor grado macrófagos, neutrófilos y células endoteliales linfáticas.27 Posteriormente, las APC deben procesar y presentar en forma cruzada antígenos tumorales para la maduración y activación de las células T (células ‘naive’ CD4 + células T + células CD8) que residen en los ganglios linfáticos GLs (o LNs de la sigla en inglés Linfatic nodes).13 Por último, las células T auxiliares activadas (células Th) y los linfocitos T citotóxicos (CTLs) se infiltran en el sitio del tumor, desplazando el microambiente inmunosupresor del tumor hacia un entorno proinflamatorio 28 como se observa en la figura 1. Esta alteración en el microentorno ayuda a los CTL a destruir células tumorales y está acompañada por otros mecanismos para la muerte de células tumorales, por ejemplo, la activación de células asesinas naturales (NK, del inglés Natural Killer), y la citotoxicidad celular dependiente de anticuerpos.28
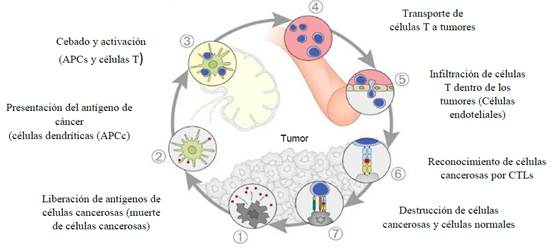
Fig. 1 Representación del ciclo de inmunidad contra el cáncer, que ilustra la respuesta inmune a un tumor 13, (figura modificada con autorización de los autores)
Acerca de los biomateriales
Históricamente, los primeros elementos empleados como biomateriales fueron el oro y marfil. Los egipcios y romanos lo usaban para corregir defectos craneales, pero no fue hasta el siglo XX que materiales biológicos, como la placenta, se empezaron a utilizar. El celuloide basado en nitrato de celulosa fue el primer plástico artificial utilizado para los defectos craneales, y luego en la Segunda Guerra Mundial el polimetacrilato de metilo (PMMA) fue uno de los primeros polímeros empleado como biomaterial.29) Dependiendo de la reacción del tejido al biomaterial con el tejido ósea, se puede dar una primera clasificación de estos materiales: 29
Materiales biotolerantes: están separados del tejido óseo por una capa de tejido fibroso.
Materiales bioactivos: tienen la propiedad de establecer enlaces de carácter químico con el tejido óseo, en un proceso conocido como osteointegración. En este proceso la fase de colágeno y mineral del hueso adyacente se deposita directamente sobre la superficie del implante.
Materiales bioinertes: en esta clase es posible tener contacto directo con el tejido óseo adyacente bajo ciertas condiciones. Además, no se producirán reacciones químicas entre el implante y el tejido.
La identificación de esta interfase activa entre los biomateriales y los sistemas biológicos ha expuesto varias ideas importantes sobre la biocompatibilidad, las cuales persisten hoy en día y son de gran importancia.29) La primera idea es que las interacciones material-tejido ocurren en ambos sentidos, es decir el material estimula una respuesta del organismo y, a su vez, el organismo estimula una respuesta del material. Es así como los materiales cambiarán en algún momento si son introducidos en un entorno biológico, ya sea por deposición de sustancias, corrosión, degradación, modificación química u otro mecanismo de acción. Este intercambio de respuestas resulta útil para sugerir una segunda idea, donde se propone que la relación material-tejido es un sistema dinámico, donde estos se modifican mutuamente, llevando a otros cambios en sí mismos. Es decir, que no hay una relación estática, sino que está cambiando a lo largo de su vida útil, lo cual es evidenciado en procesos normales como el envejecimiento o el desarrollo de enfermedades sistémicas o locales, etc. La tercera idea es que las reacciones material-tejido son una función del tejido donde esta se crea. Por su parte, la cuarta idea plantea que los biomateriales son cuerpos extraños que generan respuestas biológicas como reacción natural.29
Finalmente, una idea reciente sobre la biocompatibilidad es que es posible personalizar las interacciones en la interfase, donde se pueden obtener materiales con funciones que permitan personalizar y optimizarla en los tejidos para asegurar los mejores resultados clínicos.29) Asimismo, se requiere que los materiales desempeñen funciones a largo plazo en los tejidos, donde se pueda modificar la superficie de un material para limitar la adsorción de proteínas no específicas, incorporar secuencias peptídicas para estimular las interacciones de proteínas o células nativas, o proporcionar una estructura tridimensional para fomentar la formación de la matriz. Por estas razones, el estudio de los biomateriales es un campo versátil y amplio.29,30
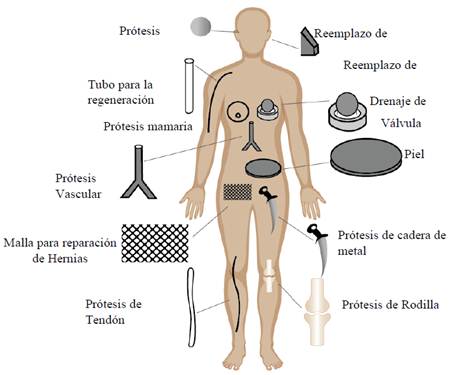
Otra forma de clasificar los biomateriales es respecto a su origen, dividiéndose en sintéticos y naturales. Los sintéticos se obtienen por procesos químicos y su diseño se centra en el desarrollo de polímeros biodegradables y bioadsorbibles, que puedan ser descompuestos a medida que vaya avanzando la regeneración del tejido. Entre estos materiales se destacan: polioles, los poliacrilatos, poliamidas, polisiloxanos, poliésteres, policarbonatos, poliestirenos, poliuretanos, polialquenos y polipéptidos sintéticos.30-32 Los naturales se pueden extraer a partir de una fuente presente en la naturaleza, y suelen ser polimeros de origen animal, vegetal, de hongos o microorganismos. Estos biomateriales y sus derivados tienen la ventaja de poseer alta biocompatibilidad, funcionalidad, durabilidad y un aspecto importante, buenas reacciones inmune in vivo31, y se pueden obtener desde proteínas, poliésteres naturales y polisacáridos.30-32 En la figura 2 se presentan las aplicaciones principales de los biomateriales con incidencias médicas.29
Los biomateriales y las vacunas contra el cáncer
Son numerosos los tratamientos para el cáncer que emplean vacunas pero que han presentado resultados insatisfactorios, entre otros, por la falta de métodos efectivos para su liberación.33 En este sentido, las vacunas peptídicas (Vacunas de subunidades las cuales están basadas en péptidos sintéticos, proteínas, o polisacáridos que han demostrado contener epítopos protectores) resultan un adecuado ejemplo, ya que cuando éstas son suministradas sin modificar, la velocidad general de respuesta clínica es apenas del 3%.34) No obstante, si se aíslan las células dendríticas (CDs) de un paciente y luego se tratan con péptidos ex vivo y se inyectan nuevamente, se puede observar una mejora de la respuesta clínica.35 Esta diferencia se puede explicar teniendo en cuenta que los péptidos sin modificar presentan dificultades para alcanzar las CDs in vivo, lo cual disminuye su eficiencia cuando no cuentan con una plataforma de liberación para ese tipo de células.35 Por lo tanto, los sistemas de liberación que emplean biomateriales son adecuados como alternativa para vencer las barreras que presentan las vacunas para el cáncer in vivo y mejorar la eficiencia de éstas 36, otro aspecto es que las propiedades van a depender del tipo de vacuna usada.37
Sistemas de liberación empleando nanopartículas
Las vacunas a base de nanopartículas son una variedad de sistemas de liberación que incluyen liposomas y nanopartículas poliméricas auto-ensambladas o lipídicas.38 La incorporación de nanopartículas en ellas puede mejorar la liberación en ciertos órganos o tejidos, tales como los ganglios linfáticos (GLs), el bazo o los tumores sólidos, incrementando su efecto sobre el lugar de interés. Los liposomas, son quizás, las primeras nanopartículas estudiadas para su uso en vacunas contra el cáncer, con algunas formulaciones que ya se encuentran en pruebas clínicas, pues han sido aprobadas por la FDA en las primeras fases.38 Constituyen una opción llamativa para una rápida aplicación clínica y muestran capacidad para mejorar la liberación cuando se comparan con fármacos libres.39
Sin embargo, esta primera generación de liposomas presenta algunas desventajas, como la baja capacidad de carga, estabilidad y toxicidad.40 Otro tipo de portador de fármacos a base de nanopartículas ampliamente estudiado y aprobado por la FDA, son los desarrollados a base de ácido poli (láctico-co-glicólico) o PLGA, por sus siglas en inglés (Poly Lactic-co-Glycolic Acid); pero que presenta el mismo inconveniente de baja capacidad de carga.40,41 En contraste, entre las ventajas de usar nanopartículas de PLGA se encuentran el poder generarlas, precisa y consistente, usando protocolos bien establecidos para la obtención de un amplio rango de tamaño de las partículas.42) Una notable diferencia entre los liposomas y el PLGA, que afecta su uso como plataformas de liberación, es la hidrofilicidad y/o hidrofobicidad de la carga terapéutica.43 Los liposomas se constituyen por un centro hidrofílico y una bicapa hidrofóbica, lo cual permite la carga de compuestos tanto hidrofílicos como hidrofóbicos en la misma nanopartícula; mientras que los PLGA, tienen un mayor contenido hidrofílico, lo cual permite un menor encapsulamiento para compuestos hidrofóbicos.43,44
Para superar los obstáculos que aún se presentan con los sistemas de liberación comúnmente usados, se han intentado modificaciones químicas de las formulaciones que contienen liposomas o PLGA, mejorando la estabilidad y la velocidad de encapsulación de la carga.45 En este sentido, se han desarrollado nuevas clases de nanopartículas, como las nanopartículas auto-ensambladas, que con frecuencia tienen altas capacidades de carga y suministran satisfactoriamente vacunas peptídicas o de ácidos nucleicos, o las nanopartículas lipídicas, con su historial de liberación exitosa del ARN de interferencia pequeño (ARNip), que se han usado ampliamente para la liberación en vacunas de ARN mensajero (mARN).38,46,47
Sistemas de liberación a base de biomateriales scaffold
Las vacunas contra el cáncer a base de scaffold, son de liberación local, tales como los polímeros e hidrogeles.38 Los scaffolds usualmente encapsulan una variedad de moléculas, entre los que se encuentran antígenos e inmunomoduladores, que programan eficientemente al tejido periférico y facilitan la infiltración en la célula inmune.48 Las vacunas para cáncer a base de scaffold usadas comúnmente incluyen tres materiales degradables y altamente biocompatibles: el PLGA, los hidrogeles a base de alginato y los microtubos a base de sílica mesoporosa (MSRs, por sus siglas en inglés mesoporous silica rods).49) El PGLA está aprobado por la FDA, pero no es inyectable y, debido a su rigidez, debe ser implantado.50 A su vez, los hidrogeles a base de alginato pueden ser procesados bajo condiciones criogénicas para formar criogeles, los cuales cuentan con propiedades de memoria, de forma que facilita su inyección en el paciente.20 Sin embargo, los criogeles requieren agujas de gran calibre que pueden ocasionar lesiones en el sitio de inyección.48 Los scaffolds tanto de PLGA como los criogeles, han mostrado buen desempeño para el encapsulamiento de antígenos derivados de células tumorales, pero el PLGA es más usado para encapsular antígenos de lisado tumoral, en tanto que lo criogeles, se usan para transportar células tumorales enteras irradiadas.20,50,51 Los MSRs, son quizás las formas de scaffolds inyectable más usadas, ya que se ensamblan para formar estructuras tridimensionales in situ, después de su inyección.51) No obstante, solo se pueden usar para encapsular pequeñas cargas (ácidos nucleicos, péptidos o proteínas), por lo que no son apropiados para encapsular células tumorales enteras como fuentes de antígenos.51 Dado el hecho de que las vacunas a base de scaffolds requieren el encapsulamiento de un número significativo de moléculas, mientras permiten la infiltración de células inmunes, son diseñadas para que contengan estructuras porosas, cuyos poros se puedan ajustar para acomodarlos a distintos tipos de carga.48-51 Las modificaciones químicas sobre estos, permiten que puedan cargar casi todos los tipos de vacunas, incluyendo ácidos nucleicos, péptidos, lisados tumorales y células tumorales enteras.38,52
Una clara diferencia entre la liberación en las vacunas a base de nanopartículas y de scaffold, consiste en la duración de éstas y su interacción con la célula inmune.20 Las primeras se pueden internar fácilmente usando los APCs en el tejido o los GLs después de la inmunización intersticial, debido a su pequeño tamaño. En contraste, las vacunas a base de scaffold, por su gran tamaño, pueden interactuar con las células inmunes a través de las cargas terapéuticas encapsuladas que se pueden liberar en un periodo prolongado.36 Por lo tanto, las vacunas a base de nanopartículas requieren varias dosis para alcanzar la inmunidad antitumoral efectiva, mientras que aquellas a base de scaffold logran respuestas antitumorales con una o pocas dosis.51
Vacunas a base de biomateriales para la liberación en los ganglios linfáticos [GL]
Objetivo: Ganglio linfático (GL)
Los Ganglios linfáticos GLs y sus alrededores contienen una amplia y diversa población de tipos de células, tales como APCs, células T y células endoteliales linfáticas, que participan en las respuestas inmunes 53,54, por lo que usarlas como objetivo, es una estrategia prometedora para controlar la magnitud de la eficiencia de la vacuna, tanto en escenarios terapéuticos como profilácticos.55
Después de años de investigaciones, se ha encontrado que los parámetros físicos y químicos de las vacunas, tales como el tamaño, la carga, las propiedades superficiales y la composición química, puede afectar gravemente su biodistribución. Estas propiedades se listan en la figura 3.9,13
De estos factores, el tamaño es determinante, ya que afecta la biodistribución cuando se aplican por inyección intersticial, debido a las diferencias entre la sangre y los vasos linfáticos residentes en el espacio intersticial.9,13) Mientras que las células endoteliales vasculares forman uniones rígidas alrededor de los capilares sanguíneos [de menos de 10 nm de tamaño], las linfáticas forman uniones discontinuas alrededor de los capilares linfáticos (de cientos de nanómetros).9) La vacuna ideal tendría un tamaño entre los 2 y 200 nm, ya que reduce la entrada al vaso sanguíneo y la diseminación sistémica, mientras permite la entrada a los vasos linfáticos.9
Además del tamaño, la carga también es un factor importante que afecta el tráfico de las vacunas hacia los GLs y su transporte por APCs, pues la carga negativa de la bicapa fosfolipídica que compone a las membranas de las células crea una repulsión contra las vacunas aniónicas. Ello no sólo disminuye la interacción célula-vacuna, sino que también disminuye el contacto con las células, ayudando al movimiento cuidadoso de las mismas a través del vaso linfático e inhibe el consumo de estas por APCs, una vez que alcanzan los GLs.9,13,56 En contraste, las vacunas catiónicas presentan una mayor interacción célula-vacuna, pero pueden quedar atrapadas en el intersticio o el endotelio linfático antes de alcanzar los GLs.9,13,56

Fig. 3 Interés de las propiedades biofísicas de los biomateriales: tamaño, carga y la PEGilación en el destino de las vacunas administradas intersticialmente dirigidas a los linfonodos.13 Modificado con autorización de los autores
Liberación en objetivo: células dendríticas
Estas células dendríticas (CDs o DCs del inglés dendritic Cells) son un tipo de células inmunes muy importantes que pueden procesar los antígenos presentes, por lo que usarlas como objetivo resulta prominente para preparar las células Tnaive CD8 e iniciar la inmunidad antitumoral.57 Sin embargo, existen diversos retos en la liberación de vacunas en las CDs. En primer lugar, las otras células fagocíticas [macrófagos y neutrófilos], compiten con las CDs para fagocitar antígenos exógenos, lo cual reduce la cantidad de antígenos asimilada por las CDs.9,55,56 Además, las propiedades fagocíticas de las CDs maduras es menor, de modo que la capacidad para procesar e internalizar los antígenos está disminuida.58) Como se mencionó antes, algunas vacunas utilizan el PGE o una superficie aniónica para mejorar la biodistribución en los GLs, aunque la internalización en las CDs puede verse afectada debido a la fuerte diferencia de hidrofilicidad o la repulsión electrostática entre las membranas celulares y la vacuna.13,58,59 Para superar este obstáculo, una vez las vacunas alcanzan los GLs, se deben llevar a cabo estrategias para mejorar la recepción de las CDs que se encuentran en los GLs. Entre éstas se han desarrollado aproximaciones apuntando a ligandos específicos de las CDs, para reducir los efectos secundarios fuera de rango de actuación de la vacuna 13,58, así como el uso de componentes funcionalizados con anticuerpos que permiten mejorar tanto la especificidad, como la capacidad de mejorar la presentación del antígeno.13 En la figura 4 se presentan un ejemplo de la actuación de vacunas liberadas mediante biomateriales en las células dendríticas.
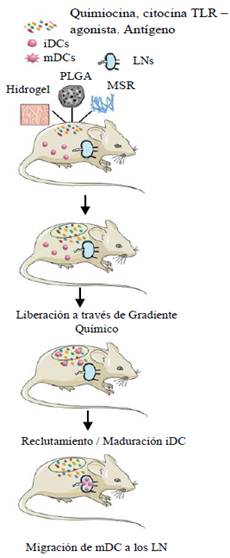
Fig. 4 Esquema de vacunas basadas en biomateriales con Scaffolds, con materiales como hidrogeles, poliácido láctico-coglicólico) (PLGA) y micro-barras de sílice mesoporosa (MSR) para ser liberarlos en los ganglios linfáticos empelando CDs. 9,13,60-62) Modificado con autorización de los autores
Las células dendríticas inmaduras: iDCs que se convierten en células dendríticas maduras: mDCs y migran a los ganglios linfáticos (LNs) donde inician su actividad antitumoral.
A continuación, se describen brevemente algunos resultados encontrados para dos tipos de vacunas a base de scaffold inyectable: hidrogeles y los microtubos a base de sílica mesoporosa.
Hidrogeles inyectables
Como se ha mencionado anteriormente, las vacunas a base de PLGA han mostrado ser promisorias para tratar el cáncer, aunque tienen como desventaja la implantación quirúrgica, procedimiento que es doloroso y puede dejar cicatrices en el paciente.44,45 Para disminuir estos efectos sobre el paciente, se han buscado alternativas como el uso de scaffolds inyectables tales como los criogeles, los cuales son obtenidos mediante la polimerización del alginato metacrilado a -20 °C, temperatura a la cual se forman cristales de hielo dentro de la estructura del criogel, y cuyos macroporos lo constituyen los espacios que se originan al derretir el hielo a temperatura ambiente.48
Una característica importante de los criogeles es su capacidad para retener formas, lo que les permite recuperar su configuración inicial después de su inyección con una aguja de calibre 16 convencional.48,53) Para evaluar su bioactividad, se han realizado pruebas que indican que las vacunas a base de criogeles inducen una mayor tasa de supervivencia en ratones que aquéllas a base de PLGA, aplicando el mismo esquema de inmunización.48 No obstante, la primera generación de criogeles no era adecuada para ser inyectada usando una aguja de calibre menor al 16, sin dañar el criogel; por lo que aún se dejaban heridas en el sitio de inyección.63,64 Para perfeccionar esto, se desarrolló una segunda generación de criogeles, incorporando enlaces iónicos adicionales que mejoran su elasticidad y la posibilidad de inyectarlos usando agujas de calibre 18, sin dañar su estructura.9,63
Microtubos a base de Sílica Mesoporosa (MSR)
La sílica mesoporosa se ha usado ampliamente en el diseño de muchos biomateriales a causa de su gran biocompatibilidad 64; especialmente para su aplicación en vacunas contra el cáncer. Las mismas se han sintetizado con ciertas relaciones características (88 μm × 4,5 μm). Estos microtubos son inyectables una vez reconstituidos en tampón fosfato salino (PBS). No obstante, debido a las relaciones mencionadas, se auto ensamblan aleatoriamente luego de ser inyectados y generan poros de mayor tamaño que las células, permitiendo su infiltración.51 Se ha reportado que una dosis única de MSR cargadas con TAA (del inglés Tumor-Associated Antigens), Factor Estimulante de Colonias de Granulocitos-Macrófagos (GM-CSF por sus siglas en inglés Granulocyte Macrophage Colony-Stimulating Factor) y CpG (regiones del ADN donde existe una gran concentración de pares de citosina y guanina enlazados por fosfatos) puede inducir una potente inmunidad antitumoral protegiendo al 90% de los ratones con linfoma de células EG7.OVA.51 Otro aspecto por resaltar es que una dosis única de vacuna MSR también indujo respuestas de anticuerpos duraderas.51 Esto significa que las MSR también se pueden usar para otros tipos de vacunas, como Zika, Ébola y contra Plasmodium falciparum, donde la inducción de anticuerpos de alto título es crucial para la prevención de la enfermedad.65
Vacunas a base de Scaffolds de nanotubos de carbón
Las vacunas basadas en nanotubos de carbón CNT del inglés carbon nanotubes, requieren de varios pasos sintéticos y de purificación en el transcurso de la producción. La caracterización completa de las identidades fisicoquímicas de los materiales de partida, intermedios y productos finales es importante para obtener resultados biológicos reproducibles e interpretables, dada la variabilidad inherente que se observa en los estudios inmunoterapéuticos.24
La capacidad de vincular múltiples copias de antígenos o estimulantes inmunes simultáneamente a los nanotubos de carbón permite diversas posibilidades para su uso en la formulación de vacunas; de hecho, se pueden incorporar componentes virales, bacterianos y protozoarios, así como adyuvantes CpG.66); Uno de los primeros intentos de aplicar la CNT como scaffolds para el desarrollo de vacunas consistió en la unión covalente de los péptidos de una envoltura viral a los CNT.67 Esto demostró que era posible retener la estructura del epítopo determinante antigénico en una forma inmunogénica, cuando se unía al CNT. De hecho, los complejos moleculares de proteínas virales del CNT fueron capaces de generar respuestas inmunitarias específicas en modelos animales. Por ejemplo, se ha demostrado que el péptido CNT provocó respuestas en Inmunoglobulina G (IgG) que son neutralizantes.57 También se ha usado un lisado de células tumorales conjugado a CNT de pared única, como una vacuna terapéutica contra el cáncer en un modelo con ratones con hepatoma. Este prototipo de vacuna conjugada estudiada en ratones mejoró las tasas de curación de los animales en comparación con los lisados solos, aparentemente al mejorar la activación de las células T citolíticas.68,69 Adicionalmente, se han comparado los efectos de CNT de múltiples paredes con células madre embrionarias, inyectadas por separado en los mismos ratones para suprimir el crecimiento del carcinoma de colon. Esta combinación resultó más efectiva que cualquiera de los agentes administrados solos, y a su vez estimuló la activación de células CD4 y CD8.70
Conclusiones
Se han presentado diversos estudios para el desarrollo de vacunas contra el cáncer empleando biomateriales como sistemas de liberación. Los biomateriales tienen características que les permiten ser portadores efectivos, incluida la multivalencia, su estabilidad y la posibilidad de internalización en las células presentadoras de antígenos. En este sentido, el uso de Scaffolds es solo una de las tantas aplicaciones, como portadores solos o con pequeñas moléculas incorporadas a ellos que mejoren la liberación de vacunas, por ejemplo, los scaffolds basados en nanopartículas de carbono. Sin embargo, se requiere una mejor comprensión de las especificaciones que controlan este proceso, como la longitud, la carga, la hidrofobicidad, para optimizar su uso.
Es importante resaltar que, aunque se han logrado diversos avances en la aplicación de las vacunas contra el cáncer, empleado, el paso final será traducir las novedosas técnicas desarrolladas en los laboratorios académicos a fases clínicas. La capacidad de producción a gran escala de estas vacunas y el control de éstas deben ser factores importantes que deben abordarse antes de que las vacunas basadas en biomateriales puedan ser comercializadas. Un aspecto para mejorar el potencial de aplicaciones clínicas es el desarrollo de tecnologías de liberación compuestas por materiales que ya han sido aprobados por las agencias reguladoras