Introducción
La humanidad genera grandes volúmenes de residuales, lo que crea uno de los mayores problemas de contaminación al medioambiente. En este sentido, las actividades agropecuarias y agroindustriales generan desechos agrícolas y forestales que representan una fuente potencial para la producción de bioadsorbentes. Éstos son utilizables en la remoción de contaminantes de naturaleza orgánica e inorgánica; por lo que se valoriza un residuo sólido que se caracteriza por su bajo costo y además se emplea para reducir el impacto negativo que provoca la presencia de metales pesados en los recursos hídricos y la consiguiente contaminación ambiental.1-2
La caña de azúcar (Saccharum officinarum) es materia orgánica originada en un proceso biológico, a través de la fotosíntesis. Está compuesta por celulosa, hemicelulosa y lignina como constituyentes mayoritarios, con grupos funcionales polares en su superficie como hidroxilos, carbonilos, fenoles, carboxilos, entre otros. Estos grupos poseen la habilidad de unirse a los metales al donar un par de electrones, para formar complejos con los iones metálicos en disolución.3 El bagazo, es resultado del proceso agroindustrial de manufactura de la caña y en la actualidad, sólo una fracción se utiliza productivamente en calderas para generar energía y calor.4 Esta razón justifica la realización de investigaciones, cuyo fin es diversificar los productos de la industria azucarera cubana, teniendo en la mira lo imprescindible de alcanzar un desarrollo sostenible.
El cobre es un metal rojizo que se encuentra naturalmente en rocas, aguas, sedimentos y en niveles muy bajos, en el aire. Referente a sus funciones biológicas, es esencial para los seres humanos. Se encuentra ampliamente distribuido en los tejidos biológicos, presentándose principalmente como complejos orgánicos, muchos de los cuales son proteínas y funcionan como enzimas. Este metal se requiere para un crecimiento normal del organismo, para los mecanismos de defensa, fortaleza ósea, maduración de glóbulos rojos y glóbulos blancos, transporte de hierro, desarrollo cerebral y contribuye al mantenimiento de los vasos sanguíneos, sistema nervioso, sistema inmunitario y fortalecimiento de los huesos. Pero su ingestión desmedida puede producir náuseas, vómitos, diarrea y un exceso en sangre puede dañar el hígado y los riñones, e incluso causar la muerte con solo 30 g de CuSO4 en el organismo.5
Además, posee propiedades físicas y químicas que propician su uso industrial en múltiples aplicaciones, siendo el tercer metal más consumido en el mundo, después del hierro y el aluminio. La actividad humana ha contribuido a aumentar su contenido en suelos, tanto en zonas urbanas, como en áreas agrícolas y silvestres. Las actividades mineras de extracción del mismo pueden provocar la contaminación de ríos y aguas subterráneas con cobre y otros metales, durante su explotación o una vez abandonada la mina. Se han registrado concentraciones de 2 g/kg a 3 g/kg en suelos cercanos a fundiciones y plantas de extracción de minerales.5
En este sentido, la “Laguna azul” de “El Cobre” situada en Santiago de Cuba, es un recurso hídrico que se ha formado, debido a las excavaciones mineras procedentes de la explotación a cielo abierto de las minas de cobre en esta ciudad. En la misma se han detectado elevadas concentraciones de iones sulfato (tabla 1), que puede ser justificada por la presencia de algunos minerales constituidos por este anión, así como la realización de un proceso de extracción que incluye la lixiviación con ácido sulfúrico. Esto puede influir también en la acidez identificada en estas aguas y que se verifica a través de su pH. Por último se identifica presencia de varios iones, sus concentraciones totales se presentan en la tabla 1, algunas de las cuales (Al3+ y Mn2+) son superiores a los valores normados para este tipo de agua, de ahí lo imprescindible de realizar trabajos para la remediación de las mismas.6
Tabla 1 Parámetros físico-químicos determinados en muestras de agua de la Laguna azul
| Determinaciones realizadas | Muestreo (Mayo-2017) | Muestro (Junio 2017) | Muestreo (Febrero 2018) | NC: 1021-2014 [7] |
|---|---|---|---|---|
| pH(U) | 4,37 | 4,37 | 4,37 | 6,5-8,5 |
| λ (mS.cm-1) | 18,27 | 18,27 | 18,27 | - |
| SO4 2- (mg/L) | 8200 | 8200 | 8200 | 400 |
| K+ (mg/L) | 5,58 | 5,58 | 5,58 | - |
| Na+ (mg/L) | 52,52 | 59,00 | 60,07 | 200 |
| Al3+(mg/L) | 5,428 | 5,304 | 5,112 | 0,2 |
| Zn2+(mg/L) | 3,712 | 3,786 | 3,573 | 5,0 |
| Mn2+(mg/L) | 5,428 | 5,304 | 5,401 | 0,1 |
| Cu2+ (mg/L) | 43,36 | 42,15 | 41,75 | 2,0 |
La adsorción es un fenómeno superficial, el cual consiste en la acumulación de una especie presente en fase líquida o gaseosa sobre la superficie de un sólido poroso, gracias a las interacciones entre la superficie del material y las partículas de la especie, que puede ser un ion o una molécula. El bagazo de caña natural o modificado se ha impulsado como una tecnología promisoria en procesos de remoción de especies químicas disueltas, debido a su simplicidad, analogía operativa con el intercambio iónico, eficiencia aparente y disponibilidad de biomasa y bioproductos de desechos.7-8 El bagazo utilizado en este trabajo fue caracterizado por Rodríguez y colaboradores y se precisó que la humedad real es de 7,26±0,22 %; cenizas 1,53±0,12 %; materia orgánica 98,47±0,12 y pH de 4,84±0,18. De forma general se identifican contenidos de cenizas bajos, carácter ácido de la biomasa y otros parámetros similares a lo reportado por otros autores.6 En este mismo trabajo se utiliza con éxito el bagazo natural y modificado para la remoción de iones manganeso, también presentes en las aguas de la laguna azul.
Según lo anterior, el objetivo de este trabajo es utilizar el bagazo de caña natural y modificado químicamente para la adsorción de iones Cu2+, en muestras de agua de “La Laguna Azul”, en la localidad minera de “El Cobre”, en Santiago de Cuba; por lo que se tributa a la esencial temática de remediación de recursos hídricos.
Materiales y métodos
La experimentación se realizó en los laboratorios de Química-Física y Adsorción; Química Inorgánica y Centro de Estudios de Biotecnología Industrial, de la Facultad de Ciencias Naturales y Exactas, de la Universidad de Oriente y en el Laboratorio UEB “Elio Trincado” de la Empresa Geominera Oriente.
La preparación de las disoluciones para los ensayos y la experimentación se realizó según los procedimientos normativos establecidos en el Standar Method, Normas ISO 5667-1, 5667-3, 5667-10 y NC 1021: 2014.9,10-11 Los reactivos usados son de marcas registradas: UNI-CHEM, China; MERCK, Alemania; PANREAC, España y BDH-ANALAR, Inglaterra. Las disoluciones de ensayos se preparan con agua bidestilada. Se usan Micropipetas RONGTAI, China, Balanza Analítica SARTORIUS BP 121 S, España y otros especificados en cada ensayo.
Muestras de agua
Se efectuaron tres muestreos a las aguas procedentes de la “Laguna Azul”, poblado “El Cobre”, Santiago de Cuba, en los meses de Mayo y Junio del 2017 y Febrero del 2018, en función del clima en el territorio. La toma de muestra fue superficial hasta 1 m de profundidad y su localización se realizó según.10-12 Para la colecta se usan envases plásticos de 5 L, conservándola según Standard Methods y se determinan la temperatura in situ.10,11
Biomasa
Se emplearon muestras de bagazo de caña de azúcar, procedentes del CAI América Libre en el municipio de Contramaestre, Santiago de Cuba. El mismo procede de la variedad C86-12 y es secado a 105 °C hasta peso constante y se homogeniza en un molino de cuchillas (KM-700, China). Posteriormente se lleva a un tamizador (RETSCH, Francia) para obtener la fracción 0,074mm de tamaño de partícula.6
Selección del pH para el proceso de adsorción
Los experimentos fueron realizados por triplicado en erlermeyers de 250 mL, utilizando 0,5 g/L de biomasa seca de 0,074 mm y concentración de Cu2+ de 50 mg/L, con agitación en zaranda horizontal (VEB, Alemania) a 150 rpm, durante 1 h, a temperatura ambiente. Para el ajuste del pH entre 2 y 6 unidades, se utilizó pH-metro OP-211/1, Alemania y fueron utilizadas disoluciones de HCl 0,01mol/L e NaOH 0,01 mol/L. Las disoluciones sobrenadantes, luego de finalizado el experimento de adsorción, se filtraron y conservaron a 4ºC (Refrigerador HAIER, China) hasta su posterior lectura.6
Selección de la masa de adsorbente
En los experimentos se utilizaron 0,25 g y 0,50 g de biomasa seca en 50 mL de disolución patrón a temperatura ambiente, con agitación en zaranda (VEB, Alemania) a 150 rpm, durante 6 h. Dicha experiencia se realiza aplicando los valores de pH de 3,3 unidades y granulometría del adsorbente de 0,074 mm, a un nivel de concentración de Cu2+ 50 mg/L. A las disoluciones sobrenadantes, luego del experimento, se les determinan las concentraciones de Cu2+ tal como se refiere anteriormente.
Selección del tiempo de contacto
Para conocer el tiempo adecuado de adsorción, se realizaron experimentos, teniendo en cuenta los valores obtenidos de los parámetros anteriores, pero en los siguientes tiempos 15, 30, 45, 60 y 90 min en las mismas condiciones de agitación y niveles de concentraciones de Cu2+.
Activación de la biomasa seleccionada
Fueron utilizadas disoluciones de NaOH y H3PO4 de 0,5 mol/L. El bagazo natural fue impregnado en cada una de ellas de forma aislada, por 24 h y luego son filtradas y secadas a 105oC en estufa (VENTICELL, España).6,13-14
Los parámetros físico-químicos determinados a las muestras de aguas antes y después de ser tratadas con el adsorbente (bagazo modificado), fueron comparados utilizando la norma cubana NC: 1021-2014.9 El análisis estadístico se efectúa con el Statgraphics Plus 5.1 versión para Windows.15Todos los gráficos fueron realizados utilizando Microsoft Excel, 2010.16 Para detectar diferencias significativas entre los diferentes niveles de la variable en estudio; fue realizado un análisis de varianza de clasificación simple, tomando como variable respuesta los porcientos de remoción.
Determinación Espectrofotométrica de Cu2+ en las disoluciones, antes y después del proceso de adsorción
Se basa en su reacción con una disolución de amoniaco ligeramente en exceso, formando el ion [Cu(NH3)4]2+de color azul intenso, con un máximo de absorción a λmáx= 620 nm. Se usa una disolución patrón de 1,0 g/L preparada a partir de cobre en polvo, disuelto en 20 mL de H2SO4 1 mol/L y 1 mL de HNO3 al 63 %. La curva de calibración se obtiene a partir de alícuotas de dicho patrón y exceso de amoniaco concentrado. A partir del valor de absorbancia medido y utilizando la curva de calibración, se determinan las concentraciones antes y después del proceso de adsorción. Las mediciones se efectúan en un Espectrofotómetro VIS-723 G; Inglaterra.
Preparación de las disoluciones de Cu2+ después de la adsorción y previo a la medición en el espectrofotómetro
Transcurrido el tiempo de contacto con la biomasa, las muestras se centrifugaron a 4500 rpm durante 10 min (Centrifuga MLW, Alemania). La disolución sobrenadante se filtró con Milipore (White GSWP, 0,22 ± 0,2 µm) de 20 mm de diámetro, para eliminar los sólidos que pueden interferir en el análisis. Los filtrados obtenidos se conservaron a 4 ºC (Refrigerador HAIER, China) hasta su posterior lectura.6
Resultados y discusión
Inicialmente a las muestras de agua procedentes de la Laguna Azul, se les determina la concentración de iones Cu2+, sus valores medios son 43,27; 42,15 y 41,75 mg/L para los meses de mayo, junio 2017 y febrero 2018 respectivamente. Fue realizado un análisis de varianza de clasificación simple, donde se demuestra que no existen diferencias estadísticamente significativas entre los valores estudiados. Al comparar los valores medios calculados, con el establecido según NC: 1021-2014.9 que es de 2,0 mg/L, se evidencian altas concentraciones de iones cobre en este recurso hídrico. Las causas principales pueden atribuirse a la Mina Grande del Cobre, cercana a la Laguna Azul, que fue explotada durante muchos años y todavía quedan reservas de cobre aunque menos importantes desde el punto de vista económico y a fenómenos mineralo-químicos que propician el incremento de estos iones en las aguas. Ejemplo, puede ocurrir procesos de oxidación de minerales presentes en este lugar, tales como la Calcosina (Cu2S) y/o Calcopirita (CuFeS2), que originan sales solubles y que por procesos de lixiviación natural arrastran dichos compuestos hasta la laguna. Llamamos la atención que los iones que se encuentran en mayores concentraciones en estas aguas son el SO4 2- y el Cu2+.6 Estas mayores concentraciones justifican la realización de investigaciones de este tipo, cuya finalidad es llevar a cabo procesos de remediación de este recurso hídrico.
Previo al proceso de remediación, es imprescindible ajustar los parámetros experimentales que favorecen la adsorción de iones cobre en una disolución patrón inicialmente y luego en la matriz real, es decir las aguas de la laguna azul, poblado “El Cobre”, Santiago de Cuba.
Efecto del pH en la adsorción de iones Cu2+ en una disolución patrón
Este parámetro es esencial en procesos de este tipo debido a su influencia en la solubilidad de las especies químicas presentes o en la activación de los grupos funcionales de la biomasa, al favorecer la protonación o no de grupos aminos, amidas, hidroxilos y carboxilos.17 Esta última razón hace menos o más lábil la interacción de los centros metálicos, con los sitios de unión del sólido utilizado. Se ha demostrado que éste parámetro modifica la adsorción de los metales, según tipo de biomasa y adsorbato empleado.18-19
La figura 1 muestra el comportamiento del proceso de adsorción de iones Cu2+ de una disolución con respecto al pH, cuando se utiliza el bagazo de caña como adsorbente. En la misma se puede observar el efecto explicado. A bajos valores de pH los iones H3O+ se encuentran en una concentración elevada, por lo que existe una competencia con los iones metálicos por ocupar los sitios de unión del adsorbente. Esto generalmente conlleva a una reducción de la inmovilización de los metales presentes, ya que la mayoría de los grupos funcionales responsables de la adsorción se encuentran protonados y pierden la capacidad de unirse a los centros metálicos. Sin embargo, no puede excluirse la posible participación en reacciones de formación de complejos. Al incrementarse el pH, las cargas negativas en el adsorbente aumentan y algunos grupos funcionales como los carboxilos, favorecen el establecimiento de enlaces con los iones metálicos, esto puede determinar que la remoción del metal puede estar ocurriendo a través de un mecanismo de intercambio iónico.19
El pH es responsable (como parámetro) de la especiación de iones cobre en la disolución, la cual varía dependiendo del mismo, como es demostrado en la figura, que para un pH de 3,3 los iones estudiados son más lábiles.
Los resultados estadísticos muestran que existe homogeneidad de dispersiones para un 95 % de confiabilidad, debido a que el valor de la probabilidad de la prueba de Cochran es mayor que el nivel de significación empleado (α = 0,05). Por otro lado, la descomposición de la varianza arroja un valor de probabilidad a un 95 % de confiabilidad que indica diferencias estadísticamente significativas entre los resultados obtenidos para los % de remoción en función de los niveles de pH estudiados. Mediante la prueba de Rangos Múltiples utilizando el procedimiento de las diferencias honestamente significativas (HSD) de Tukey es posible ver que el valor adecuado de pH para el proceso de adsorción de Cu2+ es de 3.30 unidades con un 95 % de confiabilidad.
Efecto de la masa de bagazo en la adsorción de iones Cu2+ en una disolución patrón
El parámetro masa de bagazo/volumen de la disolución es un aspecto experimental importante que limita el proceso, debido a la baja densidad del sólido, de ahí que sea otro aspecto a estudiar. Con una masa de 0,25 g/50 mL se obtiene 22,1 ± 1,7 % y cuando la masa es de 0,50 g/50 mL se obtiene 31,6 ± 2,2 % de remoción de Cu2+ respectivamente, como valores medio de tres réplicas. El análisis estadístico según comparación de medias, por la prueba F no arroja diferencias significativas entre las dispersiones de los conjuntos de valores, puesto que el valor de la probabilidad es mayor que el nivel de significación (α=0,05). El valor de la probabilidad de la prueba t-Student es menor que el nivel de significación (α=0,05) lo que indica que las relaciones masa/volumen son diferentes para un 95 % de confiabilidad. Como se evidencia, con el valor de 0,50 g de adsorbente en 50 mL de disolución se observan los mayores valores de remoción, siendo el valor más adecuado. Resultados similares fueron obtenidos en los estudios de adsorción de manganeso en aguas de la laguna azul.6
Efecto del tiempo de contacto en la adsorción de iones Cu2+ en una disolución patrón
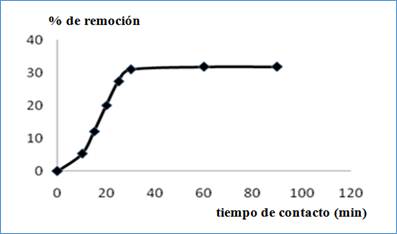
El tiempo de contacto es otro parámetro que influye en el proceso de adsorción de iones Cu2+ de una disolución, utilizando bagazo de caña. Los resultados de este estudio se presentan en la figura 2.
Se observa un aumento de la capacidad de adsorción con el transcurso del tiempo hasta 30 min, con 31,6 % de remoción de Cu2+. A partir de este valor, no se aprecian aumentos, alcanzando rápidamente el equilibrio. En estudios de adsorción de iones Mn2+ en disolución acuosa en condiciones similares, se demostró que a los 60 min se alcanza un 19,4% de remoción de este ion.6 Es evidente que el Cu2+ es más lábil porque es adsorbido en menor tiempo y se logra una mayor remoción, lo que demuestra una mayor interacción de los iones Cu2+ con los grupos funcionales localizados en la superficie del adsorbente, en este caso el bagazo de caña natural. Algunos autores reportan que a partir de los 180 s el proceso de adsorción de metales sobre sólidos adsorbentes tiende al equilibrio.20
Activación de la biomasa seca con disoluciones de NaOH y H3PO4 y proceso de adsorción de iones Cu2+ con el bagazo modificado
Las características visuales de las biomasas impregnadas con NaOH y H3PO4 son diferentes a la biomasa natural (ver figura 3); acentuándose el color amarillo y suavidad en la textura al ser tratada con el NaOH 0,5 mol/L y un color negro típico del carbón vegetal, al usar H3PO4 0,5 mol/L. Carvajal y colaboradores 21 refieren que la impregnación de adsorbentes con hidróxidos no muestran cambios visibles porque no tiene una acción deshidratante acentuada, ni tributa esencialmente a la carbonización del material. Este agente produce probablemente la fragmentación de la lignina y la hemicelulosa menos polimerizadas que la celulosa, por la presencia de hidróxidos fuertemente nucleofílicos. A diferencia de la activación con ácido fosfórico que produce la hidrólisis del material, además de otras reacciones que causan la fragmentación de la celulosa y otros componentes como la hemicelulosa y la lignina. Este ácido tiene una acción deshidratante más acentuada, contribuyendo en mayor medida a su carbonización. Aunque estos autores recomiendan después de la impregnación llevar a cabo un calentamiento entre 400 y 700 °C para completar este proceso.
Para comprobar la carbonización parcial de la biomasa debido a la acción deshidratante del ácido fosfórico, se decide caracterizar por difracción de rayos X el bagazo de caña impregnado con ácido fosfórico (ver figura 4). Se identifican al menos dos fases: una fase con estructura predominantemente amorfa, característica de sólidos porosos, debido a la presencia de un pico ancho alrededor de los 24° en 2θ. Pinedo y colaboradores 22 encontraron un pico similar en carbones activados modificados y lo asigna al plano grafítico d002 y la otra fase más cristalina por la presencia de al menos 4 picos más estrechos, debe corresponder a la presencia de materia inorgánica, muy probablemente relacionada con las cenizas presentes en este residuo.
Los resultados de los experimentos de adsorción, usando una masa de 0,50 g del absorbente modificado en 50mL de disolución patrón, fijando el resto de los parámetros precisados son los siguientes: Para el caso del bagazo tratado con NaOH, se obtiene un valor medio de tres réplicas de 39,3 ± 3,3% y para el tratado con H3PO4 se obtiene un valor medio de tres réplicas de 93,30 ±3,3% de remoción Cu2+ respectivamente. El análisis estadístico indica que existen diferencias significativas entre las medias de los porcientos de remoción para cada tratamiento con 95% de confiabilidad, siendo el p-valor menor que 0,05 asumiendo igualdad de varianza en ambas muestras.
Es evidente la mayor efectividad del bagazo modificado químicamente, siendo mucho mejor cuando se activa con ácido fosfórico. De estos resultados se infiere que este ácido provoca una modificación de la estructura del adsorbente, que se evidencia entre otros aspectos por el color negro que adquiere y el perfil de difracción (DRX) presentado, lo que puede generar mayor abertura de poros, existencia de nuevas cavidades porosas pro-tratamiento y a la generación de nuevos grupos funcionales. Carvajal y colaboradores 21 refieren que la impregnación de carbones con H3PO4 puede modificar en mayor o menor grado su estructura porosa. Además, este activante aumenta la concentración de sitios ácidos en la superficie del adsorbente. Este carácter ácido se asocia normalmente a la presencia de grupos funcionales superficiales como carboxilos, lactonas y fenoles que sin dudas reaccionaran más rápidamente con el catión cobre disuelto, dado la basicidad de este catión metálico.
Proceso adsorción de iones Cu2+ en una matriz real
A continuación se presentan los resultados experimentales obtenidos al estudiar las muestras de agua de la Laguna Azul. Cuando se usa la Biomasa natural se obtiene 18,3 % y para las biomasas tratadas con NaOH y H3PO4 se obtienen 29,4 % y 86,5 % de remoción de iones Cu2+ respectivamente, siendo inferiores a los porcentajes logrados con la disolución patrón. Sin dudas, lo anterior está relacionado con la presencia de otros iones metálicos en la matriz real, que al tener radios iónicos menores o semejantes, pueden competir según sus labilidades con Cu2+ y ocupar sitios activos del material adsorbente, dando como resultado menor capacidad de adsorción. La concentración de Cu2+ remanente es de 5,8 mg/L, superior a los límites permitidos (2,0 mg/L) según NC: 1021-2014 9 pero mucho menores que las concentraciones detectadas inicialmente. Los resultados obtenidos en este trabajo evidencian que el bagazo de caña de azúcar modificado con ácido fosfórico tiene potencialidades para la remoción del ion estudiado, por lo que podría emplearse como una alternativa de tratamiento para minimizar el impacto que ejercen el mismo sobre los reservorios acuáticos.
Consideraciones teóricas del proceso de adsorción de iones Cu2+ con bagazo tratado químicamente.
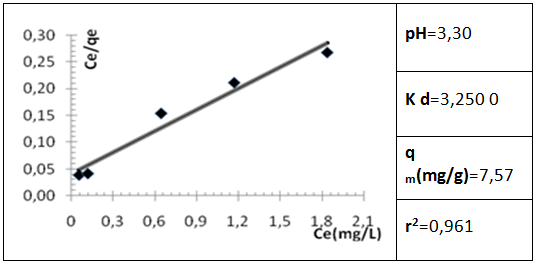
La adsorción del Cu2+ en muestras de agua de la Laguna azul puede modelarse utilizando el Modelo de Langmuir, en el cual el aumento de la capacidad de adsorción de la biomasa alcanza el equilibrio en función de la saturación de los sitios activos, con formación de una monocapa. 23-24 En la figura 5 se muestran los parámetros del modelo de Langmuir y el coeficiente de correlación para la adsorción del ion objeto de estudio.
Como se observa, la capacidad máxima de adsorción (qm) alcanza el valor de 7,57 mg/g a un pH de 3,30 unidades. El valor obtenido para el coeficiente de correlación indica el grado de ajuste de los datos experimentales al modelo matemático utilizado, lo cual permite inferir que el modelo de Langmuir explica satisfactoriamente el proceso de adsorción estudiado.
Conclusiones
Se demuestran las potencialidades del bagazo de caña natural y modificado químicamente para la adsorción de iones Cu2+, en muestras de agua. Se precisan los parámetros adecuados de dicho proceso que son: pH de 3,30 unidades, tiempo de contacto de 30 min y masa de adsorbente de 0,50 g/50 mL. Se calculan los porciento de remoción de Cu2+ en disolución patrón utilizando bagazo modificado con NaOH y H3PO4, que fueron de 39,3 y 93,30 % respectivamente. Cuando se estudia la matriz real, muestras de agua de La Laguna Azul de la localidad minera de “El Cobre”, con la biomasa natural y modificada con NaOH y H3PO4 se obtienen remociones de Cu2+ de 18,3; 29,4 y 86,5 % respectivamente. Los resultados obtenidos evidencian la posible aplicación del bagazo de caña como material adsorbente de dicho ion, por lo que podría emplearse como alternativa de tratamiento para minimizar el impacto ambiental que ejerce el mismo sobre las corrientes hídricas de esa región