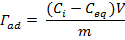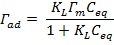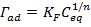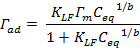Introducción
El agua es de gran importancia para el desarrollo de las diferentes formas de vida. Sin embargo, el creciente desarrollo de la industria ha provocado un aumento en la explotación de los recursos hídricos y generado residuales líquidos que son vertidos a los cuerpos de agua, provocando su contaminación. Entre los disímiles contaminantes de las aguas, los compuestos farmacéuticos han disparado las alarmas, 1 debido a que su actividad biológica trae consigo un impacto ecológico negativo, así como efectos adversos sobre la salud humana.1,2) Los fármacos se encuentran entre los llamados contaminantes emergentes (CE), término que engloba a la mayoría de los contaminantes no regulados, que pueden ser candidatos a regulación futura dependiendo de investigaciones sobre sus efectos potenciales en la salud y los datos de monitoreo con respecto a su incidencia. Este grupo de contaminantes posee por lo general una alta tasa de transformación/reducción, por lo que no son persistentes en el ambiente, sin embargo, su introducción continua es suficiente para causar efectos negativos.2
Diferentes compuestos farmacéuticos han sido detectados en aguas subterráneas e incluso en aguas potables, reconociéndose como principal vía de entrada al ambiente las aguas residuales de la industria farmacéutica y de hospitales.3) Estos residuales presentan gran variabilidad, caracterizándose por un elevado contenido de materia orgánica, que normalmente contiene tanto compuestos fácilmente biodegradables como sustancias orgánicas más resistentes, además de su posible toxicidad. Dado que los tratamientos de aguas residuales empleados tradicionalmente en plantas de tratamiento no logran remover totalmente estos contaminantes, han cobrado auge en los últimos años estudios encaminados a entender los mecanismos a través de los cuales estos compuestos se transforman, así como a identificar y evaluar la eficiencia de otras tecnologías para su eliminación.4) El objetivo final es proponer alternativas que permitan minimizar la presencia de fármacos en las aguas a un bajo costo económico, energético y ambiental.
Las zeolitas son aluminosilicatos cristalinos con estructura de enrejado tridimensional, que presentan poros y canales de dimensiones moleculares y poseen excelentes propiedades como adsorbentes, intercambiadores iónicos y catalizadores.5 Estas propiedades, unidas a su adecuada estabilidad química y térmica, su bajo costo y posibilidades de regeneración, las convierten en materiales muy atractivos para aplicaciones medioambientales.
Como las zeolitas son materiales microporosos, la adsorción de moléculas de gran tamaño, como la mayoría de los fármacos, se ve limitada a la superficie externa. En este sentido, la obtención de zeolitas jerarquizadas, que combinan micro y mesoporosidad en su estructura, es una alternativa para aumentar las capacidades de adsorción y mejorar los procesos de difusión, al tiempo que se conservan las propiedades de intercambio iónico y catálisis. El desarrollo de zeolitas jerarquizadas, ya sea obtenidas por síntesis directa o por tratamientos post-síntesis, ha cobrado gran auge en los últimos 10 años y ha ampliado considerablemente el espectro de aplicaciones de estos materiales.6,7,8)
Teniendo en cuenta estos antecedentes el presente trabajo tiene como objetivo sintetizar y caracterizar una zeolita jerarquizada para su posible empleo en la adsorción de fármacos, y la evaluación de la adsorción de ciprofloxacina como molécula modelo. Se empleará además la clinoptilolita natural del yacimiento Tasajeras, Villa Clara, a modo de comparación, ya que Cuba cuenta con abundantes reservas de esta zeolita natural. Para la síntesis de la zeolita se emplearán cenizas de cáscara de arroz como fuente de silicio, las que constituyen un desecho de la agroindustria cubana, lo que eleva el impacto medioambiental de la investigación.
Materiales y Métodos
Reactivos
El ácido clorhídrico (HCl) y el hidróxido de sodio (NaOH) en perlas, fueron de la firma Merck, con una pureza de 36 % y ≥ 98 %, respectivamente. El Aluminato de Sodio (NaAlO2), con una pureza ≥ 97 % y el cloruro de bencildimetilhexadecilamonio (CH3(CH2)15N(Cl)(CH3)2CH2C6H5) de pureza ≥ 98 %, fueron de la firma Sigma-Aldrich. El clorhidrato de ciprofloxacina (C17H18FN3O3), materia prima farmacéutica, fue suministrado por los Laboratorios SolMed.
Preparación y caracterización de los materiales zeolíticos
Purificación y acondicionamiento de la clinoptilolita natural
En el trabajo se empleó el mineral zeolítico del yacimiento Tasajeras, provincia de Villa Clara, que está constituido por alrededor de 70 % de clinoptilolita, 5 % de mordenita, 15 % de anortita y 10 % de cuarzo.9) El material fue tamizado en húmedo para seleccionar la fracción con tamaño de partícula entre 40 y 90 µm. Se empleó una batería de tamices marca VEB MLW LABORTECHNIK procedente de Alemania. La fracción seleccionada se lavó tres veces a temperatura ambiente con agua destilada, empleando una relación sólido/líquido de 1 g/50 mL y agitación magnética (agitador magnético con calentamiento J.P. SELECTA, España), por un tiempo de 2 h. Pasado este tiempo se dejó sedimentar la zeolita y se decantó el agua de lavado. Estos lavados permitieron eliminar las impurezas solubles y las fases magnéticas de hierro. Posteriormente se realizaron tres lavados empleando las mismas condiciones, pero a una temperatura de 100 °C, para eliminar las impurezas poco solubles. Finalmente se secó la zeolita a 80 °C en un horno convencional (PRESICION SCIENTIFIC, Estados Unidos).
Síntesis de la zeolita tipo A jerarquizada
Las zeolitas se sintetizan por lo general a partir de una mezcla de disoluciones de aluminatos y silicato en medio básico, a una temperatura en el intervalo de 100 - 200 °C, durante un periodo de tiempo determinado.10) En este trabajo se empleó la cáscara de arroz como fuente de silicio para la síntesis de la zeolita tipo A, que fue suministrada por el Instituto de Investigaciones de Granos. La cáscara fue lavada con agua corriente para eliminar restos de suelo. Posteriormente se lavó con HCl 1 mol/L para eliminar impurezas metálicas, empleando una relación sólido/líquido de 1 g/10 mL, con agitación mecánica (agitador mecánico de hélice FALC, AT-MD 10, Italia) por 1 h, seguido de lavados con agua destilada para eliminar el exceso de ácido. El sólido lavado se secó a 100 °C en un horno convencional (PRESICION SCIENTIFIC, Estados Unidos) y se calcinó a 700 °C durante 2 h en un horno mufla (SX2-12TP, China) para obtener las cenizas. Para la extracción del silicio se adicionaron 100 mL de NaOH 2 mol/L a 10 g de cenizas y se dejó en agitación magnética (agitador magnético con calentamiento J.P. SELECTA, España) a 60 oC durante 4 h. Luego se dejó enfriar y se separó por centrifugación (centrífuga de mesa Bioridge, TD4Y, China) la disolución sobrenadante que contiene el silicato de sodio, la cual se guardó en un frasco plástico para emplear en la síntesis de la zeolita. El sólido remanente se lavó varias veces con agua destilada para eliminar los restos de la disolución de silicato, se secó a 100 °C y se pesó para determinar por diferencia de pesada la cantidad de silicio extraído. Se logró disolver alrededor de un 96 % de la ceniza, lo que representa 9,6 g (0,16 mol) de óxido de silicio extraído.
Para la síntesis de la zeolita se empleó un método reportado previamente en la literatura por el grupo de trabajo.11) Se pesó (balanza analítica Sartorius Entris II, Alemania) la cantidad de aluminato de sodio necesaria para tener una relación molar Si/Al igual a 1. Para esto se tuvo en cuenta la cantidad de silicio presente en la disolución de silicato de sodio extraída de la ceniza. El aluminato se disolvió en 8 mL de NaOH 2 mol/L y 10 mL de agua destilada. La disolución de silicato de sodio (extraída de la ceniza) se adicionó lentamente a la disolución de aluminato de sodio bajo agitación magnética constante (agitador magnético con calentamiento J.P. SELECTA, España). Sobre el gel formado se adicionó, seguido de agitación vigorosa para homogenizar, el cloruro de bencildimetilhexadecil amonio. Este reactivo se empleó como plantilla para crear la mesoporosidad, con una concentración en el gel de síntesis de 4 veces el valor de su concentración micelar crítica (CMC = 0,52 mmol/L). El gel se dejó envejecer por 20 días a temperatura ambiente y luego se llevó a cabo la reacción en un horno convencional (PRESICION SCIENTIFIC, Estados Unidos) en condiciones estáticas a 70 oC por 6 h. Después de transcurrido el tiempo de cristalización el sólido fue separado por centrifugación (centrífuga de mesa Bioridge, TD4Y, China) y se realizaron varios lavados con agua destilada hasta que las aguas de lavado tuvieron un pH de alrededor de 7. Finalmente se secó el sólido a 100 oC en un horno convencional (PRESICION SCIENTIFIC, Estados Unidos). Parte de la muestra fue calcinada a 300 oC en un horno mufla (SX2-12TP, China) por 5 h para eliminar el surfactante empleado como plantilla.
Caracterización de las cenizas y los materiales zeolíticos
La composición química elemental de las cenizas y la clinoptilolita natural se estudió usando la técnica de espectroscopia de emisión atómica con plasma acoplado por inducción (ICP-AES). Se empleó un equipo ARL-3580 ICP-OE procedente de Estados Unidos. Para registrar los termogramas se empleó un equipo NETZSCH STA 409 PC/PG de procedencia alemana, con una velocidad de calentamiento de 10 °C/min, en el intervalo de temperatura de 25 - 1000 °C y en una atmósfera de aire seco. La sensibilidad de la termobalanza utilizada fue de ± 1 µg y las masas de muestras analizadas fueron de alrededor de 30 mg.
Los ensayos de difracción de rayos X (DRX) se realizaron empleando un difractómetro de polvo PHILIPS X´PERT-PRO de procedencia holandesa, con una intensidad de 40 mA y una potencia de 45 Kv. Los patrones de difracción de las muestras en polvo fueron registrados en modo continuo utilizando la radiación Kα del Cu (λ = 1,540 60 nm). Se barrió el intervalo de 5o ≤ 2θ ≤ 60o, con un paso de 0,02o y 2 segundos como tiempo de conteo.
Para los estudios texturales de las zeolitas se empleó un equipo MICROMERITICS ASAP 2010 procedente de Estados Unidos. Las isotermas de adsorción de N2 se realizaron a la temperatura del nitrógeno líquido (77 K). Antes de llevar a cabo las mediciones las muestras fueron tratadas en vacío a 250 °C durante 12 h para eliminar el agua adsorbida. Para la determinación del área superficial específica se empleó el método de Brunauer- Emmett-Teller (BET) 12 en el intervalo de presiones relativas P/P0 = 0,04 - 0,2. El volumen total de poros fue estimado para P/P0 = 0,99. El volumen de microporos y el área superficial externa fueron determinados empleando el método t-plot 13, mientras que para el estudio de la distribución del diámetro de poros se empleó el método mejorado de Barrett-Joyner-Halenda (BJH) 14) en la rama de desorción de la isoterma.
El estudio morfológico y el análisis químico de la zeolita sintética se realizaron por microscopia electrónica de barrido (MEB) y espectrometría de dispersión de energía de rayos X (EDS). Las muestras se fijaron al portamuestras empleando cinta de carbono y fueron observadas sin recubrimiento. Se empleó un microscopio electrónico de barrido marca TESCAN modelo VEGA3 (Alemania), equipado con una sonda electrónica OXFORD.
Estudios de adsorción de ciprofloxacina en los materiales zeolíticos
La ciprofloxacina (CIP) es un antibiótico de amplio uso a nivel mundial y constituye uno de los principales fármacos contaminantes en aguas.15) Teniendo en cuenta esto fue seleccionado como fármaco modelo para evaluar las características adsortivas de las zeolitas en estudio.
Estudio de estabilidad de ciprofloxacina en medio acuoso
Se preparó una disolución de CIP de concentración 40 ppm. Cada 1 h una alícuota de 1 mL de esta disolución se diluyó en 100 mL de agua destilada y la disolución resultante se midió por espectroscopia UV-Vis (espectrofotómetro RAYLEIGH UV-2601, China) empleando cubetas de cuarzo de 1 cm, en el intervalo de longitudes de onda entre 200 y 400 nm para obtener el espectro de absorción. Se realizaron mediciones hasta completar 8 h.
Adsorción de ciprofloxacina en los materiales zeolíticos
Para obtener las isotermas de adsorción de CIP en las zeolitas se pusieron en contacto 100 mg del sólido con 5 mL de disolución del fármaco a diferentes concentraciones (200, 600, 1000, 2000, 4000, 6000 y 8000 ppm). Las suspensiones se dejaron en contacto a temperatura ambiente en zaranda a 100 rpm por un tiempo de 1 h. Pasada la hora de contacto se filtró para separar el sólido y las disoluciones se midieron por espectroscopia UV-Vis a 275 nm para determinar la concentración del fármaco en el equilibrio. La cantidad de CIP adsorbida se determinó mediante la ecuación:
donde:
Γ ad es la cantidad de CIP adsorbida (mg/g),
C i es la concentración inicial de CIP (mg/L),
C eq es la concentración de CIP en el equilibrio (mg/L),
V es el volumen de disolución (L) y m es la masa de zeolita (g). Cada punto de la isoterma se realizó por duplicado.
Los datos experimentales de las isotermas se ajustaron empleando los modelos de Langmuir, Freundlich y el modelo combinado Langmuir-Freundlich. Se realizó un ajuste no lineal empleando el programa Origin 9,64. Las ecuaciones de los modelos y sus parámetros se presentan en la tabla 1.
Tabla 1 Modelos empleados en los ajustes de las isotermas de adsorción.
Estudio de la influencia de la masa de la zeolita sintética en la adsorción de ciprofloxacina
Para el estudio de dosis de adsorbente se preparó una disolución inicial del fármaco de concentración 7600 ppm. Se pusieron en contacto 5 mL de esta disolución con diferentes masas de la zeolita A jerarquizada (0,025, 0,05, 0,1, 0,15, 0,2, 0,3 y 0,5 g) y se dejaron en agitación en zaranda por 1 h a temperatura ambiente y 100 rpm. Una vez concluido el tiempo de contacto se separaron ambas fases por filtración. La disolución se midió por espectrofotometría UV-Vis a 75 nm para la cuantificación del fármaco. Cada experimento fue realizado por triplicado.
Resultados y discusión
Caracterización de la ceniza y los materiales zeolíticos
La composición química elemental de las cenizas, expresada en % en masa de los elementos en forma de óxidos, se presenta en la tabla 2. Los resultados obtenidos indican que el componente mayoritario de las cenizas es el silicio, con algunas impurezas de aluminio, hierro, magnesio y fósforo, fundamentalmente.
Tabla 2 Composición química elemental de las cenizas de cáscara de arroz obtenida por espectroscopia de emisión atómica y expresada en % en masa del elemento en forma de óxido
| SiO2 | Al2O3 | Fe2O3 | MgO | CaO | Na2O | K2O | TiO2 | P2O5 | PC |
|---|---|---|---|---|---|---|---|---|---|
| 92,70 | 0,11 | 0,22 | 0,17 | 0,07 | 0,10 | 0,07 | 0,03 | 0,23 | 0,06 |
En la figura 1 se muestran las curvas termogravimétricas de la cáscara de arroz y las cenizas obtenidas a partir de esta. En el caso de la cáscara de arroz se observa un pico de pérdida de masa a una temperatura de 78 oC, asociado a la pérdida del agua adsorbida, y dos picos de descomposición de la materia orgánica (celulosa, hemicelulosa y lignina) a 292 y 470 oC. En el caso de las cenizas no se observan los picos de descomposición de la materia orgánica, lo que indica que ocurrió la descomposición total durante la calcinación a 700 oC.
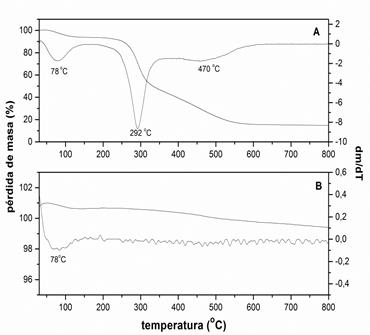
Fig. 1 Curvas termogravimétricas (TG/DTG) de la cáscara de arroz (A) y las cenizas de cáscara de arroz obtenidas por calcinación a 700 oC (B)
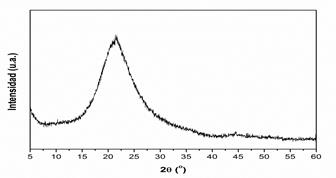
El patrón de difracción de rayos X de las cenizas se muestra en la figura 2. Puede observarse una banda ancha centrada en aproximadamente los 21,6o, lo cual es característico de un material completamente amorfo. Esto es muy conveniente para su uso como material de partida en la síntesis de zeolitas, ya que el silicio se puede extraer fácilmente en forma de silicatos empleando disoluciones básicas.
En la figura 3 se presentan los patrones de difracción de rayos X de la clinoptilolita natural purificada (NZp) y la zeolita A sintetizada, luego de la extracción de la plantilla. Las fases presentes fueron identificadas por comparación con las estructuras reportadas en la base de datos de la ICDD (International Centre for Diffraction Data). En el caso de NZp predomina la fase correspondiente a clinoptilolita, corroborada con la ficha PDF 00-047-1870. Se encuentran además como fases secundarias mordenita (PDF 00-038-0318) y cuarzo (PDF 04-007-0522). En el difractograma de la muestra sintética se puede apreciar una alta cristalinidad, indicada por la agudeza de los picos y la ausencia de fondo característico de material amorfo. El patrón de difracción de la muestra obtenida coincide con el reportado para una zeolita A (PDF: 00-039-0222), y no se observa ningún pico correspondiente a otras fases. Esto demuestra que el método empleado permite obtener zeolita A con una alta pureza, a pesar de emplear como fuente de silicio las cenizas en lugar de silicatos comerciales.
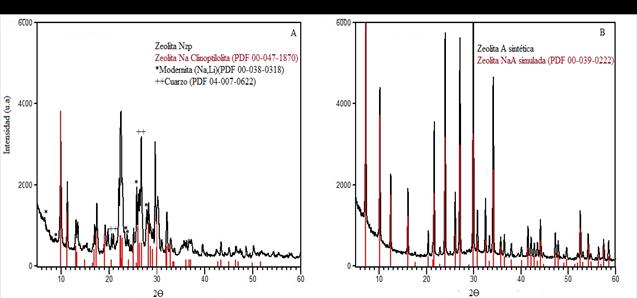
Fig. 3 Patrón de difracción de rayos X de la clinoptilolita natural purificada, NZp (A) y la zeolita A sintetizada (B). A modo de comparación se incluyen los difractogramas reportados en la base de datos de la ICDD para ambas zeolitas
En la figura 4 se presentan las curvas termogravimétricas de NZp y la zeolita A. En la curva de la zeolita natural se pueden distinguir tres regiones: 1) por debajo de 200 oC, 2) entre 200 y 400 oC y, 3) entre 400 y 1000 oC. En la primera región tiene lugar una pérdida de masa de un 8,3 %, que ocurre en dos pasos, con picos centrados en 50 y 108 oC y que corresponden a la pérdida de agua fisisorbida en la muestra. La pérdida de masa de un 2,7 % que ocurre en la segunda región se debe al agua de coordinación de los cationes intercambiables que se encuentran en los canales de la zeolita. Finalmente, la pérdida de masa (3 %) que tiene lugar en la tercera región, con un pico bien definido centrado en 675 oC se debe a la pérdida del agua estructural de la zeolita, lo que conlleva al colapso de la estructura cristalina.
El análisis termogravimétrico de la zeolita sintética sin calcinar arroja una pérdida de masa entre 50 - 120 oC debido al agua físicamente absorbida, de 150-300 oC tiene lugar la pérdida de masa relacionada con la descomposición del surfactante y entre 350 - 500 oC ocurre la pérdida del agua que se encuentra dentro de las cajas sodalíticas de la estructura. En la curva correspondiente a la muestra calcinada no se aprecia el pico de descomposición del surfactante, lo que permite comprobar que la calcinación a 300 oC fue efectiva para eliminar la plantilla.
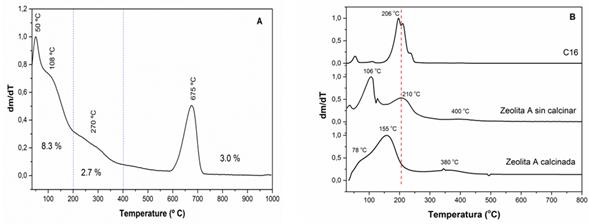
Fig. 4 Curvas termogravimétricas de la clinoptilolita natural purificada (A) y la zeolita A sintética (B), antes y después de la calcinación. Se muestra además la curva termogravimétrica del surfactante empleado como plantilla (C16)
Las isotermas de adsorción de nitrógeno a 77 K en NZp y la zeolita A se presentan en la figura 5 A. La zeolita NZp exhibe una isoterma de adsorción combinada de tipo II-V y un lazo de histéresis de tipo H3 según la clasificación de la IUPAC.16) La forma híbrida II-V que presentan muchas zeolitas naturales puede ser debida a la presencia de impurezas y materiales amorfos (arcillas, cuarzo, etc.). El lazo de histéresis H3 es característico de condensación capilar en dos láminas paralelas, y en zeolitas se atribuye a la presencia de mesoporosidad.16) En el caso de la clinoptilolita, que es una zeolita microporosa, la mesoporosidad está relacionada con el espacio interpartícula debido al empaquetamiento de los granos.17 La isoterma de adsorción de nitrógeno de la zeolita sintética es de tipo IV, la cual es característica de materiales porosos cuyos poros poseen diámetros en el intervalo de 15 a 1000 Å. Puede observarse además, el lazo de histéresis característico de materiales mesoporosos.
En la figura 5 B se presenta la distribución de tamaño de poros de ambas zeolitas según el análisis BJH. 14 Se puede observar la presencia de mesoporos (2 - 50 nm) y macroporos (˃ 50 nm). En ambos casos se aprecia una distribución ancha de tamaños de poros que se atribuye a la heterogeneidad del diámetro de mesoporos. Esto es coherente en el caso de la clinoptilolita con el hecho de que la mesoporosidad se debe al espacio interpartícula, o sea, es una mesoporosidad secundaria.17) Además, puede deberse a irregularidades superficiales y a la presencia de impurezas típicas de un mineral zeolítico. En el caso de la zeolita A la distribución ancha del tamaño de poros puede estar relacionada con la formación de micelas de diferentes tamaños y/o simetrías por problemas de dispersión de las moléculas de surfactante en el gel de síntesis que tiene una alta densidad. Mediante los ajustes de BET, t-plot y BJH se determinaron los parámetros texturales de las muestras, los cuales se presentan en la tabla 3.
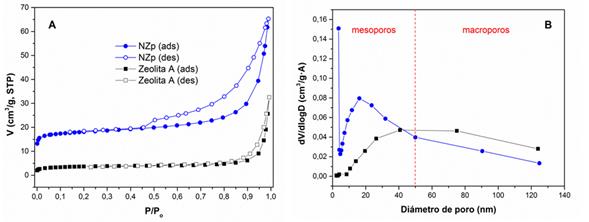
Fig. 5 Isotermas de adsorción de nitrógeno a 77 K (A) y distribución de tamaño de poros según método BJH (B) de las zeolitas clinoptilolita natural purificada (NZp) y zeolita A sintética
Tabla 3 Propiedades texturales de la zeolita A y la clinoptilolita natural purificada (NZp) derivado de los ajustes de BET, t-plot y BJH de las isotermas de adsorción de nitrógeno.
| Muestra | S (m2/g) | Vp (cm3/g) | Dp (nm) | |||
|---|---|---|---|---|---|---|
| BET | Interna (t-plot) | Externa (t-plot) | microporos | mesoporos | ||
| NZp | 62,3 | 46,5 | 15,8 | 0,021 | 0,084 | 11,53 |
| Zeolita A | 13,1 | 6,9 | 6,2 | 0,003 | 0,048 | 33,33 |
S: área superficial específica, V p : volumen de poro, D p : diámetro medio de mesoporos
Se conoce que la zeolita NaA (zeolita A con Na como catión de compensación) presenta un área superficial específica muy baja cuando se emplea N2 como adsorbato. Esto se debe a que los cationes Na+ ocupan posiciones cercanas a las aperturas de los poros, reduciendo su tamaño de 4,4 Å a menos de 3,1 Å, bloqueando así la entrada del nitrógeno a los canales y cavidades.18) Por tal motivo, comúnmente se intercambia la zeolita con cationes divalentes para reducir a la mitad el número de cationes en la entrada de los canales y favorecer la adsorción de nitrógeno en el sistema microporoso. Por ejemplo, Corona y col.18) reportan un área superficial específica de 12 m2/g para una zeolita NaA, mientras que es de 264 m2/g para una zeolita CuA y de 423 m2/g para una zeolita ZnA. La zeolita A sintetizada en el presente trabajo tiene sodio como catión de compensación (NaA), ya que es el mayoritario en el gel de síntesis, y el valor de área superficial específica obtenido está en el orden de lo reportado en la literatura, aunque ligeramente superior (13,1 m2/g). En el caso del volumen mesoporoso, la zeolita A sintetizada en este trabajo presenta un valor de casi el doble de lo reportado para zeolitas NaA (0,025 cm3/g).18) Este hecho, unido a la presencia del lazo de histéresis en la isoterma de adsorción, permite corroborar que se logró obtener una zeolita jerarquizada usando el surfactante cloruro de bencildimetilhexadecilamonio. El diámetro promedio de mesoporos de la muestra, determinado por el método BJH, fue de alrededor de 33 nm, lo cual es muy favorable para su aplicación en la adsorción de moléculas voluminosas, como es el caso de los fármacos.
Las imágenes de microscopia electrónica de barrido (SEM) realizadas a la zeolita A se presentan en la figura 6. Se aprecian partículas uniformes con morfología cúbica con aristas definidas y biseladas, características de la zeolita tipo A. El diámetro promedio de las partículas es de 0,5 µm con una relación Si/Al igual a 1 (determinada por EDS). Resultados similares fueron obtenidos en estudios previos en la síntesis y caracterización de zeolita A.11,19
Estudios de adsorción de ciprofloxacina en los materiales zeolíticos
Estudios de estabilidad de ciprofloxacina
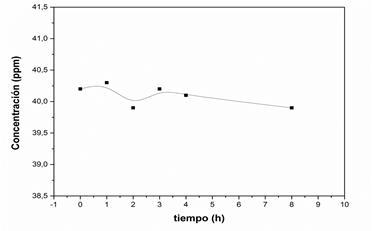
La estabilidad de la CIP en disolución acuosa se estudió para determinar el tiempo máximo a emplear en los estudios de adsorción del fármaco en los materiales zeolíticos sin que ocurra la descomposición. En la figura 7 se muestra la curva de concentración de CIP en función del tiempo. Como puede observarse, la concentración se mantuvo estable hasta las 8 h de estudio. Por otra parte no se observaron cambios en los espectros en función del tiempo, ni la aparición de alguna banda adicional indicativa de posibles productos de degradación.
Isotermas de adsorción de ciprofloxacina en los materiales zeolíticos
En la figura 8 se presentan las isotermas de adsorción del fármaco CIP en la clinoptilolita natural purificada y la zeolita A jerarquizada (que combina micro y mesoporos en la estructura). Para las dos zeolitas se obtienen isotermas tipo H2, según la clasificación de isotermas de adsorción sólido-líquido propuesta por Giles y col.20, donde H es la clase y 2 es la subclase. Las isotermas tipo H muestran una porción inicial con orientación vertical, y las cantidades adsorbidas son considerables incluso cuando la concentración de soluto tiende a valores cercanos a cero. Las especies adsorbidas son a menudo unidades grandes, por ejemplo, micelas iónicas o moléculas poliméricas, y en ocasiones pueden ser iones simples que se intercambian con otros de menor afinidad con la superficie adsorbente. Este tipo de isoterma indica quimisorción y adsorción por fuerzas electrostáticas.21) La subclase 2 indica que no hay interacción intermolecular entre el soluto, formando una meseta larga, lo que indica una saturación de la monocapa adsorbente. En este caso, los datos de equilibrio se pueden representar mediante el modelo de Langmuir y la meseta está representada por la capacidad máxima de adsorción.(21
Se puede observar, en líneas generales, que ambas zeolitas son capaces de adsorber el fármaco. Según la forma de las isotermas la adsorción ocurre muy probablemente mediante interacciones electrostáticas entre la superficie con densidad de carga negativa de las zeolitas y la especie catiónica de la molécula de CIP, la cual predomina en disolución a valores de pH por debajo de 6 unidades.22

Fig. 8 Isotermas de adsorción de ciprofloxacina en las zeolitas. Se muestran los ajustes realizados usando los modelos de Langmuir (líneas continuas) y Freundlich (líneas discontinuas)
Los resultados de los ajustes de las isotermas según los modelos de Langmuir, Freundlich y Langmuir-Freundlich se presentan en la tabla 4. Para ambas zeolitas el modelo de Langmuir se ajusta mejor a los datos experimentales, lo que coincide con la clasificación previa realizada de la subclase 2 de la isoterma tipo H. Los valores obtenidos por el ajuste de Langmuir indican que la zeolita A jerarquizada presenta una mayor capacidad de adsorción de CIP (383 mg/g), aunque la afinidad es mayor en el caso de la zeolita NZp, dado que presenta un mayor valor de la constante KL. El mejor ajuste de los datos a este modelo para ambas zeolitas puede ser un indicativo de que, aunque las superficies sean heterogéneas, la adsorción ocurre en sitios preferenciales. En el caso del ajuste de Freundlich los resultados indican que para ambas zeolitas las isotermas son favorables (valores de n superiores a 1) y que hay una mayor heterogeneidad superficial en la zeolita NZp. Esto es razonable si se tiene en cuenta que NZp es una muestra natural (mineral), donde, a pesar del proceso de purificación, hay presencia de fases acompañantes. En el ajuste por el modelo de Langmuir-Freundlich se obtiene un coeficiente b cercano a 1, lo que indica que la isoterma se aproxima a Langmuir.
Tabla 4 Parámetros de los ajustes de las isotermas de adsorción de ciprofloxacina en las zeolitas según los modelos de Langmuir y Freundlich
| Modelo | NZp | Zeolita A | |||
|---|---|---|---|---|---|
| Parámetros | R2 | Parámetros | R2 | ||
| Langmuir | Γm = 73 ± 6 mg/g KL = 0,011 ± 0,004 L/g | 0,908 7 | Γm = 383 ± 33 mg/g KL = 0,002 ± 0,0004 L/g | 0,978 8 | |
| Freundlich | KF = 9 ± 4 mg1-n L1/n/g n = 4 ± 1 | 0,820 6 | KF = 10 ± 4 mg1-n L1/n/g n = 2,2 ± 0,3 | 0,956 5 | |
| Langmuir - Freundlich | Γm = 71 ± 9 mg/g KLF = 6 x 10-3 ± 2 x 10- 3 L/g b = 0,9 ± 0,6 | 0,886 7 | Γm = 343 ± 63 mg/g KLF = 8 x 10- 4 ± 10 x 10- 4 L/g b = 0,9 ± 0,2 | 0,974 9 | |
donde:
Γm: Cantidad máxima adsorbida,
KL: Constante de Langmuir,
KF: Constante de Freundlich,
n: coeficiente de Freundlich,
KLF: Constante de Langmuir-Freundlich,
b: Coeficiente del modelo Langmuir-Freundlich.
La mayor capacidad de adsorción de CIP de la zeolita A jerarquizada puede estar relacionada con la menor relación Si/Al que presenta, lo que favorece las interacciones electrostáticas. Además, la presencia de mesopororos de diámetro medio de 33 nm (330 Å) en esta zeolita, permite que la molécula de CIP, con dimensiones de 13,5 × 3 × 7,4 Å, 23) pueda difundir con facilidad a través de la estructura mesoporosa, por lo que la adsorción no se ve limitada sólo a la superficie externa, como ocurre en el caso de la clinoptilolita.
La adsorción de CIP en diferentes materiales adsorbentes, incluidas varias zeolitas naturales y sintéticas, ha sido ampliamente estudiada. En la tabla 5 se presenta la capacidad máxima de adsorción reportada en la literatura para algunos de estos materiales.
Tabla 5 Capacidad de adsorción de ciprofloxacina de diferentes adsorbentes según reportes de la literatura
| Adsorbente |
|
Referencia |
|---|---|---|
| Zeolita 13X | 12,8 | (24 |
| Zeolita Y | 26,1 | 24 |
| Mordenita | 3,9 | 24 |
| Clinoptilolita | 5,5 | 22 |
| Birnesita | 57 | 25 |
| Carbón activado | 77 | 26 |
| Carbón de dátiles | 133,3 | 27 |
| Grafeno funcionalizado | 172,6 | 28 |
| Cáscara de avena pre-tratada | 83 | 29 |
| Carbón vegetal modificado con KOH | 23,36 | 23 |
| Nanopartículas de Fe3O4 | 24 | 30 |
| Óxido de grafeno/alginato de calcio | 39,06 | 31 |
| Hidrogel de grafeno | 348 | 30 |
| Nanocomposito Fe3O4/óxido de grafeno | 283,4 | 32 |
Γ m : Cantidad máxima adsorbida de ciprofloxacina.
Puede observarse que los valores de capacidad de adsorción de ciprofloxacina de todas las zeolitas reportadas en la tabla se encuentran por debajo de los obtenidos en el presente trabajo, tanto para la zeolita A jerarquizada como para la zeolita natural. Es de destacar también que la capacidad de adsorción de la zeolita A jerarquizada supera a la de todos los materiales reportados en esta tabla. Es evidente que esta zeolita constituye un adsorbente muy promisorio para la remoción de ciprofloxacina.
Estudios del efecto de la dosis de adsorbente
Para la zeolita A jerarquizada no fue posible alcanzar la meseta en la isoterma de adsorción (figura 8) debido a las limitaciones de solubilidad del fármaco, que no permitió seguir aumentando la concentración inicial. Por tal motivo, se evaluó el efecto de la dosis de adsorbente en la cantidad de CIP adsorbida. Los estudios se realizaron a temperatura ambiente, un pH = 4, durante un tiempo de contacto de 1 h y concentración inicial de CIP de 7600 ppm. En la figura 9 se presentan los gráficos de cantidad de CIP adsorbida en función de la masa de zeolita A jerarquizada, expresada en porcentaje de remoción y en miligramos por gramo de zeolita.
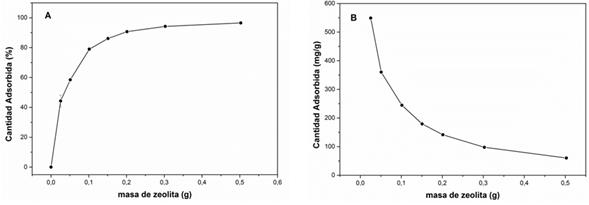
Fig. 9 Cantidad de ciprofloxacina adsorbida en función de la masa de zeolita A jerarquizada, expresada en porcentaje de remoción (A) y en miligramos por gramos del material (B)
Como puede observarse en la figura 9 para una masa de zeolita superior a 200 mg, se logra adsorber más del 90 % de la CIP en disolución, mientras que para una masa de 500 mg se adsorbe el 97 % de la CIP, lo que representa un resultado muy prometedor para futuras aplicaciones del material en la remoción de este fármaco en aguas de desecho de la industria farmacéutica, así como de otros fármacos con características estructurales similares. Es de destacar que se logra alcanzar una adsorción de 549 mg/g para una masa de zeolita de 25 mg, muy superior a la capacidad máxima de 383 mg/g obtenida por el ajuste de la isoterma de adsorción según el modelo de Langmuir. Esto es debido, como ya se ha mencionado, a que no se logró alcanzar la saturación debido a limitaciones de solubilidad de la CIP.
Conclusiones
En este trabajo se desarrolló una zeolita A jerarquizada con una alta capacidad de adsorción de ciprofloxacina, para su posible empleo en la adsorción de fármacos presentes en las aguas residuales de la industria farmacéutica. El método de síntesis empleado permitió obtener un material con alta pureza y cristalinidad, usando como fuente de silicio para la síntesis cenizas de cáscara de arroz. La zeolita sintetizada posee un diámetro medio de partículas de 500 nm, una relación Si/Al de 1, un área superficial específica de 13 m2/g y un diámetro medio de poros de 33 nm. Los resultados de los estudios de adsorción de ciprofloxacina demostraron que la quimisorción y/o fuertes interacciones electrostáticas son el mecanismo fundamental por el cual se adsorbe la molécula. La zeolita A jerarquizada presenta una alta capacidad de adsorción (383 mg/g), lo que se debe fundamentalmente a su relación Si/Al y a la presencia de mesoporos. La clinoptilolita, aunque presenta una menor capacidad (73 mg/g) con relación a la zeolita A, muestra valores comparables, y en algunos casos superiores, a otros materiales reportados en la literatura. Los resultados obtenidos evidencian las potencialidades del material desarrollado en la remoción de fármacos de aguas residuales provenientes de la industria farmacéutica.