Introducción
La enfermedad de Alzheimer (EA) es la forma de demencia más prevalente en todo el mundo, a la que le corresponde entre el 60 y 80 % de todas ellas. Se ha estimado que cerca de 24 millones de personas en el mundo la padecen y se predice que este número se duplique cada 20 años. El diagnóstico precoz de la EA permitiría incrementar la eficacia de las terapias potenciales desde las primeras etapas de su progresión y disminuir hasta cinco años la aparición de los síntomas más críticos de la enfermedad.1
La técnica de Imágenes por Resonancia Magnética (IRM) ha venido ganando terreno en el diagnóstico de EA. La obtención de imágenes nítidas con el empleo de agentes de contraste incrementa la capacidad de diagnóstico por IRM. Dichos agentes están constituidos por iones paramagnéticos capaces de modificar los tiempos de relajación T1 y T2 de los protones del agua, aumentando de este modo el contraste entre los tejidos sanos y patológicos. Su utilización está autorizada desde 1988, para lo cual se utilizan distintos compuestos que se clasifican según su composición, propiedades magnéticas y efecto sobre la relajación longitudinal (T1) y transversal (T2).2-5
En la actualidad, los compuestos de Gd(III) son los más utilizados como medio de contraste para IRM, debido a su alto paramagnetismo, sus propiedades favorables en términos de relajación cuántica, su eficiente biodistribución, eliminación y su estabilidad e inercia, relativamente altas tanto termodinámicamente como cinéticamente.6 Este elemento paramagnético posee 7 electrones desapareados en el orbital 4f, que afectan eficientemente el tiempo de relajación de los protones del agua. Los iones de Gd(III) son tóxicos porque pueden reemplazar fácilmente a los iones calcio(II) en el organismo, al poseer ambos similares radios iónicos. Estos iones, a pH fisiológico, precipitan en forma de cristales de hidróxido de Gd(III) 7, que pueden acumularse en el hígado, el bazo y los huesos, resultando muy dañinos para la salud. Para evitar esto, se coordinan con ligandos orgánicos que tienen como función clave, impedir la liberación de los iones Gd3+ al organismo. Los complejos de Gd(III) más empleados en medicina son: Magnevist® (Gd(DTPA)), Dotarem® (Gd(DOTA)), Prohance® (Gd(HP-DO3A)) y Omniscan® (Gd(DTPA-BMA)).8-9
En el Centro de Neurociencias de Cuba se han sintetizado diferentes derivados mono-sustituidos del naftaleno (Amylovis) que, resultan afines a las placas β-amiloides. Estos compuestos tienen como característica la presencia de grupos aminos y carboxilos libres; por lo que pueden ser funcionalizados mediante la formación de un enlace amida; con nanopartículas magnéticas recubiertas con polímeros que posean estos mismos grupos funcionales libres. Además, estos derivados Amylovis son hidrofóbicos, lo que les permite atravesar la barrera hematoencefálica (BHE) y así, ser capaces de adherirse a las bioestructuras patológicas características de la EA.10
Una de las estrategias actuales en la detección precoz de Alzheimer es la síntesis de complejos y/o materiales nanoparticulados con propiedades magnéticas y capacidad de atravesar la barrera hematoencefálica. Los ligandos empleados deben poseer afinidad in vitro por las placas β-amiloides.11,12,13 Todo ello conlleva a la necesidad de sintetizar agentes de contraste para MRI que permitan, desde etapas tempranas, la detección in vivo de las placas seniles presentes en la EA.
El objetivo del presente trabajo es sintetizar y caracterizar partículas de Gd2O3 recubiertas con PEGdiCOOH y conjugadas a la N 1-(2-aminoetil)-N 4-(1-naftil) succinimida. Este compuesto pertenece a la familia Amylovis®, cuya afinidad por las placas β-amiloides características de la EA ha sido demostrado mediante evaluaciones in silico, in vitro e in vivo.10,14,15,16) Las nanopartículas obtenidas podrían constituir una plataforma de trabajo como agentes de contrastes novedosos y selectivos para el diagnóstico precoz de la enfermedad de Alzheimer por Imágenes de Resonancia Magnética.
Materiales y métodos
Reactivos y disolventes
Los siguientes reactivos provienen de la firma Sigma-Aldrich: GdCl3 (99%), NaOH (99%), el polietilenglicol (PEG, 400 Da) y el polietilenglicol-dicarboxílico (PEGdiCOOH, 600 Da). La N1-etil-N3-(3-dimetilaminopropil)carbodiimida (EDC), N-hidroxisuccinimida (NHS), y N-hidroxibenzotriazol (HOBT) fueron suministradas por la Merck, al igual que los disolventes DMSO y DMF. La dimetilformamida (DMF) se purificó y se secó mediante destilación en presencia de benceno (mezcla v/v, 10:1) y se guardó sobre tamices moleculares activados de 4 Å. La N1-(2-aminoetil)-N4-(1-naftil)succinimida (Amylovis®-1) fue suministrada por el Departamento de Neuroquímica del Centro de Neurociencias de Cuba.
Síntesis de partículas de óxido de gadolinio(III) recubiertas con polietilenglicol dicarboxilado (Gd2O3- PEGdiCOOH)
En un balón de 50 mL, equipado con un condensador de reflujo, se disolvieron 3,45 g (5 mmol) de GdCl3.6H2O en 25 mL de PEG (400 Da) a 100 °C con agitación magnética. A esta disolución se le añadió 0,6 g (15 mmol) de NaOH disuelto en 10 mL de PEG (400 Da). La mezcla de reacción se calentó y agitó a 180°C durante 4 h, en una plancha de agitación magnética (Heidolph MR30001, Alemania). A continuación, se disminuyó la temperatura hasta 80 °C para adicionar 4 mL (8 mmol) de PEGdiCOOH (600 Da). Se calentó nuevamente la mezcla de reacción a 180 °C por 4 h, con agitación constante. Una vez transcurrido este tiempo, se enfrió a temperatura ambiente para llevar a cabo la purificación del crudo de la reacción. Para ello, se desarrollaron dos variantes:
A) Purificación por centrifugación: La mezcla de reacción se dispersó en una mezcla de etanol:acetato de etilo (1:2, v/v) y se centrifugó a 2000 rpm durante 30 min, en una centrífuga Eppendorf 5810 R (Alemania). Las partículas sedimentadas se lavan con mezcla de etanol:acetato de etilo (1:2, v/v) y se repite el proceso dos veces. El sólido sedimentado se secó al vacío en una pistola con pentóxido de difósforo (P2O5). Las partículas de Gd2O3-PEGdiCOOH se dispersaron en DMSO para registrar el perfil de DLS. Se almacenaron a temperatura ambiente. DLS: mayor de 2 μm.
B) Purificación por precipitación en agua: La mezcla de reacción se dispersó en 500 mL de H2O destilada. Se agitó la suspensión coloidal durante 10 min y luego, se dejó reposar hasta la sedimentación de las partículas (alrededor de una semana). El líquido sobrenadante se decantó y el sólido se lavó con agua y se secó al vacío en una desecadora sobre P2O5. Gd2O3-PEGdiCOOH: Rendimiento: 893 mg. FT-IR {número de onda (cm-1); asignación}: 3369, (OH; 1731, (C=O correspondiente al grupo -COOH libre; 1585, (as COO; 1434, (s COO; 1351, δOH; 1110, (COC del PEG y 586, (GdO.
Conjugación de las partículas de Gd2O3-PEGdiCOOH con Amylovis®-1
En un balón de 25 mL, se dispersaron 5 mg de Gd2O3-PEGdiCOOH en 4 mL de DMF. A esta dispersión se adicionó una disolución de 40 mg (0,26 mmol) de N-(3-dimetilaminopropil)-N′-etilcarbodiimida (EDC) en 4 mL de DMF. Luego, la mezcla de reacción se enfrió en un baño con hielo durante 30 min y se adicionó 20 mg (0,13 mmol) de hidroxibenzotriazol (HOBT). Se mantuvo la agitación durante 30 min más y se adicionaron 40 mg de Amylovis®-1 (0,14 mmol). La mezcla de reacción se agitó a temperatura ambiente durante 4 días y se monitoreó su avance por CCD. Al cabo de este tiempo, se centrifugó a 10 000 rpm por 30 min para eliminar el líquido sobrenadante. El sólido sedimentado se lavó con etanol (10 mL x 3) y se centrifugó nuevamente bajo condiciones similares a las descritas. El sólido se secó al vacío en una desecadora sobre P2O5. Gd2O3-PEGdiCOOH-Amylovis®-1: Rendimiento: 2,7 mg. FT-IR {número de onda (cm-1); asignación}: 3282, (NH; 1635, (c=o; 1581, (as COO; 1527, (NH; 1431, (s COO; 1095 (COC del PEG y 594, (GdO.
Caracterización y equipos empleados
Cromatografía en Capa Delgada (CCD)
El avance de las reacciones se verificó mediante Cromatografía en Capa Delgada (CCD). Se utilizaron placas pre-elaboradas de gel de sílice Merck GF-254; de 0,25 mm de grosor, con indicador de fluorescencia. Como fase móvil se empleó una mezcla de cloroformo-metanol (3:1, v/v). El revelado de las placas cromatográficas se realizó con luz ultravioleta generada por una lámpara UV- Vis a una longitud de onda de 254 nm. Las muestras aplicadas a las placas, fueron previamente diluidas en acetato de etilo.
Espectroscopia FT-IR
Los espectros infrarrojos se registraron en un espectrómetro WQF-510 de la firma Ray-leigh, en el intervalo de 400-4000 cm-1. Se realizaron de 32 barridos por cada muestra preparada en pastillas de bromuro de potasio a temperatura ambiente.
Espectrometria de dispersión dinámica de la luz (DLS)
Se determinó el radio hidrodinámico de las partículas sintetizadas, mediante el registro de los perfiles de DLS en un espectrómetro DelsaNano C de la firma Beckman Coulter. Las mediciones se realizaron en muestras dispersadas en agua y DMSO, a 25oC.
Análisis Térmico
Los termogramas simultáneos de Análisis Térmico Diferencial (DTA) y Termogravimetría (TG), se obtuvieron en un equipo de la marca NETZSCH, modelo STA 449 F3. Los barridos se realizaron en un intervalo de temperatura de 24-10000C bajo atmosfera de aire, con una velocidad de calentamiento de 10.0 K/min.
Microscopía electrónica de barrido (SEM, del inglés Scanning Electron Microscopy)
La preparación de la muestra se realizó adhiriendo partículas de sólido sobre una cinta adhesiva de carbón conductor y fue visualizada directamente sin necesidad de ser recubiertas con oro. Las imágenes de SEM fueron registradas en un microscopio electrónico de barrido con filamento de emisión de campo (FE-SEM), marca FEI modelo NOVA NANOSEM 230.
Espectrometría de plasma acoplado inductivamente (ICP, del inglés Inductively Coupled Plasma spectrometry)
El contenido de Gd de una disolución de la muestra, previamente digerida en HCl (37 %), se midió por duplicado en un equipo ICP-OES, marca Spectro, modelo Spectroflame. La potencia empleada por el equipo fue de 1200 W. Se utilizó un flujo de nebulización de 1,2 L/min de Argón y una presión de nebulización de 3,8 bar. El flujo auxiliar y el de enfriamiento fueron de 1,2 L/min (Ar) y de 18,8 L/min (Ar), respectivamente. La altura de observación fue de 15 mm con respecto a la bobina. Se empleó como patrón Gd2O3 de 99,9 % de pureza, el cual fue disuelto en HCl (37 %) para preparar la curva de calibración en un rango de 0,01 a 10 ppm.
Determinación de relaxitividad
Los tiempos de relajación, longitudinal (T1) y transversal (T2), fueron medidos en un equipo SIEMENS Magnetom Allegra 3T. Se prepararon seis disoluciones con concentraciones de 0,09 mg/mL, 0,075 mg/mL, 0,06 mg/mL, 0,048 8 mg/mL, 0,024 4 mg/mL y 0,012 4 mg/mL en DMSO. Los TR empleados variaron de 37 ms a 10000 ms, los TE entre 8,7 ms y 940 ms, y los TI entre 25 ms y 2000 ms. Todas las funciones incluidas en la herramienta desarrollada fueron programadas en MATLAB 2014a. Los valores de relaxitividad, r1 y r2, se estimaron a partir de los gráficos de velocidad de relajación (R1; R2) versus concentración. Los valores de las pendientes de estos gráficos, ajustados por el método lineal de mínimos cuadrados, son r1 y r2.
Para el cálculo de T1 y T2 las condiciones fueron las siguientes: T1. Secuencia: se2d1. FOV: 150 x 100 mm. Espesor de corte: 6 mm. Cantidad de planos: 1. Matriz de adquisición: 192 x 128. TR: . TE: 11 ms. Tiempo total del experimento: 1h 30 min.
T2. Secuencia: se2d1. FOV: 130 x 89 mm. Espesor de corte: 6 mm. Cantidad de planos: 1. Matriz de adquisición: 128 x 88. TR: 10000 ms. TE: . Tiempo total del experimento: 1h 43 min.
Resultados y discusión
Las nanopartículas de Gd2O3 se sintetizaron mediante el método del poliol 17, en el cual se utilizó el polietilenglicol (PEG) que permite emplear elevadas temperaturas (180oC), y evita la agregación de las nanopartículas al actuar como agente estabilizante y surfactante. La obtención de las nanopartículas conjugadas al Amylovis®-1 se llevó a cabo en tres etapas como se representa en la figura 1. En la primera de ellas, ocurre la síntesis de las partículas de Gd2O3 recubiertas con el PEG (figura 1a), luego se produce un intercambio de ligandos, del PEG por el PEGdiCOOH (600 Da) (figura 1b) y, por último, la funcionalización del Gd2O3@PEGdiCOOH con el derivado de Amylovis®-1 (figura 1c).
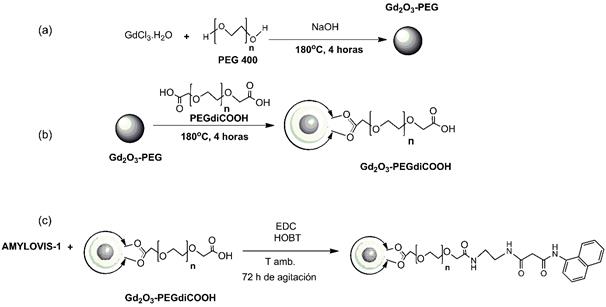
Fig. 1 Diferentes etapas de la síntesis de las nanopartículas de Gd2O3 recubiertas con PEGdiCOOH y conjugadas a Amylovis®-1
La conjugación de las partículas de Gd2O3-PEGdiCOOH con Amylovis®-1 se llevó a cabo siguiendo el protocolo conocido como reacción de Steglich. Para ello, se seleccionó como agente acoplador la N1-etil-N3-(di-metilaminopropil)carbodiimida (EDC), en presencia del N-hidroxibenzotriazol (HOBT). Así, se forma in situ un éster activado con el PEGdiCOOH que recubre las partículas de Gd2O3 y además, se evita que se produzcan reacciones colaterales, que traerían consigo una disminución del rendimiento. El éster formado se conjuga con el grupo amino libre del Amylovis®-1 a través de un enlace tipo amida.
Caracterización mediante espectroscopia IR
En la figura 2 se muestran los espectros FT-IR de los reactivos de partida, de las partículas de Gd2O3@PEGdiCOOH y Gd2O3@PEGdiCOOH- Amylovis®-1.
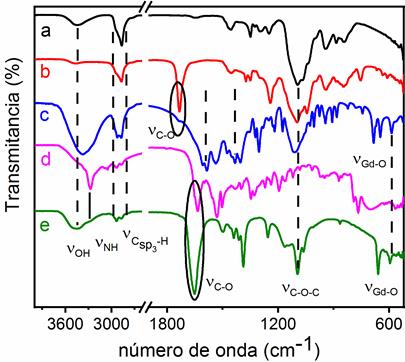
Fig. 2 Espectros FT-IR: PEG (línea negra, a), PEGdiCOOH (línea roja, b), Gd2O3@PEGdiCOOH (línea azul, c) Amylovis®-1 (línea magenta, d), Gd2O3@PEGdiCOOH- Amylovis®-1 (línea verde, e)
La funcionalización de la superficie de las partículas con grupos carboxílicos se llevó a cabo mediante una reacción de intercambio, empleando para ello el PEGdiCOOH de 600 Da. La presencia del PEGdiCOOH sobre la superficie del Gd2O3 se corroboró al observar por FT-IR una banda de baja intensidad a 1735 cm-1 (figura 2c), correspondiente a la vibración de valencia (C=O del grupo -COOH libre del extremo del PEGdiCOOH, que no está enlazado a la superficie del Gd2O3. Este grupo carboxilo libre justifica el incremento observado en la solubilidad de las partículas en agua y permite la conjugación posterior a Amylovis®-1.
Las señales en 1585cm-1 y 1432 cm-1 se asignaron a las vibraciones de valencia antisimétrica (νas COO ) y simétrica (νs COO) del grupo carboxilato del PEGdiCOOH unido directamente a la superficie del Gd2O3. El valor de ⧍ ((as COO - (s COO) permitió diferenciar el tipo de enlace que se establece entre los grupos carboxilato y la superficie del núcleo metálico. En este caso, las bandas se encuentran separadas en 153 cm-1, valor que indica que el COO- se enlaza al Gd2O3 en forma de puente.18,19 También, se observaron bandas en los 3370 ((OH), 2925 y 2872 ((CH2), 1350 (δOH) y 1111 cm-1 ((COC), características del PEGdiCOOH unido a las superficie del Gd2O3. La banda en 586 cm-1 se asignó a la vibración de valencia del enlace metal oxígeno,((GdO), lo cual se corresponde con lo reportado en la literatura.20
En el espectro FT-IR de las nanopartículas conjugadas a Amylovis®-1 (figura 2e), se observa la presencia de dos bandas, en 1651 cm-1 y 1439 cm-1, que se corresponden a las vibraciones de valencia antisimétrica (νas COO) y simétrica ((s COO) del carboxilato del PEGdiCOOH enlazado al Gd2O3. También, se observan diferentes bandas a los 1440 (δCH2), 1411 ((C-N), 1390 (δOH), 1255 ((s COC), y 1100 ((as COC) cm-1. La desaparición de la señal en 1731 cm-1, asignada a la vibración de valencia ((C=O), corroboró la conjugación del grupo carboxilo libre del PEGdiCOOH con el grupo amino del Amylovis®-1. El hombro en 3285 cm-1 se asignó a la vibración de valencia (NH de la amida. De esta forma se verificó que la conjugación ocurrió entre el PEGdiCOOH y el ligando orgánico derivado del naftaleno.
Análisis termogramigravimétrico de G2O3-PEGdiCOOH y determinación del contenido de Gd por ICP en las partículas G2O3-PEGdiCOOH-Amylovis®-1
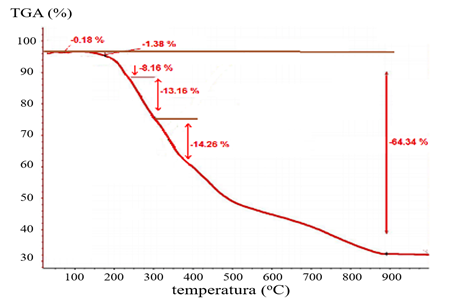
Las G2O3-PEGdiCOOHNPs se caracterizaron mediante TGA (figura 3). En el termograma se observó una pequeña pérdida de masa (0,18%) sobre los 105(C que se asocia al agua de hidratación del compuesto. Desde los 219(C a los 900(C ocurrió una pérdida significativa de masa, de un 64,3 %, que se debió a la descomposición del recubrimiento orgánico de las partículas.
Tanto los resultados obtenidos por FT-IR como los de TGA, corroboraron la presencia del PEGdiCOOH en la superficie de las Gd2O3NPs, lo que permite su posterior conjugación al derivado de Amylovis®-1.
Una vez llevada a cabo la conjugación del derivado de Amylovis®-1 a las partículas de Gd2O3-PEGdiCOOH, se determinó el porcentaje en masa de gadolinio mediante la técnica ICP. Así, el valor medio obtenido interpolando en la curva de calibración del patrón, fue de un 30,29 % de gadolinio.
Caracterización mediante SEM y DLS
La morfología de las partículas y su distribución Gd2O3-PEGdiCOOH-Amylovis®-1 se analizó mediante la microscopia electrónica de barrido (SEM) (figura 4a y 4b). En esta micrografía se muestra que las nanopartículas sintetizadas tienen forma quasiesférica, con un diámetro promedio de 18,4 ± 2,9 nm. También se observan regiones con una alta polidispersidad o aglomeración, que pudiera atribuirse al método de síntesis empleado. La presencia del ión metálico en las partículas esféricas se corroboró mediante microanálisis por dispersión de rayos X (EDX), con la presencia de la señal de la línea L del Gd (figura 4c). Además, se detectaron los elementos sodio y cloro que sugieren que el proceso de purificación no fue eficiente. Por tanto, sería recomendable dializar como una alternativa para eliminar dichas impurezas en trabajos futuros.
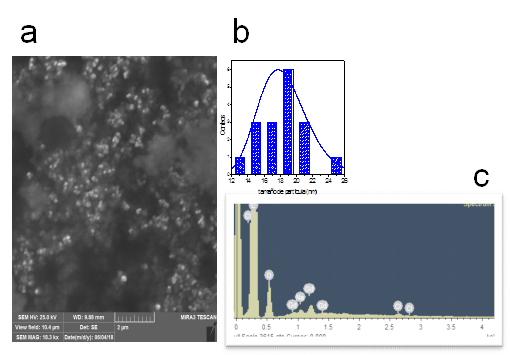
Fig. 4 Caracterización morfológica de las nanopartículas por SEM G2O3-PEGdiCOOH- Amylovis®-1, imagen SEM (a), distribución de tamaños (b) y EDX (c)
El objetivo final de la síntesis de nanopartículas es poder emplearlas como agentes de contraste en la detección precoz de Alzheimer, para lo cual el tamaño es un parámetro esencial que define el cruce a través de la barrera hematoencefálica. En este trabajo, los diámetros hidrodinámicos de las partículas sintetizadas se midieron a través de los perfiles obtenidos por Espectrometría de Dispersión Dinámica de la Luz (DLS). En la tabla 1, se resumen los valores encontrados, así como el índice de polidispersidad para cada una de las mediciones.
Tabla 1 Perfiles de DLS de las partículas sintetizadas
| NPs | (H (μm) | IP |
| Gd2O3-PEGdiCOOH | 1,05 ± 0,85 | 0,4 |
| Gd2O3-PEGdiCOOH- Amylovis®-1 | 2,79 ± 0,64 | 0,3 |
Como se observa en la tabla 1, al conjugar Amylovis®-1 a las partículas Gd2O3-PEGdiCOOH se observa un incremento del diámetro hidrodinámico. Estos valores se encuentran por encima de los valores que permitirían el traspaso pasivo de la membrana hematoencefálica. Lo anterior conlleva al diseño de nuevas metodologías de síntesis que permitan obtener nanopartículas con diámetros hidrodinámicos por debajo de los 200 nm.
Estudio de relaxitividad
La relaxitividad es una propiedad de los agentes de contraste para MRI que refleja cómo cambia la velocidad de relajación de una disolución en función de su concentración. Los tiempos de relajación longitudinal (T1) y transversal (T2) se midieron en varias disoluciones con diferentes concentraciones de iones Gd(III). De las pendientes de las gráficas de 1/T1 y 1/T2 versus la concentración de iones Gd(III) se calcularon los valores de las relatividades (r1, r2) y la razón entre ellas (r2/r1). En la figura 5 se muestra la gráfica de las variaciones con respecto a T1.

Fig. 5 Representación gráfica de las variaciones de T1 de las partículas de Gd2O3-PEGdiCOOH- Amylovis®-1
Las partículas sintetizadas en este trabajo presentaron un valor de r1 igual a 7,7 mM-1s-1. Dicho valor se asemeja al valor de los iones de Gd3+ libres en H2O (7,9 mM-1s-1). Por tanto, esto indica que el recubrimiento orgánico de las partículas sintetizadas no impide que el Gd(III) interactúe con las moléculas de agua del entorno, y que se propague su efecto paramagnético, por lo que su capacidad de relajación longitudinal se puede considerar buena.
En la siguiente tabla 2, se muestran los valores de r1, r2 y r2/r1 para algunos compuestos de gadolinio y se comparan con los obtenidos en este trabajo.
Tabla 2 Valores de r1, r2 y r2/r1 para algunos compuestos de Gd y G2O3-PEGdiCOOH- Amylovis®-1.18
| .Agente de contraste | r1 (mM-1s-1) | r2 (mM-1s-1) | r1/ r2 |
| GdCl3 | 7,9 | 9 | 1,14 |
| Magnevist (Gd-DTPA) | 3,5 | 4,1 | 1,17 |
| Gd2O3-PEGdiCOOH- Amylovis®-1 | 7,9 | 18,5 | 2,4 |
Si se compara los valores de r1, r2 y r2/r1 de las partículas de Gd2O3-PEGdiCOOH- Amylovis®-1 con los del Magnevist (agente de contraste comercial de uso clínico), se observa que presentan un mayor valor de r1. No obstante, la relación r2/r1 del producto sintetizado en este trabajo resultó de 2,4, mayor que la del Magnevist.
En la tabla 3 se muestran valores morfométricos y magnéticos de una serie de compuestos análogos al sintetizado en este trabajo. Aquí se observa que en general valores de r2/r1 superior a 1 indican que los sistemas nanoestructurados pueden usarse como agentes de contraste para RMI. Por tanto, las partículas de Gd2O3-PEG-Amylovis®-1 podría ser potencial candidato como agente de contraste, aunque el procedimiento de síntesis debe ser mejorado con vistas a disminuir el diámetro hidrodinámico.
Tabla 3 Valores de relaxitividad para compuestos análogos al Gd2O3-PEGdiCOOH-Amylovis®-1.21-22
| Compuesto | Diámetro (nm) | Relaxitividad (mM-1s-1) | r2/r1 | |
| r1 | r2 | |||
| Gd-PEG250 | 1,3 | 5(1 | 55(2 | 11 |
| Gd-PEG600 | 1,3 | 0,1(1 | 10(1 | 100 |
| Gd2O3-DEG | 2-5 | 3,6-5,3 | 9,6-17,2 | 2,6-3,24 |
| Gd2O3-DEG | 4-5 | 6,9 | 7,9 | 1,14 |
| Gd2O3-PEG | 1,3 | 10,4-16,2 | 17,2-17,7 | 1,6-1,09 |
| BSA-PEGD-GdNP | 2,0 | 6,0 | 28 | 4,6 |
| C-BSA-PEGD-GdNP | 2,0 | 7,6 | 22 | 2,89 |
| GdNP-BSA | 20-40 | 6,7 | 38,5 | 5,74 |
Como se observa en la tabla se han reportado valores mayores que 1 para la relación r2/r1 en compuestos análogos a las partículas de Gd2O3-PEGdiCOOH-Amylovis®-1. Al realizar el análisis del perfil DLS se observó un valor del mismo en el orden de las micras, además de que en el SEM se podían observar zonas donde las NPs se encontraban agregadas. Se ha descrito que el elevado diámetro hidrodinámico de las partículas, o un efecto de su agregación en el tiempo, generan un mayor valor de r2, por lo que la relación r2/r1 tiende a ser mayor que 1. Con este análisis se concluye que el valor de r2/r1 para Gd2O3-PEGdiCOOH-Amylovis®-1 se encuentra en el intervalo aceptable para este tipo de agente de contraste. A partir de los resultados del estudio de relaxitividad, las nanopartículas obtenidas pudieran ser consideradas con potenciales aplicaciones como agentes de agentes de contraste positivo. El trabajo futuro deberá encaminarse a desarrollar una estrategia de síntesis donde se logre que el diámetro hidrodinámico sea menor de 200 nm.
Conclusiones
Se logró por primera vez sintetizar partículas de Gd2O3 funcionalizadas con Amylovis®-1, de simetría esférica y diámetro hidrodinámico promedio de 2,5 μm. Sus propiedades magnéticas, dadas por los valores de relaxitividad r1 y r2 iguales a 7,7 y a 18,7 mM-1s-1, respectivamente, así como la relación r2/r1 igual a 2,4, indican que estas partículas pueden ser un potencial agente de contraste para IMR. El presente trabajo constituye una plataforma para la obtención de sistemas nanoparticulados novedosos y selectivos de Gd2O3 funcionalizados con ligandos de la familia Amylovis®.