Introducción
La afectación a la calidad del aire constituye en la actualidad una inminente preocupación a nivel local, regional y global, debido a las implicaciones negativas para la salud humana, el medio ambiente y los bienes materiales.1,2) La Organización Mundial de la Salud ha estimado que una de cada nueve muertes en todo el mundo, es el resultado de condiciones relacionadas con la contaminación atmosférica. Una de las principales fuentes de contaminación atmosférica son las emisiones procedentes de los procesos industriales que implican la combustión, así como el uso cada vez mayor de automóviles que generan dióxido y monóxido de carbono, óxidos de nitrógeno y azufre, entre otros contaminantes.2) Debido al aumento de la población mundial y al desarrollo tecnológico, dichas emisiones son propicias a aumentar, influyendo en el cambio climático, específicamente en el efecto invernadero y en las lluvias ácidas. Es por ello que se trabaja en la búsqueda de técnicas de tratamiento de gases generados que sean cada vez más eficientes, entre las que se destacan: la reducción selectiva catalítica, la reducción selectiva no catalítica y la adsorción.3-5
Los materiales zeolíticos son muy utilizados en diferentes aplicaciones medioambientales, tales como la adsorción de gases industriales contaminantes, la remoción de metales pesados, la remoción de compuestos orgánicos de aguas de desecho, y el mejoramiento de suelos, entre otras.6-8) Sin embargo, en Cuba la aplicación de estos materiales para la remediación medioambiental no alcanza aún los niveles deseados, a pesar de que el país cuenta con varios yacimientos de estos versátiles y económicos minerales con reserva para más de 100 años de explotación.9) Desde hace varias décadas, las zeolitas se han empleado en procesos de separación y purificación de gases, aprovechando sus excelentes propiedades como adsorbentes, tamices moleculares y catalizadores.10,11) Se pueden mencionar a modo de ejemplo la separación de dióxido de carbono y metano y de dihidrógeno y metano.12
En la actualidad se ha prestado especial atención al uso de membranas poliméricas para la adsorción, purificación y separación de gases.13) Las tecnologías de membranas son atractivas debido a sus ventajas tales como eficiencia energética, continuidad operativa y simplicidad, tamaño reducido, competitividad de costos y respeto al medio ambiente. También exhiben una excelente flexibilidad bajo una velocidad de flujo y composición de alimentación variable.14 Para un adecuado rendimiento de las membranas la permeabilidad y la selectividad deben ser altas. (15) Las membranas poliméricas no pueden superar el problema de la inconsistencia entre la selectividad y la permeabilidad, como sí es posible en las membranas inorgánicas, tales como las de carbono y zeolita, aunque estas últimas son difíciles de fabricar a gran escala. Es por ello que en años recientes de han desarrollado las llamadas membranas de matriz mixta, que buscan aumentar la eficiencia de las membranas poliméricas e inorgánicas. Estas son membranas híbridas en las que un sólido, un líquido o ambos, se adicionan como relleno a la matriz del polímero.14) En particular, los rellenos inorgánicos con alta estabilidad térmica, química y mecánica, y una capacidad de adsorción alta, como es el caso de las zeolitas, ofrecen subcapas porosas gruesas, mientras que los polímeros con estabilidad fisicoquímica y baja densidad proporcionan una capa superficial fina y densa que permite la dispersión uniforme de las partículas adsorbentes.14,16,17
La presente investigación está orientada al desarrollo de nuevos materiales a base de membranas de alcohol polivinílico cargadas con una clinoptilolita natural cubana para el control de contaminantes atmosféricos, específicamente el CO2 formado durante los procesos de combustión, con vistas a su posible empleo como filtros adsorbentes.
Materiales y métodos
Reactivos y materiales
El etanol (CH3CH2OH), grado técnico, con una pureza de 95 %, se empleó para disolver el polímero. Los ácidos sulfúrico (H2SO4, Sigma-Aldrich, pureza 98 %), fluorhídrico (HF, Sigma-Aldrich, pureza 48 %), y perclórico (HClO4, Sigma-Aldrich, pureza 70 %), se emplearon en la digestión de la zeolita para su posterior análisis elemental.
Como matriz polimérica se empleó el alcohol polivinílico (PVA) grado reactivo de la marca MERCK, número CAS: 9002-89-5, con una masa molar promedio de 72 000 g/mol. El mismo fue usado sin purificación adicional. Este polímero se seleccionó teniendo en cuenta que es estable térmicamente, amigable con el medio ambiente y biodegradable.
En el trabajo se empleó la clinoptilolita natural del yacimiento Tasajeras, en la provincia de Villa Clara, la cual ha mostrado buenas propiedades de adsorción y una adecuada estabilidad química y térmica.18) Esta zeolita consiste en una mezcla de alrededor de un 70 % de clinoptilolita, un 5 % de mordenita, un 15 % de anortita y un 10 % de cuarzo.19) El mineral fue tamizado en seco (batería de tamices marca VEB MLW LABORTECHNIK, Alemania), y se seleccionó la fracción comprendida entre 32 y 36 μm. Posteriormente se realizó un proceso de purificación para eliminar fases acompañantes no zeolíticas, que consistió en realizar tres ciclos de lavado con agua destilada a temperatura ambiente, empleando una relación de 1 g de zeolita / 50 mL de agua destilada. La suspensión zeolita/agua se mantuvo en agitación magnética constante de 400 rpm por una hora (agitador magnético con calentamiento J.P. SELECTA, España), luego de lo cual se dejó decantar para separar el líquido sobrenadante. Durante los lavados se realizó la separación magnética de especies de hierro. El proceso de lavado se repitió a una temperatura de 80 oC. Finalmente, la zeolita se secó en la estufa a 100 oC por 4 h (PRESICION SCIENTIFIC, Estados Unidos).
Preparación de las membranas
Las membranas fueron preparadas por el método de síntesis solution casting, que consiste en extender la disolución de polímero sobre una superficie plana horizontal permitiendo la evaporación del disolvente y obteniendo una membrana polimérica delgada y uniforme.20)
Para la obtención de la membrana de PVA (M-PVA) se colocaron 1,94 g (7,7 x 10-5 mol) del polímero en un vaso de precipitados de 25 mL al que se adicionaron 5 mL de etanol al 95 %. En paralelo se adicionaron a un vaso de precipitados 20 mL de agua destilada y se calentó a 80 oC en un agitador magnético con calentamiento, a una velocidad de agitación de 500 rpm (agitador magnético con calentamiento J.P. SELECTA, España). Cuando se alcanzó la temperatura deseada se añadió lentamente la mezcla de PVA-etanol, se redujo la velocidad de agitación a 350 rpm y se dejó hasta disolución completa. Una vez disuelto el PVA se trasvasó a una placa Petri para su secado en estufa a 45 oC durante 4 h (PRESICION SCIENTIFIC, Estados Unidos). Con el objetivo de estudiar la influencia del volumen de agua adicionado para disolver el polímero en la calidad de la membrana obtenida, se siguió el mismo procedimiento descrito anteriormente, pero empleando 10 mL de agua destilada.
Para la obtención de las membranas de PVA cargadas con zeolitas (M-PVA-Z1 y M-PVA-Z2) se siguió el procedimiento descrito anteriormente empleando 10 mL de agua para la disolución del polímero. Una vez disuelto el PVA se adicionaron 0,14 g y 0,28 g de zeolita para las membranas M-PVA-Z1 y M-PVA-Z2, respectivamente, y se mantuvo la agitación hasta la homogenización del sistema. Finalmente, se trasvasó a una placa Petri para su secado en estufa a 45 oC durante 4 h (PRESICION SCIENTIFIC, Estados Unidos).
Caracterización de la zeolita y las membranas
Las características estructurales y las fases cristalinas presentes en el mineral zeolítico se estudiaron mediante difracción de rayos X (DRX). Se empleó un difractómetro Philips Xpert, de procedencia holandesa, con radiación de la línea Kα del Cu (λ = 1,541 838 Å). Se barrió un intervalo de 2( entre 5 y 60o, con un paso de 0,033o.
La determinación de la composición química de la zeolita después del proceso de purificación se realizó mediante espectroscopía de absorción atómica. Las muestras fueron disueltas empleando una mezcla de ácidos sulfúrico, perclórico y fluorhídrico y calentando hasta la aparición de humos densos. Después de disolver, se trasvasó a volumétrico de 100 mL y se realizaron las diluciones necesarias para medir. Se empleó un espectrómetro Shimadzu 6800E de procedencia japonesa. Para la determinación del silicio las muestras se digirieron por fusión alcalina.
Las imágenes fotográficas de las membranas se obtuvieron con una cámara digital Canon PowerShot A530 de 5.0 megapíxeles, zoom óptico de 4x y pantalla LCD de 1,8 pulgadas. El diámetro y espesor se midieron empleando un calibre pie de rey (150 mm) marca Mitutoyo de procedencia japonesa.
Para estudiar las características morfológicas de las membranas obtenidas se empleó la microscopía electrónica de barrido (MEB). Se utilizó un microscopio HITACHI S-530, de procedencia japonesa, empleando voltajes de 2,0 y 10,0 kV. Las muestras fueron recubiertas con oro para su observación.
La espectroscopía infrarroja con reflectancia total atenuada (FTIR-ATR) se utilizó para conocer características estructurales de las membranas obtenidas. Se empleó un equipo FTIR Perkin-Elmer con ATR (Estados Unidos), en el intervalo de longitud de onda de 400 a 4000 cm-1, con un paso de 0,5 cm-1 y un número de barrido de 64. Las muestras fueron analizadas en forma de películas delgadas.
La estabilidad térmica de las membranas preparadas, así como las transformaciones térmicas que tienen lugar, se estudiaron mediante análisis termogravimétrico. Se empleó un equipo TGA Q5000 (Estados Unidos), con una velocidad de calentamiento de 50 oC/min, un intervalo de temperatura de 25 a 400 oC y flujo de aire seco a una velocidad de 50 mL/min. La masa de muestra analizada fue de aproximadamente 5 mg en todos los casos.
Experimentos de adsorción de CO2 a 25 oC
Los análisis de adsorción de CO2 se realizaron en un equipo Micromeritics ASAP 2050 (Estados Unidos), a una temperatura de 25 oC hasta 10 bar de presión. Las muestras fueron desgasificadas a 80 oC por 2 horas a una velocidad de calentamiento de 3 oC/min en condiciones de vacío (10-3 bar). Las isotermas obtenidas se ajustaron usando el modelo de Freundlich no lineal según la ecuación (1), haciendo uso del programa Origin 9,64.
donde:
qads es la cantidad de CO2 adsorbida en el equilibrio (mmol/g),
KF es la constante de Freundlich, que indica la capacidad de adsorción y la afinidad adsorbato-adsorbente (mmol/g bar1/n), y
n es una constante relacionada con la afinidad adsorbato-adsorbente y la heterogeneidad de la superficie.
Resultados y discusión
Caracterización de la zeolita natural purificada
En la figura 1 se muestra el patrón de difracción de rayos X de la zeolita natural purificada, señalándose las reflexiones más importantes de la fase clinoptilolita.21) La agudeza de los picos indica un alto grado de cristalinidad de la muestra. Sin embargo, el ligero levantamiento del fondo del difractograma denota la presencia de material amorfo. Se aprecia, además, la presencia de la zeolita mordenita y del cuarzo como fases acompañantes, las cuales no pueden ser eliminadas con el proceso de purificación efectuado.
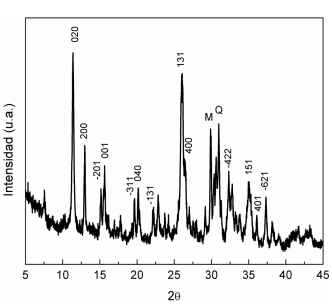
Fig. 1 Patrón de difracción de rayos X de la clinoptilolita natural purificada (M: mordenita, Q: cuarzo)
La composición química de la zeolita purificada, expresada en % en masa del elemento en forma de óxido, se presenta en la tabla 1. Como puede observarse, la clinoptilolita natural del yacimiento Tasajeras presenta como cationes de compensación calcio, sodio, potasio y magnesio, siendo mayoritariamente cálcica. Se ha reportado que el hierro puede encontrarse como catión de compensación, sustituyendo al silicio y aluminio en posiciones tetraédricas en la estructura y como una fase acompañante en el mineral, generalmente en forma de magnetita.22) En nuestro caso el porciento de este elemento es bajo debido a la separación magnética de la magnetita presente en el mineral durante el proceso de purificación. La relación Si/Al de la zeolita purificada es de 5.01, que concuerda con lo reportado en la literatura para la clinoptilolita.23
Tabla 1 Composición química del mineral zeolítico después de su purificación expresada en % en masa del elemento en forma de óxido.
| SiO2 | Al2O3 | CaO | Na2O | K2O | MgO | Fe2O3 |
|---|---|---|---|---|---|---|
| 66.3 | 11,2 | 3,4 | 1,4 | 1,12 | 0,6 | 1,1 |
La baja relación Si/Al de esta zeolita es favorable para su empleo en procesos de adsorción e intercambio iónico. En un estudio realizado por Hernández y colaboradores24 sobre la adsorción de CO2 en clinoptilolitas naturales y modificadas químicamente, los autores demostraron que a menor relación Si/Al la capacidad de adsorción de CO2 es mayor.
Preparación de las membranas
Teniendo en cuenta la importancia de la cantidad de disolvente empleado en las características de la membrana obtenida, éstas se prepararon con PVA y sin adición de zeolita, empleando 20 y 10 mL de agua. En el primer caso la membrana quedó completamente deformada mientras que al emplear 10 mL de agua la membrana es más uniforme, lo cual indica que es necesario reducir la cantidad de agua al mínimo necesario para que el proceso de secado ocurra a mayor velocidad. En este sentido, hay que tener en cuenta, además, la viscosidad de la disolución de PVA y el tiempo necesario para la completa disolución del polímero, porque al disminuir el contenido de agua, la viscosidad aumenta y el proceso de disolución se hace muy lento. Es por ello que no se usaron volúmenes inferiores a 10 mL.
Una viscosidad muy elevada de la disolución conlleva a que se dificulte su trasvase hacia la placa de Petri donde se realiza el secado, dando lugar a la obtención de membranas con un grosor no uniforme. Por otra parte, una viscosidad alta de la disolución puede conducir a que no se disperse de forma homogénea la zeolita cuando se preparen las membranas compuestas. Teniendo en cuenta los resultados, seleccionamos un volumen de 10 mL de agua para disolver el PVA y obtener membranas de buena calidad, con un diámetro de 7 cm y un grosor de 2 mm; además de ser transparentes, incoloras y flexibles (figura 2A).
Las imágenes fotográficas de las membranas preparadas adicionando dos cantidades diferentes de la clinoptilolita purificada, se presentan en la figuras 2 B y C. Cuando se mezcla la disolución de PVA con la clinoptilolita se forma un material compuesto y en la medida en que se incrementa la cantidad de esta, se observan cambios en la flexibilidad y transparencia de las membranas resultantes, como consecuencia de las propiedades físicas de la zeolita en estudio. Las membranas mantienen su flexibilidad, la cual disminuye con el aumento de la cantidad de zeolita adicionada, siguiendo el orden: M-PVA > M-PVA-Z1 > M-PVA-Z2. Por su parte, la transparencia manifiesta un comportamiento similar al de la flexibilidad. A simple vista se aprecia una buena dispersión de la zeolita en toda la extensión de la membrana. Se debe señalar, sin embargo, que la cara superior de ambas membranas es completamente lisa y "brillante", mientras que la cara inferior es rugosa y opaca. Esto indica claramente que durante el proceso de secado la zeolita se va depositando lentamente en el fondo de la placa, a pesar de que la disolución precursora es bastante viscosa y de que se empleó un tamaño de partícula de zeolita pequeño (32-36 μm).
Caracterización de las membranas
Las imágenes de microscopía electrónica de barrido de las membranas M-PVA, M-PVA-Z1 y M-PVA-Z2 se presentan en la figura 3. En el caso de la membrana M-PVA se observa una superficie homogénea, sin indicios de rugosidad y porosidad, en la mayoría de las zonas observadas. Resultados similares han sido reportados por Escobar-Sierra y Perea-Mesa 25 y por Nagahama y col. 26 para membranas de PVA, PVA-quitosano y quitosano-gelatina. Sin embargo, en algunas zonas se observan defectos superficiales (figura 3A1) que parecen como pequeñas grietas. Estos defectos es posible que se hayan formado debido a la salida del vapor de agua durante el proceso de secado. Se pueden observar también partículas muy pequeñas, de dimensiones menores a 1 μm, que al parecer se deben al polímero, a pesar de que en todos los casos, a simple vista, la disolución del PVA fue completa (figura 3A2).
Las imágenes de las membranas compuestas (figura 3B y 3C) corresponden a la cara inferior de las mismas, donde se aprecia a simple vista una mayor cantidad de zeolita. A diferencia de la inspección a simple vista, donde se observó una distribución homogénea de la zeolita en toda el área de la membrana, aquí se aprecian zonas de conglomerados de partículas. Es interesante notar que, aunque la zeolita se tamizó y se seleccionó un tamaño de partícula entre 32 y 36 μm, en las imágenes se observan partículas mucho más pequeñas, de alrededor de pocas micras, formando parte de los conglomerados. Esto indica que las partículas se encontraban agregadas cuando se realizó el tamizado en seco.

Fig. 3 Imágenes de microscopía electrónica de barrido de las membranas obtenidas. (A) M-PVA, (B) M-PVA-Z1 y (C) M-PVA-Z2 (la escala corresponde a 100 nm en la imagen B2 y a 1 µm en el resto de las imágenes)
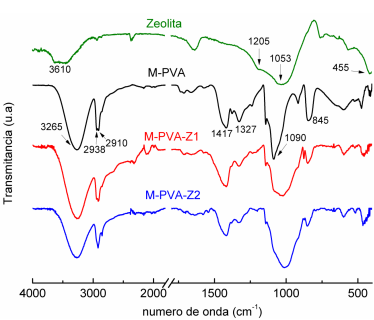
En la figura 4 se presentan los espectros FTIR con ATR de la clinoptilolita y las membranas obtenidas: M-PVA, M-PVA-Z1 y M-PVA-Z2. En el espectro de la membrana M-PVA se destacan las principales bandas del polímero.27 La banda ancha centrada a 3265 cm-1 corresponde a las vibraciones de valencia de los grupos O-H del PVA, las bandas entre 2938-2910 cm-1 corresponden a las vibraciones de valencia asimétricas y simétricas de los grupos CH y CH2, las bandas entre 1417-1327 cm-1 están asociadas a los doblajes en el plano (asimétricos y simétricos) de los grupos CH2, y la banda a 1090 cm-1 asociada al enlace C-O. Se aprecia una banda alrededor de 1724 cm-1 que corresponde a las vibraciones de valencia del enlace C=O de los grupos acetato residuales, lo que concuerda con un PVA parcialmente hidrolizado. Se ha reportado en la literatura que las bandas por debajo de 1000 cm-1 están relacionadas con las vibraciones del esqueleto carbonado del PVA y son, por lo general, de difícil asignación.26,27
Los espectros infrarrojos de M-PVA-Z1 y M-PVA-Z2 son similares al de la membrana de PVA, aunque se pueden observar también algunas de las bandas características de la clinoptilolita. La banda correspondiente a las vibraciones externas asimétricas de valencia de los tetraedros TO4 de la clinoptilolita (1053 cm-1) 28 y la banda correspondiente a las vibraciones de valencia de los enlace C-O del PVA (1090 cm-1) tienen frecuencias similares, pero la forma es diferente. Se puede notar que la relación de intensidades entre estas bandas se modifica con la composición de la membrana, incrementándose esta relación con el aumento de la cantidad de zeolita en la membrana. En los espectros de las membranas compuestas, la banda a 1053 cm-1 presenta la forma de la del espectro de la zeolita. Las bandas características del PVA, y en particular las asociadas a los enlaces O-H y C-OH (3265, 1417 y 1090 cm-1), no muestran ningún desplazamiento en los espectros de las membranas compuestas, por lo que podemos asumir que no hay interacciones por puente de hidrógeno entre la zeolita y el polímero.
La estabilidad térmica de las membranas resulta determinante a la hora de definir su utilización para la separación de gases, fundamentalmente a nivel industrial. Por tal motivo se necesita conocer la temperatura a la cual comienza el proceso de descomposición de éstas. Es importante destacar que el análisis termogravimétrico se realizó hasta la temperatura de 400 oC y no hasta los 700 oC, temperatura a la cual se descompone casi en su totalidad el PVA.29) Nuestro interés se enfocó, solamente, en determinarla temperatura a la cual comienza el proceso de descomposición de las membranas, teniendo en cuenta la posible aplicación como filtros adsorbentes en lugares donde las temperaturas no superan los 200 oC. Las curvas TG y DTG de las membranas se presentan en la figura 5.

Fig. 5 Curvas TG y DTG de las membranas, registrados entre 25 y 400 oC, a una velocidad de calentamiento de 50 oC/min y flujo de aire seco de 50 mL/min
La membrana M-PVA presenta una primera pérdida de masa de 5,5 % en el rango de temperaturas entre 65 y 180 oC, relacionada con la merma de agua adsorbida en la membrana, que como se puede observar es muy pequeña. Una segunda pérdida de masa de un 50,5 % tiene lugar en el rango de temperatura entre 230 y 270 oC, la cual se presenta como un pico muy agudo centrado en 247 oC en la curva de DTG. En la literatura se plantea que está relacionada con la primera etapa de descomposición del PVA.29) Posteriormente se observa una pérdida de masa de alrededor de un 15 % en el rango de temperatura entre 300 y 400 oC, lo cual se corresponde con el inicio de la segunda etapa de descomposición del polímero.
Es importante mencionar que la clinoptilolita es una zeolita muy estable térmicamente. El colapso estructural ocurre a los 700 oC aproximadamente, y a menores temperaturas solo se observan pérdidas de masa asociadas al agua fisisorbida (entre 70 y 100 oC) y al agua de coordinación de los cationes (entre 150 y 300 oC), lo que representa alrededor de un 10 % en masa.23
Las membranas M-PVA-Z1 y M-PVA-Z2 muestran un comportamiento similar a la membrana M-PVA en cuanto a la pérdida de masa asociada al agua adsorbida, pero el comportamiento es diferente para las pérdidas de masa asociadas a la descomposición del polímero. En el caso de la membrana M-PVA-Z1 ocurre una pérdida de masa de 48,1 % asociada a la primera etapa de descomposición del polímero, que ocurre en el rango de temperatura entre 220 y 260 oC, centrada en 233 oC. Este ligero corrimiento, a menores temperaturas, no es muy significativo con vistas a la futura aplicación de la membrana. En el caso de M-PVA-Z2 ocurre una pérdida de masa de un 47 % que tiene lugar en el rango de temperatura entre 215 y 300 oC. Esta pérdida de masa se observa como dos picos anchos, bien definidos, centrados en 234 oC (16,5%) y 258 oC (30,5%), respectivamente, en la curva de DTG. Estos resultados sugieren que hay un cambio en el mecanismo de degradación del polímero cuando se adiciona la zeolita en cantidades apreciables (nótese que en la membrana M-PVA-Z1, no se observa este comportamiento).
En la literatura se reporta que la primera etapa de degradación del PVA involucra principalmente reacciones de eliminación y consecuentemente solo aparece un pico en la curva DTG (ver curva de membrana M-PVA).29) En la membrana M-PVA-Z2 el pico a temperatura más baja puede ser causado por las reacciones de eliminación, mientras que el que aparece a mayor temperatura puede estar originado por la superposición de las eliminaciones continuas y las reacciones de escisión en cadena, que necesitan más energía y ocurren a una temperatura más alta. En la literatura se reportan resultados similares al estudiar el mecanismo de degradación térmica de nanocomposites de PVA/SiO2.29
Estudios de adsorción de CO2
En la figura 6A se muestran las isotermas de adsorción-desorción de CO2 a 25 oC hasta 10 bar obtenidas para las tres membranas: M-PVA, M-PVA-Z1 y M-PVA-Z2. Las isotermas fueron de tipo III según la clasificación de la IUPAC 30 con lazos de histéresis de tipo H4. El lazo de histéresis es más pronunciado en la muestra M-PVA-Z1, donde el gas es gradualmente liberado en el rango de 10 a 1.5 bar y agudamente desorbido a menores presiones. Todas las isotermas obtenidas exhiben lazos de histéresis abiertos, lo que puede significar que la presión de equilibrio no se establece debido a la velocidad lenta de difusión del CO2, el cual primero tiene que difundir a través de la membrana y posteriormente en los microporos de la clinoptinolita. Este tipo de fenómenos es típico para poros muy estrechos o poros con forma de botella.

Fig. 6 Isotermas de Adsorción de CO2 a 25 oC hasta 10 bar (A) y ajustes de las isotermas según modelo de Freundlich no lineal (B) para las tres membranas estudiadas
La membrana M-PVA presentó un valor de cantidad máxima adsorbida de 0,991 mmol/g. La membrana M-PVA-Z1 (cargada con 0,14 g de clinoptilolita) mostró mejor capacidad de adsorción, con un valor de cantidad máxima adsorbida de 2.129 mmol/g, denotando la contribución de la zeolita en la adsorción de CO2. Contrario a lo esperado, la membrana M-PVA-Z2 mostró menores valores de cantidad adsorbida (0,921 mmol/g), lo cual puede deberse al bloqueo parcial de los poros del PVA con las partículas de zeolita en el proceso de dispersión. Como consecuencia el CO2 no difunde con facilidad a través de los poros y canales, traduciéndose en una disminución de la adsorción por el material.
Las isotermas se ajustaron mediante el modelo de Freundlich no lineal (figura. 6B) obteniéndose los valores de la constante de Freundlich y de n que se muestran en la tabla 2. Todas las isotermas se ajustaron bien al modelo, con valores de r 2 superiores a 0,98.
Tabla 2 Parámetros obtenidos de los ajustes de las isotermas de adsorción de CO2 empleando el modelo de Freundlich.
| Muestra | K F (mmol/g bar1/n) | n | r 2 |
|---|---|---|---|
| M-PVA | 0,023 ± 0,004 | 0,62 ± 0,02 | 0,983 9 |
| M-PVA-Z1 | 0,039 ± 0,005 | 0,57 ± 0,02 | 0,992 1 |
| M-PVA-Z2 | 0,034 ± 0,004 | 0,71 ± 0,04 | 0,988 5 |
Los valores del coeficiente n se encuentran entre 0 y 1 para todas las membranas, indicando una isoterma tipo S o no favorable, esto es coherente con la forma convexa de las curvas respecto al eje de la presión. El valor de K F es mayor para la membrana M-PVA-Z1, lo que es un indicativo de que son más fuertes las interacciones adsorbato-adsorbente. El mayor valor de n para la membrana M-PVA-Z2 nos indica que aumenta la heterogeneidad de la superficie.
La adsorción de CO2 en las zeolitas es principalmente debida a las interacciones vía momento cuadrupolar de la molécula de CO2 - gradiente de campo eléctrico que crean los cationes en los canales, en el caso de la clinoptinolita de dimensiones: a ≈ 7,5 x 3,1 Å, b ≈ 4,6 x 3,6 Å and c ≈ 4,7 x 2,8 Å. 31 Teniendo en cuenta que el CO2 tiene un diámetro cinético de 3,3 Å y una polarizabilidad de 1,9 Å3, ocurre la entrada de la molécula al sistema microporoso de la zeolita, lo que hace que la molécula se vea influenciada por dicho gradiente de campo eléctrico y que, por tanto, el CO2 pueda adsorberse en sitios poco accesibles del sólido. Se conoce que la adsorción de CO2 en clinoptilolita y otras zeolitas de poro angosto aumenta con el incremento de la temperatura, y por lo general es baja, para valores inferiores a los 200 oC. 32 Teniendo en cuenta esto y la estabilidad térmica de las membranas, se realizarán en trabajos futuros, estudios de adsorción de CO2 a mayores temperaturas, para conocer si aumenta la capacidad de adsorción de las membranas desarrolladas, lo que en caso positivo ampliaría su espectro de aplicaciones.
Conclusiones
En el presente trabajo se desarrollaron membranas poliméricas de PVA cargadas con una zeolita natural con vistas a su empleo futuro en el control de contaminantes atmosféricos provenientes de los procesos de combustión. Se obtuvieron membranas flexibles, delgadas y de espesor uniforme, con una distribución macroscópica bastante homogénea de la zeolita en todo el diámetro de la membrana. Se evidenció la importancia de la cantidad de agua adicionada en las características físicas de las membranas. La caracterización realizada y los estudios de adsorción de CO2 permitieron establecer que no hay interacciones significativas entre el polímero y la zeolita en las membranas compuestas, que éstas son térmicamente estables y que presentan una buena adsorción de CO2. Los resultados obtenidos sugieren que las membranas compuestas PVA/zeolita pueden ser candidatas para su empleo en la adsorción de CO2 derivado de procesos de combustión.