Introducción
El biodiesel es un combustible renovable consistente en metil/etil ésteres de ácidos grasos (FAME/FAEE, por sus siglas en inglés) que es producido mediante la transesterificación de triglicéridos (TAG) con metanol o etanol.1 En dependencia del origen de la fuente de aceite a utilizar, el biocombustible es referido como de primera, segunda o tercera generación. Mientras que los biocombustibles de primera generación utilizan los aceites vegetales de cultivos como la colza y la soya para la transesterificación, los de segunda generación utilizan biomasa lignocelulósica. Los primeros tienen como principal inconveniente que los cultivos utilizados para su producción son empleados también como alimentos, mientras que en los últimos la biomasa debe someterse primeramente a un tratamiento biológico o termoquímico.1
Con los combustibles de tercera generación se trata de reducir el conflicto generado por la utilización de cultivos destinados a la alimentación humana para la producción de biocombustibles, a través del uso de ácidos grasos producidos por microorganismos oleaginosos. Se consideran como oleaginosos aquellos microorganismos que acumulan más del 20 % de su peso seco en forma de lípidos 2-4, lo cual incluye diferentes especies de levaduras, bacterias, hongos filamentosos y algas.
El uso de levaduras oleaginosas tiene ciertas ventajas sobre otros microorganismos heterotróficos debido a su relativamente rápido crecimiento y su alto contenido lipídico.5 Además, estos lípidos están compuestos principalmente de TAG, lo que los hace, por sus propiedades físico-químicas y posibles aplicaciones, comparables a los aceites vegetales.6 Algunas levaduras, como Rhodosporidium sp., Lipomyces sp. Y Rhodotorula sp. pueden acumular lípidos intracelulares hasta valores tan altos como el 70 % de su peso seco.7
La fuente de carbono ha sido identificada como uno de los principales factores que encarecen el proceso de producción de lípidos microbianos.2 La utilización de fuentes de carbono baratas y disponibles ayudaría a reducir los costos de producción, haciéndolos más competitivos frente al biodiesel derivado de aceites vegetales. En tal sentido, varios autores han evaluado una gran variedad de sustratos para el cultivo de levaduras oleaginosas, con énfasis en el uso de subproductos o residuales agroindustriales. Algunos de los sustratos empleados son el glicerol 8-10, las melazas 10-12, los hidrolizados de residuos agrícolas 13, las vinazas de destilería 14 y el lactosuero 15, entre otros. En el presente trabajo se optimizó la producción de lípidos en una cepa autóctona de levadura oleaginosa, utilizando medios de cultivo a base de lactosuero y melaza como fuentes de carbono.
Materiales y métodos
La investigación se realizó en el Centro de Estudios de Biotecnología Industrial (CEBI) de la Universidad de Oriente y en la Estación Territorial de Investigaciones de la Caña de Azúcar (ETICA) “Oriente - Sur”, en el período comprendido desde octubre del 2019 hasta julio del 2020.
Obtención de los subproductos agroindustriales
El lactosuero se obtuvo en el Combinado Lácteo “Palma Soriano”, perteneciente al municipio Palma Soriano de la provincia Santiago de Cuba. Este residual, procedente del proceso de elaboración de queso, se colectó en un recipiente plástico con cierre hermético, el cual se llenó completamente (aproximadamente 5 L) con el fin de que no quedara aire libre en su interior. La muestra se conservó en congelación hasta su uso.
La melaza se obtuvo del central azucarero “Dos Ríos”, localizado en el mismo municipio. La melaza o miel, como también se le conoce, es un subproducto de la fabricación de azúcar de caña. La colecta se efectuó en un recipiente plástico con cierre hermético, el cual se llenó completamente (aproximadamente 5L). La muestra se conservó en cámara fría hasta su uso.
Pretratamiento de los subproductos agroindustriales
Antes de realizar la caracterización de los subproductos agroindustriales, estos se sometieron a un pretratamiento con el objetivo de eliminar aquellos componentes que pudieran interferir en su utilización como medios de cultivo.
Desproteinización del lactosuero. Se realizó según El-Salam et al.15 con algunas modificaciones. El lactosuero se llevó a un pH de 4,6 con ácido láctico (Scharlau, España) y luego se calentó durante 10 min a 100 oC, se enfrió a temperatura ambiente y se centrifugó a 3,000×g durante 20 min (HealForce, China) para eliminar las proteínas precipitadas. El sobrenadante se filtró a través de un lecho de algodón para eliminar la grasa. Por último, el pH se ajustó a 6 con NaOH (Scharlau, España) 1 mol/L. El lactosuero desproteinizado se mantuvo en congelación hasta su uso.
Dilución y eliminación de lodos en la melaza. La melaza se diluyó en proporción 1:5 con agua destilada, luego se calentó durante 10 min a 100 oC, se enfrió a temperatura ambiente y se centrifugó a 3,000×g durante 20 min (HealForce, China) para eliminar los sólidos insolubles presentes. La melaza clarificada se mantuvo en congelación hasta su uso.
Determinaciones analíticas
Los azúcares reductores totales (ART) se determinaron según el método de Somogyi-Nelson.16 La concentración de proteínas solubles se estimó mediante el método de Lowry 17, para lo cual se leyó la absorbancia a 650 nm y se utilizó como patrón seroalbúmina bovina (BDH, Inglaterra) en el rango de 20 - 500 µg/mL. Los contenidos de nitrógeno (N), fósforo (P) y potasio (K) se determinaron luego de realizar la mineralización de las muestras con ácido sulfúrico concentrado (Panreac, España), según los métodos estándar para el análisis de aguas y aguas residuales.18 La concentración de amonio se estimó mediante el método colorimétrico del fenato 18 y el contenido de lípidos en la biomasa se determinó según el método de la sulfo-fosfo-vainillina 19 de acuerdo con las modificaciones de Izard y Limberger.20
Microorganismo, medios y condiciones de cultivo
Se trabajó con una cepa de levadura oleaginosa (cepa número 75) de la Colección de Cultivos Microbianos del CEBI, la cual se conservó a 4° C en cuñas de medio YPDA, cuya composición (en g/L) fue: extracto de levadura (10), glucosa (20), peptona (20) y agar bacteriológico (20). Todos los componentes empleados fueron de UNI-Chem (China).
La propagación de la levadura se efectuó en el medio de cultivo MGY (composición, en g/L): glucosa (Panreac, España) (20), (NH4)2SO4 (Scharlau, España) (5), MgSO4(7H2O (Scharlau, España) (0,5), CaCl2 (Scharlau, España) (0,1), KH2PO4 (Scharlau, España) (1), Extracto de levadura (Scharlau, España) (2,5). La variante sólida del medio (MGYA) se obtuvo mediante la adición de agar bacteriológico (Scharlau, España) (20).
Cultivos de levadura crecidos durante 12 horas en el medio MGY, con agitación a 160 rpm y a temperatura ambiente, se utilizaron como inóculo (4 % v/v) en los ensayos de optimización.
Evaluación de la melaza y el lactosuero como fuentes de carbono
Para evaluar la producción de lípidos por la levadura utilizando como fuentes de carbono estos subproductos agroindustriales, se emplearon cuatro medios de cultivo:
Medio 1: Melaza como fuente de carbono, sin adición de (NH4)2SO4.
Medio 2: Melaza como fuente de carbono.
Medio 3: Lactosuero como fuente de carbono, sin adición de (NH4)2SO4.
Medio 4: Lactosuero como fuente de carbono.
La composición de todos los medios fue la misma del medio MGY, pero reemplazando la glucosa por la melaza y el lactosuero, de modo tal que todos los medios tuviesen la misma concentración de carbono elemental. Con el objetivo de observar la influencia del (NH4)2SO4 en la acumulación de lípidos, a dos de los medios no se le adicionó este nutriente. El pH se ajustó a 6 con NaOH 1 mol/L en todos los casos.
La levadura se cultivó en frascos Erlenmeyer de 250 mL que contenían 50 mL de medio de cultivo. Los cultivos se mantuvieron en agitación (160 rpm) durante 72 h a temperatura ambiente. Transcurrido este tiempo se separó la biomasa por centrifugación (HealForce, China) y se determinó su contenido gravimétricamente (secado a 105 ºC); el contenido de lípidos se determinó directamente en la biomasa húmeda.20
Se realizó un análisis de varianza (ANOVA) de los resultados y se utilizó la prueba de comparación de medias de Tukey, empleando un nivel de significación del 5 %. Estos análisis se realizaron con ayuda del paquete estadístico Statgraphics Centurion XV (Stat Point, Inc.; USA).
Optimización de la producción de lípidos
Diseño experimental. Para la creación y posterior análisis del diseño experimental se utilizó el programa Statgraphics Centurion XV.
Selección de los factores que influyen sobre la producción de lípidos. Con el objetivo de conocer cuáles componentes del medio de cultivo ejercían mayor influencia sobre la producción de lípidos y de biomasa por la cepa de levadura se utilizó un diseño de cribado tipo Plackett-Burman con nueve factores en dos niveles y tres puntos centrales, para un total de 15 variantes experimentales. Los factores y niveles evaluados fueron: concentración de la fuente de carbono, expresada como ART (Cc) (80-100 g/L), concentración de carbono aportada por el lactosuero (Cc suero) (0-3 %, con respecto al carbono total), relación carbono-nitrógeno (R C:N) (100-200), así como las concentraciones de MgSO4(7H2O (0-0,5 g/L), KH2PO4 (0-1 g/L), CaCl2 (0-0,1 g/L), extracto de levadura (0-1 g/L) y Tween 20 (0,5-1,5 g/L) (Scharlau, España) y el pH del medio.5-6
Optimización del medio de cultivo. Una vez conocidos cuales eran los factores que mayor influencia ejercían sobre la producción de lípidos y de biomasa, se utilizó la metodología de superficies de respuesta en base a un diseño Box-Behnken, con tres factores en tres niveles y tres puntos centrales, para un total de 15 variantes experimentales. Los factores y niveles estudiados fueron: concentración de la fuente de carbono (Cc) (60-70-80 g/L); concentración de KH2PO4 (0-0,3-0,6 g/L) y pH (5,5-6,0-6,5). Se obtuvieron las ecuaciones de regresión (modelos) que predicen los valores máximos de acumulación de lípidos (%) y concentración de biomasa (mg/mL) por el método de los mínimos cuadrados.
Resultados y discusión
Caracterización de los subproductos agroindustriales
En la tabla 1 se presenta la caracterización química de los dos subproductos agroindustriales utilizados en el presente estudio. La melaza presentó una concentración de ART comparable a la reportada en la literatura 656 g/L y un pH dentro del rango descrito, según Otero et al. 21, de 5,5 a 6,5. La concentración de nitrógeno fue ligeramente menor a la informada en esta misma fuente. El contenido de fósforo resultó similar al encontrado por Amorim et al. 22 El lactosuero presentó un pH dentro del rango correspondiente al denominado suero dulce 4,5-6,7, informado por Moulin y Galzy 23; en tanto, los contenidos de nitrógeno, fósforo y potasio obtenidos son comparables a los reportados por dicho autor, 1,45 g/L, 0,41 g/L y 1,45 g/L, respectivamente.
Evaluación de los residuales agroindustriales como fuente de carbono
Se observaron diferencias significativas (p<0,05) entre los cuatro medios de cultivo utilizados (tabla 2). La concentración de lípidos en la biomasa de levadura (Fig. 1) fue superior cuando se utilizó melaza como fuente de carbono (medios 1 y 2). Esto pudiera estar relacionado con una utilización más eficaz por la levadura de los azúcares contenidos en la melaza (sacarosa, glucosa y fructosa, principalmente) con respecto a la lactosa, principal azúcar presente en el lactosuero. Por esta razón, para el diseño de cribado se utilizó como fuente de carbono principal la melaza y se evaluó la influencia del lactosuero como suplemento nutricional en los medios de cultivo. El aporte de este último representó sólo una pequeña parte de la concentración de carbono total en los medios (3%).
Tabla 2 Análisis de varianza para concentración de TAG obtenida*
| Fuente | Suma de Cuadrados | Gl | Cuadrado Medio | Razón-F | Valor-P |
|---|---|---|---|---|---|
| A: Medios | 137475 | 3 | 45 824,9 | 180,17 | 0,000 7 |
| B: Réplicas | 190,515 | 1 | 190,515 | 0,75 | 0,450 4 |
| 763,027 | 3 | 254,342 | |||
| TOTAL (CORREGIDO) | 138428 | 7 | |||
*Los resultados corresponden a cultivos de 72 horas, agitación 160 rpm, temperatura ambiente; Gl, grados de libertad.
La adición de (NH4)2SO4 a los medios que utilizan la melaza como fuente de carbono produjo una disminución importante en la acumulación de lípidos por la levadura, lo cual sugiere que la adición de este componente resulta en un exceso de nitrógeno en el medio. Se ha demostrado por varios autores 8,11 que la producción de lípidos en las levaduras oleaginosas aumenta con la disminución de la concentración de nitrógeno en el medio, o sea, cuando existe una elevada relación C/N.
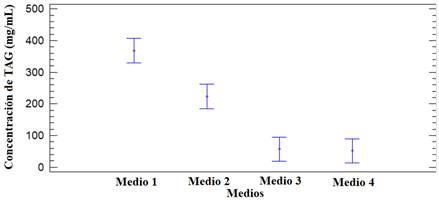
Fig. 1 Producción de lípidos por la cepa 75 utilizando como fuentes de carbono subproductos agroindustriales.
Leyenda: Medios 1 y 2, con melaza como fuente de carbono; Medios 2 y 4 con lactosuero como fuente de carbono; Medios 1 y 3, sin adición de (NH4)2SO4
En las siguientes etapas de optimización se estudió la relación C/N como uno de los factores a tener en cuenta para la optimización del medio de cultivo, con el fin de maximizar la obtención de lípidos en esta levadura.
Optimización dela producción de lípidos
Selección de los factores que influyen sobre la producción de lípidos
Para la determinación de los factores que influyen de forma significativa sobre el crecimiento microbiano (Fig. 2a) y la acumulación de lípidos (Fig. 2b) se utilizaron los diagramas de Pareto estandarizados. En la producción de lípidos resultaron significativos los efectos de la concentración de la fuente de carbono (Cc), del extracto de levadura (YE), del KH2PO4, y de la concentración de carbono aportada por el suero (Cc Suero); en tanto, en la formación de biomasa (crecimiento) no influyó ninguno de manera significativa, aunque se apreció una mayor influencia del pH y de la concentración de KH2PO4. El efecto favorable en el crecimiento observado a concentraciones mayores de la fuente de potasio y fósforo (KH2PO4) permite suponer que en los sustratos utilizados, melaza y lactosuero, alguno de estos macronutrientes resulta deficitario para el óptimo crecimiento de la levadura. De acuerdo a la caracterización realizada (Tabla 1) este macronutriente pudiera ser el fósforo.

Fig. 2 Diagramas de Pareto estandarizados a) para la biomasa, b) para el % de Triglicéridos obtenidos
Leyenda: DW, concentración de biomasa (base seca); % TAG, porcentaje de lípidos en la biomasa (base seca).
Un análisis por separado de la influencia de cada uno de los factores sobre la acumulación de lípidos, incluyendo algunas consideraciones adicionales sobre su contribución al crecimiento de la levadura, permite concluir lo siguiente:
La concentración de la fuente de carbono (Cc) influyó de forma negativa sobre la acumulación de TAG, pero muestra una tendencia (no significativa) a favorecer el crecimiento, por lo que se tomó como el primer factor a estudiar en el próximo paso de la optimización;
La concentración del extracto de levadura (YE), componente este que actúa como fuente de aminoácidos, vitaminas y minerales, influyó de forma positiva sobre la acumulación de lípidos y también favoreció el crecimiento, por lo que este parámetro se fijó en el valor máximo (1 g/L) durante la siguiente etapa de optimización;
El KH2PO4influyó de forma negativa en la acumulación de lípidos, pero su incremento parece favorecer el crecimiento. Además, debido al bajo contenido de fósforo en el lactosuero y la melaza, su adición debe considerarse como relevante para el crecimiento de la levadura, por lo que se tomó como el segundo factor a optimizar;
La concentración de carbono aportada por el lactosuero (Cc Suero) influyó de forma negativa en la acumulación de lípidos; sin embargo, su presencia resultó favorable para el crecimiento (aunque no de forma significativa). Por estas razones, en la etapa de optimización este parámetro se fijó en el valor mínimo, o sea, se decidió no adicionarlo como suplemento a los medios de cultivo.
pH: Este parámetro no influyó de forma significativa en la síntesis y acumulación de TAG, pero fue el que tuvo un efecto más pronunciado sobre el crecimiento. Aunque para el nivel de significación utilizado (95 %) no se pudo demostrar su influencia (negativa) en la concentración de biomasa, es posible suponer que en una experiencia con un mayor número de réplicas, esta influencia pudiera ser detectable. Sobre la base de estas consideraciones se tomó esta variable como el tercer factor a estudiar en el ensayo de optimización.
Los restantes factores no resultaron relevantes para el estudio, por lo que su concentración se fijó en el estudio de optimización a los valores óptimos sugeridos por el modelo de regresión obtenido para la concentración de TAG en el diseño Plackett-Burman (datos no mostrados).
Optimización del medio de cultivo para la obtención de lípidos
Con el objetivo de determinar el grado de influencia de los factores estudiados (concentraciones de la fuente de carbono y del KH2PO4 y pH) sobre la producción de lípidos y el crecimiento de la levadura, así como obtener la composición del medio de cultivo optimizado, que permita maximizar el porcentaje de lípidos acumulados en la biomasa (% TAG), se utilizó un diseño experimental Box-Behnken, evaluando tres factores en tres niveles. Los resultados obtenidos se presentan en la tabla 3.
Los medios de cultivo cuya composición favoreció la acumulación de lípidos correspondieron a las variantes 6 y 4, con acumulados de lípidos en la biomasa superiores al 50 % base seca. Ambas variantes se caracterizaron por altas concentraciones de la fuente de carbono (80 g/L) y pH con tendencia a la neutralidad (6 y 6,5). En tanto, el crecimiento de la levadura igualmente se favoreció a elevadas concentraciones de la fuente de carbono y pH ácido (5,5 y 6), destacando las variantes 2 y 6. Esta última variante favoreció las dos respuestas estudiadas.
Para lograr una mejor interpretación de los resultados se utilizaron los diagramas de Pareto estandarizados (Fig. 3). Según estos, en la acumulación de lípidos resultaron significativas la concentración de la fuente carbono, con influencia positiva; en tanto se apreció también un efecto significativo de la interacción entre las concentraciones de la fuente de carbono y la de KH2PO4 y del término cuadrático de la concentración de este último, ambos con efecto negativo. En la concentración de biomasa solo tuvo influencia significativa la componente cuadrática de la concentración de KH2PO4, la cual evidenció un efecto negativo.
Tabla 3 Concentración de biomasa (DW) y porcentaje de lípidos acumulados (% TAG) obtenidas en las variantes experimentales del diseño Box-Behnken
| Medios | Cc (g/L) | pH | KH2PO4 (g/L) | DW (mg/mL) | TAG (%) |
| 1 | 60 | 5,5 | 0,3 | 11,15 | 29,87 |
| 2 | 80 | 5,5 | 0,3 | 14,05 | 33,67 |
| 3 | 60 | 6,5 | 0,3 | 10,40 | 35,38 |
| 4 | 80 | 6,5 | 0,3 | 9,55 | 53,89 |
| 5 | 60 | 6 | 0 | 9,50 | 40,32 |
| 6 | 80 | 6 | 0 | 11,35 | 64,14 |
| 7 | 60 | 6 | 0,6 | 8,80 | 46,93 |
| 8 | 80 | 6 | 0,6 | 10,60 | 41,32 |
| 9 | 70 | 5,5 | 0 | 8,75 | 43,58 |
| 10 | 70 | 6,5 | 0 | 10,25 | 38,18 |
| 11 | 70 | 5,5 | 0,6 | 8,70 | 39,81 |
| 12 | 70 | 6,5 | 0,6 | 7,85 | 46,03 |
| 13 | 70 | 6 | 0,3 | 10,95 | 33,46 |
| 14 | 70 | 6 | 0,3 | 11,00 | 34,21 |
| 15 | 70 | 6 | 0,3 | 11,05 | 33,45 |
Los resultados de este experimento indican la existencia de un efecto complejo del KH2PO4 que requerirá de estudios posteriores. El aporte simultáneo y en cantidades equimolares de iones K+ y PO4 3-por esta sal, cuyos roles fisiológicos son muy diferentes en la célula, puede ser la causa de los efectos observados.

Fig. 3 Diagramas de Pareto estandarizados (a) para la biomasa (DW) y (b) para el porcentaje de triglicéridos en la biomasa (% TAG)
El medio de cultivo optimizado para maximizar el acumulado de lípidos en la biomasa de la levadura presentó la siguiente composición (en g/L): Cc (80); MgSO4(7H2O (0,1); CaCl2 (0,1); extracto de levadura (1); Tween 20 (0,6), relación C/N de 180 y un pH de 6,5.
Las ecuaciones de regresión (modelos de superficies de respuesta) obtenidas para la acumulación de lípidos (% TAG) y concentración de biomasa (DW), fueron:
% TAG = 396,961 - 10,7121Cc - 7,8975pH - 10,1403KH2PO4 + 0,0538667(Cc)2 + 0,7355Cc(pH - 2,4525Cc(KH2PO4 - 3,56333(pH)2 + 19,3667pH(KH2PO4 + 100,935(KH2PO4)2
DW (mg/mL) = -102,225 + 0,17375Cc + 34,45pH + 33,2917KH2PO4 + 0,0073125(Cc)2 - 0,1875Cc(pH - 0,004 166 67Cc(KH2PO4 - 1,775(pH)2 - 3,916 67pH(KH2PO4 - 18,5417(KH2PO4)2
Los modelos obtenidos predicen valores máximos de acumulación de lípidos de 65 % y de concentración de biomasa de 13 mg/mL. Estos valores son similares a los reportados en la variante número 6 (tabla 3), donde se alcanzó una acumulación de lípidos del 64,14 % y una concentración de biomasa de 11,35 mg/mL, lo que evidenció la correspondencia de los modelos con los resultados experimentales.
El uso de la melaza de caña de azúcar como fuente de carbono en el proceso de obtención de lípidos por varias cepas de levaduras oleaginosas ha sido informado por otros autores, con resultados comparables a los obtenidos en la presente investigación. Boviatsi et al.11 estudiaron esta fuente de carbono para la producción de lípidos por la cepa de levadura Rhodosporidium toruloides NRRL Y-27012. Para ello estudiaron varias estrategias de suplementación de nutrientes, las cuales incluyeron la adición de elementos traza y sales de fosfato a la melaza. Los resultados indicaron que las adiciones de dichos suplementos disminuyeron la velocidad de consumo de azúcar en el medio, lo cual se debió a que la melaza contiene estas fuentes de nutrientes. La levadura logró acumular un 61 % de lípidos cuando se utilizó un cultivo discontinuo alimentado durante 92 horas, resultado similar al valor óptimo estimado en el presente trabajo.
Kongruang et al.10 utilizaron melaza en el cultivo de varias cepas de levaduras oleaginosas (Rhodosporidium toruloides, Yarrowia lipolytica, Rhodoturola glutinis y Rhodoturola graminis). La cepa de levadura R. toruloides TISTR 5154 fue la que acumuló una mayor cantidad de lípidos (32,35%), valor inferior al encontrado en este trabajo, pero similar al obtenido por Jiru et al.24, los cuales también utilizaron melaza de caña en un medio con limitación de nitrógeno, para cultivar otra cepa de levadura (Rhodosporidium kratochvilovae SY89), la cual acumuló un 38,25 % de lípidos con una concentración de biomasa similar (13,25 mg/mL) a la obtenida en el presente trabajo. Las dos últimas investigaciones citadas no solo tuvieron como objetivo proveer información sobre la obtención de lípidos microbianos por parte de estas cepas de levaduras; en estas se obtuvo, además, el biodiesel a partir de dichos lípidos (con un rendimiento del 85,3 % en el caso de Jiru et al.24 El biodiesel obtenido fue caracterizado en ambos trabajos y se comprobó que sus propiedades y calidad eran comparables con los estándares internacionales.
Estos estudios demuestran la factibilidad de utilizar las melazas como fuente de carbono en el cultivo de levaduras oleaginosas para obtener lípidos microbianos, con el objetivo de su posterior empleo en la fabricación de biodiesel. La cepa de levadura que se utilizó en este trabajo presentó un gran potencial para dichas aplicaciones, ya que logró acumular lípidos en valores comparables a otras levaduras estudiadas. Por lo tanto, se requiere de futuras investigaciones donde se estudie el proceso de obtención de biodiesel a partir de los lípidos producidos por esta cepa de levadura.
Conclusiones
Se demostró la factibilidad del empleo de la melaza como fuente de carbono barata y disponible para la producción de lípidos por una cepa de levadura oleaginosa, no siendo así con el lactosuero. Mediante el diseño de cribado Plackett-Burman se determinó que de los nueve factores estudiados sólo cuatro tuvieron una influencia significativa sobre el porcentaje de lípidos acumulados: las concentraciones de la fuente de carbono, del extracto de levadura, del KH2PO4 y la concentración de carbono en el lactosuero. La optimización del medio de cultivo mediante la metodología de superficies en base a un diseño Box-Behnken permitió determinar la composición óptima del medio de cultivo para la producción de lípidos en esta cepa de levadura, utilizando melaza como fuente de carbono. La composición optimizada encontrada fue (en g/L): concentración de la fuente de carbono (80); MgSO4(7H2O (0,1); CaCl2 (0,1); Extracto de levadura (1); Tween 20 (0,6); con una Relación C/N de 180 y pH de 6,5. Además, las ecuaciones de regresión obtenidas predicen valores máximos de acumulación de lípidos del 65 % y de concentración de biomasa de 13 mg/mL, con lo cual se demuestra el potencial de esta cepa de levadura para futuros trabajos encaminados a la producción de biodiesel.














