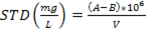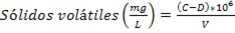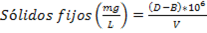Introducción
Actualmente, la fitoterapia aumenta vertiginosamente debido a la demostración científica de su beneficio terapéutico, mejor tolerancia, disponibilidad y costo reducido del tratamiento. También se ha evidenciado que la investigación basada en moléculas sintéticas no ha supuesto un incremento en el índice de producción de nuevos fármacos, lo que conlleva a que la fitoterapia siga ganando terreno no solo como tratamiento médico para curar, sino también por la expansión que la misma ha tenido en la producción de coadyuvantes y aditivos alimenticios para prevenir. Por otra parte, la Organización Mundial de la Salud ha declarado también que, debido a la pobreza y la falta de acceso a la medicina moderna, alrededor del 65-80% de la población mundial que vive en países en vías de desarrollo, depende esencialmente de las plantas para la atención primaria de salud.1,2
El control de la calidad y estandarización de los fitofármacos implican varias etapas. Sin embargo, la etapa que implica los estudios de calidad de las materias primas juega un papel fundamental para garantizar la estabilidad de las formulaciones a partir de estas. Factores como la temperatura, exposición a la luz, período y tiempo de recolección, método de recolección, secado, almacenamiento y transporte de la materia prima, la edad y órgano de la planta recolectada, etc., pueden afectar en gran medida dicha calidad y con ello, el valor terapéutico de sus formulaciones.
En el caso de extractos líquidos de plantas medicinales, entre los factores que afectan la estabilidad se encuentran el pH, la luz, la temperatura y el solvente. El pH depende en gran medida de los componentes y en el caso de extractos con alto contenido de polifenoles, los mismos pueden degradarse en medio básico. Los rayos UV promueven reacciones redox y en el caso de los flavonoides se ha reportado una ligera disminución en su contenido debido a la exposición a la luz.3 Un aumento de la temperatura acelera la cinética de las reacciones de degradación enzimática que pueden modificar la estructura de los metabolitos secundarios.
El agua como solvente polar y prótico, durante las reacciones redox, produce intermediarios de reacción polares y el electrón a transferir es capaz de solvatarse de manera muy eficiente, favoreciendo dicha reacción redox. Por otra parte, su capacidad para donar un protón le permite interaccionar con el electrón, promoviendo también la oxidación y favorecer la formación de especies reactivas de oxígeno: como el radical hidroxilo y peróxido de hidrógeno.3 La utilización del etanol como solvente mitiga esta acción y por otra parte evita la proliferación de microorganismos patógenos que invalidan el uso de la formulación.
La especie arbórea Spondias mombin L. (Anacardiaceae) (Fig. 1), llamada comúnmente ciruelo (Honduras), ciruela amarilla (México, Ecuador), jobito (Panamá), cajá (Brasil) y jobo (Costa Rica, Nicaragua, Cuba), se ha usado tradicionalmente como antiséptico, cicatrizante, antidiarreico, anticonceptivo, antimicrobiano, antihelmíntico y antinflamatoria en varios países de África, Asia y América.
Los órganos de la planta que más han sido utilizados para tales fines son la corteza, las flores, el fruto y en menor medida las hojas.4-6 Infusiones de las hojas y tallos de esta especie han sido aplicadas en Cuba para combatir la dermatofitosis sin reportar efectos colaterales asociados a su actividad.7
Se ha demostrado que la hoja de S mombin exhibe actividades in vitro e in vivo como antibacteriano 8, antiulceroso 9, antiviral 10,11, hipolipemiante 12, antiinflamatorio 13, antitumoral 14) anticonceptivo 15 y antidiabético.16 Resultados de tamizajes fitoquímicos de esta especie en algunas regiones de África y Brasil evidencian la presencia de saponinas, alcaloides, flavonoides y taninos. 8,17,18
Los flavonoides exhiben marcada actividad y capacidad antioxidante in vitro19 por lo que las formulaciones que presenten mayoritariamente esta familia de metabolitos secundarios mostrarán mayor estabilidad, ya que pueden prevenir la degradación oxidativa de otros fitocompuestos concomitantes.
Teniendo en cuenta el potencial uso terapéutico de la especie, la baja toxicidad 20) demostrada por varios modelos experimentales in vivo y considerándola como una fuente de droga activa sin explotar, el presente trabajo tiene como objetivo determinar la estabilidad de una tintura al 70% de las hojas de la especie S mombin, a temperatura ambiente, durante un periodo de un año y utilizando como parámetros de calidad determinadas propiedades físico-químicas.
Materiales y métodos
Las determinaciones experimentales fueron realizadas en los Laboratorios de Bioquímica y Tecnología Farmacéutica de la Facultad de Ciencias Naturales y Exactas, de la Universidad de Oriente en Santiago de Cuba.
Recolección y procesamiento del material vegetal
El material vegetal consistió en hojas de S. mombin procedentes del poblado “El Caney” en el municipio de Santiago de Cuba, recolectadas entre los meses de septiembre del año 2016 y junio del 2017. Sus coordenadas son longitud oeste 75°45´26” y latitud norte 20°2´39”.
La identificación botánica fue realizada por el especialista Félix Acosta Castillo y luego depositada en el Herbario del Centro Oriental de Ecosistemas y Biodiversidad (BIOECO) de la ciudad de Santiago de Cuba. La misma se cotejó con el ejemplar de herbario BSC 15 946 N.º 969, Siboney-Juticí. El material vegetal se lavó con agua destilada, luego se colocó en la estufa de secado (Boxun, China) a una temperatura de 37ºC y después de secado hasta peso constante se trituró manualmente.21
La floración de S. mombin ocurre después de las primeras lluvias que se producen posteriormente a los meses de sequía. La fructificación puede llegar hasta el mes de agosto y ya en septiembre se considera el comienzo de la etapa vegetativa, que puede extenderse hasta enero cuando ocurre la abscisión total de las hojas. Para tener en cuenta la influencia de las diferentes etapas de su ciclo de vida en los parámetros de calidad, se prepararon extractos fluidos con material vegetal colectado entre los meses de septiembre-noviembre de 2016 (crecimiento vegetativo, antes de la caída de las hojas), entre diciembre-enero del 2017 (floración, caída de las hojas) y entre mayo-junio del 2017 (Fructificación, etapa reproductiva).
Preparación de extracto total
La extracción se efectuó por maceración utilizando como menstruo etanol al 70% (preparado a partir de etanol al 96% Merck, Alemania) durante 48 horas y agitando 15 minutos dos veces al día en zaranda (Modelo THYS-2, Alemania). Por cada 50 g de material triturado se utilizaron 150 mL de menstruo.22) Posteriormente el líquido fue separado del residuo por decantación. El residuo fue escurrido y lavado con menstruo hasta completar el volumen. Luego se dejó reposar por 30 días en un recipiente color ámbar bien cerrado a temperatura ambiente y luego filtrado. La disolución fue concentrada hasta 50 mL en rotoevaporador (IKA RV Basic, Alemania) a una temperatura menor de 40oC obteniéndose un extracto total EHSm para cada muestra de droga seca, correspondiente a cada período de recolección establecida en el diseño del experimento.
Análisis químico de las principales clases de metabolitos secundarios
Se realizó tamizaje fitoquímico a cada extracto para evaluar y comparar la calidad de la droga utilizando ensayos químicos convencionales mediante reacciones colorimétricas y de precipitación en tubos de ensayo.23,24 Se utilizó la cromatografía líquida de alta resolución con detector espectrofotométrico UV-VIS (HPLC-DAD-Agilent Technologies, Eindhoven, Países Bajos) para el análisis de material liofilizado obtenido del extracto total EHSm. A partir del material liofilizado se preparó una disolución con 10 mg en 3 mL de solvente metanol: agua (50:50, v/v). Se utilizó un sistema de la serie Agilent 1200 con desgasificador, bomba cuaternaria, inyección automática (20μL), compartimento de columna termostático (26oC) y detector por arreglo de diodo (HPLC-DAD-Agilent Technologies, Eindhoven, Países Bajos). Se usó una columna de fase reversa GraceSmart C18 basada en sílice (250 × 4,6 mm, 5 µm de tamaño de partícula), utilizando como fase móvil acetonitrilo/H2O y un gradiente de 5% a 100% de acetonitrilo en 60 min. La velocidad de flujo fue de 1 mL/min. Los espectros UV fueron monitoreados en el intervalo de longitud de onda 200 a 400 nm y los cromatogramas fueron registrados a 254, 260, 270, 280 y 366 nm (Software Agilent ChemStation UV-VIS). La identificación de las principales clases de metabolitos secundarios y algunos compuestos mayoritarios se realizó, siempre que fue posible, por comparación de espectros UV y tiempos de retención reportados para extractos hidroalcohólicos de la hoja de especies del género Spondias. 18,23,25
Determinación de los parámetros de calidad
A partir de extractos totales EHSm obtenidos del material vegetal correspondiente a cada período de recolección se prepararon extractos en menstruo hidroetanólico al 70% con una relación de 1:5.
Se determinaron las propiedades físico-químicas: características organolépticas, pH, densidad relativa y sólidos totales según la Norma Ramal de Salud Pública 312 de 1992.26 La densidad fue determinada a 25oC por el método picnométrico utilizando balanza analítica (Nagema, Alemania), para la determinación del pH se utilizó un pH metro Fisher-AB150 (Cole Parmer, Singapur). Para la determinación de los sólidos totales disueltos (STD), sólidos volátiles y sólidos fijos se utilizaron las expresiones matemáticas (1-3) según la APHA.27
A = peso en g de la cápsula más el residuo de la muestra extraída de la Estufa (105oC)
B = peso en g de la cápsula vacía
C = peso en g de la cápsula más el residuo antes de la ignición (550oC)
D = peso en g de la cápsula más el residuo después de la ignición (550oC)
V = Volumen de muestra en mL
Se cuantificaron fenoles totales y flavonoides totales. Para la cuantificación de fenoles totales se empleó el método de Folin-Ciocalteu.28) El procedimiento realizado consistió en disolver los extractos en etanol al 70% en concentraciones finales entre 30 - 50 mg/mL. Luego se adicionaron en el orden indicado a 30 mL de los extractos, 2,5 mL de agua destilada y 2,5 mL del reactivo de Folin-Ciocalteu (Sigma-Aldrich, USA) y previamente preparado en agua destilada. La mezcla se agitó y luego se dejó en reposo por 5 min. A continuación, se adicionaron 10 mL de una disolución de carbonato de sodio (Merck, Alemania), al 20%; se enrasó a 50 mL con etanol al 70% (preparado a partir de etanol al 96% Merck, Alemania), se agitó para homogenizar y se dejó reposar por 30 min. Se midió la absorbancia a 700 nm. La muestra de referencia fue el ácido gálico (AG) (Sigma-Aldrich, USA, ˃ 99%), utilizando la ley de Lambert-Beer se construyó la curva de calibración en el intervalo de 10 a 60 mg/mL y se siguió el mismo procedimiento anterior. En esta curva se interpolaron las absorbancias obtenidas con cada uno de los extractos, obteniendo la concentración de fenoles totales expresada como miligramos equivalentes de ácido gálico/mL.
Para la determinación de flavonoides totales en los extractos se empleó el método espectrofotométrico con AlCl3.29 El procedimiento realizado consistió en disolver los extractos en etanol al 70% a concentraciones finales entre 10 - 50 mg/mL. Luego a 30 mL de los mismos se adicionaron 10 mL de AlCl3 (Merck, Alemania) al 10%, 10 mL CH3COONa (Merck, Alemania) 1M y se enrasó a 250 mL con agua destilada. La mezcla se agitó y luego se dejó en reposo por 30 min. Se midió la absorbancia a 430 nm. La muestra de referencia fue la quercetina (Q) (Sigma-Aldrich, USA), utilizando la ley de Lambert-Beer se construyó la curva de calibración en el intervalo de 5 a 20 mg/mL y se siguió el mismo procedimiento anterior. En esta curva se interpolaron las absorbancias obtenidas con cada uno de los extractos, obteniendo la concentración de flavonoides totales expresada como miligramos equivalentes de quercetina/mL.
Todas las determinaciones se realizaron por triplicado y los resultados fueron expresados por sus valores promedio y desviación estándar.
Estudio de estabilidad
Para el estudio de estabilidad se utilizó el extracto obtenido a partir de droga seca (1gmL-1) colectada en el mes de octubre diluyendo hasta lograr una relación droga: solvente 1:5. La misma fue envasada en un frasco de vidrio color ámbar previamente esterilizado y se almacenó a temperatura ambiente en un lugar seco, fresco y protegido de la luz, según se establece en la Norma Ramal de Salud Pública 311 de 1992.22 El estudio de estabilidad se realizó por un período de un año. Los análisis fueron realizados a 0, 7, 30. 90, 180 y 360 días.
Análisis estadístico
Los resultados obtenidos fueron expresados en medias y desviaciones estándar ±DE. Se aplicó la prueba de Kolmogórov-Smirnov para comprobar si los datos presentaban distribución normal y la prueba de Bartlett para la homogeneidad de varianzas. Se realizó un análisis de varianza (ANOVA) de clasificación simple y prueba de comparaciones múltiples de Tukey (HSD) para comparar subconjuntos homogéneos. Se consideró como significativo un p<0,05. Letras distintas para una misma fila indican diferencias estadísticamente significativas. Se utilizó el paquete estadístico Statgraphics Centurion XV para Windows versión 15.2.05.
Resultados y discusión
Composición química cualitativa
Se evidenció la presencia de alcaloides, cumarinas, flavonoides, saponinas, taninos y azucares reductores. Estos resultados (Ver tabla 1) coinciden con estudios anteriores 24) y con reportes de otros autores para extractos hidroetanólicos de las hojas de S. mombin.6,8,17,18
Tabla 1 Familias de metabolitos secundarios evaluados en el extracto hidroetanólico al 70% de las hojas de S. mombin.
| METABOLITOS | ENSAYO | RESULTADO |
|---|---|---|
| Alcaloides | Wagner | + |
| Cumarinas | Lugol | + |
| Flavonoides | Shinoda Ácido sulfúrico | + + |
| Saponinas | Espuma estable | + |
| Triterpenos y esteroides | Liebermann- Burchard Tricloroacético | - - |
| Fenoles y taninos | Cloruro de hierro III | + |
| Azucares reductores | Fehling Benedict | + + |
| Aminoácidos libres | Ninhidrina | - |
+ Presencia - Ausencia
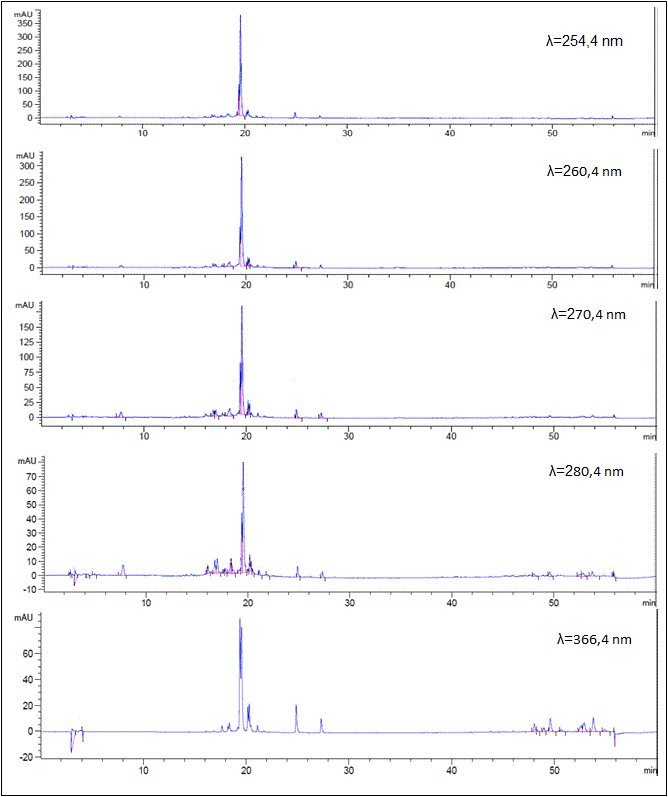
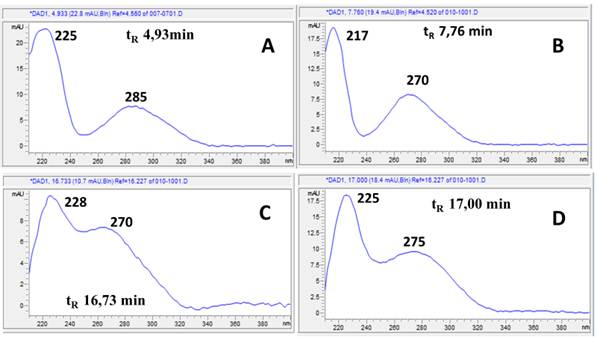
Fig. 2 Cromatogramas HPLC-DAD de extracto hidroetanólico de la hoja de S mombin. C18 (250 × 4,6 mm, 5 µm), acetonitrilo/agua), gradiente: 5-100% de acetonitrilo. Detección a: 254,4, 260,4, 270,4, 280,4 y 366,4 nm.
El análisis cromatográfico por HPLC-DAD permitió identificar los compuestos mayoritarios, teniendo en cuenta los tiempos de retención y espectros UV reportados en la literatura. La figura 2 muestra los cromatogramas registrados a diferentes longitudes de onda.
En el cromatograma registrado a λ=280,4 nm se detecta el número máximo de picos por lo que se tomó como referencia para seleccionar los picos mayoritarios, como se muestra en la tabla 2.
Tabla 2 Picos mayoritarios del extracto hidroetanólico al 70% de las hojas de S. mombin. Registro a λ=280,4 nm.
| tR (min) | % Área relativa | tR (min) | % Área relativa |
|---|---|---|---|
| 7,76 | 7,024 6 | 19,553 | 43,212 5 |
| 16,733 | 5,074 5 | 20,167 | 4.397 4 |
| 17,000 | 6,424 4 | 20,306 | 3,229 4 |
| 18,380 | 3,438 5 | 24,877 | 3,774 0 |
| 19,327 | 17,148 4 | 27,305 | 1,795 8 |
Se puede apreciar que los de mayor intensidad corresponden a los picos con tiempos de retención en 19,327 min y 19,553 min con % de áreas relativas 17,148 4 y 43,212 5, respectivamente.
Estudios realizados a extractos hidroalcohólicos de la hoja de varias especies del género Spondias en Brasil arrojó que todas, incluyendo la S mombin, presentan una composición fenólica similar, con la presencia mayoritaria de flavonoles 3-O-glicósidos sin detección de los aglicones libres, siendo la rutina uno de los principales constituyentes a excepción de la ramnetina 3-O-rutinosido, presente solamente en dos especies provenientes del bosque costero atlántico de dicho país. También se evidenció que en algunos casos prevalecían los ácidos fenólicos y en otros los flavonoles.18 Teniendo en cuenta que los ácidos fenólicos no conjugados no absorben por encima de los 300 nm es de esperar que los espectros cuyos máximos de absorción se encuentran por debajo de este valor correspondan a esta clase de metabolitos.
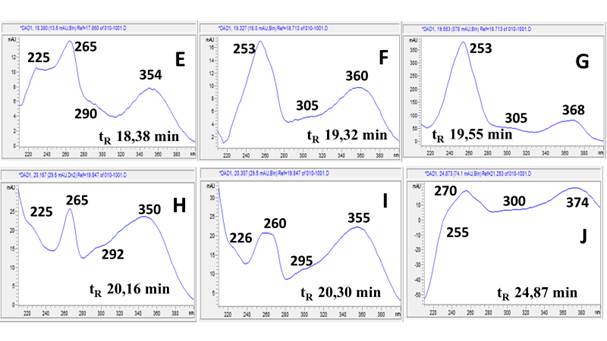
En la figura 3 se muestran los espectros UV correspondientes a los picos detectados a λ=280,4 nm y que no fueron detectados a λ=366,4 nm. Los mismos presentan perfiles de compuestos fenólicos sustituidos por grupos auxócromos; ello significa que, teniendo en cuenta sus bajos tiempos de retención en las condiciones de registro, pueden ser atribuidos al ácido gálico y sus derivados hidrolizables.
El espectro UV del ácido gálico 25) presenta solamente dos bandas de absorción: la banda β a 224 nm y banda primaria p a 272 nm correspondientes a transiciones π-π* del anillo aromático sustituido por grupos hidroxilos, los cuales producen corrimientos batocrómicos en todas las bandas del anillo bencénico β, p y α, llegando la banda primaria p a sumergir la banda secundaria bencenoide α. Es por ello se atribuye el espectro de la figura 3-D al ácido gálico y los correspondientes 3-A, 3-B y 3-C a sus derivados hidrolizables más polares, entre los cuales están 1-O-galoil-β-D-glucopiranosa, β-1,2,3,4,6-pentagaloil-O-glucopiranosa y el ácido digálico, respectivamente.10
Los picos mayoritarios que fueron detectados a la longitud de onda 366,4 nm (Fig. 4) responden a compuestos con estructuras altamente conjugadas atribuibles a flavonoles y ácidos fenólicos con extensión de la conjugación en sus transiciones π-π*.
La presencia de ácido gálico está asociada generalmente a la presencia de su dímero ácido elágico, el cual presenta bandas con máximos de absorción en 254 y 368 nm, esta última de menor intensidad 30, pudiéndose atribuirle al mismo el espectro de la figura 4-G con tiempo de retención de 19,55 min y un área relativa de 43,2% (compuesto mayoritario). Los espectros 4-E y 4-F pueden ser atribuidos a derivados conjugados del ácido elágico como ácido elágico ramnósido y ácido elágico pentósido, respectivamente.31
Por otra parte, la quercetina presenta en su espectro UV máximos de absorción en aproximadamente 256 y 370 nm 32) correspondientes a las bandas II y I respectivamente. La banda I debida a la absorción del anillo B del sistema cinamoil y la segunda a la absorción del anillo A, teniendo en cuenta la estructura nuclear de flavonoides.19 Otros autores han reportado además que la glucosilación de la quercetina provoca que la banda I tienda a desplazarse hipsocrómicamente, por ello comparando con datos de la literatura 25 y los tiempos de retención, se puede tentativamente identificar a los picos correspondientes a esta clase de metabolitos.
El pico con tR= 20,16 min (Fig. 4-H) puede atribuirse a la quercetina 3-O-rutinosido (rutina), el de tR= 20,30 min (Fig. 4-I) a la quercetina 3-O-glucopiranósido y el pico con tR= 24,87 min (Fig. 4-J) pudiera atribuirse a cualquiera de los siguientes aglicones: quercetina, isoramnetina o ramnetina ya que los mismos presentan similitud en sus espectros UV y sus tiempos de retención difieren en valores decimales en las condiciones de registro.25 Es importante destacar que la rutina ha sido utilizada como marcador fitoquímico de diferentes especies del género Spondias. Sin embargo, la presencia de la misma es controversial ya que al ser un flavonol 3-O-glucósido muy inestable puede sufrir fácilmente hidrólisis hasta dar la quercetina.32
Un estudio cuantitativo realizado por otros autores para S mombin mediante HPLC y utilizando maceración en etanol: agua, v/v 70:30 como menstruo 13, reporta la presencia mayoritaria de ácido elágico (0,048 5 mg/mL) y ácido clorogénico (0,03mg/mL). Otros estudios para la especie, pero utilizando maceración en metanol: agua, v/v 80:20, evidenció presencia de quercetina (0,236 μg/mL) y ácido elágico (4,156 μg/mL).11 Cabe destacar que independientemente de las zonas geográficas, de los factores tecnológicos que inciden en dichos resultados como tiempo de maceración, diferentes índices de polaridad de los solventes utilizados, entre otros, dicha diferencia puede deberse a la biogénesis tanto de los ácidos fenólicos como de los flavonoides que, al presentar los mismos precursores, puede generar un mecanismo de compensación para la producción de un metabolito secundario particular.33 En nuestro caso, la presencia del pico mayoritario con tiempo de retención igual a 19,553 min asignado al ácido elágico permite establecer de manera cualitativa que dicho metabolito es el que prevalece para esta especie en el hábitat de recolección de la planta.
Parámetros de calidad de los extractos en menstruo hidroalcohólico al 70 %
La estandarización de los extractos a base de drogas es de vital importancia para evaluar la calidad, seguridad y eficacia de las formulaciones en función de sus principios activos. Ya la presencia de ácidos fenólicos y flavonoides les confieren a dichos extractos una probable actividad antioxidante que permite que los mismos sean más estables para el almacenamiento a largo plazo y por tanto más fáciles de preparar y manipular.
En la tabla 3 se muestran los parámetros físico-químicos determinados a los extractos en etanol al 70 % de las hojas de Spondias mombin L. recolectadas en diferentes etapas del ciclo de vida. Las propiedades organolépticas se mantuvieron iguales en las tres etapas del ciclo de vida: transparentes sin partículas suspendidas, color verde olivo, respecto al olor y sabor prevaleció el solvente. Al no presentarse diferencias significativas mediante la prueba de comparaciones múltiples, de los parámetros físico-químicos entre las diferentes etapas del ciclo de vida de la planta para este órgano, puede inferirse que cualquier época del año resulta óptima para la recolección. Los coeficientes de variación fueron los siguientes: para el pH 4,7 %, para densidad relativa 5,0 %, para sólidos totales disueltos 3,5 %, para sólidos fijos 46,3 %, para sólidos volátiles 11,7 %, para fenoles totales 7,4 % y para flavonoides totales 10,5%; estos resultados sugieren, en este estudio, no tener en cuenta al parámetro de sólidos fijos como posible índice de control.
Tabla 3 Caracterización físico-química de los extractos en etanol al 70% de las hojas de Spondias mombin L. recolectadas en diferentes etapas del ciclo de vida. Los resultados fueron expresados como 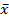 ±DE.
±DE.
| Parámetro | Etapa del ciclo de vida | ||||
| Crecimiento vegetativo (Previo a la caída de las hojas) | Floración (Caída de las hojas) | Fructificación | Intervalo de confianza | ||
| Límite inferior | Límite superior | ||||
| pH | 6,13±0,42a | 5,90±0,1a | 6,03±0,31a | 5,73 | 6,31 |
| Densidad relativa (gmL-1) | 0,890 8±0,047 4a | 0,870 5±0,039 6a | 0,9029±0,056 9a | 0,847 4 | 0,928 7 |
| Sólidos Totales Disueltos (mgL-1) | 37,06±0,85a | 36,57±1,72a | 35,74±1,21a | 34,79 | 38,12 |
| Sólidos Fijos (mgL-1) | 1,94±0,75a | 2,05±0,27a | 3,00±1,73a | 0,88 | 3,77 |
| Sólidos volátiles (mgL-1) | 2,78±0,43a | 2,71±0,36a | 3,10±0,11a | 2,35 | 3,38 |
| Fenoles Totales (mgmL-1) | 4,56±0,36a | 4,38±0,49a | 4,72±0,02a | 4,14 | 4,97 |
| Flavonoides Totales (mgmL-1) | 0,20±0,03a | 0,23±0,02a | 0,21±0,00a | 0,18 | 0,25 |
Las mediciones se realizaron por triplicado y los resultados se expresaron como 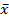 ±DE. Letras distintas indican diferencias estadísticamente significativas para cada parámetro en las diferentes etapas del ciclo de vida de la planta. (ANOVA, Tukey, p<0,05).
±DE. Letras distintas indican diferencias estadísticamente significativas para cada parámetro en las diferentes etapas del ciclo de vida de la planta. (ANOVA, Tukey, p<0,05).
Los sólidos totales disueltos evidenciaron la constancia de grandes cantidades de compuestos polares extraíbles en etanol al 70 %, lo que constituye un valor agregado a la calidad de la materia prima durante todo el año.
La composición total fenólica para S mombin ha sido reportada por otros autores utilizando técnicas de extracción diferentes a la maceración, como la extracción en Soxhlet 34) utilizando como menstruo etanol: agua, obteniéndose un contenido de fenoles totales de 33,74 mg/mL; en nuestro caso se obtuvo un promedio de 4,55 mg/mL, cuyo menor valor está justificado por la menor extracción de metabolitos cuando se utiliza la maceración.
Estabilidad
S mombin es una especie caducifolia, donde la formación de primordios foliares ocurre en el mes de mayo alcanzando la total madurez en el periodo de septiembre - noviembre; la misma permanece con follaje hasta diciembre, tiempo en que se inicia la completa abscisión de la hoja.35 Ello condujo a que se planificara el estudio de estabilidad con la formulación preparada a partir de la droga seca del mes de octubre correspondiente a la etapa de crecimiento vegetativo previo a la caída de las hojas; sin embargo, los resultados obtenidos mostraron para los parámetros de calidad en las diferentes etapas de su ciclo de vida, que no existen diferencias significativas.
En la Tabla 4 se muestran los resultados obtenidos del estudio de estabilidad del extracto en tiempo real durante un año a temperatura ambiente (zona climática IV). La prueba de comparaciones múltiples no mostró diferencias significativas en los valores de densidad relativa poniendo de manifiesto la constancia en la relación masa/volumen del extracto.
Tanto el pH como los sólidos totales disueltos mostraron diferencias significativas. El pH aumentó a partir de los 30 días, sin embargo, se mantuvo en el rango de ligeramente ácido durante todo el año, indicador de un bajo grado de degradación de los componentes fenólicos, aunque no se descarta la hidrólisis ácida de los glicones presentes, aspecto que no debe interferir en la calidad del extracto.
Tabla 4 Estudio de estabilidad en tiempo real durante un año del extracto en etanol al 70% de las hojas de S. Mombin
| Parámetros de calidad | Mediciones en días | |||||
| 0 | 7 | 30 | 90 | 180 | 360 | |
| pH | 6,00±0,01a | 6,07±0,03b | 6,10±0,00b | 6,61±0,01c | 6,10±0,00b | 6,10±0,01b |
| Densidad relativa (gmL-1) | 0,943±0,006a | 0,937±0,015a | 0,953±0,015a | 0,953±0,015a | 0,949±0,006a | 0,947±0,006a |
| Sólidos Totales Disueltos (mgL-1) | 37,39±0,01a | 37,11±0,01b | 37,12±0,02b | 37,70±0,01c | 37,10±0,00b | 37,46±0,01d |
Las mediciones se realizaron por triplicado y los resultados se expresaron como 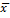 ±DE. Letras distintas indican diferencias estadísticamente significativas para cada parámetro en los diferentes periodos de tiempo medidos en días. (ANOVA, Tukey, p<0,05).
±DE. Letras distintas indican diferencias estadísticamente significativas para cada parámetro en los diferentes periodos de tiempo medidos en días. (ANOVA, Tukey, p<0,05).
Estudios sobre la influencia del pH en la respuesta electroquímica de polifenoles e hidroquinonas ponen de manifiesto que a partir de valores de pH básicos es que pueden ocurrir reacciones de degradación de los mismos como, por ejemplo, la quercetina, que puede degradar hasta formar el ácido 3,4-dihidroxibenzoico.36 Es de notar como hasta los 180 días existe una dinámica similar para el pH y los sólidos totales disueltos los cuales pueden estar correlacionados si tenemos en cuenta los diferentes procesos de equilibrio de disociación iónica que pueden estar ocurriendo. Por otra parte, la matriz que está conformada por compuestos polares, dígase ácidos fenólicos, azúcares, flavonoles, entre otros y los solventes etanol y agua, puede involucrar la formación de complejos moleculares a través de puentes de hidrógeno intermoleculares tanto soluto-soluto como soluto-solvente con la consiguiente formación de entidades poliméricas hidrosolubles. Teniendo en cuenta la constancia de la densidad, la inexistencia de partículas suspendidas, el mantenimiento del pH a valores ligeramente ácidos, se puede aseverar que la formulación en estudio fue estable durante un año.
Conclusiones
Los parámetros físico-químicos evaluados permitieron establecer algunos indicadores de calidad para el extracto de las hojas de S mombin en vehículo hidroetanólico al 70%, los cuales, hasta nuestro conocimiento, no han sido reportados en la bibliografía consultada. Los datos del estudio de estabilidad obtenidos permiten asegurar comportamiento estable de la formulación durante un año, desde un punto de vista físico-químico.