Introducción
La enfermedad de Alzheimer (EA) es un trastorno neurodegerativo del cerebro con síntomas que incluyen demencia, déficits cognitivos y deterioro de la memoria con una alta incidencia entre los ancianos.1
Su diagnóstico precoz requiere mejoras para maximizar la eficacia de las posibles terapias en las etapas tempranas de progresión de la enfermedad y en la eficiencia de los ensayos clínicos de fármacos terapéuticos.2 El primer paso hacia su diagnóstico temprano in vivo es el desarrollo de sondas de imágenes moleculares, dirigidos a las placas seniles como marcadores de EA.3 Varios agentes aglutinantes específicos de Aβ, que son derivados de naftaleno, benzotiazol, estilbeno u otros derivados heterocíclicos relacionados, que contienen un grupo donador de electrones en uno de los anillos aromáticos, son candidatos útiles.
En los últimos años, las tecnologías de imagenología molecular, como la tomografía por emisión de positrones (PET), la tomografía computarizada por emisión de fotón único y la resonancia magnética (MRI), se han utilizado ampliamente para el diagnóstico precoz de enfermedad. Por lo tanto, el diseño de sondas de imágenes moleculares para placas de β-amiloide en el cerebro ha atraído cada vez más la atención de los investigadores.4,5
La resonancia magnética es actualmente una de las herramientas de diagnóstico más poderosas de las ciencias médicas; ha sido la herramienta preferida para obtener imágenes del cerebro y el sistema nervioso central, para evaluar la función cardíaca y para detectar tumores. Hasta la fecha, varios grupos han trabajado en la obtención de imágenes de β-amiloide in vivo. Su identificación mediante resonancia magnética mostró baja sensibilidad y se necesita el desarrollo de agentes de contraste que mejoren, especialmente, las señales de amiloide.6,7
La mayoría de los agentes de contraste para MRI actualmente disponibles son complejos paramagnéticos, generalmente quelato de gadolinio (Gd3 +). Entre ellos, el Gd-DTPA ha sido el más utilizado.8 Nanopartículas (NPs) de MnO modificadas con polietilenglicol han mostrado ser muy útiles y no tóxicas, no obstante, solo se aplican en animales debido a la toxicidad ion Mn2+ libre en el organismo.9
Las nanopartículas magnéticas de óxido de hierro se han utilizado ampliamente como agentes de contraste de resonancia magnética debido a su baja toxicidad, alta biocompatibilidad y su capacidad para acortar los tiempos de relajación T2.10,11 El desarrollo de nanopartículas magnéticas (MNP) con grupos funcionales llamados inteligentes, ha venido ganando terreno en los últimos años.12,14
En este artículo se reporta la síntesis y caracterización de nanopartículas de óxido de hierro funcionalizadas con dos derivados de naftaleno que han exhibido una alta afinidad por las placas de β-amiloide.
Materiales y métodos
Reactivos y disolventes
Los reactivos y disolventes utilizados fueron puros para síntesis. El polietilenglicol (PEG, 300 Da) y polietilenglicol-dicarboxílico (HCOOPEGCOOH, 600 Da) fueron suministrados por la firma Sigma-Aldrich. La N1-etil-N3-(3-imetilaminopropil)carbodiimida (EDC), N-hidroxibenzotriazol (HOBTz) y [Fe(acac)3] fueron adquiridos a través de la Merck, al igual que los disolventes dimetisulfóxido (DMSO) y dimetilformamida (DMF). La DMF, se secó mediante destilación en presencia de benceno (mezcla v/v, 10:1) y se guardó sobre tamices moleculares activados de 4 Å. Los siguientes derivados de Amylovis® : N-[4-(1-naftilamino)-4-oxobutanoil]-β-alanina (Amylovis®-1 ) N1-(2-aminoetil)-N4-(1-naftil)succinimida (Amylovis®-2) fueron facilitados por el Departamento de Neuroquímica del Centro de Neurociencias de Cuba. Las nanopartículas comerciales empleadas son de la firma CANdot® (5 µM, CANdot® Series M aqua, CAN GmbH - Hamburg).
Síntesis de nanopartículas magnéticas de óxido de hierro y conjugación a moléculas de Amylovis®
Nanopartículas comerciales (IONP-1) conjugadas con la N-[4-(1-naftilamino)-4-oxobutanoil]-β-alanina (Amylovis®-1) (IONP-2)
En un balón de 50 mL se añadió Amylovis®-1 (10 mg; 31,8 µmol) disuelta en DMF (1 mL). A la mezcla de reacción se añadió HOBTz (4,7 mg; 35 µmol), previamente disuelta en DMF (500 µL). Posteriormente se adicionó EDC (8,2 mg; 52,4 µmol) disuelto en DMF (500 µL). La mezcla de reacción se continuó agitando y al cabo de media hora se añadieron 200 µL de suspensión coloidal de las nanopartículas comerciales (IONP-1) dispersas en agua. La mezcla se dejó agitando a temperatura ambiente por 48 h y se siguió la reacción por cromatografía de capa delgada (CCD). El producto se separó magnéticamente, se lavó con DMF (2 · 250 µL) y con agua (2 · 250 µL). A los lavados se les realizó CCD (B) para confirmar que no quedaba reactivo de partida. Después del último lavado, las partículas se secaron en una pistola de P2O5 al vacío por un día. Se obtuvo 3,5 mg del producto y se dispersó este en 1 mL de DMSO y en estas condiciones se almacenaron a temperatura ambiente. Masa del producto obtenido: 3,5 mg. FT-IR {( (cm-1); asignación}: 1643 (amida I), 1527 cm-1 (amida II), 1100 ((C-O-C), 575 ((Fe-O). DLS: Diámetro promedio: 810 nm, PI: 0,497.
Síntesis de nanopartículas de óxido de hierro recubiertas con HCOO-PEG-COOH (IONP-3)
La reacción se llevó a cabo en atmósfera de Ar en un balón de 50 mL, donde se mezclan con agitación constante, 10 mL de PEG (300 g/mol) y 0,4 g de HCOO-PEG-COOH (600 g/mol), hasta disolver este último a temperatura ambiente.
En un balón de 50 mL se mezclaron con agitación constante, 10 mL de PEG (300 g/mol) y 0,4 g de HCOO-PEG-COOH (600 g/mol), hasta disolver este último a temperatura ambiente. La reacción se llevó a cabo en atmósfera de Ar. Con posterioridad, se añade [Fe(acac)3] (0,18 g, 0,51 mmol) en 2,5 mL PEG. La temperatura del sistema se eleva a 160 y se mantiene durante 30 min. Después, se eleva la temperatura a 220 y la reacción se mantiene con agitación vigorosa y atmósfera inerte por 2 h. Al cabo de ese tiempo se deja enfriar la mezcla de reacción a temperatura ambiente y luego a -20 °C durante 24 h. Luego, la mezcla se deja que alcance temperatura ambiente y se añade éter, raspando las paredes y agitando hasta obtener una dispersión homogénea y la aparición de dos fases. La mezcla se enfría nuevamente a -20 °C, durante 30 min y se repite el procedimiento anterior. Finalmente, la mezcla se deja a temperatura ambiente y se divide en dos fracciones. A una de ellas se le añade etanol. Las partículas se separan por centrifugación a 10 000 rpm, y se secan en una pistola de secado con pentóxido de fósforo al vacío por un día. Masa del producto obtenido: 200 mg. FT-IR {( (cm-1); asignación}: 3271 ((OH), 2866 ((CHsp3), 1571 ((as COO), 1408 ((s COO), 1327, 1259, 1080 ((C-O), 644 y 581 ((Fe-O). DLS: Diámetro promedio: 76 nm, PI = 0,457.
Conjugación de IONP-3 a la N1-(2-aminoetil)-N4-(1-naftil)succinimida (Amylovis-2). (IONP-4).
En un balón de 50 mL se añadieron 200 µL (IONP-3), dispersas en DMF (1 mL), y la suspensión se enfrió en un baño de hielo. A la mezcla se añadió una disolución de HOBTz (4,7 mg, 35 µmol), en DMF (500 µL) y a continuación una disolución de 1-etil-3-(3-dimetilamino) propilcarbodiimida (EDC, 8,2 mg, 52,4 µmol) en DMF (500 µL). La mezcla de reacción se agitó y al cabo de 30 min se añadió 3 (10 mg, 35 µmol), disueltos en DMF (500 µL). La mezcla se agitó a temperatura ambiente por 48 h. Finalmente, las nanopartículas conjugadas (NP-3) se separaron magnéticamente, se lavaron con DMF (2 · 250 µL) y con posterioridad con agua (2 · 250 µL). Las NPs se secaron en una pistola de secado con P2O5 al vacío por un día. Las partículas se dispersaron en DMSO (4 mL), y de esta forma se almacenaron a temperatura ambiente. Masa del producto obtenido: 40 mg. FT-IR {( (cm-1); asignación}: 3445((NH), 1592 ((as OCO), 1397 ((s OCO), 620 ((Fe-O) DLS: Diámetro promedio: 944 nm, PI = 0,12.
Equipos empleados en la caracterización de las nanopartículas
Espectroscopía Infrarroja (FT-IR)
Los espectros infrarrojos se registraron en un equipo ATI Mattson Genesis Serie FTIR con transformada de Fourier (FTIR) en el intervalo de 4 000 a 400 cm-1. Se tomaron 35 barridos por cada muestra, preparadas en pastillas de bromuro de potasio a temperatura ambiente.
Espectrometría de dispersión dinámica de la luz (DLS)
Los perfiles de DLS se obtuvieron en un espectrómetro Delsa Nano C de la firma Beckman Coulter. Las mediciones se realizaron a un ángulo de 179o, y permitieron determinar las distribuciones de tamaño de las dispersiones coloidales de las nanopartículas estudiadas.
Microscopia electrónica de barrido (SEM)
Las partículas de sólido se depositaron sobre una cinta adhesiva de carbón conductor y se visualizaron directamente sin necesidad de ser recubiertas con oro. Las imágenes de SEM se registraron en un microscopio electrónico de barrido con filamento de emisión de campo (FE-SEM), marca FEI modelo NOVA NANOSEM 230. Dicho equipo, tiene acoplado un sistema de microanálisis por dispersión de energía de rayos X de la marca EDAX modelo Ametek, que permite realizar un análisis semicuantitativo de la composición elemental de las muestras. Además, el equipo posee un software específico que permite obtener un mapa de composición en un área definida de la muestra.
Análisis térmico
Los termogramas simultáneos de Análisis Térmico Diferencial (DTA) y Termogravimetría (TG), se obtuvieron en un equipo de la marca NETZSCH, modelo STA 449 F3. Los barridos se realizaron en un intervalo de temperatura de 24-1 000 oC bajo atmósfera de aire, con una velocidad de calentamiento de 10.0 oC /min. Los datos de las curvas correspondientes al DTA, DTG y al TG se convirtieron en termogramas continuos con el empleo del programa “Proteus” para el procesamiento de datos de Análisis Térmico, en su versión 5.2.1/07.04.2001. Este programa es suministrado por el fabricante del equipo, compatible a su vez con Windows para Office. El error del análisis cuantitativo TG que se reporta es del ± 2,00 %.
Resultados y discusión
Las nanopartículas magnéticas comerciales de hierro (CANdots®, serie M, CAN GmbH, Alemania) (IONP-1), con propiedades superparamagnéticas, se obtienen a través de un procedimiento de intercambio de ligandos, en el cual se utiliza un reactor de flujo continuo para obtener NPs altamente monodispersas.15 De acuerdo con la ficha del fabricante, estas NPM son homogéneas, presentan una forma esférica con una distribución de tamaño estrecha (<10 %), de diámetro de alrededor de 40 nm y un radio hidrodinámico de 50 nm. Son estables en agua por tres meses, y su concentración de hierro es de 5 μM. Estas NPs fueron utilizadas como modelo para valorar la posibilidad de conjugación de los Amylovis® a sistemas magnéticos nanoestructurados. La presencia en las ION-1 (Candots®) de un grupo amino libre determinó la selección del N-(4-(1-naftilamino)-4-oxobutanoil(-β-alanina (Amylovis®-1), el cual posee un grupo carboxilo libre. La conjugación se llevó a cabo mediante el método de la carbodiimida, dando lugar a un enlace amida.
En la figura 1 se representa el procedimiento general de síntesis de las IONP-1 funcionalizada con Amylovis®-1 (IONP-2).
En la figura 2 se presentan los espectros FT-IR de las nanopartículas comerciales (IONP-1), la Amylovis®-1 y de IONP-2. En el espectro de FT-IR, correspondiente al Amylovis®-1 (figura 2a), se distinguen las señales a 3 320 y 3 250 cm-1, las cuales corresponden a la vibración de valencia NH de los grupos amidas ((CONH) y al OH ((OH) presente en el grupo carboxílico. Las señales, poco intensas a 3 015 y 2 940 cm-1, pertenecen a las vibraciones de valencia νCsp2-H y νCsp3-H, respectivamente. A 1 710 cm-1 se observa una señal de intensidad media asignable a la vibración de valencia del enlace carbonilo (νCO). Dos señales intensas a 1 643 y 1 527 cm-1 son típicas de vibraciones de valencia tipo banda amida I ((CO) y banda amida II ((HNCO + δNH). En el espectro se observan las frecuencias de vibraciones correspondientes al anillo naftilo entre 1 436-1 159cm-1, conocidas como huella de la molécula.
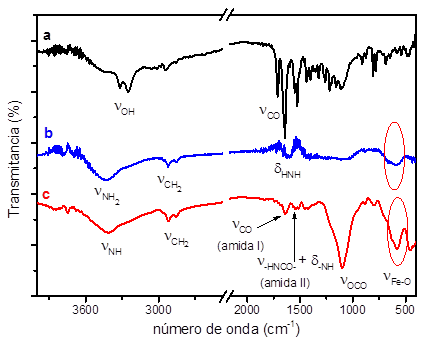
Fig. 2 Espectros FT-IR de N-(4-(1-naftilamino)-4-oxobutanoil(-β-alanina (Amylovis®-1) (a), IONP-1 (b), y IONPs-2 (c)
En el espectro (figura 2b) aparece un conjunto de bandas características de las nanopartículas magnéticas comerciales, que sugieren que se encuentran recubiertas con un derivado pegilado aminado. A 3 440 cm-1 se observa la banda correspondiente a la vibración de valencia del grupo NH2 primario ((NH). A 2 920 y 2 850 cm-1 aparecen las vibraciones de valencia (as (CH) y (s (CH) de los CH2, de la cadena carbonada del ligando PEG aminado. A 1 568, 1 440 y a 1 070 cm-1 se observan señales que revelan la presencia de vibraciones del tipo δHNH, característico en aminas primarias, de δCH2 y de (CN, respectivamente. Finalmente, alrededor de 575 cm-1 aparece una banda poco resuelta asignable a la vibración de valencia Fe-O.
En el espectro FT-IR de las IONP-2 (figura 2c), aparecen las señales que corroboran el acoplamiento del grupo carboxilo terminal de la Amylovis®-1 con el grupo amino terminal de las nanopartículas magnéticas comerciales. Las bandas de vibración de valencia del Amylovis®-1 (figura 1a), a 3 248 cm-1 (OH y a 1 710 cm-1 (CO, desaparecen, confirmando que el grupo carboxilo libre del Amylovis®-1 reacciona, dando lugar a un enlace amida bandas de vibración (amida I y II, νNH y (HNCO + δNH a 1 635 cm-1 y 1 550 cm-1 (figura 1c). La banda que aparece a 1 010 cm-1 se atribuye a la vibración de valencia (OCO del derivado aminado del polietilenglicol. Finalmente se observa a 585 cm-1 la banda de valencia correspondiente a la vibración de valencia (Fe-O.
Caracterización mediante DLS y SEM
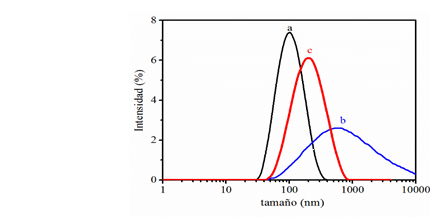
Con el objetivo de realizar un estudio comparativo entre el tamaño de las nanopartículas magnéticas comerciales y las IONP-2, se determinó el diámetro hidrodinámico por DLS de ambos compuestos. En la figura 3 se observan los perfiles de DLS de las nanopartículas comerciales (IONP-1) y de IONP-2 antes y después de filtradas a través de un filtro de 450 nm.
El diámetro hidrodinámico en las nanopartículas comerciales resultó ser 95 nm con un índice de polidispersión de un 15 %. Estos valores son mayores que los reportados por el fabricante, lo que indica una tendencia a la agregación en el tiempo de estas nanopartículas.
En el caso de las IONP-2, el diámetro hidrodinámico resultó ser de 820 nm, con un índice de polidispersión del 49 %. Al filtrar dichas nanopartículas a través de un filtro de 450 nm, el diámetro hidrodinámico disminuyó a 173 nm con un índice de 24 %. Una vez filtradas las IONP-2 pudieran ser utilizadas para futuros ensayos preclínicos, pues su diámetro hidrodinámico es inferior a 200 nm y, por tanto, pudieran ser capaces de atravesar la barrera hematoencefálica (BHE).
Estudios posteriores deberán realizarse con el objetivo de valorar la estabilidad en el tiempo de las IONP-2 filtradas. Los registros de los perfiles de DLS en un intervalo de 2 min no mostraron cambios apreciables en los diámetros hidrodinámicos (176, 173 y 179 nm); mientras que el índice de polidispersión se mantiene constante. Amylovis®-1 presenta una cadena amidoalquílica con un grupo naftilo, que pudiera provocar impedimentos estéricos, evitando que ocurran interacciones entre partículas vecinas.
La morfología de IONP-2 se estudió a través de Microscopia Electrónica de Barrido. Las IONP-2 filtradas, muestran una morfología cuasi esféricas (figura 4), observándose que existen aglomeraciones en diversas regiones de la muestra, lo que se pudiera correlacionar con los resultados de DLS.
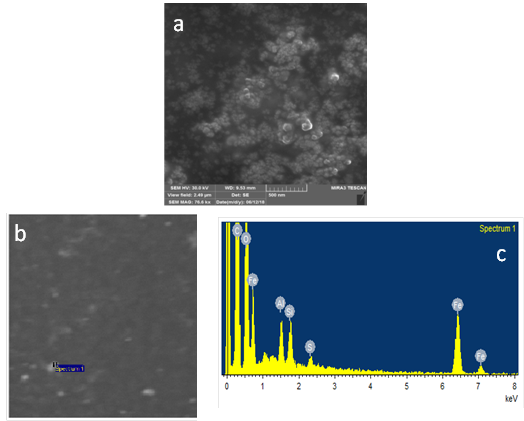
Fig. 4 Imagen obtenida por Micrografía Electrónica de Barrido (SEM) de las IONP-2 filtradas (a), mapeado (b) y espectro EDX correspondiente IONP-2 filtradas (c)
La composición elemental de las IONP-2 filtradas se determinó mediante el espectro EDX. Este espectro, se obtuvo a través de un mapeado de la localización de los elementos más significativos, en zonas de la imagen donde existe una población elevada de partículas (figura 3c). En este espectro se confirma la presencia de hierro (8,66 %), oxígeno (27,84 %), carbono (61,85 %), lo cual indica la presencia de nanopartículas de óxido de hierro. El elevado porcentaje de carbono con respecto a los otros elementos se debe a la cinta adhesiva utilizada para depositar las muestras. La presencia de aluminio (0,71 %) y azufre (0,70 %) puede deberse a contaminación del porta-muestra.
Síntesis de nanopartículas de óxido de hierro recubiertas con HCOO-PEG-COOH (IONP-3) y conjugación a N1-(2-aminoetil)-N4-(1-naftil) succinimida (Amylovis®-2) (IONP-4)
Tomando como base la metodología de conjugación del derivado Amylovis®-1 con las nanopartículas magnéticas comerciales, se desarrolló un procedimiento de síntesis de IONPs que permitiera extender el mismo a otro tipo de molécula de Amylovis®.
Las nanopartículas de magnetita fueron sintetizadas mediante el método del poliol.16 Para ello se utilizó una sal de hiero(III) y HCOO-PEG-COOH, en presencia de polietilenglicol (PEG), que actúa como disolvente y agente reductor moderado (figura 5).

Fig. 5 Procedimiento general para la obtención de IONP-3 y posterior conjugación a Amylovis®-2 con formación de IONP-4
Las NPs que se obtienen en esta reacción, recubiertas con HCOO-PEG-COOH, poseen grupos carboxilos libres que garantizan la conjugación con el derivado de Amylovis®. Luego de purificar las NPs, se realizó la caracterización estructural mediante la técnica FT-IR (figura 6). Estas NPs modificadas con el polietilenglicol dicarboxilado, HOOC-PEG-COOH, se conjugaron Amylovis(-2 mediante la reacción de Steglich (método de la carbodiimida) (figura 5). A partir de este procedimiento se obtuvieron las IONPs-4.
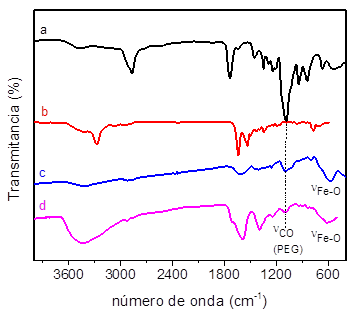
Fig. 6 Espectros FT-IR del HOOC-PEG-COOH (600, comercial) (a), y N1-(2-aminoetil)-N4-(1-naftil)succinimida (Amylovis(- 2) (b), IONPs-3 (c), IONPs-4 (d)
En el espectro de HOOC-PEG-COOH (figura 6a) se observa una banda alrededor de 3 500 cm-1 que corresponde a la vibración de valencia (-OH y a 2 890 cm-1 la de los grupos CH2 ((-Csp3-H). La señal intensa y estrecha a 1 740 cm-1 se atribuye al enlace C=O ((C=O), y la de 1 150 cm-1 a las vibraciones del enlace -OCO- ((OCO).
En el espectro FT-IR de IONP-3 (figura 6c) se observa a 588 cm-1 la banda típica del enlace Fe-O de la magnetita. También aparece una señal ancha a 3 275 cm-1 que corresponde a la vibración de valencia del grupo -COOH ((-OH) y otra a 1 100 cm-1, perteneciente al -OCO- del PEG ((OCO). Esto confirma la presencia del ligando PEG en la molécula. A 2 866 cm-1 se observan las vibraciones de valencia de los grupos CH2 ((Csp3-H). Además, en el espectro no aparece la banda típica a 1 740 cm-1 de los grupos carboxilos libres del HOOC-PEG-COOH que evidencia que encuentran recubriendo los núcleos de magnetita. También se definen dos bandas a 1 571 y 1 408 cm-1 que corresponden a las vibraciones de valencia del grupo carboxilato, ((COO), antisimétrica y simétrica, respectivamente.
De acuerdo con Nakamoto y col., la diferencia de los valores de las frecuencias de las bandas asignadas a las vibraciones de tensión del grupo carboxilato (Δ = [(as COO- - ( s COO-]), permite deducir el modo en que el ligando se coordina al metal.17 En este caso, el Δ =[(as COO - - ( s COO -] es igual a 163 cm-1, por lo que la coordinación del HOOC-PEG-COOH con la NPs es del tipo puente.
En el caso del espectro FT-IR de la IONP-4 se observa una banda ancha e intensa a 3 427 cm-1 que se corresponde con la vibración de valencia del enlace NH de las amidas secundarias. Las bandas antisimétrica y simétrica ((COO-1 593 y 1 398 cm-1, respectivamente; y la diferencia entre ellas de 195 cm-1 sugiere, que el tipo de coordinación de la capa de recubrimiento con el núcleo se mantiene de tipo puente. Por último se observa una banda poco intensa alrededor de 620 cm-1, asignable a la banda de valencia (Fe-O.
Análisis termogravimétrico
En la figura 7 se observan los termogramas correspondientes al análisis termogravimétrico (TG), el análisis térmico diferencial (ATD), así como la derivada del análisis termogravimétrico (TGD) de las IONPs-3.
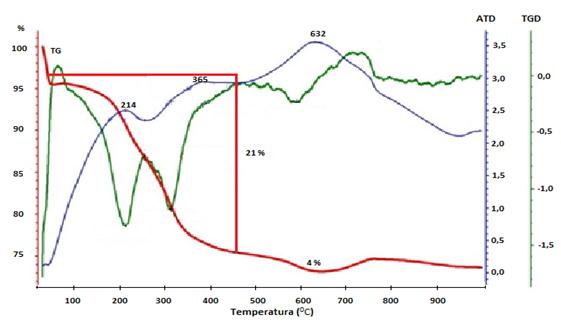
Fig. 7 Curvas de TG (línea roja), DTG (línea verde) y ATD (línea violeta) de las IONPs-3 sometidas a un tratamiento térmico desde temperatura ambiente hasta 1 000 ºC bajo un flujo de Ar
La curva del TG se caracteriza por la existencia de una primera etapa donde ocurre una disminución de masa de aproximadamente de un 5 %, que corresponde a la humedad de la muestra. Luego se produce una pérdida de un 21 % de la masa, entre los 125 y los 460 0C, con dos máximos en la curva de ATD a 214 y 365 0C. Al observar la curva DTG hay dos máximos que pudieran estar indicando que al menos dos reacciones están ocurriendo simultáneamente, coincidiendo uno de esos máximos con el hombro que se observa en la curva ATD (aproximadamente a 300 oC), relacionados estos con los procesos de descomposición de la materia orgánica, catalizados por la presencia de magnetita.18 También ocurre la desorción de la materia orgánica de la superficie de las NPs. Una tercera pérdida de un 4 % en peso se registra a partir de los 591 0C, donde se observa un proceso endotérmico en la curva de ATD con un máximo en los 632 0C. A 675 0C se observa una ganancia de peso, que corresponde a la transición de fase cristalina de la magnetita a maghemita originada por la oxidación, con la obtención finalmente de la hematita que es la fase cristalina más estable termodinámicamente.19
Caracterización mediante DLS y SEM
La morfología de las IONPs-3 y del producto de la posterior conjugación al Amylovis(- 2 (IONP-4) se determinó a través de la Microscopia SEM (figura 8). En la imagen de la figura 8a se observa la forma cuasi esférica que presentan las partículas de IONP-3, así como su alto grado de aglomeración.
En el espectro EDX de las IONPs-3, correspondiente al mapeado de la micrografía SEM (figura 8a) se confirma la presencia de los elementos hierro (6,1 %), oxígeno (21,33 %) y carbono (72,57 %), lo que se corresponde con la composición de las NPs de óxido de hierro sintetizadas.
A diferencia de las micrografías SEM de las IONPs-3, en las de las IONPs-4 después de filtradas (figura 8b) no es posible definir la forma de las partículas, aunque se evidencian de igual manera que se encuentran formando aglomerados.
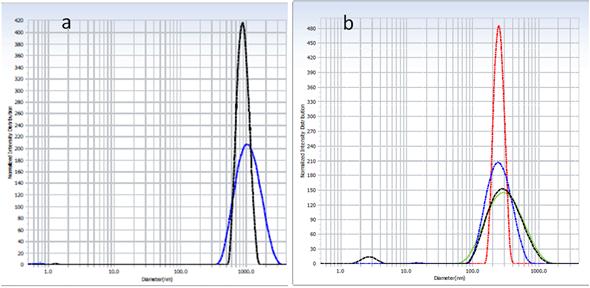
En la figura 9 se observan los perfiles de DLS correspondientes a las IONPs-PEG-COOH-Amylovis(-2, antes y después de filtrar a través de un filtro de 450 nm.
Estas mediciones del diámetro hidrodinámico revelaron que inicialmente las NPS tienen 900 nm, con un índice de polidispersión de un 12 %. Después de someterlas al proceso de filtración, los diámetros disminuyen a 262 nm con un 23 % de índice de polidispersión. La estabilidad de las IONP-4 después de filtradas se evaluó a través de mediciones por DLS, a intervalos de 2 min. Se efectuaron tres mediciones y los diámetros hidrodinámicos fueron de 275, 265 y 271 nm (figura 9b).
De acuerdo con estos resultados, no existe variación en los valores de los diámetros hidrodinámicos de las IONPs-4 filtradas, por lo que se puede plantear que el sistema presenta una estabilidad en DMSO en el tiempo de estudio. Esto pudiera explicarse debido a que, al conjugarse con Amylovis(-2, en las NPs existe una menor interacción entre partículas vecinas, por el impedimento estérico que ocasionan los grupos naftilos, sustituidos por una cadena amidoalquílica, los cuales se presentan en la capa más externa de la nanoestructura.
Por otro lado, la presencia de los grupos naftilo constituye una limitante a la dispersabilidad de estas nanopartículas en agua, por lo que investigaciones futuras deben estar dirigidas a controlar el grado de conjugación de Amylovis( en la superficie de las nanopartículas, indispensables para el reconocimiento de las placas ( amiloides.
Conclusiones
Se lograron conjugar dos Amylovis( a nanopartículas de óxido de hierro recubiertas con derivados de PEG aminados y carboxilados mediante la reacción de Steglich. Las nanopartículas conjugadas fueron caracterizadas mediante las técnicas FT-IR, TGA y SEM acoplado a EDX. Las dispersiones acuosas de las nanopartículas IONP-2 y IONP-3 presentan una morfología cuasi esférica. Las IONPs conjugadas a Amylovis(-1 y Amylovis(-2 presentaron, después de filtradas, diámetros hidrodinámicos de 173 nm y 262 nm, respectivamente, con un índice de polidispersión alrededor del 20 %.