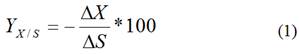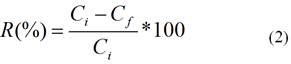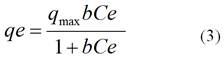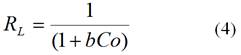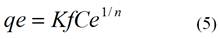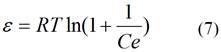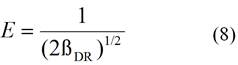Introducción
La contaminación ambiental es un problema mundial que ha atraído la atención de varios sectores de la sociedad, los cuales han realizado diversos esfuerzos para tratar de disminuir la magnitud del impacto de los metales pesados. De particular relevancia es la contaminación del agua, ya que este líquido es esencial para la vida de todos los organismos vivos del planeta.1 Con la finalidad de disminuir su contaminación, se han establecido diversas normas ambientales que pretenden regular la introducción de agentes contaminantes y, con ello, controlar la calidad de este vital líquido. Además, se han diseñado tecnologías fisicoquímicas y/o biológicas más eficientes y eficaces para la remoción de los contaminantes.
Las industrias Rente, Fibrocemento y Galvánica presentan concentraciones relativamente elevadas de metales pesados, entre los que producen habitualmente efluentes con contenido de Pb (II) y Cr (VI). En tales situaciones es necesaria la búsqueda de tratamientos que minimicen o eliminen el impacto de estos al menor costo posible, siendo el tratamiento biológico el más adecuado para estos fines, en dependencia del tipo de metal que se pretenda remover.
La Kluyveromyces marxianus es un microorganismo unicelular, nucleado, sin motilidad, homotalico, perteneciente a la subclase de los hemiascomicetos; se reproduce por gemación multilateral, liberándose las esporas al llegar a su madurez, sus esporas son esféricas. Posee capacidad de crecer en un amplio intervalo de temperaturas (4 ºC a 52 ºC), característica esta que la hace aplicable en fermentaciones a elevada temperatura, exhibe altas velocidades de crecimiento. Es una levadura respiro fermentativa (aerobia-facultativa), por lo que puede obtener energía tanto por el ciclo del ácido tricarboxílico (fosforilación oxidativa) como por fermentación etanólica. La pared celular de Kluyveromyces marxianus, posee una composición de quitina que oscila entre 0,57 y 1,9 % en base a peso seco, lo cual está en dependencia de las condiciones de cultivo en cuanto a composición del sustrato, temperatura del cultivo y pH, similares a los obtenidos en otras levaduras, destaca el hecho que en los cultivos limitados de nitrógeno (estrés nutricional) y a 40 ºC (estrés físico) los valores son significativamente superiores.2 Por su parte, la relación glucanos/carbohidratos total está en el orden de 60-75 %. Tanto quitina como los compuestos péptidos-glucanos presentes en la pared celular de hongos y levaduras, son los protagonistas en la adsorción de metales pesados, existiendo una fuerte atracción de los iones metálicos por los grupos funcionales de estas macromoléculas.
En cambio, existen métodos biológicos que permiten minimizar la generación de desechos tóxicos y la recuperación del metal, que hace que sean más eficientes, rápidos y económicos que los métodos químicos, además de poder ser aplicados fundamentalmente cuando existen bajas concentraciones de metales, un ejemplo es la bioadsorción. Estos procesos no son excluyentes y pueden involucrar fenómenos físicos, químicos y biológicos.3
El uso de biomasas de origen microbiano evita problemas de contaminación y no es costoso, ya que el biomaterial puede ser regenerado.4 El objetivo del trabajo fue estudiar la bioadsorción de cromo (VI) y plomo (II) utilizando biomasa seca de la cepa Kluyveromyces marxianus CCEBI 2011.
Materiales y métodos
Obtención de la biomasa microbiana
La muestra microbiana proviene de la colección de cultivo del Centro de Estudios de Biotecnología Ambiental, Universidad de Oriente (CCEBI), conservada a 4 ºC. Para el estudio se toman muestras frescas (18 h de incubación) de la cepa de Kluyveromyces marxianus conservada en cuñas de YPGA con una composición (levadura 1,0 g L-1; peptona micológica 2,0 g L-1; glucosa 2,0 g L-1 y agar 2,0 g L-1).
Preparación del preinóculo
El pre-inóculo fue preparado en erlemenyer de 250 mL de capacidad que contiene medio de cultivo líquido YPG (levadura 1,0 g L-1; peptona micológica 2,0 g L -1 y glucosa 2,0 g L-1, al que se le añadió una azada de la muestra fresca bajo cabina de flujo laminar (CLB 20103-Korea). El cultivo se incubó durante 72 h a 150 rpm y 32 ± 2 ºC a pH 7,0 ± 0,2 unidades.
Cultivo de Kluyveromyces marxianus CCEBI 2011
Se tomaron 50 mL del inóculo y se sembraron en erlemenyer de 1 L que contenía 250 mL de caldo YPG estéril. El cultivo se dejó crecer entre 6 y 7 días a 32 ± 2 ºC con agitación continua a 150 rpm en mini zaranda (Mizard, 2001-Cuba) y a pH 7 ± 0,2 unidades. Este procedimiento se repitió 3 veces hasta obtener toda la biomasa necesaria para el estudio.
Obtención de biomasa seca
Los cultivos se centrifugan a 4 500 rpm durante 10 min en equipo de laboratorio (Neofuge 15, 2009-China). El precipitado se lava 3 veces con agua destilada para eliminar iones u otros residuos propios del medio, el cual una vez limpio se deposita en cápsula de porcelana para conocer la masa húmeda con ayuda de la balanza analítica (IP 30, 1983 RDA). Posteriormente, se procede al secado en estufa (AISETYLD-6000-China) a 105 ºC durante un tiempo aproximado de 12 h hasta peso constante. Transcurrido el mismo, se determinó el peso seco según lo establecido en American Public Health Associattion.5 La biomasa seca se pulveriza por medio de un mortero, se pesa (Sartorius, Germany) y conserva en frascos secos y cerrados herméticamente, obteniéndose 10,3 g para un 51,5 % de rendimiento.
Para el cálculo de rendimiento se utilizó la siguiente ecuación de Monod
donde:
Yx/s (%): rendimiento de crecimiento biomasa/sustrato;
∆X (g): cantidad de biomasa formada;
∆S (g): cantidad de sustrato orgánico consumido.
Estudio de bioadsorción
Disoluciones sintéticas de cromo (VI) y plomo (II)
Se emplearon disoluciones sintéticas de cromo (VI) y plomo (II), preparadas a partir de dicromato de potasio (K2Cr2O7) y nitrato de plomo (II) Pb (NO3)2 grado reactivo (MERCK). Se les ajusta el pH utilizando NaOH 0.01N o HCl 0.01N, acorde con los experimentos para realizar mediante el pH-metro (PACITONIC-Alemania) con electrodo de vidrio combinado. Se pesaron las masas correspondientes para obtener soluciones madres de concentración 1,0 g L-1 para cada una de las sales, a partir de las cuales se realizaron las disoluciones necesarias hasta obtener las concentraciones 2,5; 10,0; 20,0 y 40,0 mg L-1 para el cromo (VI) y para el plomo (II) 0,2; 2,5; 7,5 y 10,0 mgL-1. Todas las disoluciones se prepararon con agua destilada.
Proceso de bioadsorción
Se tomaron 0,25 g L-1 de biomasa microbiana seca 6, se mezclaron con 100 mL de disolución de cada uno de los metales a diferentes concentraciones por separado y se mantuvieron en agitación constante durante 60 min a 150 rpm. Transcurrido el tiempo de contacto, las muestras se centrifugaron a 4 500 rpm en centrífuga (Neofuge 5 Heal Force, CHINA) durante 10 min. La disolución sobrenadante se filtró con filtros Milipore acoplado (White GSWP, 0,22 ± 0,2 µm) de 20 mm de diámetro 7, para eliminar los sólidos que pueden interferir en el análisis, los filtrados obtenidos se conservaron a 4 ºC hasta su posterior análisis.
La concentración de los metales después del proceso de bioadsorción se determinó por Espectroscopia Óptica de Emisión Atómica mediante Plasma de Acoplamiento Inductivo (ICP-AES) en un espectrómetro AMETEK, ALEMANIA. El cálculo del por ciento de remoción se calcula a partir de la siguiente ecuación:
donde:
R (%): por ciento de remoción;
Ci (mg L-1): concentración inicial;
Cf (mg L-1): concentración final.
Efecto del pH sobre la bioadsorción del cromo (VI) y plomo (II)
Con vistas a conocer el efecto del pH en la bioadsorción de cromo (VI) y plomo (II) por la biomasa seca de Kluyveromyces marxianus CCEBI 2011 y poder seleccionar el pH para utilizar en el estudio de concentración, fueron tomados estos valores de pH de acuerdo con los óptimos valores de por ciento de remoción.6 Se prepararon las disoluciones sintéticas de los metales pesados en estudio a las concentraciones antes mencionadas a valores de pH 5,5 y 6,0 unidades.
Efecto de la concentración sobre la bioadsorción del cromo (VI) y plomo (II) a pH 5,5 y 6,0 unidades
La bioadsorción de cromo (VI) y plomo (II) por la biomasa seca Kluyveromyces marxianus se realizó en disoluciones sintéticas, cuyas concentraciones iniciales de cromo (VI) fueron de 2,5; 10,0; 20,0 y 40,0 mg L-1 y de 0,2; 2,5; 7,5 y 10,0 mg L-1 para el plomo (II).
Determinación de la naturaleza de la bioadsorción por la biomasa seca de Kluyveromyces marxianus
La relación en equilibrio entre un adsorbente y un soluto son explicadas satisfactoriamente a través de las isotermas de adsorción () como se describe a continuación:
Isoterma de Langmuir
El modelo de Langmuir asume que la adsorción ocurre únicamente en una monocapa, con una superficie uniforme, homogéneamente estructural, y que puede ocurrir en un número fijo de sitios localizados del adsorbente, con todos los puntos de adsorción idéntica y energéticamente equivalentes y sin interacción entre las especies adsorbidas en los sitios adyacentes.9
Estos modelos tienen el propósito de relacionar la concentración del ion metálico en solución con la cantidad adsorbida en la superficie del bioadsorbente.10,11
Los datos de adsorción fueron evaluados usando la isoterma de adsorción de Langmuir en su forma lineal:
donde: qmax (mg g-1): constantes de Langmuir relacionadas con la capacidad máxima de adsorción de la biomasa; b (L mg-1): constantes de Langmuir relacionadas con la energía libre de adsorción; Ce (mg L-1): concentración en el equilibrio.
La representación lineal, mostrará una recta si los datos experimentales se corresponden con el modelo. Las constantes qmax y b fueron calculadas a partir del intercepto y la pendiente de la recta de mejor ajuste a los datos experimentales, respectivamente.
El factor de separación (RL) se determinó según la expresión.10
Co (mg L-1): concentración inicial
Isoterma de Freundlich
Este modelo es empleado para corregir los defectos de la isoterma de Langmuir, en particular para determinadas regiones de concentración. El modelo se aplica para describir los procesos de adsorción en múltiples sitios, indistintamente de su distribución sobre superficies heterogéneas con la interacción entre las especies adsorbidas, sin presentar una barrera energética.9
Para la aplicación de la isoterma de Freundlich se utilizó la ecuación.12
donde: Kf (mg g-1) y n son las constantes de Freundlich e indican la capacidad y la intensidad de la adsorción, respectivamente.
La representación lineal de ln (qe) contra ln (Ce), mostrará una recta si los datos experimentales se corresponden con el modelo. Las constantes Kf y n fueron calculadas a partir del intercepto y la pendiente de la recta de mejor ajuste a los datos experimentales respectivamente.
Isoterma de Dubini-Radushkevich
Es una ecuación semiempírica, donde el proceso de adsorción sigue un mecanismo de llenado de los poros del adsorbente. Este modelo asume que la adsorción tiene un carácter multicapas, que involucra las fuerzas de Van der Waals, y es aplicable a los procesos de adsorción física.13
Para valores de E menores de 8 kJ mol-1, se infiere que el proceso de bioadsorción es de naturaleza física en la que intervienen fuerzas de interacción electrostáticas débiles de Van der Waals; valores de E entre 8 y 16 kJ mol-1, indican que en el proceso de bioadsorción predomina el intercambio de iones, y para valores de E superiores a 16 kJ mol-1, entonces se considera que la bioadsorción es de naturaleza química, predominando la formación de enlaces estables entre el adsorbente y los iones metálicos.13
La ecuación de Dubinin-Radushkevich, es usada para diferenciar la adsorción física de los iones metálicos de la adsorción química.10 Para la aplicación de este modelo se utilizaron las ecuaciones (6) y (7).
donde: qDR (mmol g-1): es la capacidad máxima de adsorción; βDR (mol2 kJ2): es el coeficiente de actividad relacionado con la energía libre de adsorción; ε es el potencial de Polanyi
Calculado según (7).
donde: R: constante de los gases, de 8,314 kJ mol-1; T: temperatura absoluta en grados Kelvin; E (kJ mol-1): energía libre media de adsorción.
Las constantes qDR y βDR se determinaron a partir de la representación lineal de ln (qe) vs ε2. La representación lineal de ln (qe) contra ε2, mostrará una recta si los datos experimentales se corresponden con el modelo. Las constantes qDR y βDR fueron calculadas a partir del intercepto y la pendiente de la recta de mejor ajuste a los datos experimentales, respectivamente.
Resultados y discusión
Se debe tener en cuenta al estudiar detalladamente este proceso, la influencia de estos factores como el pH, concentración de adsorbente y las isotermas del metal en el proceso de bioadsorción.
Influencia del pH en la bioadsorción
Esta es una de las variables más importantes en el proceso de remoción de metales pesados, ya que la especiación del metal en la disolución puede cambiar dependiendo de este valor. En la tabla 1 se muestra la remoción del cromo (VI) a pH 5,5 y 6,0 unidades en disoluciones acuosas del metal cromo (VI) a concentraciones. Se observa que a pH 5,5 unidades, los por cientos de remoción alcanzan valores entre 94,0 y 95,2 %; en cambio a pH 6,0 unidades alcanzan valores entre 97,3 y 99,4 %
Tabla 1 Remoción de cromo (VI) por la biomasa seca Kluyveromyces marxianus CCEBI 2011 a pH 5,5 y 6,0 unidades
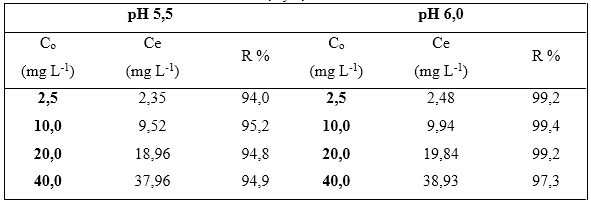
Leyenda: Co: concentración inicial; Ce: concentración equilibrio; R % de remoción
La tabla 2 muestra la variación de la remoción del plomo (II) en función del pH. El por ciento de remoción estuvo entre 81,1 y 92,9 % a pH 5,5 y a pH 6,0 unidades la remoción obtenida estuvo entre 90,6 y 94,9 %.
Tabla 2 Remoción de plomo (II) por la biomasa seca Kluyveromyces marxianus CCEBI 2011 a pH 5,5 y 6,0 unidades
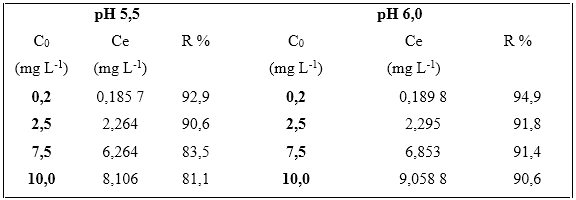
Leyenda: Co: concentración inicial; Ce: concentración equilibrio, R % de remoción
El pH de la disolución tiene un efecto significativo en la capacidad de bioadsorción, debido, fundamentalmente, al fenómeno de protonización que ocurre a bajos valores de pH y al efecto del mismo en la química de las disoluciones; por tanto, la capacidad de adsorción puede verse afectada por el pH. Los sitios de unión en los microorganismos son los grupos carboxilos, aminas, fosfatos, sulfatos e hidroxilos. El aumento de la disponibilidad de estos grupos funcionales depende del desplazamiento de protones que está en función del pH.14,15,16
La pared celular de Kluyveromyces marxianus posee una composición de quitina que oscila entre 0,57 y 1,9 % en base a peso seco.2 Por su parte, la relación glucanos/carbohidratos totales está en el orden de 60-75 %. Tanto la quitina como los péptido-glucanos presentes en su pared celular son los protagonistas en la adsorción de metales pesados, existiendo una fuerte atracción de los iones metálicos por los grupos funcionales de estas macromoléculas.
A pH bajos, los protones (H+) se encuentran en una concentración elevada, existiendo competencia con los iones metálicos por ocupar los sitios de unión en el biosorbente. Esta competencia, generalmente, conlleva a una reducción de la inmovilización de los metales presentes en disolución, es decir, la protonación de la pared celular inhibe fuertemente la adsorción de metales si el pH es muy ácido.15
Además, cuando el pH disminuye, la superficie de la célula tiende a estar más cargada positivamente, reduciendo la atracción entre la biomasa y los iones metálicos, existiendo competencia entre los protones y el metal. También a bajos valores de pH, la mayoría de los grupos funcionales de las moléculas que conforman la pared celular no se encuentran disociados y pierden la capacidad de unirse a los iones metálicos presentes en la disolución 14; sin embargo, pueden participar en reacciones de formación de complejos.
Pérez y col. obtuvieron para la remoción de cobre por Pseudomona aureginosa un pH óptimo de 6,5 unidades, mientras que para zinc y manganeso el pH óptimo de remoción fue 7,0 unidades.17 De igual modo, Díaz y col. obtuvieron el mayor valor de adsorción de níquel por biomasa microbiana de Phyllanthus orbicularis a pH 6,5 unidades. Tur y col. (2012), reportaron el pH 6,2 unidades como el más adecuado para realizar el proceso de bioadsorción de Pb (II) por Kluyveromyces marxianus CCEBI 2011.6
Los resultados obtenidos muestran claramente la importancia del pH en el proceso de remoción de metales pesados. Su influencia en el proceso de biosorción de iones metálicos, se da por la competencia entre los cationes del metal, los iones hidronio presentes en la disolución, por los sitios activos en la superficie de la biomasa.
Efecto de la concentración sobre la bioadsorción del cromo (VI) y plomo (II) a pH 6,0 unidades
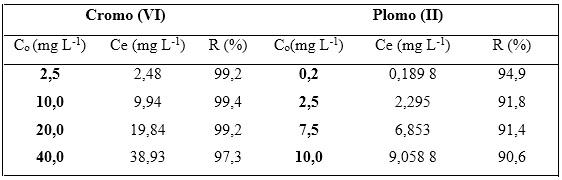
La tabla 3 muestra el comportamiento de la eficiencia de remoción de la biomasa seca de Kluyveromyces marxianus CCEBI 2011 a las concentraciones estudiadas. Los valores de remoción de cromo (VI) oscilaron entre 97,3 y 99,4 %, destacándose que el mayor por ciento es a la concentración de 10,0 mg L-1 de cromo (VI). En el caso del plomo (II) la remoción estuvo entre 90,6 y 94,9 %, obteniéndose mayor valor a la concentración de 0,2 mg L-1.
Tabla 3 Parámetros obtenidos de la adsorción de cromo (VI) y plomo (II) por la biomasa seca Kluyveromyces marxianus CCEBI
La pared celular de las levaduras está compuesta, fundamentalmente por β-glucanos y mananos, los que se encuentran alrededor de la capa interna que consiste en β-(1,3) glucanos y β-(1,6) glucanos, además de contener quitina en su composición. Esta compleja estructura posibilita una mayor disponibilidad de sitios para la adsorción.18
Los resultados concuerdan con lo alcanzado para el cromo (VI) y plomo (II), mostrando mejor por ciento de remoción a 10,0 y 0,2 mg L-1, coincidiendo con Tur y col. (2012) quienes trabajaron en la adsorción del plomo (II) por Kluyveromyces marxianus.
Isotermas de bioadsorción de cromo (VI) y plomo (II) en disoluciones acuosas por la biomasa seca Kluyveromyces marxianus CCEBI 2011
Las isotermas permiten estimar la cantidad de adsorbente requerido y la sensibilidad del proceso respecto a la concentración del producto. En el presente estudio se construyeron las isotermas de adsorción de cromo (VI) y plomo (II) por biomasa seca de Kluyveromyces marxianus CEBI 2011. A los resultados experimentales obtenidos en los ensayos de bioadsorción con disoluciones sintéticas, les fueron aplicados los modelos de isotermas de adsorción de Langmuir, Freundlich y Dubinin-Radushkevich (D-R) que permiten describir el comportamiento del bioadsorbente. Los parámetros obtenidos para cada modelo se muestran en la tabla 4.
Tabla 4 Parámetros de los modelos empleados para la adsorción de cromo (VI) y plomo (II) por la biomasa seca Kluyveromyces marxianus CCEBI 2011
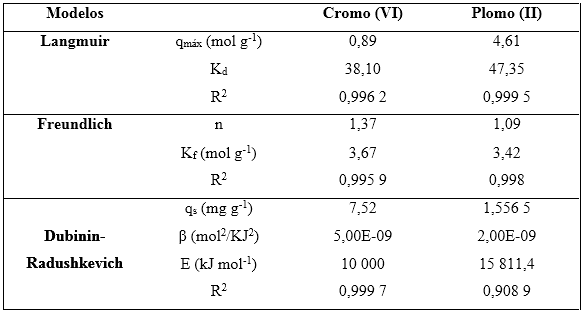
En la evaluación de los datos usando la isoterma de adsorción de Langmuir en su forma lineal (ecuación 3), se obtuvieron los valores de qmáx (4,61 mg g-1) y KL (47,35 mg g-1) con un coeficiente de correlación R2 = 0,999 5 para el plomo (II), como se aprecia en la figura 1A, y qmáx 0,89 mg g-1 y KL 38,10 mol g-1 con un coeficiente de correlación R2 = 0,996 2 para el cromo (VI), según muestra la figura 1B.
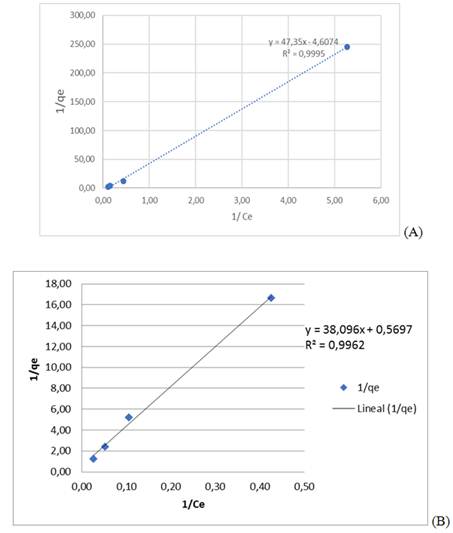
Fig. 1 Isotermas de bioadsorción de Langmuir (A) para el plomo (II) y (B) cromo (VI) por la biomasa seca Kluyveromyces marxianus CCEBI 2011
Como se muestra en la figura 2C, el valor de factor de separación (RL) determinado por la ecuación (4), oscila entre 0,002 1-0,096 para el plomo (II); y 0,000 66-0,993 para el cromo (VI), según aparece en la figura 2 D, por lo que se puede asumir que el proceso de adsorción es favorable.
El modelo de Freundlich es evaluado por la ecuación (5) que es característica de una recta, lo que permite la determinación en el gráfico de 1/n y K, siendo de 1,37 mol g-1 y 3,67 mol g-1 para el cromo (VI) /figura 3 E/ y 1,09 mol g-1 y 3,42 mol g-1 para el plomo (II) /figura 3 F/, respectivamente.
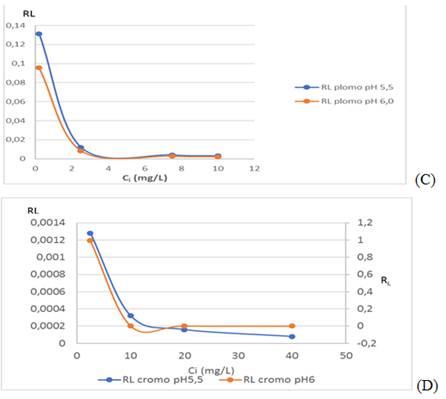
Fig. 2 Variación del factor de separación RL (C) de plomo (II) y (D) cromo (VI) de la biomasa seca Kluyveromyces marxianus CCEBI 2011
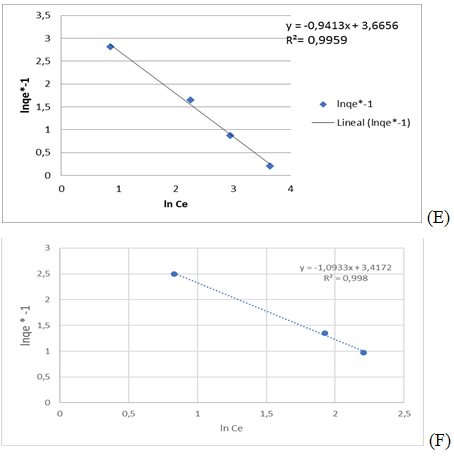
Fig. 3 Isoterma de bioadsorción de Freundlich (E) de cromo (VI) y (F) plomo (II) por la biomasa seca Kluyveromyces marxianus CCEBI 2011
Teniendo en cuenta que el recíproco de n se mantiene en valores menores que 1, el valor obtenido es atribuido a la naturaleza heterogénea de la superficie del adsorbente con una distribución exponencial de la energía de los sitios de adsorción, confirmando que la naturaleza de dicha adsorción es un proceso químico.
Comparando nuestros resultados con los de otros autores, obtuvimos un coeficiente de correlación R2 = 0,999 5 para el plomo (II) y R2 = 0,996 2 para el cromo (VI), 1/n y K, siendo de 1,37 mol g-1 y 3,67 mol g-1 para el cromo (VI) y 1,09 mol g-1 y 3,42 mol g-1 para el plomo (II), superando a Carpio (2017) muestra un R2 de 0,972, lo que indica que el mecanismo de bioadsorción de cadmio usando la biomasa de Escherichia coli, se ajusta en un 97,2 % al modelo de la isoterma de Freundlich, con un Kf de 0,180 y una afinidad entre el sorbente y el sorbato (n) de 0,755 y R2 de 0,758, esto muestra que el mecanismo de bioadsorción de plomo (II) usando la biomasa Escherichia coli, se ajusta en un 75,8 % al modelo de la isoterma de Freundlich, con un Kf de 4,539 y una afinidad entre el sorbente y el sorbato (n) de 1,353.19
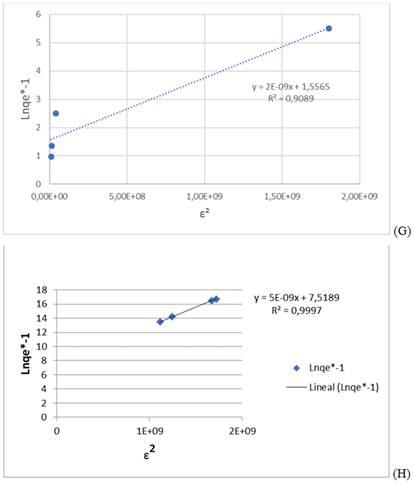
Por otro lado, la isoterma de adsorción de Dubinin- Radushkevich (D-R), según ecuaciones (6) y (7), en su forma lineal muestra una gráfica de lnqe vs . ε2, de la que se obtienen la cantidad máxima de metal adsorbido y la energía media de adsorción, de 1,56 mol g-1 y 15 811,4 kJ mol-1 para el plomo (II) /figura 4 G/ y 7,52 mol g-1 y 10 000 kJ mol-1 para el cromo (VI) /figura 4 H/.
La energía media de adsorción (E) fue valorada usando la ecuación (8). El valor obtenido fue superior a 16 kJ mol-1, por lo que se infiere que el proceso de bioadsorción es de naturaleza química.
La capacidad de adsorción de una biomasa depende de varios factores, entre los que se encuentran el pH de la disolución, la naturaleza de la biomasa y del ion que se pretende adsorber.
Las isotermas de Langmuir y Freundlich muestran un comportamiento lineal con coeficientes de correlación superiores a 0,995 para ambos metales ensayados, lo que evidencia una relación directa entre la concentración del analito en fase acuosa (Ce) y el biomaterial que lo retiene en su superficie.
Conclusiones
La mayor capacidad máxima de adsorción fue para el plomo (II) de 4,61 mg g-1. Los porcentajes de remoción de 99,4 % a 10,0 mg L para cromo (VI) y 94,9 % a 0,2 mg L para el plomo (II) a pH 6,0 unidades, respectivamente. Los valores de la energía media de adsorción obtenido derivado del modelo de Dubinin-Radushkevich fueron de 10 000 1para cromo (VI) y de 15 811,4 kJ mol para plomo (II), lo que se infiere que el proceso de bioadsorción es de naturaleza química.