Introducción
El uso de algas como alimento, medicina y abono de plantas es ancestral. Sin embargo, su implementación es casi nula a pesar de que cada año se publica al menos un artículo de revisión relacionado con su explotación con estos fines. Recientemente se realizaron sendas revisiones sobre el uso agrícola de las algas en Cuba. López-Padrón et al.1 enfatizan las potencialidades de la Spirulina en la agricultura, por ser un alga reproducida en Cuba hace más de dos décadas con fines cosméticos y farmacéuticos. Espinosa-Antón et al.2 señalan las perspectivas de bioproductos a base de extractos de algas marinas, resaltando los géneros Sargassum y Ulva, sustentada en la utilización sostenible de la biomasa, por su abundancia, disponibilidad durante todo el año y fácil accesibilidad.
Si bien en ambas revisiones se concluye la necesidad de investigaciones relacionadas con el uso agrícola de algas, no se señala el uso de Sargassum de arribazón como fuente de alginatos, polisacárido constituyente de la pared celular de las algas pardas de conocido uso agropecuario.3,5
La especie de alga parda Sargassum, es utilizada como fuente comercial de alginato, ficocoloide ampliamente investigado por sus diversas aplicaciones en las industrias farmacéutica, alimenticia, química, textil, cosmética, biotecnológica, bioimpresión 3D y agrícola,6,7 debido a sus propiedades espesantes, gelificantes, estabilizantes, así como su baja toxicidad, biocompatibilidad, biodegradabilidad y relativo bajo costo.7
Disponer de un protocolo efectivo para la producción de alginato y de sus oligosacáridos a partir de Sargassum de arribazón, permitirá la producción de formulaciones para la producción agropecuaria del país. En este trabajo se hace una revisión de los principales métodos de extracción de alginato y de obtención de oligosacáridos de alginato (OSA) a partir de algas, así como un breve resumen de la bioactividad de los OSA en la agricultura.
Desarrollo
Algas de arribazón: Sargassum spp.
Las macroalgas marinas, de amplia distribución en océanos y mares, son aquellas de talla macroscópica, que se clasifican atendiendo a su pigmentación en algas pardas (Phaeophyta), algas rojas (Rhodophyta) y algas verdes (Chlorophyta), constituyendo fuentes naturales de polisacáridos, muy utilizados en varias industrias.8,9,10,11) En el 2005 se relacionaron para la plataforma de Cuba, 483 especies de macroalgas, de las cuales 255 son algas rojas, 68 pardas y 160 verdes.8 La última actualización encontrada de esta lista fue en 2015 con 299 algas rojas, 75 pardas y 205 verdes, para un total de 579 especies.9
Las macroalgas, según señalan García & Peteiro 12 presentan grandes diferencias en su morfología, ciclo biológico, reproducción, hábitat y ecología, aspectos que se considera para establecer modelos de gestión de este recurso natural. En la tabla 1 se presentan las especies representativas de estos tipos de algas, así como los polisacáridos estructurales y de reserva que contienen.
Tabla 1 Especies representativas de algas y principales polisacáridos según clasificación de acuerdo con criterio de pigmentación
| TIPOS DE ALGAS | ESPECIES | POLISACÁRIDOS |
| ALGINATO, FUCOIDANO, CELULOSA, LAMINARINA | ||
| AGAR, CARREGANO, CELULOSA, XILANO, MANANO, ALMIDÓN | ||
|
|
ULVANO, GALACTANO SULFATADO, DEXTRANO, XILANO, CELULOSA, ALMIDÓN |
El fenómeno recurrente, relacionado con eventos meteorológicos y corrientes marinas, mediante el cual el mar arroja a la orilla una amplia variedad de especies de macroalgas, es conocido como arribazón.10 En Cuba, las arribazones de algas marinas no se presentan de manera significativa comparado con otras regiones del mundo. No obstante, autores como Torres Conde & Martínez Daranas refieren la necesidad de monitoreo de este fenómeno ambiental en nuestras costas, debido a su posible incremento en los años venideros.13
El sargazo pelágico, arribazón de mayor magnitud en el litoral cubano durante todo el año, está constituido por las especies Sargassum fluitans (Børgesen) Børgesen y Sargassum natans (Linnaeus) Gaillon.14 Estas especies que flotan en grandes aglomerados en el Mar de los Sargazos, ubicado en el Atlántico norte, al noroeste de Cuba, tienen alto valor ecológico debido a que sirven de hábitat, áreas de desove, vías migratorias y base alimentaria a un conjunto diverso de flora y fauna, incluyendo especies endémicas en peligro de extinción y de importancia económica.15 Sin embargo, representan un problema por su impacto negativo sobre la industria turística, pesquera, el medio ambiente y la sociedad.14
Las poblaciones naturales de Sargassum se explotan con fines alimenticios y medicinales, debido a que contienen varios compuestos orgánicos e inorgánicos con elevado valor nutricional y curativo, 1,16) la aplicación industrial se restringe a la extracción de alginato que ha alcanzado importancia comercial como aditivo alimenticio, así como en las industrias cosmética, textil, médica y agrícola.16,17 El valor nutritivo de las algas, así como la composición de polisacáridos, dependen de la especie, la estación del año, localización geográfica y la temperatura del agua.4,18
En nuestro país, Sargassum spp de arribazón constituye un residuo marino que no se explota como recurso económico, y su gestión para la producción de insumos agropecuarios se correspondería con una práctica de economía circular. En el sector de valorización de residuos y reciclaje es posible reducir los desechos que se envían a vertederos o se incineran, y en el sector de la bioeconomía se ofrecen oportunidades para establecer sistemas alimentarios y agrícolas sostenibles, que pueden ayudar a evitar disyuntivas entre los objetivos económicos, sociales y medioambientales.19
Alginato: composición y características estructurales
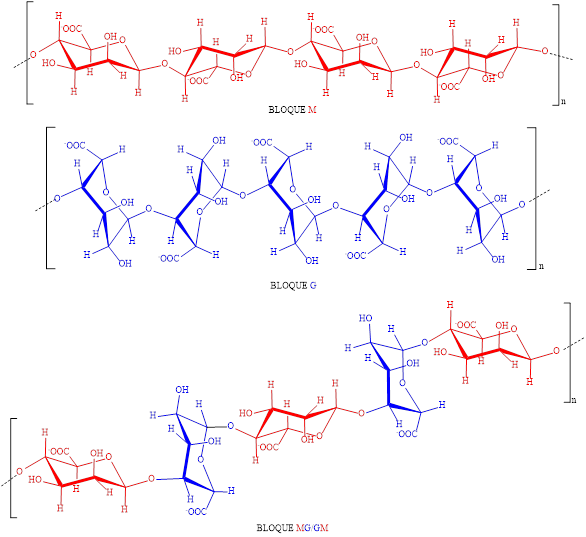
El alginato es un polisacárido lineal constituido por unidades de los ácidos urónicos (-D-Manurónico (M) y (-L-gulurónico (G), provenientes de la oxidación selectiva del grupo -CH2-OH del extremo terminal de los epímeros D-Manosa y L-Gulosa, respectivamente (figura 1), las que se unen formando este heteropolímero a través de enlaces glicosídicos 1,4, con configuración ( o ( (figura 2). En las algas pardas, el alginato se encuentra en forma de sales monovalentes (sodio y potasio) y divalentes (calcio, magnesio, estroncio y bario),17 es por ello que los monómeros constituyentes de los bloques M, G y MG/GM representados en la figura 2, se encuentran en forma de sales (carboxilatos).

Fig. 1 Representaciones de las unidades de monosacáridos epímeros que componen el polímero de alginato
Mediante hidrólisis parcial del alginato se ha constatado la presencia de tres fracciones o bloques;20 dos de ellas consisten en moléculas homopoliméricas de G y M, denominados bloques G y M, respectivamente; mientras que la tercera reside en un copolímero con proporciones casi iguales de M y G, denominado bloque MG o GM. Mediante las técnicas de difracción de RX y RMN-13C fue posible conocer la estereoquímica del alginato,20 siendo cuatro las posibilidades de enlace glicosídico (figura 2): diecuatorial ( 1(4 (MM), diaxial ( 1(4 (GG), ecuatorial-axial ( 1(4 (MG), axial-ecuatorial ( 1(4 (GM).
En la figura 2 se distingue para el bloque M una estructura tipo cinta plana, para el bloque G una estructura abultada o capsular, y en el bloque MG/GM una estructura tipo escalera.17 La distribución secuencial y cantidad relativa de los monómeros M y G dependen de la fuente de alginato, especie de alga, partes del alga, condiciones de crecimiento, variaciones geográficas y estación del año.4,20,21 Los frutos de Ascophyllum nodosum contienen altas cantidades de ácido manurónico cuando se compara con el contenido de tejidos viejos, los que son abundantes en ácido gulurónico.22 De manera similar, las hojas de Laminaria hyperborean contienen una gran cantidad de ácido manurónico, a diferencia de la corteza que es rica en gulurónico.23) La relación M:G es generalmente 1:1, aunque la relación M:G en Ascophyllum nodosum puede aparecer en proporción 2:1.21 Para algunas macroalgas se han reportado los contenidos de bloques y de unidades monoméricas, los que se exhiben en la tabla 2.7,24,25
Tabla 2 Contenido de los bloques M, G y MG, y de unidades M y G de alginato extraído de diferentes algas pardas
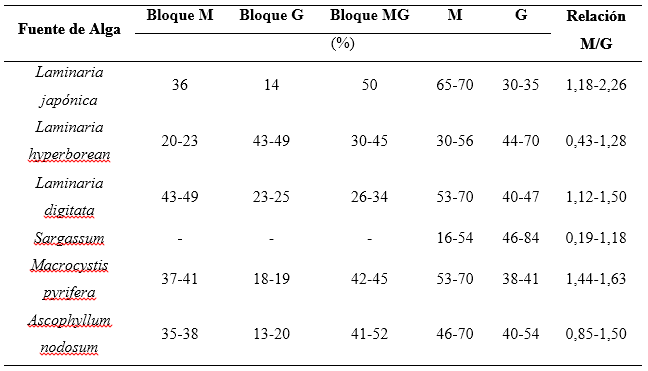
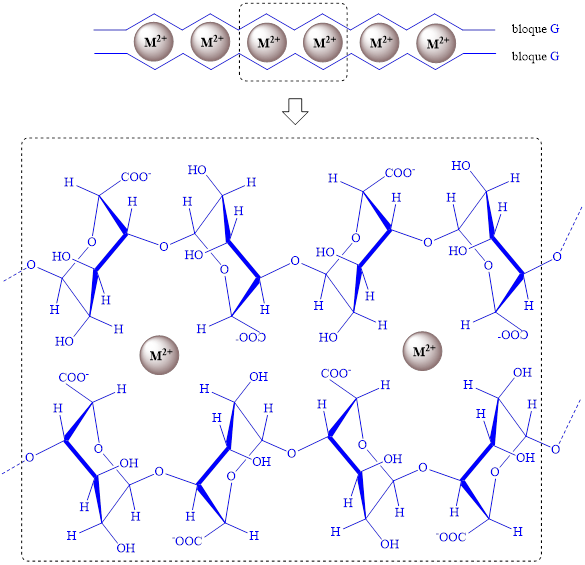
En la mayoría de las macroalgas se observa la superioridad de unidades de ácido manurónico, siendo predominantes en ácido gulurónico las especies en orden creciente Ascophyllum nodosum, Laminaria hyperborean y Sargassum (tabla 2). El contenido de unidades G se relaciona con una de las propiedades del alginato más destacada y explotada en la industria: su capacidad de formar hidrogeles mediante entrecruzamiento iónico con cationes divalentes.17,26 Los cationes divalentes se enlazan a cadenas poliméricas adyacentes de bloques G, formando una red de gel tridimensional, según el modelo denominado “caja de huevos” (figura 3).26,27 Aunque el contenido de unidades G se considera como el factor principal que determina la elasticidad del gel, porosidad y estabilidad, 26 se ha señalado que las unidades de M, formando parte del bloque MG/GM, pueden contribuir a la formación de hidrogeles. De esta forma, se establecen tres posibles uniones de cadenas poliméricas adyacentes: bloque G-bloque G, bloque MG- bloque MG y bloque G-bloque MG.26
Alginato: métodos de extracción
A finales del siglo XIX, con la publicación de la patente del químico británico Edward Charles Cortis Stanford, relacionada con la preparación de ácido algínico a partir de algas pardas, se inician las investigaciones relacionadas con los métodos de extracción de alginato.25 La expectativa de crecimiento anual del mercado global de alginato está entre 2-3 %.28
El procedimiento de extracción es otro de los factores determinantes en las características estructurales del alginato que se aísla. Esto refuerza la importancia de la metodología de obtención del polímero, ya que las características estructurales determinarán sus propiedades físico-químicas y mecánicas, y por consiguiente, su aplicación.29
En 2019 salió a la luz una revisión detallada de los métodos convencionales y novedosos de obtención de alginato a partir de algas pardas.29 Los primeros se basan, principalmente, en tratamiento térmico con Na2CO3, mientras que los nuevos se corresponden con protocolos de extracción asistida por ultrasonido o por microondas. En los procedimientos de extracción de alginato, independientemente que sea convencional o novedoso, pueden distinguirse tres etapas fundamentales: (a) pre-tratamiento del alga, (b) extracción y (c) purificación.17
En la etapa de pre-tratamiento se incluye el lavado y limpieza del alga con agua corriente para la eliminación de “material extraño”, el tratamiento con ácido diluido (generalmente HCl) con la finalidad de convertir todo el alginato que está en el alga en forma de sales (M(Alg)2 o MAlg) en forma de ácido (HAlg), y el tratamiento con formaldehído o etanol para ablandar los tejidos y eliminar los compuestos fenólicos con lo que se evita la pigmentación del alginato.28,29,30 El alga puede procesarse fresca o seca, aunque trabajar con el alga seca y molida favorece las reacciones químicas del proceso y el transporte del material.30
La etapa de extracción se corresponde con una digestión básica, y usualmente se emplea Na2CO3 o NaOH, donde todo el alginato en forma de ácido (HAlg) presente en el alga es extraído en forma de alginato de sodio (NaAlg). Los protocolos varían atendiendo a la concentración de la sal de sodio, la agitación, la temperatura y el tiempo de digestión.28,29,30 En general, los mejores rendimientos de la producción de alginato a partir de Sargassum se obtienen cuando se utiliza Na2CO3 (1,5-2 %) y agitación mecánica a temperaturas entre los 60-100 ºC durante 2-3 h.29
En la última etapa de purificación, el alginato de sodio (NaAlg) obtenido mediante digestión, se precipita en forma de alginato de calcio [Ca (Alg)2] o de ácido algínico (HAlg), mediante la adición de CaCl2 y HCl, respectivamente. En los procedimientos donde se precipita el alginato como Ca(Alg)2, este se acidifica para convertirlo en HAlg, el que se neutraliza con Na2CO3, obteniéndose alginato de sodio.17 En esta etapa se incluyen también los ulteriores procesos de clarificación o blanqueo, secado, molienda y tamizado del NaAlg producido.17,28,29,30 En la figura 4 se resume el protocolo general de extracción de alginato a partir de algas pardas, y las transformaciones que ocurren en cada etapa.
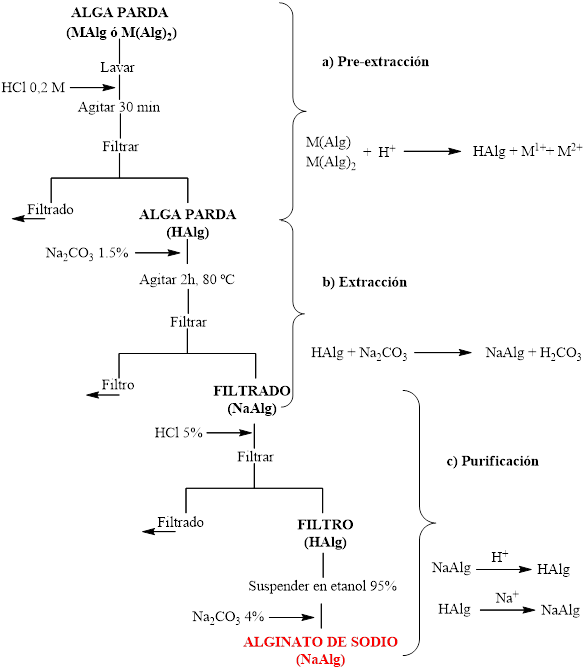
Fig. 4 Procedimiento general de la extracción de alginato a partir de algas pardas y transformaciones de cada etapa
En la década de los noventa del siglo pasado, el Centro de Biomateriales de la Universidad de La Habana desarrolló un protocolo para la obtención de alginatos para su uso en las industrias alimenticia, médica y farmacéutica.31 Sin embargo, en la actualidad no se realizan investigaciones relacionadas con la extracción de este polímero natural. Es posible, que para estos fines no haya sido factible la producción de alginato; no obstante, la búsqueda de un protocolo simple y eficiente para la obtención de este polímero para uso agropecuario, es una tarea pendiente que contribuirá a la implementación de prácticas de economía circular en nuestro país.
En la agricultura, los alginatos se utilizan como hidrogeles, para mantener la humedad de los suelos, y como matriz para la liberación controlada de principios activos, incluyendo microorganismos que actúan como agentes de biocontrol o promotores del crecimiento vegetal.28 Sin embargo, otros usos agrícolas se restringen debido, principalmente, a la elevada viscosidad y la pobre solubilidad en agua del alginato, por lo que en los últimos años se incrementaron los reportes de actividad biológica de los oligosacáridos de alginato (OSA), los que se producen mediante la despolimerización del alginato, utilizándose diferentes métodos.5
Oligosacáridos de alginato (OSA): preparación
Los OSA se consideran como oligómeros de bajo peso molecular, que contienen de 2 a 25 unidades monoméricas de G y/o M,24 formadas, generalmente, mediante escisión de enlaces glicosídicos, aunque los OSA pueden obtenerse también a través de síntesis orgánica o vía biosintética.24 La escisión de los enlaces glicosídicos para la obtención de OSA puede llevarse a cabo mediante métodos químicos, físicos o enzimáticos.
Los métodos químicos incluyen hidrólisis en medio ácido o alcalino, y la degradación oxidativa. La hidrólisis en medio ácido es considerada como el método más simple y efectivo; sin embargo, la reacción es aleatoria y sin especificidad, dando lugar a fragmentos de bajo peso molecular con desigual grado de polimerización.5,32 De acuerdo con la diferencia del pKa entre polimanuronatos y poliguluronatos, el método de degradación ácida produce, principalmente, una mezcla de oligosacáridos con fragmentos acídicos diferentes. Varios grados de degradación del alginato pueden obtenerse controlando la temperatura y el tiempo de la reacción.
Las reacciones de hidrólisis ácida consumen de cuatro a doce horas, y se producen grandes cantidades de sales al neutralizar el ácido remanente, lo que puede interferir con la subsecuente separación y análisis de los OSA. Además, el producto resultante no tiene una buena apariencia debido a su color, y no es un método eco-amigable.33 En el caso de la hidrólisis en condiciones básicas, se reporta la obtención de otros productos colaterales (glucurónidos, ácidos isoglucónico, pentárico y metil tetrahidro), lo que sugiere la escisión de enlaces internos del ácido algínico.5
La degradación oxidativa se utiliza para degradar los polisacáridos por adición de agentes oxidantes a una disolución de alginato. Los agentes oxidantes más comúnmente utilizados son H2O2, NaClO, KMnO4 y NaNO2, entre los cuales el uso de H2O2 es frecuente, pues solo se obtiene agua como subproducto de la reacción. Aunque se suponía que la degradación oxidativa era un procedimiento aleatorio, se ha demostrado que se pueden obtener OSA con grados de polimerización específicos y un peso molecular controlado.34
La degradación física está, principalmente basada, en el tratamiento térmico, la irradiación y el tratamiento ultrasónico. La irradiación, mediante el tratamiento con rayos gamma o con microondas, no requiere ningún aditivo, y se caracteriza por su bajo costo, poca contaminación química, fácil control y la obtención de un producto de alta calidad.5 Es común que estos métodos se combinen con otras técnicas de degradación, ya que con el uso de un único método físico no se logran obtener oligosacáridos de bajo peso molecular, destacándose el uso de metodologías físico-químicas. En un estudio reciente se constató, que la hidrólisis de alginato mediante degradación hidrotérmica depende del estado físico del material de partida; obteniendo con el uso de alginatos de sodio y de calcio, oligosacáridos de composición química diferente —secuencia monomérica y proporción de monómeros—.35
En los métodos enzimáticos, el alginato por acción de enzimas del tipo liasas, derivadas de bacterias marinas, hongos, algas, moluscos y microorganismos del suelo, se degrada mediante una reacción de β-(1,4)-eliminación, para producir entre el C4 y C5 dobles enlaces en el final no reducido.36,37 Se han identificado más de cincuenta alginato liasas, que se dividen en tres categorías de acuerdo con los bloques de alginato que degradan: enzima poliM que específicamente escinde los enlaces β1→4 del bloque M; enzima poliG que quiebra los enlaces α1→4 del bloque G, y la enzima de función dual poliMG que puede ambos enlaces del bloque MG.38 La industrialización de las alginato liasas tiene como desventaja, que el costo de la separación y purificación de la enzima es alto.35
Una breve descripción de algunos de los principales protocolos de preparación de OSA mediante los métodos anteriormente descritos, se presenta en la tabla 3.
Tabla 3 Breve descripción de algunos protocolos de preparación de OSA mediante los métodos químicos, físicos y enzimáticos3,5,39

Los métodos enzimáticos son los más efectivos y prometedores para la preparación de OSA, debido a la alta eficiencia catalítica, condiciones medias de reacción, gran especificidad, y la no contaminación química. Sin embargo, los elevados costos para la producción de la enzima con un alto grado de pureza, conllevan a que estos métodos sean los menos utilizados.38,39 Por otra parte, los métodos físicos se caracterizan por ser de bajo costo, pero producen oligosacáridos de baja pureza y poco grado de despolimerización.39 En el caso de los métodos químicos, controlando las condiciones de la reacción, es posible obtener OSA de alta pureza, y tienen la ventaja de ser de bajo costo, con sistema tecnológico establecido, aunque aún existen algunos problemas como las reacciones violentas, necesidad de equipamiento anticorrosivo y contaminación ácido-base.5 La selección de un método u otro depende de la finalidad de uso de los OSA, así como de la tecnología disponible.
Bioactividad agrícola de alginato y oligosacáridos de alginato
Anualmente se realizan numerosas revisiones relacionadas con la bioactividad del alginato y sus oligosacáridos, de las cuales, en dos de ellas se aborda el empleo potencial de estos materiales en prácticas agropecuarias.1,2,3,5,6,7,11,23,40,41,42,43 En estos trabajos se destaca la ventaja de uso de estos materiales por ser biodegradables, biocompatibles, de baja toxicidad, de fácil gelación y relativo bajo costo, así como sus efectos antioxidantes, antimicrobianos, antiinflamatorios, de inmunomodulación, y como estimuladores del crecimiento de plantas y animales, así como de la respuesta inmune y la resistencia al ataque de microrganismos.
La potencial aplicación de alginato como material superabsorbente para mantener la humedad del suelo por largos periodos de tiempo, se ha quedado a nivel académico.44 No se conocen resultados recientes relacionados con investigaciones acerca de la aplicación de alginato en el suelo, ni de su empleo como suplemento en la dieta de animales. La mayor aplicabilidad del alginato es su uso como matriz para sistemas de liberación controlada.
Para la encapsulación de ingredientes químicos y biológicos es frecuente la preparación de nano, micro y macrocápsulas de alginato. Por ejemplo, se destaca la encapsulación de urea, fertilizante nitrogenado muy usado, que la planta no aprovecha en su totalidad, ya que se pierde por volatilización. También se han encapsulado microorganismos promotores del crecimiento vegetal o los empleados como biocontroladores de plagas y enfermedades. Sin embargo, la mayoría de las investigaciones se enfocan en la optimización de las metodologías de encapsulación, y no en su aplicación. Algunos trabajos recientes reportan ensayos de bioactividad in vitro, donde se utiliza el alginato para la encapsulación de los hongos Beauveria bassiana y Trichoderma harzianum, utilizados en el control biológico de plagas.45,46
Un caso similar ocurre con la aplicación de los OSA, a pesar de su mayor potencial por ser materiales menos viscosos, más solubles y disponibles para las plantas. Las investigaciones relacionadas con la optimización de los métodos de preparación de OSA superan, considerablemente a aquellas relacionadas con su bioactividad.
Salachna et al.33 recubrieron bulbos de Eucomis autumnalis con OSA de diferentes masas moleculares, y comprobaron que todos estimulan el crecimiento de la planta, obteniendo el mayor estímulo con el OSA de menor masa molecular, el que fue utilizado para verificar su posible efecto protector cuando la planta es expuesta a condiciones de estrés salino. Los autores demostraron que el OSA mitiga los efectos de la salinidad, ya que los descensos en el peso de las partes aéreas y bulbos de las plantas, en el contenido de pigmentos y en la actividad antioxidante, fueron menores en las plantas tratadas con el oligosacárido comparadas con las no tratadas. Bioensayos con el recubrimiento de semillas de frijol (Phaseolus vulgaris L.) con filmes de un composite de mezclas de alginato y material hibrido orgánico-inorgánico (ZnAl-NAA-LDH: doble capa de hidróxido de zinc y aluminio con la auxina sintética ácido 1-naftalenacético), mostraron la capacidad para incrementar la germinación e indicadores de crecimiento de plántulas de frijol.47
Recientemente se demostró, que la aplicación foliar con intervalos de treinta días, de una mezcla de oligosacáridos de quitosana y de alginato, obtenidos mediante irradiación gamma, en plantas de piña (Ananas comosus) incrementó, significativamente, indicadores de crecimiento y propiedades organolépticas (olor y sabor) del fruto.48
La mayoría de las investigaciones de bioactividad de los OSA se desarrollan en condiciones controladas o semi-controladas, siendo escasos los experimentos en condiciones de campo, donde es posible que las situaciones edafoclimáticas modifiquen los efectos de los oligosacáridos. Son necesarios realizar más estudios para explorar la eficiencia del oligómero y el genotipo de planta, las propiedades físicas y químicas del OSA, su concentración y método de aplicación.33
En la figura 5 se presenta una visión general del potencial uso agropecuario de las algas de arribazón, el alginato y sus oligosacáridos, aunque en la misma estarían faltando los extractos de algas ampliamente comercializados y comúnmente utilizados como bioestimulantes de plantas.
Conclusiones
Esta revisión resume una actualización de los principales protocolos de obtención de alginatos y sus oligosacáridos, enfatizando en los métodos químicos de fácil acceso. Se avizora la falta de investigaciones en nuestro país relacionadas con estos materiales de elevado potencial en la producción de alimentos y la preservación del medioambiente.