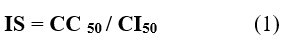Introducción
Las microalgas son organismos distribuidos en todo el planeta, con cientos de miles de especies. Sus componentes con potenciales propiedades benéficas en la nutrición y la salud, han despertado el interés científico, industrial y comercial.1 Actualmente se han investigado varias especies de microalgas por su utilidad como productos de valor añadido con notables cualidades farmacológicas y biológicas.2 Las mismas suponen uno de los grupos con mayor proyección en la industria farmacéutica, cosmética y/o biotecnológica; donde se han aislado, compuestos con importantes propiedades antioxidantes, antimicrobianas, anticancerígenas y antivirales.3-6 Sin embargo, a pesar de los usos potenciales que presentan, ha sido poca la explotación que se ha dado a este recurso.
En su composición química se encuentran pigmentos fotosintéticos que utilizan la luz solar para producir alimento y oxígeno, a partir del dióxido de carbono y agua. Además, numerosos estudios han mostrado que las microalgas representan una fuente atractiva de ácidos grasos poliinsaturados, carotenoides, ficobilinas, péptidos, polisacáridos, y son una buena fuente de vitaminas A, B1, B2 y B12. En la actualidad, se comercializan varios productos en forma de tabletas, polvo, solución o en mezclas con snacks, galletas, fideos, bebidas, caramelos, gomas, vinos y cereales.7
Existe una variedad de cepas de microalgas que ha recibido un especial interés, por sus propiedades antioxidantes, anticancerígenas y antimicrobianas.8 Entre ellas, se encuentran Spirulina maxima, Pseudanaba enatenuis, microalgas Chlorella, Dunaliella, Hematococcus, Porphyra, Porphyridium sp.9 Algunas diatomeas, como Asterionellas p., Rhizosolenia alata muestran actividad antibacteriana contra bacterias patógenas para el hombre, como Bacillus subtilis, S. aureus, Pseudomonas aeruginosa, entre otras.10 La microalga Phorphyridium sp. inhibe el crecimiento de diferentes cepas de bacterias gram-positivas y gram-negativas, levaduras y hongos.11 La capacidad antimicrobiana de las microalgas es una característica que se encuentra bajo estudio actualmente, gracias a su alto contenido de compuestos con propiedades bioactivas, como son los péptidos antimicrobianos.12
La cantidad de especies caracterizadas para su potencial aplicación, continúa siendo pequeña en relación con las existentes. Las investigaciones acerca de sus componentes, cómo aislarlos, incrementar su rendimiento, determinar su bioactividad, sus beneficios o su toxicidad e incluso el desarrollo de productos que sean organolépticamente aceptables, son todavía escasas.1 El mecanismo de acción de los antibióticos convencionales sumado al uso excesivo e inadecuado de estos compuestos, ha llevado al aumento de microorganismos resistentes y multirresistentes. Esta resistencia dificulta el tratamiento y control de enfermedades infecciosas.13 Por ello, una solución prometedora a este problema es encontrar compuestos con diferentes mecanismos de acción.
Porphyridium cruentum es una microalga roja que pertenece a las Rodofitas. Tiene la capacidad de acumular valiosas biomoléculas, como la ficoeritrina y otros carotenoides. Sus células son esféricas de 4 a 6 µm de diámetro, no muestra una pared real, en su lugar está rodeada por una membrana compuesta de polisacáridos sulfatados.14 Estos constituyen hasta el 50-70 % de la materia seca del alga; inhiben la replicación viral, promueven la actividad antioxidante, lo que sugiere un mecanismo de protección celular contra especies reactivas de oxígeno.15
En la actualidad, se intensifica la búsqueda de nuevos candidatos derivados de fuentes naturales, debido al uso excesivo e indiscriminado de los antibióticos. El objetivo del presente estudio fue determinar la capacidad de la biomasa de Porphyridium cruentum; de inhibir in vitro el crecimiento de diferentes microorganismos, Leishmania infantum, Trypanosoma rhodesiense, Trypanosoma cruzi, Trypanosoma brucei; así como determinar el efecto sobre la viabilidad celular en monocitos humanos THP-1 y macrófagos murinos RAW 264.7.
Materiales y métodos
Microalga
Se utilizaron cepas de Porphyridium cruentum, cultivada en el Laboratorio de Anticuerpos y Biomodelos Experimentales (LABEX). Esta microalga fue obtenida de la Colección de Cultivos de Organismos Autotróficos de Trebon, en la República Checa.
Condiciones de cultivo
Se cultivó la microalga P. cruentum en el medio Walne, el cual ha demostrado que existe un buen crecimiento celular.16 Para la preparación del medio de cultivo Walne se utilizó solución de micronutrientes 1 mL, solución de vitaminas 0,1 mL, solución de nutrientes 1 L, y agua de mar filtrada 1 L. El cultivo se llevó a cabo por triplicado en erlenmeyer de 50 mL de capacidad con 10 mL de medio de cultivo. Cuando estas alcanzaron la fase de crecimiento exponencial, fueron inoculados en el medio de cultivo Walne a una concentración celular de 8,7 x 105 células/mL.
El cultivo se realizó durante doce días, por triplicado en módulos (bolsas desechables) de 50 L capacidad con 10 L de medio de cultivo, sometidos a condiciones de temperatura de 20 a 24 ºC, bajo luz artificial de 300 lux, con lámparas de 40 W (GEDEME, Suecia) dispuesto de forma lateral al módulo de cultivo. Los valores de pH se ajustaron a 7,5 con Tris, de molaridad 1 molar; en el caso de la salinidad, esta no varía mucho, ya que la base de la formulación es agua de mar y las concentraciones de los reactivos que se añaden son pequeñas, se mide la conductividad al medio que debe estar alrededor de 50-55 mS/cm, lo cual corresponde a una salinidad de 35 al 37 %. El cultivo se realizó durante doce días, con mediciones diarias de absorbancia a 545 nm (espectrofotómetro UV-visible PG Instruments T60U, Jasco V-730).
Obtención de biomasa
La biomasa fue recolectada por el método gravimétrico. Diariamente se centrifugaron 25 mL de muestra del cultivo celular a 3 500 rpm. La temperatura en la estufa (DHG-9146A, electrotérmica, China) fue de 105 ºC, hasta lograr un peso constante. La biomasa concentrada se calculó en balanza analítica (Sartorius, BS 121S, Alemania) expresándose en g células·L-1.
Se filtraron 5 L de P. cruentum a través de filtros Whatman 4, separándolo del sobrenadante. Inmediatamente después del filtrado, el paquete celular se mantuvo en congelación a -20 ºC.
Composición química de la biomasa
Se realizó un barrido espectrofotométrico de la biomasa obtenida 16 para evaluar la pureza, mediante relaciones de absorbancia a 280, 545, 565, 620 y 650 nm en un espectrofotómetro UV-visible modelo UV-2061, marca Rayleigh de China, a 25 ºC.
El lisado de la biomasa se realizó con una solución buffer acetato de sodio pH 5,5, con el objetivo de romper las estructuras celulares, en una proporción de 1 g de biomasa húmeda (20 % biomasa seca) en 4 mL de buffer acetato de sodio 1 mol/L agitando, en un agitador magnético convencional a temperaturas de laboratorio, produciendo la lisis celular mediante choque osmótico. Luego se remueve el debris celular en una centrífuga refrigerada (SELECTA, España) a 25 ºC y a una velocidad de 2 500 rpm, durante 15-25 min, obteniéndose un sólido.
Obtención del extracto acuoso de la biomasa
El extracto acuoso de la biomasa fue preparado en agua desmineralizada a una concentración madre de 1 000 μg/mL. A partir de esta se realizaron diluciones hasta obtener seis niveles de concentración (512, 256, 128, 64, 32, 16 μg/mL). Estos niveles de concentración fueron los utilizados, tanto para la evaluación antimicrobiana, como para el ensayo citotóxico.
Evaluación antimicrobiana in vitro
La actividad antimicrobiana in vitro de la biomasa se determinó por el método de microdilución con resazurina en microplacas estériles de 96 pocillos.17 Esta actividad fue evaluada en los microorganismos Leishmania infantum MHOM/MA (BE)/ 67, Trypanosoma rhodesiense, Trypanosoma cruzi (Tulahuen CL2, cepa β galactosidasa, Trypanosoma bruceiSquib 427, suministrados por el Laboratorio de Microbiología, Parasitología e Higiene (LMPH) de la Universidad de Amberes, Bélgica.
Se utilizaron los fármacos de referencia, miltefosina (L. infantum), suramina (T. brucei y T. rhodesiense), benznidazol (T. cruzi), todos de Sigma-Aldrich, EE.UU., para cada uno de los microorganismos evaluados, respectivamente. Se utilizaron condiciones de cultivo específicas para garantizar el crecimiento satisfactorio de levaduras y parásitos, de acuerdo con los procedimientos estándar.
Ensayo de citotoxicidad in vitro
Se evaluó el efecto citotóxico por el método de reducción de rezasurina sobre la viabilidad celular de las líneas RAW 264.7 (macrófagos murinos, adherentes) y TPH-1 (pre-monocitos de leucemia humana en suspensión). Ambas líneas celulares se adquirieron de ATCC (American Type Culture Collection). Se usó el fármaco de referencia, tamoxifeno como control estándar. Se utilizaron condiciones de cultivo específicas para garantizar el crecimiento satisfactorio de las líneas celulares, de acuerdo con los procedimientos estándar.
Para los ensayos de citotoxicidad, las células RAW 264.7 fueron sembradas en erlenmeyers a 37 °C, a 5 % de CO2; se retiraron con raspado celular (solo para células adherentes) y centrifugaron a 130 xg de fuerza centrífuga (10 min, 4 °C). Para el ensayo 200 µL del inóculo de células (5 x 105 células/pocillo) fueron sembradas en microplacas estériles de 96 pocillos e incubadas por 24 h a 37 °C, en una atmósfera de 5 % de CO2. Pasado este tiempo, se centrifugaron las células (solo para THP-1, solo células no adherentes) 1 800 rpm/10 min, donde se desechó el sobrenadante. Se añadió 200 µL de medio fresco en las placas de 96 pocillos (las concentraciones de extracto y el disolvente que en este caso se trató del agua, deben diluirse en el medio antes). Las células de control se incubaron únicamente con 200 µL de medio. Se agregó 10 µL de fármaco de referencia (Tamoxifeno), se incubaron las placas durante 24-48 h a 37 °C en CO2 al 5 %, para luego añadir 50 µL de resazurina (2,2 µg/mL) a cada pozo e incubar por 4 h a 37 °C.
El índice de selectividad (IS) para examinar la relación entre la citotoxicidad y una actividad elegida, se definió como la relación entre el valor CC50 de citotoxicidad y el valor CI50 de actividad antimicrobiana 18, según la ecuación (1).
donde
IS: Índice de selectividad
CC50: Concentración citotóxica media
CI50: Concentración inhibitoria media
Resultados y discusión
La búsqueda de nuevos productos naturales con potencial farmacológico ha aumentado, debido a que se han extendido las investigaciones con el fin de aislar un mayor número de compuestos, que puedan combatir una gran variedad de enfermedades, y que sirvan como base para la síntesis de nuevos fármacos. En tal sentido, el presente trabajo explora tanto en la composición bioquímica fundamental de la microalga P. cruentum y su potencial efecto antimicrobiano sobre diferentes cepas de microorganismos patógenos, como en el impacto sobre la viabilidad celular de leucocitos humanos y murinos.
Cultivo celular
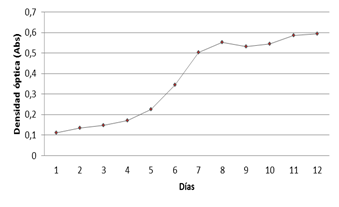
El cultivo se llevó a cabo en el Laboratorio de Anticuerpos y Biomodelos Experimentales (LABEX), el comportamiento de P. cruentum en el medio de cultivo Walne, fue observado durante doce días con mediciones diarias de absorbancia a 545 nm. Los datos obtenidos durante este tiempo fueron promediados y graficados para evaluar la curva de crecimiento de la microalga en estudio (figura 1).
La adaptación al medio de cultivo no se comportó de manera rápida durante los primeros cuatro días, su crecimiento fue lento, lo cual no es muy beneficioso, pues esta adaptación debe ser alrededor de las 48 h de iniciado el cultivo.
La fase de crecimiento exponencial o aceleración positiva comenzó a observarse al quinto día de cultivada la microalga, donde se observó un resultado importante, ya que evidencia un crecimiento celular con respecto a los niveles de producción al comienzo de los cultivos. Si se toma en cuenta que el conteo celular o la medición de absorbancia son medidas de la producción de biomasa microalgal, se puede decir que a partir de los cinco días los cultivos comenzaron a mostrar un buen rendimiento. Esta fase fue solo de cuatro días, lo cual, desde el punto de vista productivo, no es favorable; pues lo que se requiere es que las células alcancen la densidad máxima en un corto periodo de tiempo, siendo este uno de los principales requerimientos para apoyar el desarrollo de la industria de las microalgas, donde el cultivo de estas debe ser eficiente a gran escala.19
La etapa de crecimiento estacionario comenzó a partir del día ocho de iniciado el cultivo con una pequeña desaceleración en su crecimiento, que pudiera deberse al suministro de aire, ya que el crecimiento de la microalga se comporta proporcionalmente a este, donde los cultivos alcanzan densidades superiores a medidas que este aumenta. Esta fase es de vital importancia en el cultivo de las microalgas, debido a que es el período donde se alcanza la máxima velocidad de crecimiento.
La adaptación de la microalga a un medio de cultivo artificial sugiere un proceso de desarrollo de investigación, que establezca las condiciones óptimas para el desarrollo microalgal. Investigaciones a escala de laboratorio se han realizado en LABEX sobre el proceso de cultivo de esta microalga: crecimiento de P. cruentum, bajo determinadas condiciones con diferentes medios de cultivo, velocidades de agitación, y empleando agentes aceleradores del crecimiento como la zeolita y el campo magnético.19
Con la utilización de bolsas desechables de 10 L, el proceso de cultivo presentó algunos inconvenientes, principalmente con la agitación, la alimentación al sistema del aire enriquecido con CO2, y con la adherencia de las células a las paredes de las bolsas desechables, imposibilitando el apropiado crecimiento celular.
La tecnología del cultivo está relacionada, tanto con el diseño y configuración de los sistemas de cultivos abiertos o cerrados, como las condiciones operativas que conducen al equilibrio entre el crecimiento óptimo de las microalgas y la productividad
Caracterización de la biomasa
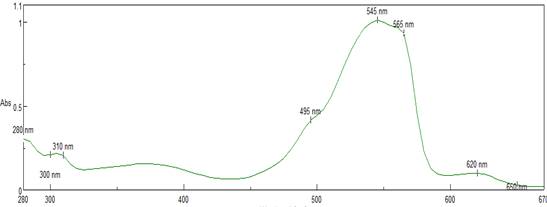
La microalga Porphyridium cruentum ha demostrado ser eficiente en la producción de ficoeritrina, ya que se ha encontrado que esta especie produce grandes cantidades de esta proteína, por lo que llevar a cabo un barrido espectrofotométrico nos puede indicar la presencia de este compuesto químico en la microalga, además de otros métodos que nos pueden indicar con exactitud la composición química de Porphyridium cruentum. El barrido de las muestras de biomasa lisadas se obtuvo mediante la relación de absorbancias a estas longitudes de onda, (545 nm/280 nm); se obtuvo una pureza promedio de 4,7 lo cual está en correspondencia con lo reportado en la literatura.20 En la figura 2 se muestra la curva de barrido obtenida.
Se observó la presencia de bandas que corresponden con las subunidades α y β, de la ficoeritrina a través de la relación de absorbancia 545/280 > 4, corroborando así la pureza de la biomasa utilizada. Esta relación es un indicador de que puede ser utilizada como grado analítico.21 Sobre la base del espectro, se puede observar la presencia de ficoeritrinas con un máximo de longitud de onda de 545 nm, y una huella espectrofotométrica a 495 nm, aportada por la absorbancia que emiten las proteínas presentes en la biomasa, lo cual corresponde a la β- ficoeritrina, demostrando la presencia de esta ficobiliproteína en la biomasa utilizada.
Evaluación antimicrobiana in vitro
En la actualidad, existe una preocupación alarmante frente al exponencial crecimiento de la resistencia antibiótica frente a numerosos patógenos que afectan a la humanidad. Muchos son los intentos desde diferentes campos para combatir esta resistencia; uno de estos es el uso de fuentes naturales para la obtención de nuevos antibióticos eficaces contra microorganismos resistentes.
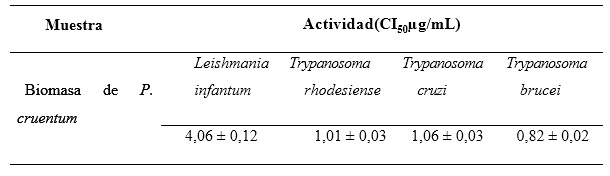
Para el estudio fueron seleccionados varios microorganismos que mostraron poseer diferentes mecanismos de resistencia a los antimicrobianos. Los parásitos T. cruzi, T. brucei, T. rhodesiense y L. infantum, han sido detalladamente estudiados por evadir los mecanismos inmunitarios y por mostrar resistencia a determinados agentes antibióticos.22 Los resultados obtenidos mediante el cribado antimicrobiano (tabla 1) revelan que el extracto crudo de biomasa presenta actividad antiparasitaria, lo cual evidencia un marcado efecto antiparasitario contra las cepas seleccionadas en el estudio.
La biomasa de P. cruentum muestra valores de actividad, sobre todo frente a parásitos del género Trypanosoma: T. brucei, T. rhodesiensis y T. cruzi. En el caso del estudio frente a L. infantum, los resultados revelaron un marcado efecto inhibitorio, pero por debajo de lo exhibido contra el género Trypanosoma, lo que denota una mayor sensibilidad por estos parásitos frente a componentes presentes en la biomasa de la microalga.23
Esta actividad antimicrobiana de la biomasa de P. cruentum frente a especies del género Trypanosoma, puede deberse a los compuestos que normalmente se encuentran en las microalgas como pigmentos, alcoholes, aminoácidos, glicerol, etc., así como polisacáridos extracelulares y ácidos grasos poliinsaturados con propiedades antibacterianas.24 Se ha reportado, además, que P. cruentum produce un exopolisacárido que evita que Heliobacter pilori y Aeromonas veronii (bacterias patógenas del humano), Vibrio campbellii, Vibrio ordalii y Streptococcuss aprophyticus, se adhieran a las células hospederas.25 Un estudio realizado obtuvo halos de inhibición de la bacteria P. aeruginosa con extractos a partir de la biomasa de Porphyridium cruentum.
Esta actividad antimicrobiana de las microalgas rojas, algunos autores la atribuyen también a los pigmentos presentes y sus derivados, los cuales han sido estudiados como compuestos antiparasitarios.25 Son escasos los reportes de actividad antiprotozoaria en microalgas, sin embargo, se ha demostrado que especies como las rojas y verdes presentan este tipo de actividad. En el caso de la actividad antimicrobiana frente al género Trypanosoma, algunos autores refieren que extractos crudos de cuatro microalgas verdes marinas (Cladophora rupestris, Codium frágilsp., Tomentosoides, y Ulva lactuca) presentan actividad tripanocida.26
En un estudio realizado sobre la llamada microalga roja irlandesa Chondrus crispus, se encontró que los extractos de esta presentaron actividad contra T. cruzi. Otros estudios han identificado extractos procedentes de microalgas que presentan actividad tripanocida, C. reinhardtii, S. obliquus y T. suecica, y fueron más efectivos que el fármaco Nifurtimox (Nfx), 10 µM, que además del Benznidazol, son los únicos fármacos disponibles hasta el momento para combatir la tripanosomiasis.
Considerando que los bajos efectos de los fármacos antichagásicos se debe, al menos en parte, a la baja eficacia contra las formas intracelulares del parásito, las terapias basadas en combinaciones de fármacos, han sido propuestas como alternativas promisorias para el tratamiento de la trypanosomiasis, considerando que algunos compuestos naturales que actualmente están bajo estudio tienen baja eficacia, por lo que la terapia combinada adquiere importancia real, para aumentar la capacidad de acción, para disminuir las dosis empleadas, y reducir los efectos adversos que generan ambos fármacos.27
Los macrófagos desarrollan la principal respuesta inmune frente a parásitos intracelulares. Los mecanismos fagocíticos dependiente (especies reactivas del oxígeno y nitrógeno) e independiente del oxígeno (enzimas lisosomales) favorecen la eliminación de estos microorganismos. Sin embargo, algunos parásitos desarrollan mecanismos para evadir la respuesta defensiva de estas células y sobreviven en el interior del macrófago, derivando en la cronicidad de la infección y dificultades para su eliminación por agentes antimicrobianos. De ahí la importancia que los agentes antiparasitarios sean capaces de eliminar los parásitos sin afectar la viabilidad celular de estas poblaciones de monocitos-macrófagos.28
En tal sentido, se realizó en forma paralela el ensayo de viabilidad celular utilizando dos líneas de leucocitos, la línea celular de macrófagos murinos RAW 264.7 y la línea monocítica humana THP-1. El estudio demostró que la biomasa de la microalga P. cruentum no afectó la viabilidad celular de estas células (CC50 > 512 µg/mL), siendo entonces selectiva frente a los parásitos seleccionados (figura 3).

Fig. 3 Efecto de la biomasa de P. cruentum sobre la viabilidad celular de monocitos THP-1 y macrófagos RAW 264.7
Los polisacáridos presentes en la microalga pueden sugerir que estos incrementan la fagocidad y la actividad de secreción de los macrófagos, inducen la liberación de citoquinas, demostrando también una actividad antiproliferativa en varios linares de células anticancerígenas humanas, sin embargo se necesitan varios estudios para demostrarlo.29
El cálculo del índice de selectividad (IS) mostró que en todos los casos el valor fue superior a 16 (IS=16). En general, la biomasa clasifica como selectiva a los microorganismos seleccionados debido a grandes diferencias entre las concentraciones activas y tóxicas expresadas a través del índice de selectividad.30
Por otro lado, esta evidencia de no ser citotóxico frente a células leucocitarias, avala el potencial uso de componentes fluorocromo derivados de esta microalga como marcadores leucocitarios. Como se mencionó anteriormente, la microalga P. cruentum es una fuente de obtención de ficoeritrina, un fluorocromo utilizado en el inmunomarcaje de células, mediante el acoplamiento con anticuerpos monoclonales para estudiar la expresión de marcadores tumorales y otros estudios histoquímicos.
Hasta la fecha, el espectro antimicrobiano de Porphyridium cruentum ha sido dirigido, básicamente, a explorar su efecto antibacteriano frente a bacterias del género Staphylococcus aureus y Pseudomonas aeruginosa. El estudio de la actividad antimicrobiana del extracto de la biomasa de la microalga demostró nuevas evidencias del amplio arsenal antimicrobiano, fundamentalmente del tipo antiparasitario.
Conclusiones
El extracto de la biomasa de la microalga Porphyridium cruentum mostró actividad antimicrobiana frente a los parásitos de los géneros Leishmania y Trypanosoma. Estos resultados avalan el uso de dicha microalga como fuente de obtención de sustancias farmacológicamente activas para combatir infecciones causadas por esos microorganismos, contribuyendo así a la reducción de la resistencia antimicrobiana. En el caso de la viabilidad celular en macrófagos humanos RAW 264 7 y monocitos THP-1, la biomasa no mostró efecto citotóxico en este tipo de células.