Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.34 no.1 Santiago de Cuba ene.-abr. 2014
ARTÍCULO ORIGINAL
Potencialidades de un biosorbente algal para la remoción de metales pesados
Potentiality of a Seaweed Biosorbent for Heavy Metals Removal
MSc. Omar Gutiérrez-Benítez, Dra. Julia González-Álvarez, Dra. María Sonia Freire-Leira, Dr. Iván Leandro Rodríguez-Rico, MSc. Ángel Ramón Moreira-González
Centro de Estudios Ambientales de Cienfuegos, Cienfuegos, Cuba. omar@gestion.ceac.cu
RESUMEN
La biosorción es considerada una tecnología alternativa para la remoción de metales pesados de aguas residuales y la utilización de algas marinas como adsorbentes incentiva el interés científico, teniendo en cuenta la variedad, abundancia y disponibilidad de diferentes especies nativas y arribantes a los litorales costeros cubanos. El objetivo del trabajo es caracterizar un biosorbente algal, preparado a partir del alga marina Sargassum, para conocer sus potencialidades para la remoción de metales pesados en soluciones acuosas. Se realizó la caracterización físico-química, morfológica y estructural del biosorbente utilizando avanzadas técnicas de microanálisis y análisis superficial. Se confirma presencia de los principales grupos funcionales presentes en el ácido algínico, alginatos, polisacáridos y proteínas que contiene este tipo de biomasa algal, biopolímeros que aportan sitios activos que facilitan los mecanismos de biosorción y por consiguiente le pueden aportar a este tipo de biosorbente una alta capacidad de biosorción de metales pesados.
Palabras clave: biosorción, biosorbente, metales pesados, algas, sargassum.
ABSTRACT
The biosorption is considered an alternative technology for removal of heavy metals from wastewater and the use of seaweeds as adsorbents encourages scientific interest, considering the variety, abundance and availability of different species growing or arriving at the coastal shoreline. The aim of the research was to characterize a seaweed biosorbent prepared from marine algae Sargassum, to know their potentialities for heavy metals removal from aqueous solutions. A characterization physico-chemical, morphological and structural of a seaweed bioadsorbent was performed using microanalysis and surface anaytical advanced techiques. Was confirmed of major functional groups present in the alginic acid, alginates, polysaccharides and proteins containing this type of seaweed biomass, biopolymers that facilitate the biosorption mechanisms and consequently they can contribute a high capacity of biosorption of heavy metals of this biosorbente.
Keywords: biosorption, biosorbent, heavy metals, seaweed, sargassum.
INTRODUCCIÓN
La contaminación ambiental por metales pesados se identifica como uno de los problemas ambientales más acuciantes por sus efectos perjudiciales para el medio ambiente y la salud humana, debido a su movilidad en los sistemas acuosos, su toxicidad y su gran capacidad bioacumulativa. En este escenario la biosorción es considerada como una tecnología alternativa para la remoción de metales pesados de aguas residuales, cuya viabilidad depende de consideraciones sobre el efluente, biosorbente, equipos de proceso, regeneración y/o recuperación del metal y transporte [1-3].
En la literatura científica [4-12] se detallan extensas referencias de resultados de investigaciones sobre la utilización de algas marinas como biosorbentes para la remoción de diferentes metales pesados. En este contexto su utilización continúa incentivando el interés científico en la búsqueda y desarrollo de nuevos materiales biosorbentes debido a su gran capacidad de biosorción, existiendo aún nichos o espacios vacíos de conocimientos de estos bioprocesos.
La caracterización de estos biosorbentes constituye un paso fundamental para la comprensión de los mecanismos físico-químicos involucrados en el proceso de biosorción. En la actualidad están teniendo cada vez una mayor aplicación, avanzadas técnicas de microanálisis y análisis superficial, tales como análisis elemental, Espectrometría de Emisión Óptica con Plasma Acoplado Inductivamente (ICP-OES), Microscopia Electrónica de Barrido con Dispersión de Rayos X (SEM/EDX), Espectrofotometría Infrarroja por Transformada de Fourier (FTIR), Espectrometría de Masas con Plasma Acoplado Inductivamente (ICP-MS) y Espectroscopia de Fotoelectrones emitidos por Rayos X (XPS), entre otras que permiten obtener información morfológica, estructural y de los grupos funcionales que contienen los biosorbentes y su particpación en los mecanismos de biosorción [1-2,13].
Teniendo en cuenta la variedad, abundancia y disponibilidad de especies de algas marinas nativas y arribantes a los litorales costeros cubanos, su utilización como biosorbentes de metales pesados puede constituir una alternativa en el desarrollo de tecnologías que permitan reducir la contaminación ambiental provocada por estos desechos. El objetivo del trabajo fue caracterizar un biomatrerial algal, preparado a partir del alga marina Sargassum, para conocer sus potencialidades como biosorbente para la remoción de metales pesados en soluciones acuosas.
MATERIALES Y MÉTODOS
Biomasa algal: La colecta y selección de la especie de algas marina Sargassum se realizó a partir de biomasa algal arribante al litoral costero de Cayo Coco, al norte de la provincia Ciego de Ávila, Cuba. El proceso de selección se realizó, in situ, teniendo en cuenta las características taxonómicas y morfológicas de la especie, reportadas en la literatura especializada para la región [14-16]. La biomasa algal fue lavada con abundante agua corriente y finalmente con agua suavizada, luego fue secada al sol durante 48 horas, envasada en bolsas de polietileno y almacenada en condiciones ambientales adecuadas.
Preparación del biosorbente algal: A la biomasa algal se le realizó cuarteos y homogenización, y luego fue sometida a lavados con agua corriente y agua destilada. Fue secada en una estufa de desecación de circulación natural Indelab Labolan S. L. a 60 oC durante 24 h y posteriormente fue secada al sol durante 5 h.
Finalmente fue almacenada en bolsas de polietileno. Se realizó la molienda del material en un molino rotatorio centrífugo orto cíclico de cuchillas Pacisa, con diámetro de cuchillas de 120 mm, velocidad de 10000 r.min-1 y tiempo de molienda de 1 minuto. Posteriormente se realizó el tamizado de la biomasa algal molida en un tamiz vibratorio con regulación de potencia, ciclos y tiempo de tamizado Filtra Vibration FTL 0200; utilizando tamices C.I.S.A. ISO 3310.1 con abertura nominal de 0.1, 0.5, 1.0, 1.6 y 2.0 mm. En la investigación se utilizó como biosorbente algal las fracciones con tamaño de partículas de 0.5-1.0 mm, 1.0-1.6 mm y 1.6-2.0 mm; las cuales fueron almacenadas en bolsas de nylon selladas y conservadas en condiciones ambientales adecuadas.
Caracterización del biosorbente algal
Contenido de agua: El contenido de agua del biosorbente algal con tamaño de partículas de 0.5-1.0 mm, 1.0-1,6 mm y 1.6-2.0 mm, expresado como por ciento de humedad base húmeda, se realizó en un analizador electrónico automático de humedad MA 30 Sartorius; determinándose el por ciento de humedad (base húmeda) de 1 g de muestra. Se realizaron las determinaciones por duplicado.
Contenido de cenizas: El contenido de cenizas del biosorbente algal con tamaño de partículas de 0.5-1.0 mm, 1.0-1.6 mm y 1.6-2.0 mm se realizó por el método gravimétrico, añadiendo aproximadamente 2 g de muestra (base seca) en crisoles previamente secos a peso constante y tarados; introduciéndolos posteriormente en una mufla W.C. HERAEUS HANAU tipo KR 170, a una temperatura de 550-600 oC por un tiempo de 2 h. Una vez que toda la materia orgánica se ha eliminado se sacan los crisoles de la mufla, se colocan en una estufa de desecación de circulación natural Indelab Labolan S. L. a 105 oC durante 24 h, se enfrían en un desecador de sílica gel al vacío durante 30 min y finalmente se pesan. El contenido de cenizas en base húmeda y en base seca se determina por diferencia de peso. Se realizaron las determinaciones por duplicado.
Superficie específica: El área superficial del biosorbente algal con tamaño de partículas de 0,5-1,0 mm se determinó mediante la técnica de biosorción utilizando la isoterma BET (Brunauer, Emmet y Teller, 1938) en un analizador de área superficial y porosidad ASAP 2020, Micromeritics. Previamente la muestra se llevó a una estufa de desecación de circulación natural Indelab Labolan S. L. a 105 oC durante 24 h y durante la determinación de la superficie específica fue desgasificada a 70 oC. Se realizaron las determinaciones por duplicado.
Análisis elemental: La cuantificación del contenido de carbono, hidrógeno, nitrógeno y azufre en el biosorbente algal con tamaño de partículas de 0.5-1.0 mm, 1.0-1.6 mm y 1.6-2.0 mm fue realizada en un analizador elemental THERMO FINNIGAN modelo FLASH 1112, y el oxígeno en un analizador elemental CARLO ERBA modelo EA 1108.
Contenido catiónico: El contenido catiónico del biosorbente algal con tamaño de partículas de 0.5-1.0 mm, 1.0-1.6 mm y 1.6-2.0 mm se fue determinado mediante Espectrometría de Emisión Óptica con Plasma Acoplado Inductivamente (ICP-OES), en un equipo ICP-OES PerkinElmer, modelo Optima 4300 DV con muestrador automático PerkinElmer AS93-plus. La muestra inicial del biosorbente fue previamente molida en un molino de bola vibratorio SPECAMILL, hasta un tamaño de partícula superfino (talco), utilizandose 0,50 g de la misma. Posteriormente es sometida a una digestión ácida en microondas y luego se diluyó 1:2 para medirlas en el ICP-OES. El análisis de realizó por duplicado y cada valor de concentración es la medida de tres réplicas consecutivas.
Microscopia Electrónica de Barrido con Dispersión de Rayos X (SEM/EDX): La caracterización morfológica del biosorbente algal con tamaño de partículas de 0.5-1.0 mm, 1.0-1.6 mm y 1.6-2.0 mm fue realizada en un microscopio electrónico de barrido de emisión de campo FESEM ULTRA Plus Zeiss Gemini. Las muestras del biosorbente algal se depositaron en la placa soporte y fueron recubiertas con oro para evitar sombras en las imágenes, para posteriormente ser introducidas en el equipo.
Espectrofotometría Infrarroja por Transformada de Fourier (FTIR): Para obtener los espectros FTIR del biosorbente algal con tamaño de partículas de 0.5-1.0 mm, 1.0-1.6 mm y 1.6-2.0 mm se empleó un Espectrofotómetro BRUKER, modelo IFS-66v. La muestra inicial fue molida previamente en un molino de bola vibratorio SPECAMILL, hasta un tamaño de partícula superfino (talco), preparándose posteriormente pastillas con KBr conteniendo un 2.5 por ciento de biosorbente. Las pastillas preparadas fueron analizadas en el espectrofotómetro en el rango de infrarrojo medio (4000-400 cm-1). A cada tamaño de partículas se le realizaron tres réplicas.
Espectroscopia de Fotoelectrones emitidos por Rayos X (XPS): Para identificar y cuantificar la concentración de los elementos presentes en la superficie del biosorbente algal con tamaño de partículas de 0.5-1.0 mm fue usando un equipo Thermo Scientific K-Alpha Electrón Spectroscopy Chemical Análisis (ESCA). La muestra inicial del biosorbente fue molida previamente en un molino de bola vibratorio SPECAMILL, hasta un tamaño de partícula superfino (talco).
Punto de carga cero (pHpzc): El punto de carga cero del biosorbente algal con tamaño de partículas de 0.5-1.0 mm fue determinado empleado la técnica de inmersión [17-19]. El procedimiento consistió en preparar 100 mL de suspensiones del biosorbente con una relación sólido-líquido conocida de 2,75 gL-1 (base seca), en una solución de nitrato de potasio (KNO3) 0.03 M, ajustadas a diferentes valores de pH (1,1.5, 2, 2.5, 3, 4, 5, 6, 7, 8) con soluciones de HCl 0.1 M y de NaOH 0.1 M. La suspensión en matraz Erlenmeyer de 100 mL fue tapada con película plástica PARAFILM y agitada durante 24 horas hasta alcanzar el equilibrio en un agitador orbital UNITRONIC-ORBITAL SELECTA ajustado a 90 r.min-1 y 25 oC. El cambio de pH (DpH) fue calculado y se determinó el pHpzc como el pH con mínimo valor de DpH. El pH inicial y final fue determinado en un pH metro MP 3230 Metter-Toledo con electrodo combinado. Las determinaciones se realizaron por duplicado.
RESULTADOS Y DISCUSIÓN
Contenido de agua: Los resultados del contenido de agua, expresado como % de humedad base húmeda, del biosorbente algal se muestran en la tabla 1, son del orden del 17,25 y 17,76 %, no existiendo diferencias apreciables con el tamaño de partículas.
Tabla 1
Contenido de agua del biosorbente algal, expresado como porciento de humedad base húmeda
| Tamaño de partícula | |||
|---|---|---|---|
| 0.5-1.0 mm | 1.0-1.6 mm | 1.6-2.0 mm | |
| Humedad(%) | 17.76 ± 0.20 mm | 17.25 ± 0.29 mm | 17.25 ± 0.16 mm |
Contenido de cenizas: Los resultados del contenido de cenizas del biosorbente algal se muestran en la tabla 2, siendo el por ciento de cenizas base seca del orden del 16,45-16,72 %, no existiendo diferencias apreciables con el tamaño de partículas. El alto contenido de cenizas determinado por el método gravimétrico se corresponde con el alto contenido catiónico determinado mediante Espectrometría de Emisión Óptica con Plasma Acoplado Inductivamente (ICP-OES), y con los valores reportados por Casas-Valdez et al. [20], Yang y Chen [21] y Sierra y Álvarez [22] para la especie Sargassum.
Tabla 2
Contenido de cenizas del biosorbente algal
| Tamaño de partícula | |||
|---|---|---|---|
| 0.5-1.0 mm | 1.0-1.6 mm | 1.6-2.0 mm | |
| Cenizas base seca(%) | 16.72± 0.04 mm | 16.50 ± 0.06 mm | 16.45 ± 0.02 mm |
Superficie específica: La superficie específica, expresada como área superficial BET (Brunauer, Emmett y Teller) del biosorbente algal con tamaño de partículas de 0.5-1.0 mm es del orden de 0,17 m2.g-1, valores bajos típicos de estos tipos de biomateriales [23].
Análisis elemental: La composición elemental del biosorbente algal se muestra en la tabla 3, observándose que en la composición del biosorbente algal hay predominio de los elementos oxígeno, carbono e hidrogeno, no existiendo diferencias apreciables con el tamaño de partículas.
Tabla 3
Composición elemental del biosorbente algal
| Elemento | Tamaño de partícula | ||
|---|---|---|---|
| 0.5-1.0 mm | 1.0-1.6 mm | 1.6-2.0 mm | |
| Carbono (%) | 35.20 | 34.67 | 34.58 |
| Oxígeno (%) | 50.45 | 50.29 | 50.84 |
| Hidrógeno (%) | 5.05 | 5.33 | 5.01 |
| Nitrógeno (%) | 0.87 | 0.92 | 0.91 |
| Azufre (%) | 0.25 | 0.31 | 0.32 |
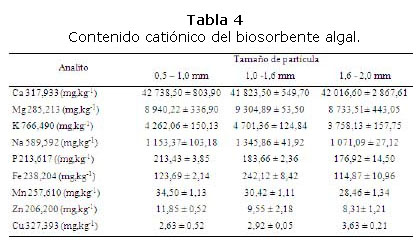
Contenido catiónico: El contenido catiónico del biosorbente algal se muestra en la tabla 4. En todos los casos hay una alta riqueza de estos elementos, característicos para la especie Sargassum y reportadas por Casas-Valdez et al. [20], Yang y Chen [21] y Sierra y Álvarez [22]; con predominio del calcio, con concentraciones superiores a los 41000 mg.kg-1 y luego por orden de magnitud el magnesio, potasio, sodio, fósforo, hierro, manganeso, zinc y cobre. Estos resultados se corresponden con el alto contenido de cenizas determinadas anteriormente por el método gravimétrico.
3.6 Microscopia Electrónica de Barrido con Dispersión de Rayos X (SEM/EDX): En la microestructura de los tres tamaños de partículas del biosorbente algal se aprecia una gran heterogeneidad morfológica y estructural, caracterizados por estructuras amorfas, laminares, cilíndricas, rugosas y protuberantes; lo cual es propio de los caracteres morfológicos de cada una de las partes que componen la especie Sargassum [15], tales como el talo, cauloide cilíndrico y liso, ramas primarias delgadas y lisas, filoides lineales, vesículas esféricas lisas o algunas mucronadas, criptóstomas, receptáculos silicuosos, filiformes, cilíndricos, ramificados dicotómicamente y verrugosos, así como la presencia de diatomeas.
En correspondencia con lo anterior los espectros del microanálisis de los tres tamaños de partículas del biosorbente algal también muestran una composición heterogénea en cuanto a los perfiles de concentración y en menor medida en los elementos químicos que lo componen; similar a lo reportado por Yang y Chen [21]. En la figura 1 se muestra un espectro del microanálisis del biosorbente algal con tamaño de partículas de 0.5-1.0 mm, observándose el alto contenido catiónico, principalmente de calcio y magnesio, lo cual esta en correspondencia con los resultados obtenidos de las cenizas gravimétricas y de la Espectrometría de Emisión Óptica con Plasma Acoplado Inductivamente (ICP-OES). Los contenidos de carbono y oxígeno se corresponden con los obtenidos en el análisis elemental.
Espectrofotometría Infrarroja por Transformada de Fourier (FTIR): Los espectros FTIR muestran que la posición de los picos más representativos encontrados en el biosorbente algal con tamaño de partículas de 0,5-1,0 mm, 1,0-1,6 mm y 1,6-2,0 mm son coincidentes, solo variando ligeramente su intensidad; lo que evidencia que este material presenta una composición altamente compleja debido a la cantidad de grupos funcionales superficiales presentes, aunque al mismo tiempo es muy similar el comportamiento con el tamaño de partículas. En la figura 2 se muestra los espectros FTIR del biosorbente algal con tamaño de partículas de 0,5-1,0 mm y en la tabla 5 se recogen la posición de los picos más representativos encontrados, junto con su número de onda (v), en cm-1 y las asignaciones atribuidas según la litetrura [24-26], constatándose la presencia de los principales grupos funcionales (-COOH, -COOM, -OH, -NH2, -CH y -SO3H) presentes en el ácido algínico, alginatos, polisacáridos y proteínas que contiene este tipo de biomasa algal [1-2,5,8,10,13,27-30].
Tabla 5
Posición de los picos más representativos en el espectro FTIR del biosorbente algal
| Pico | Número de onda (v), (cm-1) | Asignación |
|---|---|---|
| 1 | 3380 | -OH, NH |
| 2 | 2922 | -CH asimétrico |
| 3 | 1610 | -C=O (COO-M) asimétrico |
| 4 | 1508 | -NH |
| 5 | 1435 | -C=O (COO-M) simétrico |
| 6 | 1363 | -SO3 asimétrico |
| 7 | 1250 | -C-O(COOH) |
| 8 | 1145 | -SO3 simétrico |
| 9 | 1068 | -C-O(alcohol) |
| 10 | 1042 | -C-O(alcohol) |
| 11 | 815 | -S=O |
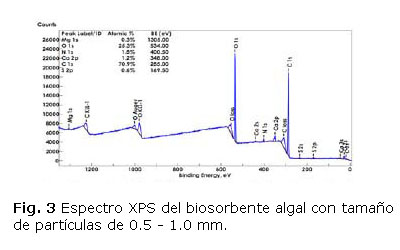
Espectroscopia de Fotoelectrones emitidos por Rayos X (XPS): La composición elemental superficial biosorbente algal con tamaño de partículas de 0,5-1,0 mm fue obtenida a partir de los espectros de baja resolución y calculadas las concentraciones atómicas de dichos elementos. En la figura 3 se muestra la identificación y cuantificación de los elementos presentes, expresada en por ciento atómico y sus correspondientes energías de enlace (BE).
Se puede apreciar que la composición de carbono y oxígeno a nivel superficial del biosorbente, del orden de 70,9 y 25,3 % atómico respectivamente, difiere significativamente de los resultados obtenidos en el análisis elemental y en el análisis semicuantitativo por EDX, habiendo en este caso un aumento del contenido de carbono y una reducción del contenido de oxígeno, que puede ser explicado teniendo en cuenta que el análisis elemental ofrece resultados de la composición global del biosorbente algal. La identificación y cuantificación de los principales enlaces presentes a partir de los picos del espectro del C1s con energías de enlace de 285, 286,62 y 288,62 eV pueden ser asignados los grupos hidrocarbono, eter, alcohol y carboxilatos presentes en los polisacáridos y alginatos de la biomasa algal [1,2,5, 8, 10,13, 27, 29,30]; confirmando los resultados obtenidos por FTIR.
Punto de carga cero (pHpzc): En la figura 4 se muestra la determinación del punto de carga cero del biosorbente algal con tamaño de partículas de 0,5-1,0 mm, mediante el comportamiento del pH de equilibrio vs pH inicial de la suspensión, observándose un comportamiento atípico, con mínimos DpH a valores de pH de 1,3 y 6,85 respectivamente, pero con un cambio definido a un valor de 6,85, donde el DpH es cero. Similar comportamiento fue reportado por González et al. [31] para la especie Sargassum muticum. Para valores de pH de las soluciones inferiores al pHpzc el biosorbente algal tendrá carga positiva, lo cual favorece la biosorción de especies aniónicas y para valores de pH de las soluciones superiores al pHpzc el biosorbente algal tendrá carga negativa, lo cual favorece la biosorción de especies catiónicas.
CONCLUSIONES
1. El biosorbente algal preparado a partir del alga marina Sargassum tiene una baja superficie específica característica de estos biomateriales; un alto contenido de cenizas y de cationes, con predominio del calcio, magnesio, potasio y sodio; y un punto de carga cero (pHpzc) sobre pH neutro. Tiene una gran heterogeneidad morfológica y estructural caracterizados por estructuras amorfas, laminares, cilíndricas, rugosas y protuberantes. Los espectros del microanálisis semicuantitativo SEM/EDX también indican heterogeneidad en los perfiles de concentración y en menor medida en los elementos químicos que lo componen; observándose el alto contenido catiónico, principalmente de calcio y magnesio; lo cual está en correspondencia con los resultados del análisis elemental, cenizas y ICP-OES.
2. Los espectros FTIR y XPS confirman la presencia de los principales grupos funcionales (-COOH, -COOM,- OH, -NH2, -CH, y -SO3H) presentes en el ácido algínico, alginatos, polisacáridos y proteínas que contiene este tipo de biomasa algal, biopolímeros que aportan sitios activos que facilitan los complejos mecanismos de biosorción y por consiguiente le pueden aportar a este tipo de biosorbente una alta capacidad de biosorción de metales pesados.
BIBLIOGRAFÍA
1. VOLESKY, Bohumil. Sorption and Biosorption. Canada, 2004. 315 p. ISBN: 0-9732983-0-8
2. Naja, Ghinwa Melodie; Murphy, Vanessa; VOLESKY, Bohumil. "Biosorption, metals". 7 Volume New York, 2010. ISBN: 978-0-471-79930-6
3. MACEK, Tomas; MACKOVA, Martina. "Potential of Biosorption Technology". Germany, 2011. p. 7-18. ISBN 978-94-007-0442-8
4. WASE, John; FORSTER, Christopher. Biosorbents for metal ions. London, 1997. 229 p. ISBN ISBN 0 7484 0431 7
5. DAVIS, Thomas A., et al. "A review of the biochemistry of heavy metal biosorption by brown algae". Water Resourse. 2003, vol. 37, núm. 18, p. 4311-4330.
6. ROMERA, Esther, et al. "Biosorption with Algae. A Statistical Review". Critical Reviews in Biotechnology. 2006, vol. 26, p. 223-235.
7. BRINZA, Loredana, et al. "Marine micro and algal species as biosorbentes for heavy metals". Enviromental Enginerrring and Management Journal. 2007, Volume 6, Issue 3, pp. 237-251.
8. MURPHY, Vanessa, et al. "Cu (II) binding by dried biomass of red, green and brown macrolagae". Water Research. 2007, vol. 41, p. 731-740.
9. FISET, Jean-François; BLAIS, Jean-François; RIVEROS, Patricio. "Review on the removal of metal ions from effluents using seaweeds, alginate derivatives and other sorbents". 2008, vol. 21, núm. 3, p. 283-308.
10. WANG, Jianlong; CHEN, Can. "Biosorbents for heavy metals removal and their future". 2009, vol. 27, p. 195-226.
11. OPEOLU, Beatrice O., et al. "Utilization of biomaterials as adsorbents for heavy metals removal from aqueous matrices". 2010, vol. 5, p. 1780-1787.
12. GONZÁLEZ, Felisa, et al. "Algal Biosorption and Biosorbents". Germany, 2011. p. 159-178. ISBN 978-94-007-0442-8
13. MURPHY, Vanessa, et al. "A novel study of hexavalent chromium detoxification by selected seaweed species using SEM-EDX and XPS analysis". Chemical Engineering Journal. 2009, vol. 148, p. 425-433.
14. TAYLOR, William R. Marine algae of the Eastern Tropical and Subtropical coasts of the Americas.Michigan, 1960. 870 p. ISBN: 0-472-08841-6
15. LITTLER, Dianne Sculion; LITTLER, Mark Masterton. Caribbean Reef Plants. An identification guide to the reefs plants of the Caribbean, Bahamas, Florida and Gulf of Mexico. Washington DC. 2000. 542 p. ISBN: 0-9678901-0-1
16. MOREIRA, Lourdes, et al. "Evaluación de la biomasa de macroalgas marinas del género Sargassum C. Agardh (PHAEOPHYTA, FUCALES)". Revista Investigaciones Marinas, 2006, vol. 27, núm. 2, p. 115-120.
17. LYCOURGHIOTIS, Alexis, et al. "Potentiometric Mass Tritrations: Experimental and Theoretical Establishment of a New Technique for Determining the Point of Zero Charge (PZC) of Metal (Hydr) Oxides". 2003, vol. 107, p. 9441-9451.
18. IQBAL, Muhammad, et al. "FTIR spectrophotometry. Kinetics and biosorption isotherms modelling, ion exchange, and EDX analysis for understanding the mechanism of Cd2+ and Pb2+ removal by mango pee waste". Journal of Hazardous Materials. 2009, vol. 164, p. 161-171.
19. FIOL, Núria; VILLAESCUSA, Isabel. "Determination of sorbent point zero charge: usefulness in sorption studies". 2009, vol. 7, p. 79-84.
20. CASAS-VALDEZ, Margarita. et al. "El alga marina Sargassum (Sargassaceae): Una alternativa tropical para la alimentación de ganado caprino". 2006, vol. 54, núm. 1, p. 83-92.
21. YANG, Lei; CHEN, J. Paul. "Biosorption of hexavalent chromium onto raw and chemically modified Sargassum sp". Bioresource Technology. 2008, vol. 99, p. 297-307.
22. SIERRA, Liliana; ÁLVAREZ, Ricardo. "Comparación Bromatológica de las algas nativas (Gracilariopsis tenuifrons, Sargassum filipendula) y exóticas (Kappaphycus Alvarezii) del caribe colombiano". 2009, vol. 13, p. 17-25.
23. BASHA, Shaik, et al. "Biosorption of hexavalent chromium by chemically modified seaweed Cystoseira indica". Chemical Engineering Journal. 2008, vol. 137, núm. 3, p. 480-488.
24. SKOOG, Douglas A.; LEARY James. Análisis Instrumental. Aravaca, Madrid, España, 1993. 960 p. ISBN 9788448101916
25. COLTHUP, Norman. B.; Daly, Lawrence H.; Wiberley, Stephen E. Introduction to Infrared and Roman Spectroscopy. 3a ed. New York, 1990. 547 p. ISBN 0-12-182554-X
26. SMITH, Brain. Infrared spectral interpretation: A systematic approach. Florida, 1998, 257 p. ISBN 0-8493-2463-7
27. MOURDER, John F., et al. Handbook of X-ray Photoelectron Spectroscopy. Minnesota, 1992. 275 p. ISBN 0-9627026-2-5
28. HENG, Tai Lai; et al. "Biosorption of chromium by locally-derived marine algal biomass. Singapore, 2004.
29. TING, Yen Peng, et al. "Sorption of lead, copper, cadmium, zinc, and nickel by marine algal biomass: characterization of biosorptive capacity and investigation of mechanisms". Journal of Colloid and Interface Science. 2004, vol. 275, p. 131-141.
30. MURPHY, Vanessa; HUGHES, Helen; MCLOUGHLIN, Peter. "Comparative study of chromium biosorption by red, green and brown seaweed biomass". Chemosphere. 2008, vol. 70, núm. 6, p. 1128-1134.
31. GONZÁLEZ, Yeslie, et al. "Nickel biosorption using Gracilaria caudata and Sargassum muticum. Chemical Engineering Journal. 2011, vol. 166, p. 122-131.
Recibido: Enero del 2014
Aprobado: Abril del 2014
MSc. Omar Gutiérrez-Benítez. Centro de Estudios Ambientales de Cienfuegos, Cienfuegos, Cuba. omar@gestion.ceac.cu