Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.34 no.2 Santiago de Cuba Mayo.-ago. 2014
ARTÍCULO ORIGINAL
Comportamiento electroquímico del Fe y sus iones durante la lixiviación estándar QT de minerales reducidos en el proceso "Caron" con diferentes aireaciones
The electrochemical Behavior of Iron and its ions During Standard Leaching Qt of the reduced Laterite Ores in Caron Process With Different Aireations
Dr. C. Antonio R. Chang-CardonaI, Armando Rojas-VargasII
I:Departamento de Metalurgia del Instituto Superior Minero Metalúrgico de Moa, Holguín, Cuba. achang@ismm.edu.cu
II:SERCONI, Holguín, Cuba. arojas@eros.moa. minbas.cu
RESUMEN
En el presente trabajo se corroboró para las condiciones experimentales de la prueba QT, que el potencial redox de la pulpa en función de la C(Fe) en licor, graficado por la ecuación de Nernst, se divide en tres zonas bien definidas para diferentes contenidos de Fe2+ en MR. Las dos primeras zonas son las de mayor interés para regular el Qa en la práctica industrial mediante el control del potencial redox de la pulpa. Para la zona I, se obtuvieron las ecuaciones estadísticas que predicen los valores de los potenciales electroquímicos de la pulpa en función del inverso del contenido de Fe2+ en MR: al finalizar el mezclado (MR con licor), justo antes de comenzar la aireación [Eºx, t=0]; el potencial de ruptura [Eºx, r] que limita el término de la reacción de orden cero por C(Fe). Mientras el potencial redox más negativo [Eºx, m], el cual inicia la reacción de orden cero, al alcanzar la máxima concentración de Fe en el licor durante los primeros minutos de lixiviación, se describió como una ecuación en función de la variación de Qa y el % de Fe2+ en MR. Para la Zona II, se obtuvo, la ecuación que predice los valores del potencial electroquímico de la pulpa [E0x ZII] como una función logarítmica de la C(Fe) por la reacción de primer orden por Fe, donde la concentración de los iones de azufre, a diferencia de la zona I, ejerce un efecto estadísticamente significativo.
Palabras claves: proceso caron, oxidación de iones de hierro, precipitación electroquímica de los iones de hierro, lixiviación carbonato amoniacal.
ABSTRACT
In this paper was confirmed for the experimental conditions of the QT test, that the redox potential of the pulp as a function of the C(Fe) in liquor, plotted by the Nernst equation, is divided into three well defined zones for different content of Fe2+ in MR. The first two zones are of most interest to regulate Qa in industrial practice by controlling the redox potential of the pulp. For the zone I, were obtained statistical equations that predict the values of the electrochemical potentials of the pulp as a function of the inverse content of Fe2+ in MR: at the end of mixing (MR - liquor), just before starting the aeration [Eºx, t = 0]; the «rupture» potential [Eºx, r] limiting the term zero-order reaction. While the redox potential more negative [Eºx, m], which initiates the zero-order reaction, reaching the maximum concentration of Fe in the liquor during the first minutes of leaching, described as an equation based on the variation of Qa and the % Fe2+ in MR. For the zone II, was obtained the equation that predicts the values of the electrochemical potential of the pulp [E0x ZII] as a logarithmic function of the C(Fe) by the first-order reaction by C(Fe), wherein the concentration of ions sulfur, unlike the zone I, exerts a statistically significant effect.
Keywords: caron process, oxidation of iron ions, electrochemical precipitation of the iron ions, ammonium carbonate leaching.
INTRODUCCIÓN
Los índices de eficiencia de recuperación de los metales en la tecnología carbonato amoniacal (TCA) se determinan a partir del valor de la extracción obtenida en el proceso de lixiviación y el extractable ofrecido por hornos de reducción. Se denomina extractable a la máxima extracción posible a obtener durante la lixiviación y al procedimiento para su determinación se le denomina "Prueba QT", sobre cuya base se realiza la contabilidad metalúrgica del Ni y el Co en las plantas de hornos de reducción y de lixiviación, y por ende, una parte importante de la economía de la empresa está sujeta a esos resultados. Entre otras aplicaciones conocidas de la prueba QT se encuentran:
Ø Estudios geológicos con vistas a actualizar reservas minerales a procesar a escala industrial.
Ø Obtención de modelos de pronósticos para recuperar níquel y cobalto en la lixiviación.
Ø Optimización de los parámetros de operación en hornos de reducción como son: los perfiles de temperatura en hogares, cámaras y porciento de petróleo aditivo para menas con diferente composición mineralógica.
Las publicaciones realizadas con anterioridad por los autores de este artículo [2, 5, 8] han demostrado que la deficiencia fundamental de la metodología QT consiste en el elevado y constante flujo específico de aire que se aplica durante todo el tiempo de retención de la pulpa en el reactor, sin tener en cuenta el contenido de Fe soluble (Fe2+) en el mineral reducido (MR) por ser mayoritario en éste. Tal intensidad de aireación provoca elevadas pérdidas de cobalto y algo de níquel con los óxidos e hidróxidos de hierro (OHH).
En la actualidad, no se han publicado con la visibilidad requerida para la lixiviación estándar QT, conocimientos suficientes sobre el comportamiento electroquímico del Fe y sus iones al variar la velocidad específica de aireación (Qa), expresada en [m3/(t,>>min)], para minerales reducidos industrialmente con contenidos variables de Fe2+. Por tal razón, el presente artículo tiene el propósito de difundir ampliamente los principales resultados sobre el comportamiento electroquímico del hierro y sus iones disueltos para las condiciones antes mencionadas con el objetivo principal de mostrar los modelos estadísticos que permiten predecir los principales tipos de potenciales redox que caracterizan cada zona del proceso para poder controlar la marcha de la prueba QT, como vía de orientación operacional de Qa [8].
FUNDAMENTOS TEÓRICOS
En el proceso de lixiviación carbonato amoniacal (LCA) del mineral reducido que contiene el metal de interés para el presente artículo (Fe0), además de Ni0 y Co0 que son los objetivos de extracción en dicho proceso, se emplea el oxígeno del aire como oxidante. Esto significa que la LCA puede ser descrita por la conocida ecuación de Nernst, que para los procesos anódicos:
Me2+ + 2e- = Me0
Se expresa por el potencial electroquímico estándar:
E25 = E0Me2+/Me0 + 0,0295logC(Me2+) (1)
Por cuanto, cada Me2+ forma amoniacatos según el número de ligandos (x), entonces, la ecuación (1) se puede transformar en función de la concentración de amoníaco libre [1] para la reacción:
Me(NH3)x2+ + 2e- = Me0 + x NH3
En este caso, la C(Me2+) en la ecuación (1) se sustituye por la expresión:
C(Me2+) = [Me(NH3)2+x]/Kx*[NH3]x (2)
donde:
Kx es la constante de estabilidad general de los amoniacatos
Por tanto, para una concentración constante de CO2 y, [Me(NH3)2+x] = 1 mol,dm-3, al simplificar la ecuación (1) modificada por (2) se obtuvo en el trabajo [1] la expresión:
E25 = A - 0,0295 * xlogC(NH3)(3)
donde:
A = E0Me2+/Me0 - 0,0295 log Kx es un valor constante para cada sistema.
Los valores del logaritmo de la constante de estabilidad para los amoniacatos involucrados se muestran en la tabla 1
Tabla 1
Valores del logaritmo de la constante de estabilidad delos complejos amoniacales[7]
| Ión | Fe2+ | CO2+ | Ni2+ | CO3+ | |
|---|---|---|---|---|---|
| X | 4 | 5 | 6 | 5 | 6 |
| log Kx | 3.7 | 5.13 | 8.01 | 30.8 | 35.21 |
Análogamente, se obtuvieron las ecuaciones de E25 para los procesos catódicos del oxígeno y los iones de cobalto con relación a la C(NH3):
0,5O2 + H2O + 2e- = 2OH-
E25 = 0,682 - 0,0592logC(NH3) (4)
Co(NH3)63+ + e- = Co(NH3)52+ + NH3
E25 = 0,027 - 0,0592log C(NH3) (5)
Sus correspondientes valores de E25 para las mismas condiciones anteriores serán:
Sistema E25, V Co3+/Co2+ [Co(NH3)63+] -0, 017
0,5O2/2OH- 0, 640
En los casos de los sistemas Fe3+/Fe2+, se pueden analizar mejor por la ecuación de Nernst por la concentración de hierro C(Fe)=[Fe(NH3)42+] en licor, ya que ésta, al inicio es muy elevada y, después debido a la aireación va disminuyendo, lo que se refleja en un potencial redox menos negativo a medida que transcurre la lixiviación.
Para las condiciones de temperatura ambiente, pH= 9,8 y C(NH3)= 5 mol/l, en los trabajo [2, 3] se obtuvieron, para cada reacción indicada más abajo, las ecuaciones siguientes:
Fe3O4 + 12NH3 + 8H+ + 2e- = 3Fe(NH3)42+ + 4H2O;
E25 = - 0,534 - 0,0888 log C[Fe(NH3)42+] (6)
Los valores de E25 obtenidos en [1] para los mencionados procesos anódicos y una C(NH3) constante se muestran a continuación:
Sistema E25, V 1. Fe2+/Fe0[Fe(NH3)42+] -0, 620 4. Ni2+/Ni0[Ni(NH3)62+] -0, 515 5. Co2+/Co0[Co(NH3)52+] -0, 460
Para la reacción de formación de la goethita:
á-FeOOH + 4NH3 + 3H+ + e- = Fe(NH3)42+ + 2H2O
E25 = -0,566 - 0,0592log C[Fe(NH3)42+] (7)
Para la reacción de formación del hidróxido de Fe3+:
Fe(OH)3 + 3H+ + 4NH3 + e- = Fe(NH3)42+ + 3H2O
E25 = -0,432 - 0,0592log C[Fe(NH3)42+] (8)
En el gráfico publicado en [3], se observa que a partir de valores del log C[Fe(NH3)42+] >= 1 , se cumple la condición del orden de formación de los óxidos e hidróxidos de hierro (OHH), que de acuerdo con el trabajo experimental [4] se ordenan en el tiempo, según: Fe3O4 -> Y-Fe2O3 -> a FeOOH -> Fe(OH)3, y los dos primeros OHH se detectaron como un sistema (magnetita-maghemita). La maghemita (Y - Fe2O3) no se pudo evaluar como ecuación por la ausencia de datos confiables. Para log C[Fe(NH3)42+] = 1 y las mismas condiciones de C(NH3) de los procesos anódicos, los valores de E25 serán:
Sistema E25, V por el log de: C(Fe) C(NH3) Fe3+/Fe2+[Fe3 O4] -0,623 -0,525 Fe3+/Fe2+[á-FeOOH] -0,620 -0,565 Fe3+/Fe2+[Fe(OH)3] -0,491 -0,315
Aquí se observa la ligera contradicción en el orden de precipitación de la magnetita y la goethita para el caso que E25 se calcule por la C(NH3), lo que ratifica la preferencia de evaluarlo por la metodología de la C(Fe).
Por los valores de E25 de los procesos anódicos y catódicos, se observa que el hierro metálico se lixivia primero y posteriormente Ni y Co. Sin embargo, el contenido de Fe0 más FeO en MR garantizan concentraciones de Fe(NH3)42+ en el licor muy altas, por consiguiente, el potencial redox de la pulpa estará determinado por dicha concentración, lo que puede ser empleado para controlar la marcha del proceso de LCA.
Todos los OHH se precipitan prácticamente junto con la lixiviación del níquel y antes que la del cobalto, formándose una cantidad considerable de OHH que pueden cubrir las partículas de dichos metales, elevando su resistencia a la difusión del oxígeno disuelto hacia el interior de los metales y sus aleaciones, además, de coprecipitarlos por segregación en sus superficies, ocasionando considerables pérdidas de Co2+ y Co3+, comparadas con las de Ni2+ debido a sus pequeños radios iónicos [7]. Dichas pérdidas se incrementarán con el aumento de las imperfecciones cristalinas de los OHH formados, lo cual se manifiesta al emplear elevados flujos específicos de aire (Qa). De ahí, la importancia de regular Qa mediante el control de la LCA por el potencial redox en dependencia del tipo de MR que se lixivia.
MÉTODOS UTILIZADOS Y CONDICIONES EXPERIMENTALES
Las corridas experimentales se efectuaron en el Centro de Desarrollo e Investigaciones del Níquel (CEDINIQ), Holguín, Cuba. El turbo-aireador empleado en la prueba QT tiene un volumen útil de 8 L, correspondiente a un diámetro interior del tanque de 220 mm, altura de 270 mm; dicho tanque posee 4 deflectores de 30 mm de ancho; el difusor de aire posee un diámetro de 30 mm. El agitador mecánico es un impelente de disco con cuatro paletas rectas, cuyas dimensiones en mm son las siguientes: diámetro del impelente- 80, diámetro del disco- 60, ancho de las paletas-15. La separación del impelente del fondo del tanque es igual al diámetro del impelente. La velocidad de agitación es de 700 rpm, la cual garantiza un régimen turbulento desarrollado, superior a su semejante industrial.
El licor empleado para los experimentos se prepara a partir de licores tomados del proceso industrial:
-
Licor fresco con una concentración de amoníaco entre 120 - 125 g.dm-3 y una relación amoníaco-dióxido de carbono entre 1,7 - 1,8.
-
Licor de recirculación de la planta de recuperación de amoníaco con 135 - 140 g,dm-3 y una relación amoníaco-dióxido de carbono entre 1,6 - 1,7.
-
Hidróxido de amonio con 200 - 220 g.dm-3 de amoníaco.
-
Agua destilada.
Por balance de masa se determina el volumen de cada solución para preparar el licor lixiviante con las especificaciones requeridas en los experimentos.
El mineral reducido se muestrea puntualmente durante el turno de trabajo en uno de los enfriadores de dicho mineral, tomándose dos kitasatos metálicos con aproximadamente 500 g cada uno. Este recipiente tiene que estar provisto de un tapón de goma lo suficientemente ajustado y de un pedazo de manguera en el tubo lateral con una presilla ajustada, de forma tal, que no haya posibilidad de entrada de aire para evitar la reoxidación del mineral. Antes de llenar los kitasatos, estos se purgan con gas inerte para desplazar todo el aire contenido, después de lo cual se cierra la boca con el tapón de goma y se aprieta la presilla.
Las muestras de mineral reducido se ordenaron de mayor a menor por el contenido de Fe2+, designándolos por Ci, tal y como se representa en la tabla 2, donde i= 1, 2, 3, 4, 5. El subíndice T significa -contenido total de Fe, Ni y Co en el mineral reducido.
Tabla 2
Muestras del mineral reducido. Contenido en porciento.
| Orden por Fe2+ (Tipo de MR) | Fe2+ | Fe0 | FeT | NiT | Ni0 | CoT | S |
|---|---|---|---|---|---|---|---|
| C1 | 31.5 | 3.09 | 45.1 | 1.35 | 1.12 | 0.111 | 0.62 |
| C2 | 29.8 | 3.15 | 46.6 | 1.37 | 1.14 | 0.110 | 0.62 |
| C3 | 28.0 | 2.46 | 47.5 | 1.32 | 1.12 | 0.113 | 0.52 |
| C4 | 26.6 | 2.37 | 49.0 | 1.30 | 1.08 | 0.101 | 0.63 |
| C5 | 24.9 | 2.10 | 46.5 | 1.21 | 0.90 | 0.107 | 0.53 |
Con estos materiales se diseñaron los experimentos de lixiviación, preparándose un licor y una pulpa con propiedades aproximadamente constante, variándose Qa y el porciento de Fe en MR. A continuación se ofrecen las condiciones de las pruebas:
Variables fijas:
-
Temperatura ambiente: 25-28 ºC.
-
Concentración de amoníaco C(NH3): 90 g.dm-3
-
Relación de concentraciones de NH3 y CO2 en g.dm-3: (NH3/CO2) = 1,8
-
Masa de mineral reducido: 500 g
-
Volumen de licor: 7 dm3
-
Relación líquido / sólido = 14/1
-
Tiempo de lixiviación total: 180 min
Parámetros a variar:
-
Contenido de Fe2+ en MR, %.
-
Flujo o velocidad específico(a) de aire Qa, m3/(t.min)
Variables dependientes:
-
Potencial redox de la pulpa, Ex, mV
-
Concentración de Fe en el licor, C(Fe), g,dm-3 o g/l
-
La concentración de S en el licor, C(S) se monitorea debido a su posible efecto de pasivación del Fe0 y sus aleaciones [6] y como reductor de los hidroxo-complejos de Fe3+ que desacelera la oxidación de los iones de hierro en el licor [3, 5]; ya que éste no es objeto de variación en el presente artículo.
La matriz experimental empleada se muestra en la tabla 3. Las repeticiones se representan por (Ri), o sea, tres veces significa que i = 1, 2, 3.
| Tipo de MR | Qa,m3/(t.min) | |||||
|---|---|---|---|---|---|---|
| 1.1 | 1.3 | 1.5 | 1.8 | 2.5 | 3.5 | |
| C1...C5 | R1 | R1 | R1 | R1 | R1 | R1 |
| R2 | R2 | R2 | R2 | R2 | R2 | |
| R3 | R3 | R3 | R3 | R3 | R3 | |
El flujo de aire se mide con un rotámetro del tipo C6 de duraluminio, cuyo tubo hueco posee una escala adimensional, calibrándose por la parte superior del flotante por la que se confecciona una carta equivalente de flujos en cm3.min-1. El aire proviene de una línea de suministro desde los compresores del proceso industrial. La presión de su alimentación al laboratorio se controla con una válvula y un manómetro para garantizar su estabilidad. Antes de alimentar el aire al rotámetro, se pasa por un elermeyer con lana de vidrio para recoger la humedad y se mide la presión con un manómetro del tipo reloj para detectar alguna tupición en la descarga del burbujeador. La temperatura del aire es la ambiente y la presión de descarga al turbo-aireador está entre (0,4 y 0,7) kgf.cm-2 ó (39,2 y 68,7) kPa.
El rango de variación del flujo específico de aire entre 1,1 y 1,8 se tomó de los trabajos de Chang-Cardona [2, 5] y, sus máximos valores de 2,5 y 3,5 se corresponden con los empleados en la industria y en el procedimiento QT actual. En la tabla 4 se muestran los datos correspondientes al régimen de aireación empleado en cada caso.
Tabla 4
Flujos de aire y su recálculo por tonelada de mineral reducido
| Qa,m3/(t.min) | 1.1 | 1.5 | 1.8 | 2.5 | 3.5 |
|---|---|---|---|---|---|
| Flujo de aire (cm3/min) | 550 | 750 | 900 | 1250 | 1750 |
| Escala rotámetro C6 | 3.3 | 4.7 | 5.5 | 6.9 | 8.8 |
| m3/t de MR | 198 | 270 | 324 | 450 | 630 |
Los métodos de análisis empleados para dichas muestras fueron los aceptados por el sistema de calidad de la industria cubana del níquel. El método de Espectrofotometría de Absorción Atómica se utilizó para la determinación de Fe, Ni y Co. Por el método volumétrico se determinaron el Fe2+, NH3 y CO2. Mientras que el S, se determinó por el método gravimétrico. Para determinar el hierro ferroso disuelto se pipeteó directamente del turbo-aireador la alícuota necesaria para la determinación analítica y se colocó en la punta de la pipeta un filtro, evitando el pase de sólidos.
El error absoluto de dichos análisis (en %) fue el siguiente: NiT = 0,02; Ni0= 0,12; CoT= 0,009; FeT = 0,45; Fe (II) = 0,5; Fe0 = 0,25; S = 0,02; NH3 = 0,8; CO2ç=0,7.
El potencial redox de la pulpa se midió en un pH-mV metro portátil con electrodo combinado Platino-Calomel, cuyas características del productor español son: CRISON PH25 S/N 425005 L-429 ELECTRODO 5055. Las muestras de pulpa se tomaron en los intervalos de tiempo en minutos: 0, 3, 6, 9, 12, 15, 18, 25, 50, 75, 100, 150, 180. En cada uno de los tiempos de toma de muestra se extrajeron 100 cm3 de pulpa, la que se reincorporó al turbo-aireador después de leído el potencial. La precisión de dicha medición es de ±1 mV.
Para el procesamiento estadístico de los resultados se emplearon el Microsoft Office Excel 2003 y el Microsoft Statgraphics 4.1.
RESULTADOS Y DISCUSIÓN
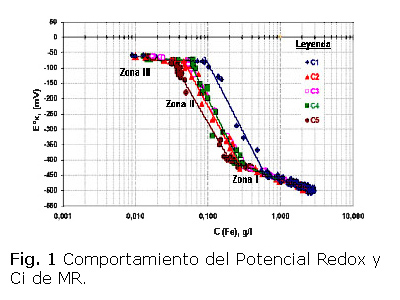
Los resultados de las concentraciones de Fe en licor para cada tipo de MR se ofrecen gráficamente, considerando todos los flujos de aire Qa evaluados, las cuales se ordenaron de mayor a menor con sus correspondientes potenciales redox medidos (E0x, mV). En la figura 1 se muestra la dependencia entre el potencial redox y el logaritmo de la concentración de hierro disuelto para los minerales MR de tipo Ci. En dicha figura se observan tres zonas para la lixiviación estándar QT.
En la zona I se aprecia que el potencial redox se coloca sobre una misma línea, en estrecha dependencia con la concentración de hierro que corresponde a los procesos simultáneos de lixiviación del hierro soluble y a la oxi-hidrólisis de sus iones en solución por la reacción de orden cero [2, 3, 8]. En la zona II, el potencial presenta un comportamiento logarítmico tal como la ecuación de Nernst de interacción por la concentración de hierro para los distintos tipos (Ci) de MR, lo que es típico de la reacción de primer orden por hierro. Mientras que en la zona III, de bajas concentraciones de Fe en el licor, ya la precipitación de los óxidos e hidróxidos de hierro (OHH) es insignificante.
El "Punto de Ruptura" [Eºx, r] o desprendimiento del potencial hacia la zona II, se caracteriza por un cambio de pendiente, que es función del contenido de Fe2+ en MR como se observa en la figura 1.
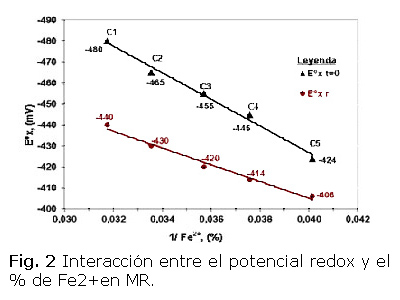
En la figura 2 se observa que el potencial redox: inicial [Eºx, t0] (antes de la aireación) y el de ruptura [Eºx, r] poseen una estrecha dependencia del contenido de Fe2+ en el mineral reducido, tal como una función inversa-x. A mayor contenido de hierro ferroso en el mineral reducido, el potencial redox es más negativo. Es necesario destacar que el potencial de ruptura es independiente del flujo de aire y se describe por la ecuación:
E0 x, r = 4001,86 * 1/Fe2+ - 565,08 (9)
R2 = 0,9829
Mientras que la del potencial redox inicial
E0 x, t0 = 6322,4 * 1/Fe2+ - 679,88 (10)
R2 = 0,9897
Para las condiciones estudiadas y diferentes fases de la lixiviación QT del MR, mediante el programa computacional Statgraphics 4.1 se obtuvieron las ecuaciones de predicción que más abajo se muestran.
La fase de contacto entre el MR y el licor carbonato-amoniacal puro se caracteriza por un breve tiempo de mezclado, donde el FeO se disuelve. En los primeros minutos de aireación transcurre, además, la de oxidación del Fe0, dando los máximos de concentraciones de Fe y los valores más negativos del potencial redox [Eºx, m].
Una vez alcanzado el [Eºx, m], la concentración de hierro comienza a disminuir linealmente por el efecto de la aireación. Esta segunda parte de la zona I se describe por la reacción de orden cero K0 [2, 3, 8], predomina la precipitación del sistema sólido maghemita-magnetita [4].
Para el futuro control del proceso por el potencial redox en esta zona I es importante predecir el valor más negativo [Eºx, m] que puede obtenerse para cada tipo de MR y Qa en la región de máxima concentración de Fe, antes de comenzar la reacción de orden cero. Al ser procesado los resultados experimentales [8], correspondientes a esta región se obtuvo la ecuación de predicción:
E0 x, m = -76,9788 - 14,5881 * Fe2+ - 74,1761 * Qa + 3,25986 * Fe2+ * Qa....(11)
Con los indicadores estadísticos siguientes:
R2: 98,81; R2 (ajustado por los grados de libertad): 98,48; Error estándar del estimado: 2,99; Media absoluta del error: 2,28; DW: 1,85.
La evaluación de la ecuación (11) en una vecindad reducida refleja, tal como lo obtenido en los resultados experimentales, que al aumentar el contenido de Fe2+ en el MR (y Qa=constante), el potencial alcanza valores más negativos; y al incrementar la Qa (para un porciento de Fe2+ constante), el potencial es menos negativo, lo que es consecuencia de una menor concentración de hierro ferroso disuelto producto de la oxi-hidrólisis. Esta regularidad se confirma en la tabla 5.
Tabla 5
Resultados de E0x,m por la ecuación (11)
| Qa=1.1m3/(t.min) constante | Fe2+ en MR=31.5% constante | ||
|---|---|---|---|
| Fe2+ en MR, % | E0x,m,mV | Qa,m3/(t.min) | E0x,m,mV |
| 29 | -478 | 1.1 | -505 |
| 30 | -489 | 1.5 | -494 |
| 31.5 | -505 | 1.8 | -485 |
Es importante destacar que estos resultados corroboran los obtenidos con soluciones puras de Fe por el autor [2, 4].
Conforme con la figura 1, el potencial redox en la zona I se caracterizó por la ecuación estadística:
E0x ZI = -462,1170 - 34,7497 * lnC(Fe) (12)
Con los indicadores estadísticos siguientes:
R2: 94,35; R2 (ajustado por los grados de libertad): 94,35; Error estándar del estimado: 5,75; Media absoluta del error: 4.67; DW: 1,8.
En la ZONA II, la reacción es claramente de primer orden por la C(Fe) en el licor y es predominante la precipitación de la Goethita. Esta zona de potencial redox se inicia una vez alcanzado el [Eºx, r].
Por medio del programa computacional Statgraphics. 4.1, se obtuvo una ecuación de predicción del potencial redox para toda la Zona II en dependencia de la concentración de hierro C(Fe) y azufre C(S) en el licor (g/l) para las Qa estudiadas. El azufre se determinó una vez finalizada la lixiviación.
E0x ZII = -956,224 - 187,285 * lnC(Fe) - 468,134 * ln C(S) (13)
Con los indicadores estadísticos siguientes:
R2: 97,71; R2 (ajustado por los grados de libertad): 97,63; Error estándar del estimado: 19,07; Media absoluta del error: 15,88; DW: 1,92.
Se puede apreciar en la ecuación (13), a diferencia de la (12), el efecto de la concentración de azufre disuelto sobre el potencial en esta zona, indicando que favorece la obtención de potenciales más negativos, lo que confirma el papel reductor que juega los iones del azufre sobre los hidroxo-complejos de Fe3+, retardando el mecanismo de precipitación de la goethita, y por tanto, mejorando la extracción del cobalto durante la lixiviación estándar QT del MR. Esto resultados corroboran los obtenidos en [3, 9].
Debido a que el potencial E0x ZII no es un valor puntual, no se incluyó el Qa, como sí se hizo en el caso de la ecuación (11). No obstante, es bien conocido que la C(Fe) es inversamente proporcional a Qa por lo que la primera será una consecuencia de la segunda variable. No obstante, la ecuación (13) tiene el valor práctico de reflejar con mayor precisión la marcha del proceso en esta zona. Mientras que la ecuación (11) permite regular el Qa antes, o sea desde el comienzo de la aireación, para mantener el potencial de la pulpa lo más electronegativo posible para cada tipo de MR.
El término de la zona II lo define el potencial menos electronegativo o máximo [Eºx, máx ZII], calculado por la ecuación:
[E0x, max ZII] = 663,25 * 1/Fe2+ -113,84 (14)
En la zona III el potencial alcanza valores entre -83 mV hasta -50 mV, indicando el término de la aireación. A estos valores de potencial le corresponden concentraciones tan bajas de hierro como 10 ppm.
CONCLUSIONES
1. Se corroboró para las condiciones experimentales de la prueba QT, que el potencial redox de la pulpa, procesado por la ecuación de Nernst se divide en tres zonas bien definidas para diferentes contenidos de Fe2+ en MR, independientemente de la variación de Qa. Las dos primeras zonas son las de mayor interés para regular el Qa en la práctica industrial mediante el control del potencial redox de la pulpa.
2. Se obtuvieron para la zona I, las ecuaciones estadísticas que predicen los valores de los potenciales electroquímicos de la pulpa en función del inverso del contenido de Fe2+ en MR: al finalizar el mezclado (MR con licor), justo antes de comenzar la aireación [Eºx, t=0]; el potencial de ruptura [Eºx, r] que limita el término de la reacción de orden cero por C(Fe). Mientras el potencial redox más negativo [Eºx, m], el cual inicia la reacción de orden cero, al alcanzar la máxima concentración de Fe en el licor durante los primeros minutos de lixiviación, se describió como una ecuación en función de la variación de Qa y el % de Fe2+ en MR.
3. Se obtuvo para la zona II, la ecuación que predice los valores del potencial electroquímico de la pulpa [E0x ZII] como una función logarítmica de la C(Fe) por la reacción de primer orden por Fe, donde la concentración de los iones de azufre, a diferencia de la zona I, ejerce un efecto estadísticamente significativo. También, se ofrece la ecuación del potencial menos electronegativo o máximo [Eºx, máx.] en función del inverso del contenido de Fe2+ en MR, el cual define elfinal de la zona II.
NOMENCLATURA
C(NH3) - concentración de NH3 libre, g/dm3;
C(Fe) - concentración de Fe en licor, g.dm-3;
Qa, m3/(t,.min)- Flujo o Velocidad específica de aire, en metros cúbicos de aire por cada tonelada métrica de mena laterítica reducida y minuto de aireación de la pulpa;
Va, m3/t- Volumen específico de aire, en metros cúbicos de aire por cada tonelada métrica de mena laterítica reducida;
[Me(NH3)x2+]- Concentración de los complejos amoniacales (Amoniacatos) de constante de estabilidad general de los amoniacatos;
Ex - Potencial redox medido en pulpa por el electrodo combinado Pt - Calomel, mV;
Eºx, t0 - potencial redox inicial de la pulpa, medido antes de la aireación, mV;
Eºx, m- potencial redox de la pulpa, medido en la región de máxima concentración de hierro en licor en la zona I, al inicio de la reacción de orden cero, mV;
Eºx, r - potencial redox de la pulpa, medido en el punto de ruptura o final de la zona I, al término de la reacción de orden cero, mV;
- potencial redox de la pulpa, medido en la zona I, mV;- potencial redox de la pulpa, medido en la zona II, mV;
Eºx, máx ZII - potencial menos electronegativo o máximo, medido en pulpa al terminar la zona II, mV.iones de metales bivalentes, mol,»dm-3;
E25 - Potencial redox estándar (a 25 0C), calculado por la ecuación de Nernst, V;
E0Me2+/Me0 - Potencial electroquímico normal de oxidación con relación al potencial normal del electrodo de hidrógeno a 25 0C, V. Se ofrecen en la literatura;
Kx - constante de estabilidad general de los amoniacatos;
Ex - Potencial redox medido en pulpa por el electrodo combinado Pt - Calomel, mV;
Eºx, t0 - potencial redox inicial de la pulpa, medido antes de la aireación, mV;
Eºx, m- potencial redox de la pulpa, medido en la región de máxima concentración de hierro en licor en la zona I, al inicio de la reacción de orden cero, mV;
Eºx, r - potencial redox de la pulpa, medido en el punto de ruptura o final de la zona I, al término de la reacción de orden cero, mV;
E0x ZI - potencial redox de la pulpa, medido en la zona I, mV;
E0x ZII - potencial redox de la pulpa, medido en la zona II, mV;
Eºx, máx ZII - potencial menos electronegativo o máximo, medido en pulpa al terminar la zona II, mV.
BIBLIOGRAFÍA
1. CHANG CARDONA, Antonio y MARIÑO, Armín. "Consideraciones sobre la Termodinámica del Proceso de Lixiviación Carbonato - Amoniacal. Parte I". Revista Minería y Geología. 1986, núm. 3, p.55-79.
2. CHANG CARDONA, Antonio Ramón; et al. "Perfeccionamiento de la Tecnología de la Empresa René Ramos Latour, Nicaro. Cuba". Universidad Estatal Minera de San Petersburgo, Rusia, 1989.
3. CHANG CARDONA, Antonio y BOBKOVSKI, Anatoli. "Estudio Experimental de la hidrólisis de los iones de hierro durante la lixiviación carbonato-amoniacal de los minerales oxidados de Níquel previamente reducidos". Revista Minería y Geología. 1993, vol. 2, núm. 2, p.75-79.
4. CHANG CARDONA, Antonio y BOBKOVSKI, Anatoli, et al. "Estudio de las particularidades estructurales y composición de fase de los productos de la hidrólisis de los iones de hierro a partir de licores carbonato-amoniacales". Zvetnie Metalli. 1995, núm. 9, p.30-34.
5. CHANG CARDONA, Antonio & ROJAS VARGAS, Armando. "La lixiviación del Proceso CARON: Síntesis del conocimiento para su perfeccionamiento industrial. Parte 2". Revista Tecnología Química. 2009, vol. 29, núm. 2, p. 96-105.
6. NIKOLOSKI, A. N.; NICOL, M. J. AND FITTOCK, J. E.: "The passivation of iron during the leaching of pre-reduced laterite ores in ammoniacal solutions". Paris, April 27, 2003. p. 1-15.
7. LURIE, Yuri. "Manual de Química Analítica". 5ta ed. Moscú, 1979. 480 p.
8. ROJAS VARGAS, Armando; et al. "Metodología perfeccionada para determinar el Extractable de Ni y Co en la lixiviación carbonato-amoniacal". Universidad de Oriente, Santiago de Cuba, 2007.
9. TAVÍO GONZALEZ, Georgina y ROJAS VARGAS, Armando. "Procesamiento en el horno SELAS y posterior lixiviación de muestras del mineral de Pinares. Nicaro, Cuba". Informe inédito. Holguín, 2004, p.43. CEDINIQ, Unidad de Proyecto de Nicaro.
Recibido: Diciembre de 2013
Aprobado: Mayo de 2014
Dr. C. Antonio R. Chang-Cardona. Departamento de Metalurgia del Instituto Superior Minero Metalúrgico de Moa, Holguín, Cuba. achang@ismm.edu.cu