Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.36 no.2 Santiago de Cuba mayo.-ago. 2016
ARTICULO ORIGINAL
Determinación de las condiciones de extracción de compuestos fenólicos a partir de Chuquiraga Jussieuijf Gmel usando la lixiviacion de muestras sólidas
Determination of Extraction conditions of Phenolic Compounds using Chuquiraga Jussieuijf Gmel solid samples leaching
MSc. Alex Dueñas-RivadeneiraI, MSc. Ulbio Alcívar-CedeñoI, MSc. Ely Sacon-VeraII, PhD. Luis Bravo-SánchezIII, PhD. Gretel Villanueva-RamosIII
I:Departamento de Procesos Agroindustriales. Universidad Técnica de Manabí, Ecuador. aduenas@utm.edu.ec
II:Escuela Superior Politécnica Agropecuaria de Manabí, Ecuador
III:Facultad de Ingeniería Química, Universidad Central Marta Abreu de las Villas, Cuba
Resumen
Se evaluó experimentalmente la capacidad de extracción a diferentes condiciones, en un medio acuoso, de los compuestos fenólicos contenidos en un sólido pulverulento de una especie vegetal autóctona del Ecuador denominada Chuquiraga Jussieui J.F Gmel, a fin de establecer los parámetros para elaborar un extracto acuoso de la especie en mención que será empleado en la elaboración de bebidas funcionales. El experimento se realizó utilizando las cantidades de 15 y 20 g de material vegetal seco y molinado de las partes aéreas de la planta con un tamaño de partícula de 3 mm en 200 mL de agua tratada, con velocidades de agitación de 60 y 100 rpm a tiempos de contacto de 30 y 45 min. En todas las interacciones la variable de respuesta fue el contenido de compuestos fenólicos determinados mediante el método FolinCiocalteau expresado en miligramos de ácido Gálico. Se estableció que las variables que inciden significativamente en el proceso de extracción sólido líquido fueron la concentración y el tiempo de contacto, determinándose los valores de los mismos.
Palabras clave: chuquiragaj Jussieui, compuestos fenólicos, lixiviación.
Abstract
The extraction capacity of phenolic compounds from a solid powder of an Ecuador indigenous vegetal specie called Chuquiraga Jussieui JF Gmel was evaluated experimentally in an aqueous medium using different conditions. Phenolic content was evaluated in order to establish the parameters for preparing an aqueous extract to be used in the development of functional beverages. The experiment was performed using the amounts of 15 and 20 g of dry milled material from the aerial parts of the plant with a particle size of 3 mm in 200 mL of treated water, with stirring rates of 60 and100 rpm and contact times of 30 and 45 minutes. In all experiments the response variable was the content of phenolic compounds determined by Folin-Ciocalteau method expressed in milligrams of gallic acid. It was established that the concentration and contact time variables affect significantly the solid-liquid extraction process and their values were determined.
Keywords: chuquiraga jussieui, phenolic compounds, leaching.
INTRODUCCION
Las especies vegetales que habitan en la cordillera de los Andes, debido a las condiciones agrestes que soportan en cuanto a la temperatura y la altura; han desarrollado características únicas que solo se hallan en estos ecosistemas del continente americano. En tal sentido, Ecuador, con una abundante y muy variada flora, refiere el uso tradicional de diferentes especies, entre ellas la Chuquiraga jussieui J.F. Gmel., usada desde tiempos ancestrales, por parte de la población nativa de la región, donde se conoce como: flor del caminante, flor de los Andes, chuquiraga y chuquiraguac. Es una especie botánica de la familia Asteraceae, y su flor es la "flor nacional de Ecuador" [14].
Las especies del género Chuquiraga se encuentran distribuidas en Los Andes, desde el suroeste de Colombia hasta el centro de Chile y en casi toda la Patagonia Argentina, donde se encuentra el mayor número de estas especies y está principalmente diversificado en los desiertos y semidesiertos de América del Sur [3]. En el Ecuador están representadas dos especies: Chuquiraga arcuataHarling y ChuquiragaJussieui J.F. Gmel, ambas se encuentran siempre sobre los 3000 m de altura sobre el nivel del mar [6].
Existen estudios que demuestran la presencia de compuestos fenólicos flavonoides, alcaloides, saponinas, triterpenos y/o esteroides, taninos pirocatecólicos en la Chuquiraga JussieuiJ.F. Gmel [5]; otros que plantean la actividadantioxidante, anti-inflamatoria yantifúngica deChuquiraga.spinosa [2]. Así mismo, los extractos metabólicos de ChuquiragastramineaSandwith, subfamilia Barnadesioideae (Asteraceae) mostraron la presencia de quercetina-3-O-glucósido, quercetina-3-O-rutinósido, kaempferol, kaempferol-3-O-glucósido y kaempferol-3-O-rutinósido, y sus extractos totales demostraron actividad antioxidantepor los métodos de DPPHyABTS (SC50 14,5 a 34,9mg/ mL), se observó una correlación positiva significativa entre la actividad antioxidante y los fenoles totales [9].
La presencia de compuestos fenólicos en los extractos de ChuquiraguaJussieui J.F Gmel indica que los mismos pueden ser utilizados en la formulación de bebidas funcionales, estas tienen origen a partir de la concepción de alimentos funcionales, que a pesar de no tener una definición ni estructura claramente dilucidada, se establece que a partir de su ingesta causarán un efecto en beneficio del consumidor en pro de su salud y calidad de vida, estos alimentos o bebidas pueden haber sido mezclados o potencializados con otros agentes de diferentes características, y se consideran nutraceúticos. Por lo tanto están destinadas a proteger y dar bienestar a los consumidores y actualmente es una tendencia de mercado, al dejar un poco de lado las bebidas tradicionales tales como gaseosas o jugos de origen sintético, aunque las características sensoriales no sean tan agradables como las de las bebidas tradicionales.
La extracción de metabolitos presentes en materias primas vegetales es cada vez más aplicada por la ciencia por su valor como fármacos o alimentos y pensar en utilizarlos en la formulación de bebidas funcionales dará un valor adicional a las mismas. La importancia de los compuestos fenólicos y su demostrada efectividad como agentes antioxidantes es considerada como un aporte en la nutrición de las personas, actualmente es recomendado ingerir vino tinto por sus efectos para el sistema cardiovascular, sin embargo, debe considerarse que el contenido de alcohol pudiera afectar el organismo.
Teniendo en cuenta lo antes expuesto, al realizar una bebida sin alcohol, rica en compuestos fenólicos, se contribuye significativamente a mejorar la calidad de vida de personas que padecen diferentes patologías, y a prevenirlas, pudiendo ser ingerida por cualquier segmento de la población, por lo que el objetivo del presente trabajo consisteen determinar si la especie vegetal Chuquiraga Jussieui J.F Gmel cumple con los parámetros de calidad establecidos para ser utilizado como materia prima en la industria alimentaria y farmacéutica, así como determinar los parámetros que influyen en el proceso de extracción de los compuestos fenólicos.
FUNDAMENTACION TEORICA
Los compuestos fenólicos son un grupo de sustancias químicas encontradas en plantas caracterizadas por la presencia de más de un grupo fenol por molécula. Los polifenoles son generalmente subdivididos en taninos hidrolizables, que sonésteres de ácido gálico de glucosa y otros azúcares; y fenilpropanoides, como la lignina, flavonoides y taninos condensados. Las plantas los sintetizan en gran cantidad, como producto de su metabolismo secundario. Algunos son indispensables para las funciones fisiológicas vegetales. Otros participan en funciones de defensa ante situaciones de estrés y estímulos diversos (hídrico, luminoso, etcétera) [8].
Numerosos estudios han avalado las propiedades biológicas de los compuestos fenólicos [13]. Estos efectos son fundamentalmente consecuencia de sus propiedades antioxidantes que pueden usualmente justificar sus acciones vasodilatadoras y vasoprotectoras, así como sus acciones antitrombóticas, antilipémicas, antiateroscleróticas, antiinflamatorias y antiapoptóticas. Además los polifenoles poseen efectos antilipémicos y antiaterogénicos [12].
Puesto que estos compuestos se encuentran en materiales vegetales es necesario separarlos de las mismas mediante operaciones de extracción. La disolución de partículas sólidas en los líquidos, es una de las operaciones básicas ampliamente empleadas en la tecnología química en la obtención de productos orgánicos y colorantes, abonos, minerales, etcétera. La disolución es premisa para acelerar diversas operaciones, puesto que en estado disuelto y disociado en grado considerable aumentan la movilidad y la actividad química de las moléculas de la sustancia disuelta [17]. Las operaciones de disolución selectiva de una o varias sustancias de los cuerpos sólidos, que son mezclas de diferentes componentes, representan en sí la extracción difusiva del componente o componentes, a partir de materiales sólidos porosos utilizando un disolvente, y se denomina extracción sólido líquido o lixiviación, usada para la recuperación de componentes valiosos de un vegetal [7]. La lixiviación en si consiste en la penetración del líquido en los poros del sólido, disolviendo los componentes a extraer (extracción física), o entrar en reacción con ellos (extracción química), la sustancia que pasa a la disolución, o el producto de la reacción se difunde hacia la superficie del cuerpo sólido y pasa a la masa fundamental del líquido.
Las sustancias de origen biológico, por ejemplo los vegetales, tienen una estructura anisótropa, es decir que los solutos se transportan en estos cuerpos con iguales velocidades en todos los sentidos. De la estructura del sólido poroso depende la conductividad difusiva, la que ejerce determinante influencia sobre la velocidad de lixiviación [15].
En algunos casos la disolución transcurre como resultado de la acción heterogénea en la interface, acompañada por la formación de productos sólidos insolubles o parcialmente solubles, o gases producto de la reacción. Esto puede crear una película, o sedimentar burbujas de gas sobre la superficie del sólido, por otra parte la fase sólida disuelta puede cristalizarse por sobresaturación y depositarse, todos estos fenómenos disminuyen considerablemente la superficie de material accesible a la interacción de este con el disolvente, y reducen por tanto la transferencia de masa [16].
Teniendo en cuenta que el proceso de lixiviación es una operación de transferencia de masa, los rendimientos de la misma se ven afectados por la velocidad de transferencia que define la Ley de Fick, por lo que varios parámetros influyen en el rendimiento de la extracción de metabolitos en general, el tiempo de extracción, la temperatura, la relación disolvente/sólido, el número de etapas de extracción, y fundamentalmente la naturaleza del disolvente. La mayoría de las técnicas comunes para extraer los compuestos fenólicos emplean disolventes, orgánicos o inorgánicos, la elección de los disolventes de extracción tales como agua, acetona, acetato de etilo, alcoholes (metanol, etanol y propanol) y sus mezclas [7] influyen en los rendimientos de compuestos fenólicos extraídos.
MATERIALES Y METODOS
Las plantas de ChuquiragaJussieuiJ.F Gmel fueron colectadas en la Cordillera de los Andes en la reserva faunística del volcán Chimborazo, en Ecuador (Lat 1º30´32.66´´ S Long 78º 51´52.91´´ W) y se realizó la caracterización botánica y taxonómica en el Herbario de la Escuela Superior Politécnica de Chimborazo. Se depositó la especie en el herbario QCA de la Universidad Católica del Ecuador para ser registrada con la identificación de espécimen correspondiente (VoucherADD 01). El análisis fitosanitario se realizó en el Laboratorio de la Politécnica Chimborazo, Ecuador. Las partes aéreas de la planta (follaje y tallos) se lavaron con abundante agua potable y secaron a la sombra [10]. Para el secado se colocó el material en un secadero de bandejas esmaltadas a 40 ºC, donde se obtuvo un peso constante a las 24 h [4].
El material seco se pasó por un molino de cuchillas y posteriormente por un tamiz de 0,315 mm, de acero inoxidable, para convertirlo en un sólido pulverulento (SP) de tamaño de partícula uniforme, que fue identificado, almacenado y conservado en una bolsa de plástico sellada herméticamente hasta su utilización.
En la estandarización del sólido pulverulento fueron determinados los parámetros de calidad que reporta la Norma Ramal de Salud Pública 309 [11]: materia orgánica e inorgánica extraña (%); humedad residual (%) por el método azeotrópico; sustancias solubles en agua, etanol al 30, 50 y 80 %; y cenizas totales.
Una vez obtenida la muestra del material pulverulento se realizó el estudio de la influencia de los diferentes parámetros sobre la operación de lixiviación, utilizando un diseño factorial de 23,* las variables a considerar fueron: la velocidad de agitación definida como 60 y 100 rpm, la relación disolvente/sólido se fija en los valores de 20 g/200mL y 15 g/200mL, ambos parámetros se toman en estos rangos debido a que en pruebas previas se determinó que una mayor concentración sólido líquido no permitía la agitación, el tiempo de contacto del material vegetal con el agua se establece en 30 y 45 min y la temperatura se mantuvo constante a 40°C, tal como recomiendan trabajos anteriores [1]. Por la misma razón, el disolvente de trabajo fue agua tratada por ósmosis inversa en un equipo de marca Watts modeloFMO4G de 4 etapas.Las muestras del sólido pulverulento fueron pesadas en una balanza analítica digital marca Sartoriusmodelo AX124 y posteriormente se colocó en un baño termostático con temperatura y agitación controlada. En todos los casos, la capacidad del recipiente agitado fue de un litro. De esta manera, el diseño de experimentos quedó de la siguiente forma. Ver tabla 1
| Corrida | Relación sol/liq | Velocidad de agitación | Tiempo de contacto |
| 1 | + | + | + |
| 1 | + | + | - |
| 1 | + | - | + |
| 1 | + | - | - |
| 1 | - | + | + |
| 1 | - | + | - |
| 1 | - | - | + |
| 1 | - | - | - |
| 2 | + | + | + |
| 2 | + | + | - |
| 2 | + | - | + |
| 2 | + | - | - |
| 2 | - | + | + |
| 2 | - | + | - |
| 2 | - | - | + |
| 2 | - | - | - |
La variable respuesta fue la capacidad de extracción sólido líquido de compuestos fenólicos determinada por el método de Folin-Ciocalteau. Las muestras del extracto sólido líquido fueron filtradas utilizando papel Wathman N° 5 y una bomba de vacío para posteriormente evaluar el contenido fenólico. Para este análisis se utilizó un espectrofotómetroUV/VIS, Marca Camp Spec, con ancho debanda de +/- 1 nm,integración de 1s, celdas de 1 cm de espesor. Se realizó la curva de calibración del patrón tomando una solución madre de ácido gálico,se pesaron 2 mg del mismo y se disolvieron en agua destilada y se enrasó a un volumen de 10 mL para obtener una solución madre con concentración 0,2 mg/mL. Posteriormente se pipetearon a partir de la disolución madre de ácido gálico las siguientes alícuotas: 50, 100, 150, 200, 250 µL y se adicionaron 200 µL del reactivo de Folin-Ciocalteau, 2 mL de Na2CO3al 7 % y se enrasaron con agua destilada hasta un volumen de 5 mL. Transcurridos 30 min se midió la absorbancia a 765 nm, utilizando la solución preparada con el mismo procedimiento sin la muestra como el blanco.
Se tomaron 70 µL de la muestra en un volumétrico de 5 mL y se adicionó a continuación 200 µL de reactivos de Folin-Ciocalteau, 2 mL de Na2CO3al 7 % y finalmente se completaron a un volumen de 5 mL con H2O destilada. Luego de transcurrir 30 minutos, se midió la absorbancia de cada uno a 765 nm contra el blanco preparado de igual forma sin la muestra. La cantidad de compuestos fenólicos en cada muestra se determinó en mg equivalentes a ácido gálico/L del extracto sólido líquido, utilizando la ecuación obtenida de la curva de calibración de ácido gálico.
Los resultados se procesaron utilizando el software estadístico StatgraphicsCenturion XV versión 15.2.14 donde se analizó la interacción de las variables entre ellas, con el objetivo de determinar el tiempo de extracción se determinó además la cinética del proceso de extracción hasta obtener una concentración de compuestos fenólicos constante.
RESULTADOS Y DISCUSION
La estandarización del sólido pulverulento obtenido de la especie vegetal Chuquiraga Jussieuise presenta en la tabla 2. Como se observa, presenta valores muy bajos de materia orgánica e inorgánica extraña y contenido de cenizas, el porcentaje de humedad residual está en el rango de lo que establece la Norma Ramal de Salud Pública 309 entre 8 a 14 % así mismo se puede señalar que existe igual cantidad de componentes de polaridad intermedia que de alta polaridad, lo que se aprecia en las solubilidades obtenidas en agua y sus mezclas con etanol. Todos los valores medios de los índices numéricos determinados se compararon con los de otras plantas de las cuales sí existen referencias y se observó que los parámetros estaban dentro de los límites de la norma referida [11].
Tabla 2
Parámetros de calidad del sólido pulverulento de Chuquiraga jussieui JF GMEL
| Parámetros | DS | |
| Materia orgánica extraña | 0, 095 | 0,004 |
| Materia inorgánica extraña | 0, 118 | 0,023 |
| Humedad residual | 11, 667 | 0,624 |
| Sustancias solubles en agua | 5, 767 | 0,205 |
| Sustancias solubles en etanol y agua al 30 % | 7,100a | 0,163 |
| Sustancias solubles en etanol y agua al 50 % | 9, 567b | 0,340 |
| Sustancias solubles en etanol y agua al 80 % | 9, 200b | 0,082 |
| Cenizas totales | 2, 400 | 0,082 |
DS = Desviación estándar; a,b= Letras diferentes en la misma columna difieren p < 0,05
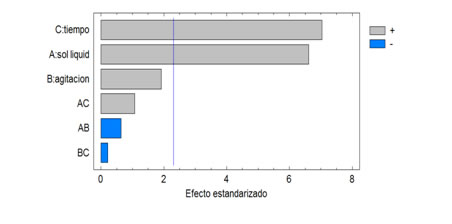
Los resultados obtenidos en el proceso de extracción sólido líquido de compuestos fenólicos en la Chuquiraga jussieuia partir de la aleatorización de los experimentos, se muestran en la tabla 3, y fueron analizados con el programa estadístico Statgraphics, donde se realizó una comparación de la interacción de las variables mediante el diagrama de Pareto tal como aparece en la figura 1.
Tabla 3
Resultados del proceso de extracción sólido líquido en la Chuquiraga jussieuia
| Corrida | Relación sol/liq | Velocidad de agitación | Tiempo de contacto | Fenoles/ mg ácido gálico |
| 1 | 20 | 100 | 30 | 572,6 |
| 1 | 15 | 60 | 30 | 385,4 |
| 1 | 20 | 60 | 30 | 572,6 |
| 1 | 20 | 60 | 45 | 685 |
| 1 | 20 | 100 | 45 | 722,5 |
| 1 | 15 | 100 | 45 | 647,6 |
| 1 | 15 | 100 | 30 | 497,7 |
| 1 | 15 | 60 | 45 | 572,6 |
| 2 | 15 | 100 | 30 | 460,3 |
| 2 | 20 | 60 | 45 | 759,9 |
| 2 | 20 | 100 | 30 | 572,6 |
| 2 | 15 | 60 | 30 | 422,8 |
| 2 | 15 | 100 | 45 | 535,2 |
| 2 | 20 | 100 | 45 | 797,4 |
| 2 | 15 | 60 | 45 | 535,2 |
| 2 | 20 | 60 | 30 | 535,2 |
Figura 1. Diagrama de Pareto estandarizado para fenoles
Por lo antes expuesto se puede comprobar que las variables que influyeron principalmente en el proceso de lixiviación fueron el tiempo de contacto entre las fases y la relación sólido disolvente tal como establece la teoría de transferencia de masa, por lo que se elige para trabajos posteriores una relación sólido disolvente de 1g de sólido /10 mL de disolvente y un tiempo de contacto de 45 min. La variable que no influyó significativamente en el rango estudiado fue la velocidad de agitación, por tanto se escoge el valor de 60 rpm por implicar un menor consumo de energía en el proceso. Además, se pudo comprobar que no existe una interacción significativa entre las variables.
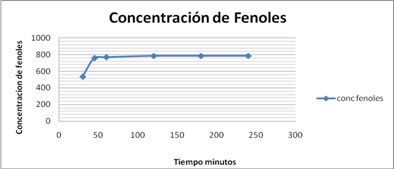
Para evaluarla cinética del proceso y poder establecer si el tiempo de extracción determinado ofrece los mejores resultados, se tomó la muestra de mayor relación sólido líquido y menor velocidad de agitación y se evaluó el comportamiento de la extracción a diferentes tiempos tal como se presenta en la figura 2.
Figura. 2 Cinética del proceso de lixiviación
A partir de este experimento se establece que la concentración de fenoles extraídos es directamente proporcional al tiempo de extracción, sin embargo entre los 45 min y 60 min, la diferencia se vuelve poco significativa y a partir de 60 min la curva se vuelve asintótica, quedando establecido que el tiempo de extracción debe ser de 45 min.
CONCLUSIONES
1. El sólido pulverulento de la especie Chuquiraga Jussieui J.F Gmel cumple con los parámetros de calidad establecidos para ser utilizado como materia prima en la industria alimentaria y farmacéutica, posee igual cantidad de componentes de polaridad intermedia así como de alta polaridad.
2. Los parámetros que influyen en el proceso de extracción de compuestos fenólicos a partir de Chuquiraga Jussieui J.F Gmel,son la relación sólido líquido y el tiempo de contacto.La velocidad de agitación no demuestra influencia en el rango estudiado.
3. A una temperatura de 40 °C se debe trabajar a la mayor relación sólido-liquido permisible, 1g de sólido /10 mL de disolvente, a 60 rpm de velocidad de agitacióny un tiempo de contacto de 45 min, a partir de este tiempo, no aumenta la extracción de compuestos fenólicos.
BIBLIOGRAFIA
1. BIESAGA M; PYRZYNSKA, K. Stability of bioactive polyphenols from honey during differentextraction methods. Food Chem. UK, 2013. vol. 136, pp. 46-54.
2. CASADO, R; LANDA, A. Anti-inflammatory, antioxidant and antifungal activity of Chuquiraga spinosa. Pharm Biol. USA, 2011. vol. 49, No. 6, pp. 620-626.
3. CORREA, Q. et al. Chuquiraga insignis. Especies Vegetales promisorias de los países del Convenio Andrés Bello SECAB. Ciencia y Tecnología. Colombia, 1990. pp. 365-367.
4. CUELLAR, A; MIRANDA, M. "Farmacognosia y Química de los Productos Naturales". Cuba: Ed. Universidad de La Habana 2000: Ciudad de la Habana. Cuba
5. DUEÑAS, A. et al. Análisis fitoquímico y de seguridad de los extractos de Chuquiraga jussieui J. F. Gmel. Centro Agrícola, Cuba, 2014, vol. 41, No 2, pp. 79-84
6. EZCURRA, C. Revisión del género Chuquiraga (Compositae-Mutisieae). Revista Darwiniana. vol. 26, pp. 219-284. Argentina. 1985.
7. GARCIA-SALAS, P. et al. Phenolic compound-extraction systems for fruit and vegetable samples. Molecules. vol. 15, pp. 8813-8826. Switzerland, 2010. .
8. MANACH, C. et al. Polyphenols: food sources and bioavailability. Am. J. Clin. Nutr. vol. 79, pp.727-747. USA, 2004.
9. MENDIONDO, M; JUAREZA, BE. Bioactivities of Chuquiraga stramineas. Nat Prod Commun Journal. vol. 6, No 7, pp. 965-968. USA 2011.
10. MORA C, Galeano E, Osorio A. Manual de prácticas de laboratorio de Farmacognosia I. Universidad de Antioquia. Facultad de Química Farmacéutica. Medellin, Colombia, 2013.
11. NRSP 309. Norma Ramal. Medicamentos de origen vegetal: Droga Cruda. Métodos de ensayo. 1992. La Habana.
12. OJEDA D, et al. Inhibition of angiotensin convertin enzyme (ACE) activity by the anthocyaninsdelphinidin- and cyanidin-3-O-sambubiosides from Hibiscus sabdariffa. J Ethnopharmacol. Netherlands, vol.127, pp. 7-10. 2010.
13. SCHROETER, H. et al. Epicatechin mediates beneficial effects of flavanol-rich cocoa on vascular function in humans. ProcNatlAcadSci, 103, pp.1024-1029. USA 2006.
14. VILLAGRÁN, C. et al. Etnobotánica del Sur de los Andes de la primera región de Chile: un enlace entre las culturas altiplánicas y las de quebradas altas del loa superior. Chungará, Revista de Antropologia Chilena, vol. 35, pp. 73-124. 2003.
15. Villanueva Ramos G.,"Aspectos Fundamentales acerca de las operaciones de extracción". Editorial UFRN. Brasil, 1991.p. 163.
16. Walas, Stanley M. Cinética de las reacciones químicas. Editorial Pueblo y Educación, La Habana, Cuba, 1965, pp. 83-87.
17. Wibisono, R.; Zhang, J.; Saleh, Z.; Stevenson, D.E.; Joyce, N.I. "Optimization of accelerated solvent extraction for screening of the health benefits of plant food materials". Health. vol. 1, pp. 220-230. USA, 2009.
Recibido: Noviembre de 2015
Aprobado: Marzo de 2016
MSc. Alex Dueñas-RivadeneiraI. Departamento de Procesos Agroindustriales. Universidad Técnica de Manabí, Ecuador. aduenas@utm.edu.ec