Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Tecnología Química
versão On-line ISSN 2224-6185
RTQ vol.36 no.2 Santiago de Cuba maio.-ago. 2016
ARTICULO ORIGINAL
Principios didácticos en la adquisición de habilidades en las clases prácticas de Química-Física II
Didactic Principles in the Acquisition of Skills in the Practical Classes of Physical-Chemistry II
Ing. Plácida Miriam Salazar-Arrastre, Lic. Bárbara Ricci-Creagh Limia, MSc. Idelsa García-Ulacia
Facultad de Ingenieria Quimica y Agronomía. Universidad de Oriente. Santiago de Cuba. Cuba. placida@uo.edu.cu
Resumen
En este trabajo se exponen las experiencias adquiridas por los profesores que imparten la asignatura Química-Física II en la facultad de Ingeniería Química de la Universidad de Oriente, en la aplicación de los principios didácticos en el desarrollo de las clases prácticas de la asignatura Química-Física II, con el objetivo de desarrollar de forma adecuada en los estudiantes las habilidades declaradas en el programa de la misma. Se muestra como teniendo en cuenta los principios didácticos que aquí se tratan, durante el desarrollo de las Clases Prácticas, es decir, haciendo énfasis en la correcta estructuración que deben tener éstas, la planificación, y la sistematización entre otros principios didácticos, es posible lograr el desarrollo de las habilidades propias de la asignatura e influir en la preparación de los estudiantes para enfrentar situaciones problémicas cada vez más complejas en asignaturas posteriores. Se presentan los Esquemas Generalizados de Actividades (EGA), de la asignatura, los cuales ayudan a desarrollar el pensamiento lógico, buscar el mejor algoritmo de solución y reforzar de forma progresiva las habilidades que a través de estas clases prácticas van adquiriendo los estudiantes.
Palabras clave: química-física II, principios didácticos, clases prácticas, habilidades, EGA.
Abstract
In this paper the experiences of teachers who teach the subject Physical Chemistry II, at the Faculty of Chemical Engineering at the University of East in the application of teaching principles in the development of practical classes of the course are exposed Physical Chemistry II, in order to properly develop in students the skills declared in the program itself. It shows how considering the didactic principles discussed here during the development of the Practice Classes, ie emphasizing the correct structure that must have these, planning, and systematization including teaching principles, is possible developing their own skills and influence the course preparing students to face increasingly complex problem situations in later courses.Generalized Scheme of Activities (GSA) of the subject, which help to develop logical thinking, look for the best solution algorithm and progressively strengthen the skills through these students are acquiring CP are presented.
Keywords: physical chemistry II, didactic principles, practical classes, skills, GSA.
INTRODUCCION
La Química-Física II se imparte en el 3er año del CRD, 1er Semestre del Plan de Estudios de la carrera de Ingeniería Química. Tiene esta asignatura una gran importancia en el proceso curricular del estudiante interesado en titularse como tal, ya que los contenidos que en ella se imparten, las teorías, conceptos y leyes estudiadas, los métodos que se aplican para la solución de situaciones diversas, posibilitan que el estudiante adquiera habilidades que en asignaturas que recibe posteriormente le son muy útiles.
Generalmente esta asignatura resulta compleja para los estudiantes ya que en ella se estudia la relación entre los procesos químicos y físicos, haciendo un uso relativamente amplio de las matemáticas, por lo que es necesaria la búsqueda de métodos que hagan más asequibles los contenidos y lograr el cumplimiento exitoso de los objetivos.
El Proceso de Enseñanza Aprendizaje (PEA) debe ser tal que prepare hombres y mujeres capaces de insertarse al mundo en que vive en ese momento y que vivirá en el futuro, participando activamente en su desarrollo y transformación [1].
El PEA tiene entre otras 3 funciones fundamentales [1]:
Instructiva: se relaciona con la cultura profesional y general.
Educativa: desarrollo de valores, actitudes, sentimientos.
Desarrolladora: capacidades creadoras, innovadoras, transformadoras
Es a través del estudio de la Didáctica como ciencia que estudia el arte de enseñar, el conocimiento de sus categorías, leyes y principios que puede el docente realizar un diseño adecuado de la forma de impartición de su asignatura con el fin de que los resultados sean satisfactorios [3].
Los principios didácticos son una forma de expresión de las leyes de la didáctica y a su aplicación en las CP de la asignatura QF II se refiere este trabajo. Ellos tienen un carácter de sistema en sus relaciones, y al establecerlos no son determinantes ni la cantidad ni la formulación, pero deben permitir la comprensión del desarrollo de la teoría y la práctica pedagógica [2].
Los principios didácticos son esenciales en el sentido de que estos ejercen su influencia en todo el proceso de enseñanza, es decir, en todos sus aspectos y tareas.
En el desarrollo de las CP los estudiantes desarrollan hábitos y habilidades, en el análisis de los datos, en la búsqueda de algoritmos de solución, selección de expresiones matemáticas, en los cálculos, en el análisis de los resultados y expresión oral, característicos de un ingeniero químico, lo que contribuye a que sean capaces de enfrentar la problemática real que encontrarán durante su vida profesional, pudiendo actuar de manera independiente, para lo cual se requiere haber alcanzado cierto grado en el dominio de los conocimientos.
OBJETIVOS
1- Ejemplificar mediante el desarrollo de EGA la forma de solucionar los ejercicios en los diferentes temas.
2- Mostrar el carácter universal del principio de la planificación y sistematización en las CP de Química Física II.
3- Evidenciar la importancia del empleo de los principios didácticos en las CP de Química Física II.
MATERIALES Y METODOS
La clase es la forma fundamental de organización del proceso de enseñanza aprendizaje, y entre sus formas están la conferencia, clase práctica, Seminario y práctica de laboratorio (C, CP, S, L) [1]; nos ocupa en este trabajo la CP.
La clase práctica (CP) es el tipo de clase que tiene como objetivos instructivos fundamentales los que a continuación se exponen: que los estudiantes sean capaces de [1].
-
Ejecutar, ampliar, profundizar, integrar y generalizar determinados métodos de trabajo de las asignaturas y disciplinas que les permitan desarrollar habilidades para utilizar y aplicar de modo independiente los conocimientos.
-
Dominar los métodos de trabajo de la asignatura, que le permitan desarrollar las habilidades para utilizar y aplicar, de modo independiente, los conocimientos.
Consolidar, ampliar, profundizar y generalizar los contenidos adquiridos durante las conferencias y la auto-preparación.
CUMPLIMIENTO DE LOS PRINCIPALES PRINCIPIOS DIDACTICOS EN EL DESARROLLO DE LAS CLASES PRACTICAS
Entre los principios didácticos a tener en cuenta en el desarrollo del proceso de enseñanza-aprendizaje, fueron seleccionados para el análisis de la influencia de su aplicación en la asignatura QF II los que a continuación se mencionan [2]:
1.- El principio de la unidad de la teoría con la práctica.
2.- El principio de la planificación y sistematización de la enseñanza.
3.- El principio del poder conductor del maestro y la autoactividad de los alumnos.
4.- El principio de la asequibilidad de la enseñanza.
5.- El principio de la atención individual al alumno, sobre la base del trabajo en el colectivo.
6.- El principio de la constante consolidación de los resultados.
Todos estos principios mantienen una relación inseparable y no es posible omitir o desatender alguno de ellos sin que el proceso sea afectado en mayor o menor medida.
Está claro que en el desarrollo de las CP se ponen de manifiesto todos ellos; son necesarios para cumplir los objetivos de las mismas, la adquisición de las habilidades declaradas en cada una.
ANALISIS DE LA INFLUENCIA DE CADA PRINCIPIO
En la preparación de cada CP se seleccionan los ejercicios de manera tal que se corroboren los conocimientos teóricos impartidos en las conferencias, que los resultados obtenidos constaten, verifiquen y reafirmen el principio y/o ley que se aplican en la solución del problema de que se trate. El papel conductor del docente es fundamental para dirigir el pensamiento lógico y estimular la actividad independiente de los estudiantes, antes, durante y después de la CP, lo cual se logra al preparar la guía de orientación, donde se indican problemas resueltos y propuestos para la auto-preparación previa y se orientan ejercicios para solucionar con posterioridad, estos últimos con mayor complejidad.
Es importante que el docente tenga en cuenta las características individuales de cada estudiante, ya que unos, los más capacitados son muy independientes mientras otros necesitan la guía constante, puede valerse de los aventajados, darles protagonismo y así estimular su desarrollo. En estos dos principios (1 y 3) se manifiesta de modo significativo el carácter dialéctico del proceso de enseñanza [2].
El principio de la asequibilidad de la enseñanza es uno de los principios didácticos clásicos.
Algunas reglas didácticas derivadas de este principio son:
- De lo sencillo a lo complejo
- De lo conocido a lo desconocido
- De lo concreto a lo abstracto
- De lo fácil a lo difícil
Este principio se evidencia en cada CP y en todo el sistema de CP correspondiente a un tema ya que la última siempre es integradora de los diversos ejercicios resueltos y se planifican y escogen de manera tal que se cumplen todas las reglas anteriores.
El principio de la constante consolidación de los resultados se logra con la repetición y sistematización planificada, la práctica continua y la aplicación de forma diversa de los conocimientos adquiridos, lo que se logra con ejercicios que introducen nuevos conceptos y requieren a la vez de la utilización de los ya aprendidos entrenándose para los que están por enfrentar y estar cada vez mejor preparados.
Finalmente, el análisis del principio de la planificación y sistematización de la enseñanza en el que se realiza es este trabajo un estudio más profundo.
Este principio se refiere a la transmisión de los contenidos en correspondencia con el plan de enseñanza, planificación de la enseñanza para lograr el desarrollo de la personalidad y fijación de los conocimientos fundamentales.
La enseñanza sistemática representa una conducción en forma fraccionada, en etapas, es decir, avanzar con pasos planificados. Se precisa tener en cuenta elementos esenciales entre los se encuentran:
- Lograr una clara definición de los objetivos por cumplir
- Adecuada distribución de los contenidos, donde se destaquen los aspectos más importantes
- Correcta estructuración de las clases
- Articulación didáctica de todos los eslabones del proceso, incluyendo la repetición, la ejercitación, la aplicación y la sistematización.
Para lograr los resultados esperados es necesario concebir y planificar las CP de manera que se conjuguen los diferentes elementos que se incluyen en este principio didáctico, propiciando la guía adecuada y el desarrollo de habilidades prácticas que puedan ser aplicadas de manera independiente, debiéndose conjugar también de manera armónica las diferentes formas de enseñanza.
Para ello se tiene que conocer qué habilidades de la asignatura deben ejercitarse en cada CP, distribuyendo así las tareas por realizar en cada actividad de manera óptima, por lo que teniendo en cuenta lo declarado en el programa de la asignatura se elaboró un listado de habilidades para la asignatura, siendo éstas las siguientes:
SISTEMA DE HABILIADADES
1. Aplicar los principios y leyes del equilibrio químico, la cinética química y la electroquímica a diferentes sistemas reaccionantes con el fin de:
-
Calcular la constante y composición de equilibrio en base a datos termodinámicos y experimentales.
-
Cuantificar la influencia de la temperatura y presión sobre el equilibrio químico, cambios de entalpía y de energía libre estándar determinando la posibilidad de que ocurra una reacción química.
2. Obtener las ecuaciones cinéticas de velocidad calculando orden y constante de velocidad a temperatura constante.
3. Aplicar los principios del balance de masa en reacciones complejas
4. Cuantificar el efecto de la temperatura sobre la velocidad de reacción en base a la ecuación de Arrhenius
5. Analizar el comportamiento de los electrolitos fuertes y débiles en base a mediciones de conductividad equivalente calculando solubilidades de sales poco solubles
6. Aplicar las leyes de Faraday en la cuantificación de los fenómenos de la electrólisis. Analizar el funcionamiento de las celdas galvánicas clasificando las mismas y los tipos de electrodos que la forman
7. Determinación experimental de los electrodos y fem de una celda galvánica, aplicando los mismos para el cálculo de pH y coeficiente de actividad de soluciones eléctricas y propiedades termodinámicas de la reacción de la celda en base a la ecuación de Nernst
8. Calcular potenciales de descarga y voltaje de descomposición, analizando los procesos consecutivos de descarga en los electrodos
9. Caracterizar los fenómenos superficiales en sistemas de un componente. Caracterizar los tipos fundamentales de adsorción y determinar la influencia de la presión y la temperatura sobre los mismos, interpretando las isotermas de adsorción
10. Determinar experimentalmente las constantes características de las isotermas de Freundlich y Langmuir
11. Interpretar el fenómeno de la catálisis y reconocer las diferencias entre reacciones catalíticas homogéneas y heterogéneas
12. Aplicar los conceptos sobre catálisis en algunos tipos de reacciones sólido-gas en las que el sólido cumple las funciones de catalizador.
13. Clasificar y caracterizar el estado coloidal y los tipos de sistemas coloidales, calculando propiedades de los sistemas coloidales tales como masa molar, viscosidad del medio y radio de partículas coloidales
ESQUEMAS GENERALIZADOS DE ACTIVIDADES (EGA)
El desarrollo de las actividades de los estudiantes usando los EGA utilizados en CP y conferencias permite enfrentar los problemas planteados con una alta eficacia, cumpliéndose así los diferentes objetivos planteados, permitir que los mismos puedan adquirir de forma consciente las habilidades previstas.
En la asignatura Química-Física II, los EGA principales son:
EGA 1: Aplicar los principios y leyes del equilibrio químico, la cinética química y la electroquímica a diferentes sistemas reaccionantes con el fin de:
-Calcular la constante y composición de equilibrio en base a datos termodinámicos y experimentales.
-Cuantificar la influencia de la temperatura y presión sobre el equilibrio químico, cambios de entalpía y de energía libre estándar determinando la posibilidad de que ocurra una reacción química.
EGA 2: Analizar los datos del problema y si se conocen datos dObtener las ecuaciones cinéticas de velocidad calculando orden y constante de velocidad a temperatura constante.
EGA 3: Aplicar los principios del balance de masa en reacciones complejas.
EGA 4: Cuantificar el efecto de la temperatura sobre la velocidad de reacción en base a la ecuación de Arrhenius.
EGA 5: Analizar el comportamiento de los electrolitos fuertes y débiles en base a mediciones de conductividad equivalente calculando solubilidades de sales poco solubles.
EGA 6: Aplicar las leyes de Faraday en la cuantificación de los fenómenos de la electrólisis. Analizar el funcionamiento de las celdas galvánicas clasificando las mismas y los tipos de electrodos que la forman.
EGA 7: Determinación experimental de los electrodos y fuerza electromotriz de una celda galvánica, aplicando los mismos para el cálculo de pH y coeficiente de actividad de soluciones eléctricas y propiedades termodinámicas de la reacción de la celda en base a la ecuación de Nernst.
EGA 8: Calcular potenciales de descarga y voltaje de descomposición, analizando los procesos consecutivos de descarga en los electrodos.
EGA 9: Caracterizar los fenómenos superficiales en sistemas de un componente. Caracterizar los tipos fundamentales de adsorción y determinar la influencia de la presión y la temperatura sobre los mismos, interpretando las isotermas de adsorción.
EGA 10: Determinar experimentalmente las constantes características de las isotermas de Freundlich y Langmuir.
EGA 11: Interpretar el fenómeno de la catálisis y reconocer las diferencias entre reacciones catalíticas homogéneas y heterogéneas.
EGA 12: Aplicar los conceptos sobre catálisis en algunos tipos de reacciones sólido-gas en las que el sólido cumple las funciones de catalizador.
EGA 13: Clasificar y caracterizar el estado coloidal y los tipos de sistemas coloidales, calculando propiedades de los sistemas coloidales tales como masa molar, viscosidad del medio y radio de partículas coloidales.
En general se sigue una misma estructura en los diferentes EGA, ya que en todos los casos existe un objetivo bien definido que a su vez requiere para su cumplimiento de la adquisición de una o más habilidades y por consiguiente de la realización de operaciones precisas, son comunes a todos los EGA las siguientes:
1- Identificación de los objetivos: El docente pretende que el estudiante conozca el problema, es decir, cuál es la incógnita, qué se le propone determinar.
2- Selección de las ecuaciones a utilizar: En este punto se trata de la ecuación que permite el cálculo de la propiedad o función problema.
3- Análisis y tratamiento de los datos: Una vez seleccionada la ecuación, se procede al análisis de los datos que posee, si son suficientes, si las unidades se corresponden con las del Sistema Internacional y de no ser así se tendrá que:
-
Proceder a calcular las variables desconocidas necesarias para la solución del problema, para ello se impone realizar una nueva selección de las ecuaciones a emplear con este fin, si fuera un método analítico o construcción de gráfico si así lo requiere el método.
-
Realizar la conversión de unidades al Sistema Internacional en caso que algún dato no lo esté, empleando las relaciones o equivalencias conocidas.
4. Solución del problema: Sustituir y realizar los cálculos.
5. Análisis de los resultados.
Generalmente en la Química Física II se trata de más de una incógnita a determinar, por lo que se debe aplicar este algoritmo general cada vez.
Para una mejor comprensión de lo expuesto, se exponen los EGA 1 y 3.
OPERACIONES A REALIZAR EN EL EGA1
1. El objetivo es aplicar los principios y leyes del equilibrio químico molecular, asumiendo que los datos permiten el cálculo de Kp
2. Escribir la ecuación química ajustada que representa el cambio químico que ocurre y establecer las condiciones de equilibrio correspondientes según los datos del problema; esto es:
-
Si ocurre con cambios en la cantidad de sustancias o no
-
Si el sistema es homogéneo o heterogéneo señalando el estado de agregación de reactantes y productos
- Si se conocen datos de Temperatura, Presión, cantidad de sustancia o composición de equilibrio o grado de conversión de algún componente.
3. Calcular la constante de equilibrio en función de presiones parciales, fracciones molares, etcétera.
4. Calcular las distintas constantes de equilibrio del sistema utilizando las expresiones que las relacionan.
5. Calcular las variaciones de las funciones termodinámicas; entalpía y energía libre que ocurren en el proceso, lo que da la posibilidad de conocer si éste es exo o endotérmico y si es o no espontáneo en las condiciones dadas.
6. Determinar cuantitativamente el efecto de la temperatura sobre la constante de equilibrio aplicando la ecuación de Van’t Hoff integrada definidamente para un intervalo de temperatura relativamente pequeño o conociendo la dependencia del calor de reacción estándar con la temperatura.
7. Calcular grado de disociación, si se tratara de este proceso.
8. Calcular composición de equilibrio en diferentes condiciones de trabajo.
9. Analizar críticamente si los resultados obtenidos mediante cálculos se corresponden con lo que se establece teóricamente según el principio de Le Chatelier- Braun acerca del efecto que sobre el estado de equilibrio ejercen los factores temperatura, presión y composición.

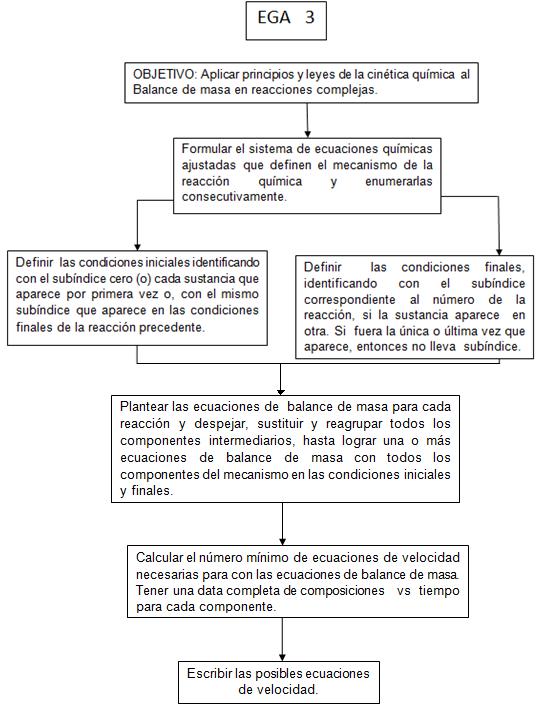
EGA 3
1. El objetivo es la aplicación de los principios y leyes de la cinética química en reacciones complejas.
2. Para aplicar los principios del balance de masa de una reacción compleja, se parte del sistema de reacciones elementales que conforman su mecanismo, numerando cada una de ellas y se procede a agrupar los componentes con las cantidades iniciales y finales de cada uno en cada reacción elemental.
3. Se identifican con el subíndice cero para las condiciones iniciales, los componentes que aparecen por primera vez y con el subíndice que corresponde al número de reacción en las condiciones finales.
4. Si alguno de los componentes participa en más de una reacción, el subíndice que corresponde en la cantidad inicial será el que tenía en la cantidad final de la reacción precedente y cuando aparece por última vez, sea cualquiera la reacción, en la cantidad final no tendrá subíndice alguno.
5. Se procede a plantear las ecuaciones de balance de masa para cada reacción, teniendo en cuenta la estequiometria en cada una de ellas y despejar, reagrupar y sustituir los componentes intermediarios hasta obtener una o más ecuaciones de balance de masa donde aparezcan todos los componentes del mecanismo en cuestión sólo en las condiciones iniciales y finales.
6. Se determina el número mínimo de ecuaciones de velocidad a tener en cuenta, para con las de balance de masas obtenidas lograr una data completa de composición – tiempo de todos los componentes de la reacción compleja y escribir las mismas.
CONCLUSIONES
1. Tiene gran importancia para el logro de los objetivos de la QF II, la aplicación de los principios didácticos en las CP de la asignatura ya que esto permite la adquisición de las habilidades por parte de los estudiantes de forma consciente y duradera.
2. Se muestra mediante el desarrollo de un EGA que contiene de forma general como solucionar los ejercicios en los diferentes temas siguiendo un algoritmo lógico que prepara al estudiante para el enfrentamiento de cualquier problema.
3. Se aprovecha el carácter universal del principio de la planificación y sistematización para que el docente haga una adecuada selección de los ejercicios a incluir en las CP y Guías de Orientación de éstas, con el fin de obtener mejores resultados en las CP de Química-Física II y por consiguiente en las evaluaciones parciales y final de la asignatura.
BIBLIOGRAFIA
1. FUENTES GONZÁLEZ H. C., et al . "Proceso Enseñanza Aprendizaje en la Educación Superior". Universidad de Oriente. 2001. p 55.
2. LAGO LAGO C., et al. Aplicación de los principios didácticos en la adquisición de habilidades en las clases prácticas de Fundamentos Químicos y Biológicos VI. Tecnología Química. Vol. 24, Nº 1, 2004, p. 20-25.
3. PEREZ PEREZ N.M. "Principios didácticos" .
4. HING CORTON R., MATOS TAMAYO R. Programa analítico de la asignatura Química Física II, carrera Ingeniería Química, curso 2014-2015.
Recibido: Noviembre de 2015
Aprobado: Marzo de 2016
Ing. Plácida Miriam Salazar-Arrastre. Facultad de Ingenieria Quimica y Agronomía. Universidad de Oriente. Santiago de Cuba. Cuba. placida@uo.edu.cu














