Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.37 no.1 Santiago de Cuba ene.-abr. 2017
ARTICULO ORIGINAL
Escalado de la fermentación incrementada en la producción de estreptoquinasa recombinante
Fed batch fermentation scale up in the production of recombinant streptokinase
MSc. Salvador Losada-NereyI, Dr. C. Orestes Mayo-AbadII, MSc. Saily Martínez-DiazIII, Ing. Michel Díaz-MartínezIII, Dr. C. Jorge Valdés-HernándezIII
I: Centro Nacional de Biopreparados, Bejucal, Mayabeque, Cuba. slosada@biocen.cu
II: Instituto Superior Politécnico "José Antonio Echeverría", La Habana, Cuba
III: Centro de Ingeniería Genética y Biotecnología, La Habana, Cuba
Resumen
Debido a la alta demanda internacional de la estreptoquinasa recombinante (Skr) producida en el Centro Nacional de Biopreparados, se plantea como necesidad el aumento de la capacidad productiva del fármaco. Para ello, se realizó un escalado del proceso de fermentación de la estreptoquinasa recombinante, utilizando un cultivo incrementado desde la escala de banco hacia un fermentador de 300 L. Como criterio de escalado se mantuvieron constantes las variables intensivas del proceso. De igual forma se mantuvieron constantes las relaciones de los volúmenes del medio fermentativo e inóculo, el coeficiente volumétrico de transferencia de oxígeno y la relación flujo de aire volumen de líquido. Con este procedimiento de escalado se lograron reproducir los resultados obtenidos a nivel de banco y duplicar el volumen de producción en biomasa con el mismo equipamiento, cumpliendo todos los requisitos de calidad del producto, con lo que se puede cubrir la demanda actual del mercado. Los indicadores técnico-económicos demostraron la factibilidad de esta opción.
Palabras clave: escalado, fermentación, cultivo incrementado, productos parenterales.
Abstract
Due to the high international demand of the recombinant streptokinase (Skr) produced at the National Center for Bioproducts (BioCen), it was necessary to increase the production capacity of the drug, since the current production volume does not cover the demand. A scale up of the process of fermentation of the recombinant streptokinase was made using a fed batch culture, from the bank scale towards a 300L fermenter. The scaling criteria used were: the intensive variables of the process, the relationships of volumes of the fermentation medium and inoculum, the volumetric coefficient of oxygen transfer and air volume to liquid flow relationship which were kept constant. With this scale up procedure it was possible to reproduce the results obtained at the bank scale of and to double the biomass production volume with the same equipment, fulfilling all the quality requirements of the product and to cover the current demand of the market. Techno-economic indicators demonstrated the feasibility of this option.
Keywords: scale up, fermentation, fed batch culture, parenteral products.
INTRODUCCION
La Estreptoquinasa es naturalmente producida y secretada por varias cepas de Estreptococos hemolíticos. Tillet y Garner en 1933, descubrieron que esta proteína bacteriana causa la lisis de los coágulos sanguíneos por lo que puede ser usada en la medicina clínica contra el infarto del miocardio, como agente trombolítico. La estreptoquinasa tiene una masa molecular de 47 kDa, es una proteína monomérica y en su composición se encontraron 414 residuos de aminoácidos, muestra su máxima actividad a pH 7,5 y su punto isoeléctrico es 4,7. Esta proteína no contiene cistinas, cisteínas, fósforo, carbohidratos conjugados ni lípidos [1] .
La Estreptoquinasa recombinante se produce en el Centro Nacional de Biopreparados (BioCen). Debido a la alta demanda internacional, se plantea como necesidad el aumento de la capacidad productiva del fármaco. La etapa de fermentación constituye un cuello de botella en el proceso, ya que su capacidad de producción se encuentra a un 70 % de la capacidad de procesamiento de la etapa de purificación, por lo que aumentar el volumen de producción en la etapa de fermentación constituye un objetivo importante en el proceso.
En investigaciones realizadas por el departamento de desarrollo del Centro de Ingeniería Genética y Biotecnología (CIGB) lograron, en un fermentador de 5L a nivel de banco, un proceso fermentativo de cultivo incrementado para esta producción, utilizando la misma cepa hospedera W3110 que en la fermentación actual, obteniéndose un rendimiento de biomasa celular tres veces superior al establecido y manteniendo los mismos niveles de expresión de la proteína de interés [2]. Es por ello que se decide investigar esta variante tecnológica mediante el escalado a un fermentador de 300L.
Desde el punto de vista económico y con el fin de lograr una producción con máxima rentabilidad, sería propicio alcanzar una alta concentración celular con elevada expresión del producto recombinante. Por lo tanto, las condiciones de cultivo y el estado del crecimiento celular al tiempo de la inducción de la expresión proteica, deben ser cuidadosamente evaluadas, debido a que los mismos pueden ser muy variables y no predecibles.
Como antecedentes de este trabajo, los investigadores Jin Zhi-Hua y Lin Jian-Ping [3], por los datos obtenidos, en un estudio en zaranda de la producción del antibiótico rifamicin B en A. mediterranei, decidieron realizar el escalado hacia un fermentador de 15 L manteniendo el nivel de saturación de oxígeno disuelto por encima de un 25 % en una fermentación por templa, obteniendo una concentración celular después de 6 días de fermentación de 10 g/L. Cambiando el método de fermentación a cultivo incrementado con una alimentación de glucosa y agua amoniacal lograron aumentar en el fermentador de 15L la concentración a 18,67 g/L. Posteriormente utilizando como criterio de escalado la potencia gaseada por unidad de volumen realizaron el escalado hacia 7 m3 y 60 m3 , logrando concentraciones de 17,25 y 19,11 g/L respectivamente. En el Instituto Investigaciones de Biociencias y Biotecnología de Corea, Chul Ho Kin y K. Jagannadha realizaron el escalado de la producción de la Hirudina recombinante obtenida en S. cerevisiae, utilizando como criterio de escalado el coeficiente volumétrico de transferencia de oxígeno (kLa), mediante una fermentación de cultivo incrementado, para la cual diseñaron un esquema de alimentación con la galactosa como fuente de carbono. El escalado se realizó a partir de los resultados obtenidos a nivel de 5 L hacia fermentadores de 30 L y 300 L. Se lograron concentraciones de 390 y 296 mg/L y un 80,4 y 90,7% de productividad volumétrica con respecto a la lograda en el fermentador de 5 L [4].
MATERIALES Y METODOS
Materiales
Microorganismo
La cepa de producción es una Escherichia coli W3110 del tipo K-12, transformada con el plásmido: pEKG-3 portador del gen que codifica para la expresión de la proteína de la estreptoquinasa, bajo el control del promotor triptófano. Como marcador de selección se empleó el gen que le confiere resistencia a la ampicilina. La cepa transformada fue conservada en forma de bancos de células en un medio Luria Bertini (LB) con 30 % de glicerol a una temperatura de -70 oC [5].
Medios de cultivos y soluciones
En la etapa de propagación se utilizó medio LB, en la fermentación: medio inicial de 240 L con, 22 g/l Glucosa; 15 g/L KH2PO4; 4 g/L MgSO4.7H2O, 15 g/L Extracto de Levadura, medio incremento de 60L con 415 g/L Glucosa; 15,5 g/L MgSO4. 7H2O; 100 g/L Extracto de Levadura y Sales trazas 1000X. Las soluciones de sales trazas, fueron filtradas empleando filtros 0,2 µm de tamaño de poro (Sartorius). Los medios de propagación, fermentación e incremento fueron esterilizado a 121 C durante 20 min en los fermentadores, el control de pH de la fermentación se realizó con soluciones de H3PO4 40 %, y solución de NH3 al 25 %.
Métodos
La pureza microbiológica se determinó mediante tinción de Gram. El crecimiento celular se determinó mediante el método turbimétrico de densidad óptica, utilizando un espectrofotómetro modelo GENESYS a 620 nm. La concentración de proteínas totales se determinaron por el método de Lowry[6], para las etapas de fermentación y ruptura celular y se utilizó el método de Biuret [7] para la etapa de semi-purificación. En la etapa de purificación se utilizó la densidad óptica a 208 nm.
La determinación del porcentaje de expresión y la de la proteína en las diferentes etapas del proceso se realizó mediante la técnica de electroforesis de SDS page en geles de poliacrilamida al 12 %, para realizar el análisis densitométrico de los geles se empleó el programa Image Master 1D prime versión 3.01.
La determinación de actividad biológica y específica de los purificados fue determinada por el método del sustrato cromogénico S-2251, a las muestras de la filtración final de la etapa de purificación.
El tratamiento de los datos experimentales se realizó de acuerdo con la experiencia acumulada en el trabajo con la E. coli realizado en el laboratorio, se consideró que el peso seco es aproximadamente el 25 % del peso húmedo (g/L). Además, se conoce que el 50 % del peso seco corresponde a la proteína total, por lo que, conociendo el porcentaje de expresión de la proteína de interés medido en la técnica de electroforesis, es posible determinar la cantidad de dicha proteína por unidades de volumen de cultivo. Para el monitoreo y control de las variables de las fermentaciones, se utilizó el software FERMACS. Se utilizó para el procesamiento de los datos experimentales y estudios estadísticos los softwares Microsoft Excel y el Statgraphic Centurión versión 16.2. Se utilizaron dos fermentadores de 50L y 300L de volumen efectivo para la preparación del inoculo e incremento y para producción, modelo CHEMAP.
RESULTADOS
Criterios de escalado
Se fijaron como criterios de escalado mantener constante en las dos escalas (5L-300 L) los parámetros siguientes: Variables intensivas del proceso de fermentación (temperatura y pH), la relación entre el volumen final del cultivo y volumen de incremento, la relación entre el volumen de inóculo y el volumen inicial de cultivo, la relación flujo de incremento y el volumen de incremento, el coeficiente volumétrico de transferencia de oxígeno y la relación entre el flujo volumétrico de aire y el volumen de cultivo.
Determinación de las condiciones de operación
Al disponer de un fermentador ya construido, solo se podrá accionar sobre las variables: velocidad de agitación, presión dentro del fermentador y el flujo de aire de alimentación. El estudio del proceso fermentativo en la escala de laboratorio se dividió en 4 etapas; la primera se desarrolla como un proceso por templa, la segunda y tercera como un cultivo incrementado, que se diferencian por la velocidad del flujo de incremento utilizado y la cuarta y última etapa transcurre en ausencia de fuente de carbono, donde, aunque no existe crecimiento celular es de gran importancia en la formación del producto.
Cálculo de la velocidad de agitación en el fermentador de producción
Se estimaron valores del coeficiente volumétrico de transferencia de oxígeno, kLa, para diferentes valores de velocidad del impelente en las dos escalas. Se utilizó, para la determinación de este coeficiente la expresión propuesta por K. van`tRiet, para sistemas no coalescentes y líquido electrolítico (medio con sales) [8].

El número de potencia se consideró igual a 6 [9], para tanques agitados en un régimen turbulento establecido (Re ≥ 104) y la relación entre la potencia gaseada y la potencia para una turbina Rushton en régimen turbulento igual a 0,4. Las dimensiones de los fermentadores y los parámetros de las ecuaciones a utilizar se muestran en la tabla 1. Se fijó en 1,5 el volumen de aire por volumen de líquido por minuto para ambas escalas y se obtuvo la correlación de la velocidad de agitación y el coeficiente volumétrico de transferencia de oxígeno, posteriormente se graficaron las dos relaciones y se obtuvo la curva de mejor ajuste para cada fermentador igualando las ecuaciones de las 2 curvas, se obtuvo la correlación de la velocidad del impelente en el fermentador de 5 L con el de 300 L. Las ecuaciones para los dos fermentadores quedan como:
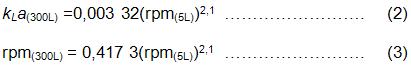
Tabla 1
Características geométricas del fermentador industrial F-300L y el de laboratorio F-7L
| Parámetro | F-7L | F-300L |
| Volumen total, Vt,(m3) | 0,007 | 0,450 |
| Volumen efectivo, Vo(m3) | 0,005 | 0,300 |
| Diámetro tanque, Dt(m) | 0,180 | 0,588 |
| Diámetro del impelente, Di(m) | 0,080 | 0,200 |
| Número de impelentes, Ni | 1 | 3 |
| Altura del líquido, HL(m) | 0,196 | 1,105 |
| Número de tabiques | 4 | 4 |
| Densidad del medio (kg/m3) | 1000 | 1000 |
La velocidad del impelente, donde se obtuvo la mejor variante en la escala de laboratorio, fue de 800 rpm y al sustituir en la ecuación se obtiene un valor de 333 rpm para el impelente en el fermentador de producción. La velocidad máxima de este solo alcanza 320 rpm. Como consecuencia, aunque la diferencia es relativamente pequeña, no se cumple con la velocidad de agitación estimada en el escalado y no se garantiza el coeficiente volumétrico de transferencia de oxígeno alcanzado a nivel de banco. Al no garantizarse esta igualdad se optó por aumentar la velocidad de transferencia de oxígeno aumentando la presión parcial dentro del fermentador a 100 kPa [10].
Cálculo de los parámetros de flujo y volumen de cultivo a incrementar en la escala productiva
Según el criterio de escalado seguido para el cultivo incrementado, se dispuso que la relación entre el flujo de incremento Fincrem y el volumen del incremento Vincrem se mantuviera constante, al igual que la relación entre el volumen efectivo Vefect y el volumen inicial del medio Vinicen las dos escalas.

Partiendo de las relaciones obtenidas a nivel de banco y los criterios anteriores, se obtuvieron los volúmenes y los flujos de trabajo que se utilizarán en la escala industrial, como se muestra en la tabla 2. De acuerdo a los cálculos, el volumen del medio utilizado para ser incrementado es de 90 L, pero el fermentador que se dispone tiene una capacidad máxima de 60 L, por lo que se propone reducir el volumen del medio de incremento a 60 L y aumentar la concentración de sustrato. Para ello, se ajustan los flujos de alimentación incremento como se muestra en la tabla 3. Aunque la relación del volumen inicial entre el volumen de incremento no se mantenga en el nuevo ajuste, se conserva como criterio de escalado mantener la relación de los flujos con el volumen de incremento.
Tabla 2
Valores de volúmenes y flujo de trabajo para las dos escalas
| Parámetros | F-7 L | F-300 L |
| Volumen inicial de medio, Vinic | 3,5 L | 210 L |
| Volumen de medio incremento, Vincre | 1,5 L | 90 L |
| Volumen efectivo, Vefect | 5 L | 300 L |
| Flujo 1 ,F1 | 0,76 mL/min | 45,6 mL/min |
| Flujo 2 ,F2 | 1,58 mL/min | 94,80 mL/min |
| Fincre 1/Vincre | 0,507.10-3 min-1 | |
| Fincre 2/Vincre | 1,053.10-3 min-1 | |
| Vefect/Vinicial | 1,429 | |
Tabla 3
Volúmenes y los flujos para el fermentador de 300 L con 60 L de medio de incremento
| Parámetros | F-300 L |
| Volumen inicial de medio, Vinic | 240 L |
| Volumen de medio incremento, Vincre | 60 L |
| Volumen efectivo, Vefect | 300 L |
| Flujo 1,F1 | 30,40 mL/min |
| Flujo 2 ,F2 | 63,20 mL/min |
| Fincre 1/Vincre | 0,507.10-3 min-1 |
| Fincre 2/Vincre | 1,053.10-3 min-1 |
Resultados del escalado del proceso de fermentación de la estreptoquinasa recombinante
Se realizaron 3 lotes de fermentación de cultivo incrementado a escala de 300 L, en la Planta de Ingredientes Activos del BioCen, con el objetivo de reproducir los resultados alcanzados a escala de laboratorio, utilizando el mismo equipamiento de la producción actual. Los lotes experimentales fueron denominados KF001/E, KF002/E y KF003/E. En la tabla 4 se observa que la biomasa centrifugada promedio obtenida en las tres fermentaciones de cultivo incrementado realizadas fue de 21 kg, lo que representa el triple del peso obtenido en una fermentación normal de 18 h. El porcientaje de expresión promedio fue de 22,47 %. Este valor es menor que el valor promedio obtenido en el laboratorio, que fue del 26 %. No obstante, el porcentaje de expresión obtenido es similar al valor promedio anual de las fermentaciones normales, que es del 22,65 % y muy por encima del valor inferior de especificación que es del 15 %.
Tabla 4
Resultados de las fermentaciones de cultivo incrementado en el fermentador de 300 L
| Lote | Peso de la biomasa (kg) | % de expresión final | (X) Peso húmedo (g/L) |
| KF001/E | 24 | 22,71 | 88,5 |
| KF002/E | 20 | 21,30 | 82,4 |
| KF003/E | 19 | 23,40 | 79,5 |
| Promedio1 | 21± 2,64 | 22,47±1,07 | 83,4±4,59 |
1Los promedios se muestran con un error de ± una desviación estándar
Con este resultado se logró el objetivo de mantener el porcentaje de expresión de las fermentaciones actuales.
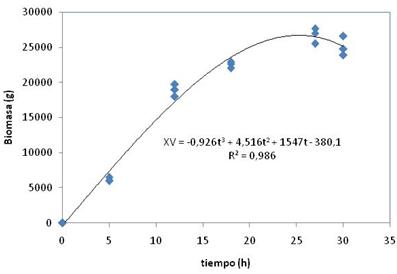
En la figura 1 se muestra que con el modelo para la obtención de biomasa donde se alcanza un máximo valor alrededor de las 25 h de fermentación, los que puede sugerir que la fermentación pudiera ser detenida antes de la hora fijada.
Fig. 1 Perfil cinético de biomasa para tres lotes de fermentación experimentales.
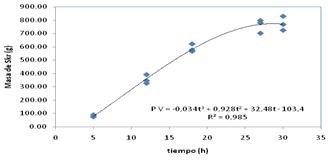
En la figura 2 se muestra el modelo para la obtención de la proteína de interés donde se alcanza un máximo a las 30 h, pero es necesario no solo que exista una expresión por encima del 15 % al final de la fermentación, sino que se encuentre insoluble para ser purificada.
Fig. 2 Perfil cinético de la masa de la proteína de interés para los tres lotes experimentales de fermentación.
ANALISIS DE LOS RESULTADOS EN LA SOLUBILIDAD DE LA ESTREPTOQUINASA EN LA FERMENTACION
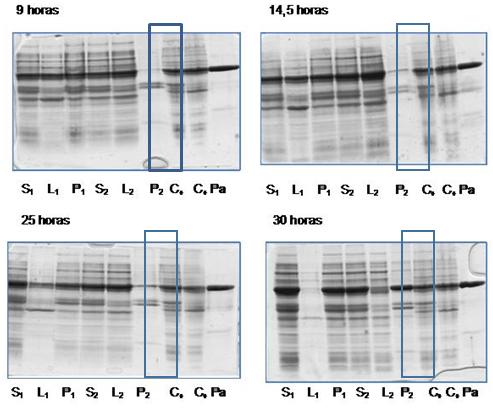
Para comprobar la productividad de la proteína de interés y la solubilidad de la misma, durante el proceso fermentativo, se tomaron muestras a diferentes tiempos del proceso y se les realizó el estudio de solubilidad donde se comparó mediante un gel de electroforesis el porcentaje de proteína de interés antes y después de realizada la ruptura analítica en el tiempo, en el sobrenadante (L) y en la biomasa (P), obteniéndose los resultados mostrados en la figura 3.
Fig.3 Estudio de la solubilidad de la proteína a diferentes tiempos de fermentación.
Leyenda: Sx Cultivo celular; Lx Sobrenadante; Px Biomasa; C+ Controles de Skr; Pa patrón de Skr; x: 1 antes de romper; 2- después de romper.
Se puede apreciar como la banda P2, que representa la proteína de interés que se encuentra insoluble después de romper y centrifugar, en las 9; 14,5 y 25 h, aun se encuentra soluble al detectarse una banda de estreptoquinasa en el sobrenadante de la centrifugación L2 después de romper y no en la biomasa, mientras que a las 30 h de cultivo si se observa en la biomasa y no en el sobrenadante. Se demuestra que el tiempo de fermentación donde la proteína esta lista para ser purificada es a las 30 h y no a las 25 h, como el análisis de producción de biomasa y producto hacía pensar y que en las condiciones de fermentación del cultivo de cultivo incrementado se logra una proteína insoluble.
ANALISIS DE RESULTADOS OBTENIDOS EN LAS ETAPAS DE PURIFICACION DE LA PROTEINA OBTENIDA A PARTIR DE LA FERMENTACION ESCALADA
Los tres lotes de fermentación de 300 L obtenidos fueron subdivididos y dieron lugar a 22 lotes del producto purificado, la purificación de la proteína de interés se realizó de igual forma que la metodología establecida actualmente en el proceso de producción de la Estreptoquinasa recombinante , los resultados se compararon con los obtenidos en lotes del proceso actual, se muestran en la tabla 5.
Tabla 5
Resultado comparativo entre los promedios de los lotes de proceso
y los promedios lotes experimentales
| Lotes | Volumen Final (L) | Proteínas Totales (mg/mL) | Peso total (g) | Actividad biológica (UI/mL) | Actividad específica (UI/mg) | Dosis estimadas |
| Fermentación escalada | 2,95 | 2,79 | 8,30 | 131 552 | 47 647 | 221 |
| Proceso actual | 2,96 | 3,14 | 9,16 | 141 471 | 44 834 | 234 |
Se realizó un análisis estadístico de las medias y las varianzas a los parámetros de concentración de proteína medidos por Densidad Óptica a 280 nm, actividad específica y dosis por purificado, no evidenciándose diferencias estadísticamente significativas.
Análisis de la capacidad productiva utilizando la fermentación de cultivo incrementado
Utilizando el cultivo incrementado se logró obtener un peso de biomasa aproximado por lote de 21 kg lo que representa el triple de biomasa de una fermentación actual. En la tabla 6 se observa que, aunque el tiempo de fermentación es nueve horas mayores en el cultivo incrementado, semanalmente se logra obtener el doble de biomasa y es posible garantizar la materia prima para la etapa de ruptura, eliminando el cuello de botella.
Tabla 6
Comparación del proceso de fermentación actual y la incrementada
| Tipo de Fermentación | Proceso actual | Cultivo incrementado |
| Tiempo de fermentación (h) | 18 | 30 |
| Biomasa de fermentación por Lote (kg) | 7 | 21 |
| Lotes de fermentación a la semana | 6 | 4 |
| Biomasa de fermentación a la semana (kg) | 42 | 84 |
| Lotes de rupturas | 5,3 | 10,5 |
| Biomasa rota semanal (kg) | 11,6 | 23 |
| Lotes de purificados | 11 | 23 |
| Dosis a la semana | 2750 | 5750 |
Como ya se explicó anteriormente, no se necesitó adquirir ningún equipamiento ni material nuevo para realizar la fermentación de cultivo incrementado, al utilizarse los fermentadores y el equipamiento de purificación existentes. Aunque el proceso fermentativo de cultivo incrementado consume más tiempo, el volumen de biomasa obtenido permite duplicar la producción en un mismo intervalo de tiempo. Además, el costo de la biomasa de fermentación se reduce en un 63,2 %.
CONCLUSIONES
1. Se escaló la fermentación a 300 L a partir de la escala de banco de un cultivo incrementado para la producción de Skr donde se ajustaron los parámetros de fermentación y los flujos de incremento de medio de cultivo durante el proceso.
2. Se determinó el tiempo de fermentación requerido para obtener la mayor producción de la proteína de interés de forma insoluble y no afectar el proceso de purificación ya establecido.
3. No existió una diferencia estadísticamente significativa entre los parámetros: concentración (m/v), actividad específica y dosis por purificado de la proteína de Skr obtenidos al final del proceso de purificación con los obtenidos en el proceso actual.
4. Mediante la implantación del cultivo incrementado se logró aumentar al doble la producción de biomasa de fermentación, por lo que la producción de dosis del fármaco aumento al doble, además se logró una disminución del costo del medio de fermentación de un 63 %.
BIBLIOGRAFIA
1. L. HERNÁNDEZ, M. M., Streptokinase. About of a thombolytic patented in Cuba. Biotecnología Aplicada, 2005. Vol. 22, Nº3.
2. MARTINEZ, S. "Alternativa de cultivo incrementado para el aumento de rendimiento de biomasa en la fermentación de Estreptoquinasa". 2005, CUJAE-CIGB: La Habana, Cuba.
3. ZHI-HUA, J. and L. JIAN-PING. Scale-up of rifamycin B fermentation with Amycolatoposis mediterranei. Journal of Zhejiang University 2004. Vol.12, Nº5: p. 1590-1596.
4. CHUL HO KIM and K. JAGANNADHA. Scale-up of recombinant Hirudin Production from Saccharomyces Cerevisiae. Engineering Biotechnology and Bioprocess. 2003. Vol. 8: p. 303-305.
5. SAMBROOOK, A., J. FRITSCH, and E.T. MANIIATIS, "Molecular Cloning a Laboratory Manual". 3 ed. Vol. 1. 2001, New York.
6. LOWRY, O.H., ROSEBROUGH, N. J., FARR, A. L., AND RANDALL, R. J., Protein measurement with the Folin phenol reagent. J. Biol. Chem, 1951. Vol. 193: p. 265-275.
7. LAYNE, E. Spectrophotometric and Turbidimetric Methods for Measuring Proteins. Methods in Enzymology, 1957. Vol. 10: p. 447-455.
8. N.W.F. KOSSEN and N.M.G. OOSTERHIR. Biotechnology. Vol. 2. 1985, p.572-605.
9. AIBA, S. Biochemical Engineering. 2 ed. 1973, New York. p. 434.
10. DORAN, P.M., "Bioprocess Engineering Principles". 1995, London. p. 439.
Recibido: Septiembre 2016
Aprobado: Diciembre 2016
MSc. Salvador Losada-NereyI. Centro Nacional de Biopreparados, Bejucal, Mayabeque, Cuba. slosada@biocen.cu