My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Tecnología Química
On-line version ISSN 2224-6185
RTQ vol.37 no.2 Santiago de Cuba Aug. 2017
ARTICULO ORIGINAL
Propuesta de ampliación de la capacidad productiva del proceso de obtención de la proteína ß -ficoeritrina
Proposal to expand the productive capacity of the process of obtaining the B-phycoerythrin protein
Ing. Yanet Cervantes-BlancoI, Ing. Juan Carlos Ferrer- RomeroI, MSc. Frank Vendrell-CalzadillaI, MSc. George Fernández- DuharteII
I: Facultad de Ingeniería Química y Agronomía, Universidad de Oriente. Cuba ycervantes@uo.edu.cu
II: Laboratorios de Anticuerpos y Biomodelos Experimentales (LABEX). Santiago de Cuba. george@cim.sld.cu
RESUMEN
En esta investigación, realizada en los Laboratorios de Anticuerpos y Biomodelos Experimentales (LABEX), en Santiago de Cuba, debido al insuficiente volumen productivo del pigmento ß-ficoeritrina (B-PE), y a partir de un estudio teórico y experimental en laboratorio, se realizó la ampliación de la capacidad productiva de obtención de biomasa de la microalga Porphyridium cruentum y la evaluación del crecimiento celular en dos medios de cultivo: f/2 Guillard y Walne. Alcanzándose una producción de biomasa 20 veces mayor que los obtenidos a escala de laboratorio en erlenmeyer de 10 mL. Resultando, para las condiciones dadas de cultivo, el medio Walne más favorable para el crecimiento con una producción de 11,5 g de biomasa seca en 30 litros y 28,8 mg de B-PE al mes. De cuatro propuestas de escalado de columnas (1,6; 2,5; 3,5 y 6,0 cm de diámetro) para la purificación cromatográfica del pigmento obtenido de dicha biomasa, sólo las dos últimas garantizan el procesamiento de todo el volumen de biomasa y la obtención de dicha cantidad de pigmento puro para un mes de trabajo. El conjugado anti-CD4-BPE, producido en nuestro país, posee favorables propiedades para ser usado en el Sistema de Salud Cubano en diversas técnicas de alta sensibilidad. Se confirmó la factibilidad económica del proceso propuesto teniendo en cuenta las dos alternativas de purificación (3,5 y 6,0 cm de diámetro) mediante el cálculo de la ganancia anual, así como la influencia sobre la ganancia de las variables precio de venta del producto y volumen de producción.
Palabras Claves: ß-ficoeritrina, medios de cultivo, escalado de columnas cromatográficas, factibilidad económica.
ABSTRACT
In this research, conducted in the laboratories of Experimental Antibodies and Biomodels (LABEX) in Santiago de Cuba, due to insufficient production volume of the pigment ß -phycoerythrin (B-PE), and from a theoretical and experimental study in the laboratory, the expansion of the productive capacity of obtaining the microalgae Porphyridium cruentum biomass´ s and evaluation of cell growth in two culture media: f/2 Guillard and Walne was made. Biomass production 20 times higher than those obtained in laboratory scale, Erlenmeyer 10 mL, was reached. For the conditions of culture given, the medium Walne result the most favorable for growth with a production of 11,5 g of dry biomass in 30 liters and 28,8 mg of B-PE on month. Four proposals for scaling columns (1,6; 2,5; 3,5 and 6,0 cm in diameter) for the chromatographic purification of the pigment obtained from the biomass, only the last two guarantee processing all the biomass volume and obtaining this amount of pure pigment for a month of work. The anti-CD4-BPE conjugate produced in our country, has favorable properties for use in the Cuban Health System in various techniques of high sensitivity. The economic feasibility of the proposed process considering the two alternative purification (3,5 to 6,0 cm in diameter) was confirmed by calculating the annual profit and influence over gain of the variables product sales price and production volumes.
Keywords: ß - phycoerythrin, culture media, scaling chromatographic columns, economic feasibility.
INTRODUCCION
En nuestro país existe una gran demanda de herramientas diagnósticas a base de anticuerpos conjugados con diversos marcadores para ser usados en diversas técnicas de alta sensibilidad, estos conjugados constituyen uno de los reactivos esenciales más costosos. El anticuerpo conjugado se conforma del anticuerpo monoclonal (AcM) y de fluorocromos, los que facilitan la detección del antígeno durante las diferentes técnicas diagnósticas empleadas. Estos fluorocromos tienen variadas fuentes de procedencia, siendo una de ellas las microalgas.
LABEX pretende incorporar un nuevo proceso productivo, el cual viene dado por la utilización de la microalga Porphyridium cruentum para obtener el fluorocromo ß-ficoeritrina, pues este producto solo se obtiene en cantidades que apenas satisfacen las necesidades del territorio oriental, es por ello que se trabaja para fomentar el cultivo de esta microalga a gran escala en nuestro territorio.
Por lo que resulta necesario establecer los procedimientos de la producción comercial del pigmento ß-ficoeritrina en dos etapas: el cultivo de la microalga y la separación y purificación de dicho pigmento de la biomasa microalgal. De esta forma se obtendría, con recursos propios, el fluorocromo con la pureza establecida para la obtención de AcMs conjugados con calidad y costo competitivos; factibles de ser exportados y que permitan financiar su propia introducción y uso en el Sistema Nacional de Salud (Bancos de sangre, Hospitales Materno Infantiles, Servicios de Inmunohematología, Oncología y Sanatorios del SIDA).
En investigaciones llevadas a cabo en LABEX, se realizaron estudios sobre el cultivo de la microalga y de diferentes procesos para la separación y purificación de la proteína [2]; y se profundizó en el proceso de crecimiento bajo determinadas condiciones de cultivo [3]. En estos estudios realizados a escala de laboratorio (Erlenmeyer con 10 mL de medio de cultivo), se obtuvieron satisfactorios resultados en cuanto a viabilidad celular, parámetros cinéticos y producción de biomasa cuando se realiza en cultivos discontinuos a una temperatura de 20 ºC a 25 ºC, bajo luz artificial garantizando intensidad de 300 lux, valores de pH y salinidad de 7,5 y 35 %, respectivamente. Además se determinó que el crecimiento de la microalga se favorece con velocidad de agitación de 120 rpm y utilizando el medio f/2 Guillard en vez del Vonshak.
Para la purificación se estableció el método convencional: ruptura celular + centrifugación + precipitación con sulfato de amonio + diálisis + DEAE celulosa, por los altos rendimientos y pureza que se reportan; no obstante, se trabaja aún en la optimización de este proceso de purificación, siendo necesario mejorar el rendimiento de las etapas iniciales [3].
En esta investigación se propone un proceso de obtención de la proteína ß-ficoeritrina, a mayor escala, a partir de la biomasa de la microalga roja Porphyridium cruentum ; para su posterior implementación en la producción de anticuerpos conjugados.
Objetivos
-
Evaluar el crecimiento de Porphyridium cruentum en módulos de 10 L, con dos medios de cultivo: Walne y f/2 Guillard.
-
Proponer variantes de escalado para la purificación cromatográfica de ß-ficoeritrina en columnas de 1,6; 2,5; 3,5 y 6,0 cm de diámetro.
-
Realizar un estudio económico y análisis de sensibilidad del proceso.
MATERIALES Y METODOS
Biomasa utilizada como inóculo
Para la realización de este trabajo se utilizaron las cepas de la microalga roja Porphyridium cruentum , obtenida de la Colección de Cultivos de Organismos Autotróficos de Trebon, en la República Checa.
Medios de cultivo
Uno de los aspectos más importantes a tener en cuenta en la producción de microalgas, es el de seleccionar el medio de cultivo química y económicamente apropiado para utilizar en los diferentes volúmenes del sistema de producción masiva. Cuando se trabaja con volúmenes grandes, el interés radica generalmente en el uso de elementos de bajo costo y que, a su vez, aseguren altas densidades de los cultivos y buena calidad nutricional de las células [3]. Por ello se trabajó con dos medios que han asegurado un buen crecimiento celular [3]; [1]: Walne y f/2 Guillard.
Cultivo celular
Se cultivó la microalga P. cruentum en placas Petri con el propósito de lograr cultivos frescos. Cuando estas alcanzaron la fase de crecimiento exponencial fueron inoculados en los diferentes medios de cultivos, f/2 Guillard y Walne. Estos se llevaron a cabo por triplicado en módulos (bolsas desechables) de 50 L de capacidad con 10 L de medio de cultivo, la instalación se muestra en la Figura 1.
Fig 1. Instalación donde se llevó a cabo el cultivo celular.
Para garantizar un mismo valor de densidad óptica de 0,200 (DO a una longitud de onda de 545 nm) en cada módulo, en las que contenían medio f/2 Guillard se añadió un volumen de 100 mL de inóculo con una densidad óptica a 545 nm (DO 545) de 2,250; y en las réplicas con medio Walne, se añadió una cantidad de inóculo de 150 mL con densidad óptica a 545 nm (DO 545) de 1,220.
Los cultivos fueron sometidos a determinadas condiciones, temperatura de 20 ºC a 25 ºC, bajo luz artificial con lámparas de 20 W, donde se le garantizó a los cultivos alrededor de 300 lux. Sin agitación. Los valores de pH y salinidad se ajustaron a 7,5 y 35 % respectivamente. La evaluación cinética de crecimiento del cultivo se realizó durante 23 días para el medio f/2 Guillard y 12 días para el medio Walne, con mediciones diarias de densidad óptica (DO) a 545 nm (Espectrofotómetro UV-visible PG Instruments T60U) en alícuotas tomadas de 1mL.
Parámetros cinéticos
Para obtener la concentración celular y los parámetros cinéticos se procedió al conteo celular, cada dos días, utilizando una cámara de Neubauer, aplicando el método de exclusión con el colorante tripán azul al 0,4 % y se utilizan las siguientes ecuaciones cuya nomenclatura se presenta:
X: Concentración células, células/mL.
Ci: Cantidad de células contadas en el cuadrante i.
n: Número de cuadrantes contados.
Fd: Factor de dilución de la suspensión celular en tripán azul.
Fc: Factor constante de la cámara (10 4 )
µ: Velocidad específica de crecimiento del cultivo en la fase de crecimiento exponencial, días -1.
X v0: Concentración celular en el primer punto de la curva en la fase de crecimiento exponencial, células/mL.
X vf: Concentración celular en el último punto de la curva en la fase de crecimiento exponencial, células/mL.
t 0: Tiempo transcurrido en el primer punto de fase de crecimiento exponencial, días.
tf: Tiempo transcurrido en el último punto de fase de crecimiento exponencial, días.
t d: Tiempo de duplicación del cultivo en fase de crecimiento exponencial, días.
N g: Número de generaciones.
tt: Tiempo de duración del cultivo, días.
Determinación de la concentración celular:

Determinación de parámetros cinéticos
Determinación de la velocidad específica de crecimiento

Determinación del tiempo de duplicación exponencial

Determinación del número de generaciones transcurridas

Técnicas de extracción y purificación de ficobiliproteínas
En la Figura 2 se presenta el procedimiento para la separación y purificación de la B-PE con detalles de los 5 pasos principales que constituyen las 3 etapas hasta obtener la proteína pura.
Una vez concluido este paso al extracto se le añade azida sódica, como conservante, a una concentración del 0,01 % en masa y se guarda a 4 ºC.
Métodos Espectrofotométricos
A las fraccionadas coloreadas se les realiza un barrido espectrofotométrico donde se miden las densidades ópticas (DO) a 280, 545, 565, 620 y 650 nm en un espectrofotómetro (Espectrofotómetro UV-visible PG Instruments T80U) en cubeta de cuarzo de 1 cm de espesor, todas las lecturas fueron tomadas a temperatura de laboratorio.
Se determinan los grados de pureza de los concentrados de B-PE para cada muestra experimental por la relación DO 545 nm/DO 280 nm.
Las cantidades de B-PE, R-ficocianinas (R-PC) y aloficocianinas (APC) en los diferentes extractos donde están contenidas las ficobiliproteínas son calculadas teniendo en cuenta las absorbancias de 565, 620 y 650 nm mediante las ecuaciones siguientes:
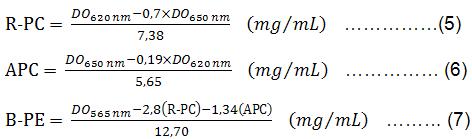
Electroforesis
Se ha utilizado la técnica de electroforesis en gel de poliacrilamida y condiciones desnaturalizantes (SDS-PAGE), para comprobar el grado de pureza en B-PE alcanzado en cada etapa del proceso de purificación. Esta técnica tiene como objetivo fraccionar las proteínas de acuerdo a su peso molecular usando un campo eléctrico. [2]
Propuesta de escalado
Se realizó una propuesta de escalado empleando columnas cromatográficas de 1,6; 2,5; 3,5 y 6,0 cm de diámetro con 15 cm de altura cada una; utilizando los resultados obtenidos en la purificación con la columna de 1,0 cm de diámetro. Para ello se emplearon las ecuaciones siguientes.
Ecuaciones empleadas en la purificación a pequeña escala con la siguiente nomenclatura:
R: Recobrado (%),
Masa 2: Masa de B-PE en la salida, mg.
Masa 1: Masa de B-PE en la entrada, mg.
Conc(x): Concentración promedio en la salida y en la entrada; mg/mL,
V(x): Volumen en la salida y en la entrada, mL.
h g: Altura de la columna, cm.
D i: Diámetro de la columna, cm.
Conc o-f: Concentración inicial y final, mg/mL.
CD: Carga dinámica, mg proteína/mL de gel.
El recobrado del proceso de purificación se calculó según:

Los valores de masa de B-PE presente en el concentrado, así como los de proteína purificada, que fueron utilizados en los cálculos de recobrado fueron calculados por:

Ecuaciones empleadas durante el escalado
Cálculo del volumen del gel en la columna (Vg)

Cálculo de la masa inicial requerida (M oR)

Cálculo de la masa final obtenida (M fR)
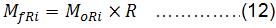
Cálculo del volumen total inicial y final a obtener (V to-f)
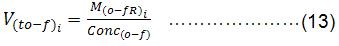
Estudio económico
Para que el diseño y puesta en marcha de cualquier proceso productivo se realice con la calidad requerida, debe ir acompañado de su respectivo análisis económico. Para ello, se necesita en primer lugar que se hayan definido las alternativas propuestas y posteriormente se evalúan económicamente dichas alternativas, escogiendo siempre la más factible.
La ganancia se calcula por el método tradicional como el resultado de la diferencia entre el ingreso por concepto de ventas y el costo de producción total.
En el análisis de sensibilidad que se realiza se tomaron en cuenta variables que influyen en los ingresos y en los costos directos:
1. Precio de venta del producto terminado.
2. Volumen de producción.
RESULTADOS Y DISCUSION
Cultivo celular
El tiempo de cultivo fue de 23 días para el medio f/2 Guillard y 12 días para el medio Walne, de los cuales los parámetros cinéticos se muestran en la tabla 1, donde se observa que los valores de velocidad específica de crecimiento para el medio f/2 son más bajos que los reportados en el estudio realizado a escala de laboratorio, por [3] a 120 rpm de agitación, en un 50 % aproximadamente. Era de esperarse que fuera el doble del tiempo de duplicación, sin embargo el número de generaciones se mantuvo igual. La fase de latencia duró más que la exponencial, al igual que la fase estacionaria.
No obstante, se observa que los resultados son semejantes a los reportados por [3] para 150 rpm de agitación, aunque la fase exponencial fue la que menos duró. En estos resultados influye el factor de la agitación, pues en el presente estudio no se agitó, y además hubo variabilidad en el suministro de CO2, lo cual influyó en el cambio de pH y en el requerimiento celular, y por ende, en el crecimiento. También hay que tener en cuenta que el volumen de inóculo añadido fue 1 % aproximadamente del volumen total del medio de cultivo.
Con la agitación se logra aumentar la transferencia de CO2 y nutrientes para el caso de esta microalga desde el medio a las células, evitando que se creen áreas estancadas con bajos niveles de CO2 y nutrientes; además, impide la formación de agregados celulares y aumenta la velocidad de transferencia de productos metabólicos de las células al medio. [3]
La agitación es un factor que incide de forma positiva sobre el crecimiento de Porphyridium cruentum , permitiendo el paso de la luz hacia el fondo del recipiente proporcionando que todas las células obtengan la iluminación suficiente para su crecimiento y desarrollo. Ver Tabla 1.
Tabla 1
Parámetros cinéticos del crecimiento de Porphyridium Cruentum en los medios f/2
y Walne en módulos de 10 L , y los reportados por [3] en Erlenmeyers de 50 mL.
| Parámetros | f/2 ( 50 mL ) 120 rpm | f/2 ( 50 mL ) 150 rpm | f/2 ( 10 L ) | Walne ( 10 L) |
| Velocidad específica (días-1) | 0,491 | 0,254 | 0,2581 | 0,6323 |
| Tiempo de duplicación (días) | 1,412 | 2,728 | 2,69 | 1,10 |
| Número de generaciones | 8,498 | 4,399 | 8,56 | 10,95 |
| Duración de fase de latencia (días) | 3 | 3 | 10 | 5 |
| Duración de fase exponencial (días) | 8 | 8 | 7 | 3 |
| Duración de fase estacionaria (días) | 1 | 1 | 6 | 4 |
Cultivo celular de Porphyridium cruentum en medio Walne y f/2 Guillard
Para el medio Walne se reportó mejor el crecimiento, pues en menor tiempo de cultivo la velocidad específica se incrementó 2,5 veces, y el número de generaciones 1,3 veces que en el medio f/2, lo cual sugiere que la composición del Walne es más propicia que el f/2 para el crecimiento de esta microalga.
En los gráficos que se muestran en las Figuras 3 y 4 se evidencia como para el medio Walne hubo una menor duración de la fase de latencia que en el medio f/2, mientras que en la fase exponencial se comportaron iguales respecto al tiempo de cultivo. Esta fase se caracteriza fundamentalmente por el exceso de nutrientes en el cultivo, limitándose sólo la velocidad de crecimiento por características propias del microorganismo [3]. También se observa una inestabilidad en los valores de densidad óptica para el medio f/2, lo que pudo ser causado por la inadecuada agitación de las bolsas antes de la toma de muestra. Por lo que es de esperarse una baja productividad de biomasa en el f/2 con respecto al Walne y por estas razones, sólo se le realizó peso seco al medio Walne.
Fig 3. Curva de crecimiento de P. cruentum en medio f/2 Guillard.
Fig 4. Curva de crecimiento de P. cruentum en medio Walne.
Con el aumento de las producciones biotecnológicas en Cuba se hace necesario valorar cuál es el medio de cultivo que garantiza una velocidad de crecimiento máxima, garantizando una mayor producción, y que no sea muy costoso para el país contribuyendo a mantener las producciones actuales y futuros productos. [3]
La velocidad de crecimiento está relacionada con la duración de la fase exponencial, encontrándose que los cultivos que presentan esta fase más larga, tienen una velocidad de crecimiento menor, que los que presentaron velocidades de crecimiento mayores y muestran una fase exponencial más corta. [3]
En estas condiciones de cultivo se obtuvo para el medio Walne 0,0032 g de biomasa húmeda por mL de medio de cultivo, lo que corresponde a 96 g en 30 litros , produciéndose 11,5 g de biomasa seca en 30 litros y 28,8 mg de ß-ficoeritrina al mes.
Purificación de ß-ficoeritrina
Puesto que la utilidad que se le quiere dar al producto es con fines biotecnológicos como marcador fluorescente se necesita con un alto porcentaje de pureza; por lo que se debe enfocar no solo en obtener mejoras en el rendimiento sino también en pureza.
Luego de llevarse a cabo la purificación a pequeña escala se obtuvieron los siguientes resultados, que fueron corroborados mediante electroforesis, lo que se presenta en la Figura 5.
Concentración de la muestra aplicada: 0,05 mg/mL
Masa de ficobiliproteínas aplicada: 2 mg
Concentración de la muestra eluida: 0,1 mg/mL
Masa de ß-ficoeritrina pura obtenida: 0,9 mg
Recobrado del proceso: 20 %.
Pureza: 4,6
El valor de pureza obtenido está en correspondencia con lo reportado en la literatura para conjugar anticuerpos.
El espectro de este extracto muestra que los picos de B-PE (545, 565 nm) es el componente principal obtenido del extracto, siendo este pico característico de la B-PE. Aunque los criterios más utilizados para comprobar la pureza de las biliproteínas es la razón de absorbancia, la pureza debe ser seguida por experimentos de electroforesis con el fin de confirmar dicho valor. En la Figura 6 se observa la B-PE obtenida por el proceso propuesto
Fig 6 . B-PE obtenida por el proceso propuesto.
Propuesta de escalado
Una vez obtenida la ß-ficoeritrina pura por la metodología propuesta (figura 6), se concibieron cuatro propuestas de escalado partiendo de los resultados obtenidos a escala de laboratorio.
En todas las propuestas se mantuvo una altura de gel de 15 cm , la velocidad lineal de 3,8 cm/min, la carga de dinámica de 0,1 mg proteína/mL de gel y la razón entre el volumen de muestra y el volumen de gel. Así se tienen los resultados que a continuación se muestran en la Tabla 2.
Tabla 2
Resultados del escalado cromatográfico para las variantes propuestas
| Parámetros | D1 = 1,6 cm | D2 = 2,5 cm | D3 = 3,5 cm | D4 = 6,0 cm |
| Volumen de gel (cm3) | 30,20 | 73,65 | 144,35 | 424,15 |
| Masa inicial requerida (mg) | 3,00 | 7,40 | 14,45 | 42,40 |
| Masa final obtenida (mg) | 0,60 | 1,50 | 2,90 | 8,50 |
| Volumen total inicial a obtener (cm3) | 60,40 | 147,20 | 288,60 | 848,20 |
| Volumen total final a obtener (cm3) | 6,00 | 33,10 | 29,00 | 84,80 |
| Tiempo de purificación cromatográfica de 30 L de medio de cultivo (días) | 48,00 | 19,20 | 9,90 | 3,40 |
Se muestra que para un volumen de medio de cultivo de 30 L por mes, la columna de 1,6 cm. de diámetro se demora 48 días y la de 2,5 cm; 19,2 días en purificar cromatográficamente; lo cual no es conveniente, pues los procesos previos a la cromatografía se demoran unos 15 días, por lo tanto para llevar a cabo el proceso de cultivo y purificación completo en un mes, se sugieren las restantes columnas.
Conjugación con anticuerpo
La ß-ficoeritrina obtenida se conjugó con el anticuerpo anti-CD4, y se obtuvo con la calidad necesaria para su uso en el Sistema de Salud. Es de relevancia notificar que es la primera vez que se produce un conjugado en nuestro país, el cual se desea comercializar por un precio de $ 400/100 determinaciones.
Cálculo económico
Para la puesta en marcha del proceso de obtención de ß-ficoeritrina a una mayor escala, se determinó la ganancia anual teniendo en cuenta las dos variantes de purificación cromatográfica de 3,5 y 6,0 cm de diámetro. Los resultados se presentan en la Tabla 3:
Tabla 3
Cálculo de la Ganancia Anual
|
| f/2 Guillard | Walne |
| Elementos | $/año | $/año |
| Capital fijo | 12534,20 | 12534,20 |
| Costos de Fabricación directos (CFD) | 6313,43 | 5557,64 |
| Costo de fabricación indirecto (CFI) | 900,47 | 900,47 |
| Costo de fabricación totales (CFT) | 7213,90 | 6458,11 |
| Gastos Generales (GG) | 1685,35 | 1551,97 |
| Costos de Producción Totales | 10152,66 | 9263,51 |
| Ingreso por venta (CUC/año) | 34452,00 | 34452,00 |
| Ganancia (CUC/año) | 24299,34 | 25188,49 |
Tabla 4
Ganancia anual de las variantes para medio Walne
| Variante | Tiempo (días) | Ganancia ($/año) |
| 3,5 cm | 9,90 | 25188,49 |
| 6,0 cm | 3,40 | 25007,00 |
Se puede observar en la Tabla 4, que la diferencia entre ambas variantes es sólo de 181,50 $/año, pero con la segunda variante se purifica en menor tiempo, por tanto, se sugiere cualquiera de las dos para llevar a cabo el proceso de producción comercial a mayor escala de ß-ficoeritrina. También se aprecia que el medio Walne cuesta 10 veces más barato que el f/2, y por tanto se obtienen aproximadamente 900 CUC/año más de ganancia utilizando el primero.
Análisis de sensibilidad
En los gráficos de las Figuras 7 y 8 se muestra la influencia de las variables seleccionadas sobre la ganancia anual de cada variante de purificación 3,5 y 6,0 cm de diámetro.
Fig 7 . Comportamiento de la ganancia al variar precio de venta y volumen de producción para un diámetro de 3,5 cm.
Fig 8 . Comportamiento de la ganancia al variar precio de venta y volumen de producción para un diámetro de 6,0 cm.
Como se puede apreciar en ambas variantes, la influencia de las variables se comporta de forma similar sobre la ganancia anual, corroborándose el gran impacto que generan las mismas, pues al aumentar tanto el precio de venta como el volumen productivo en un 20 %, las ganancias se incrementaron un 1,26 %. También se puede observar que para un 70 % aproximadamente de disminución de las variables, no se obtienen ganancias y el proyecto no sería factible, por lo que se recomienda, preliminarmente, que el precio de venta no sea menor de 30 $/mg de ß-ficoeritrina y que se produzcan más de 8,6 mg mensuales.
Para el diagnóstico y seguimiento de los pacientes con VIH/SIDA (aproximadamente 15 000 casos en Cuba) se requieren más de 300 frascos anuales. Esa cifra se eleva a más entre 1000-3000 si se incluyera el diagnóstico y seguimiento de otras enfermedades autoinmunes y los diferentes Hospitales que cuentan con el servicio de citometría de flujo en el país. [3]
En Suramérica, países como Brasil, Argentina y Chile cuentan con sistemas suficientemente avanzados para dar este tipo de servicios, ellos pueden convertirse en potenciales compradores de ß-ficoeritrina para diferentes usos. [3]
Por lo que es necesario que las materias primas para la obtención de estos fluorocromos, en este caso el medio de cultivo Walne además de su fácil preparación, la viabilidad que se alcanza en el crecimiento de las microalgas, la pureza de la ß-ficoeritrina que se obtiene; y el costo de los reactivos a emplear para su preparación, abarate los cultivos. [3]
CONCLUSIONES
1. Se alcanzó una producción de 96 g de biomasa de Porphyridium cruentum en módulos de 10 L , o sea, 20 veces más que los obtenidos a escala de laboratorio en Erlenmeyer de 10 mL, con resultados cinéticos de crecimiento celular menos óptimos que los logrados en el laboratorio, debido a diferencias en las condiciones de cultivo.
2. El medio de cultivo Walne es más conveniente que el f/2 Guillard para el crecimiento de la microalga Porphyridium cruentum tanto por su composición como económicamente, al reportar mayores ganancias.
3. Se proponen como variantes de escalado para la purificación cromatográfica de ß-ficoeritrina columnas de 3,5 y 6,0 cm de diámetro para alcanzar una producción de 28,8 mg mensuales de esta proteína en 25 y 19 días, respectivamente.
4. El conjugado anti-CD4-BPE, producido en nuestro país, posee favorables propiedades para ser usado en el Sistema de Salud Cubano.
5. Se comprobó la factibilidad económica de las dos alternativas propuestas, así como la sensibilidad de las ganancias anuales para cada una respecto al precio de venta del producto y el volumen de producción.
BIBLIOGRAFIA
1. ÁLVAREZ, H. "Medios de cultivo". Folleto de Algas. Escuela Superior Politécnica del Litoral. Capítulo IV. Impreso en Ecuador, 1994, pág. 29-37.
2. FERNÁNDEZ, George. "Obtención de la ß-ficoeritrina a partir de Porphyridium cruentum y su uso en el inmunodiagnóstico". Trabajo en opción al título académico de Máster en Biotecnología. Centro de Estudios de Biotecnología Industrial. Facultad de Ciencias Naturales. Universidad de Oriente. Santiago de Cuba. Cuba. 2007.
3 . FERRER, Dagmara. "Estudio del proceso de crecimiento de Porphyridium cruentum para la obtención de ß-ficoeritrina bajo determinadas condiciones de cultivo". Trabajo de Diploma. Facultad de Ingeniería Química. Universidad de Oriente. Santiago de Cuba. Cuba. 2012.
4. FERRER, Juan. "Aceleración del crecimiento de Porphyridium cruentum con campos magnéticos". Trabajo de Diploma. Facultad de Ingeniería Química. Universidad de Oriente. Santiago de Cuba. Cuba. 2012.
5. HERNÁNDEZ, T., BENAVIDES J., RITO M. "Proceso para la purificación del colorante proteico ß-ficoeritrina producido por Porphyridium cruentum ". Revista Mexicana de Ingeniería Química . 2006. Vol. 5. Número 002. Pág. 131-143.
6 . SARMIENTO I. "Propuesta de purificación cromatográfica del anticuerpo monoclonal Anti-CD45". Trabajo de Diploma. Facultad de Ingeniería Química. Universidad de Oriente. Santiago de Cuba. Cuba. 2012.
7. TRUJILLO M., VALDEZ N. "El uso de biorreactores desechables en la industria biofarmacéutica y sus implicaciones en la ingeniería". Dyna . 2009. Vol. 76. No. 158. Pág. 275-283.
Recibido: Noviembre 2016
Aprobado: Marzo 2017
Ing. Yanet Cervantes-BlancoI. Facultad de Ingeniería Química y Agronomía, Universidad de Oriente. Cuba ycervantes@uo.edu.cu




















