Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.37 no.3 Santiago de Cuba sep.-dic. 2017
ARTICULO ORIGINAL
Esterilización de soluciones para productos parenterales. Análisis de la problemática
Sterilization of solutions for parenterals products. Problem analysis
Ing. Yanelys Montes-GonzálezI, Ing. Luis Carlos Hidalgo-GuerreroI, Dr. Orestes Mayo-AbadII
I Centro Nacional de Biopreparados, Bejucal, Mayabeque, Cuba
II Facultad de Ingeniería Química, Universidad Tecnológica de La Habana, Cuba. omayo@quimica.cujae.edu.cu
Resumen
Las soluciones para la formulación de productos parenterales deben ser estériles antes de pasar al proceso aséptico de la formulación. Por esta sazón se analizan los diferentes métodos de esterilización referidos en la literatura. Se presentan los criterios termodinámicos que rigen la esterilización. Además, se analizan las experiencias anteriores en la esterilización de soluciones para la formulación de productos parenterales en una autoclave, los cuales muestran tiempos prolongados del proceso y solo se pueden manejar bajos volúmenes de solución. Usando tanques agitados enchaquetados para la esterilización pudieran resolver esta problemática y, por tanto, se muestran los criterios para el diseño de estos que permiten procesar altos volúmenes de solución para la formulación de productos parenterales.
Palabras clave: esterilización, tanques enchaquetados, productos parenterales.
Abstract
The solutions for the formulation of parenteral products must be sterile before the aseptic formulation process. For this reason, different methods of sterilization referred in the literature are analyzed. Thermodynamic criteria that rule the sterilization are presented. Furthermore, previous experiences in the sterilization of solutions for the formulation of parental products in an autoclave are analyzed, that take large time of processing and only low volumes of solution can be handled. Using jacketed stirred tanks for the sterilization may solve the problem and, therefore, criteria for the design of the later that allow to process high volumes of solution for the formulation of parenteral products are shown.
Keywords: sterilization, jacketed tanks, parenterals products.
INTRODUCCION
Una de las tareas más importantes en la producción de parenterales de bajo volumen está relacionada con la esterilización de las soluciones usadas en la formulación. Para esta operación en BioCen se aplican dos métodos de esterilización de líquidos, dependiendo entre otros factores del volumen y la naturaleza de los mismos.
Un método es la filtración esterilizante donde son removidos los contaminantes microbiológicos con el uso de filtros con una porosidad menor o igual a 0,2 µm, utilizando sistemas cerrados. Este método es preferentemente usado para líquidos sensibles al calor (termolábiles), pero está limitado sólo a soluciones verdaderas y de bajo volumen porque los filtros se colmatan rápidamente y la velocidad de filtración a través de ellos es lenta.
Otro método de esterilización de líquidos es por calor húmedo en una autoclave, su eficacia depende de dos factores: el tiempo de exposición y la temperatura. Este método se aplica para esterilizar tanto las suspensiones como las soluciones verdaderas, pero está limitado para soluciones que sean termolábiles. Generalmente se aplican ciclos de esterilización estándar descritos en la literatura de 30 min a 121 °C.
En el caso de la esterilización por calor húmedo en una autoclave los estudios de validación arrojaron resultados desfavorables, demostrando que, para volúmenes de soluciones verdaderas superiores a 15 L y volúmenes de suspensiones superiores a los 5 L, la temperatura no es uniforme en todo el líquido. Por lo tanto, no se alcanzan los parámetros establecidos para obtener una solución estéril. Ante esta situación, se decide incrementar la variable tiempo hasta lograr alcanzar la temperatura en el punto más frio, dando como resultado un considerable aumento del tiempo de duración de los ciclos. Además, el diferencial de temperatura entre el líquido cercano a la superficie del contenedor y el seno del líquido es demasiado grande ocasionando pérdidas por evaporación muy elevadas y en algunos casos afectación de las propiedades químicas de los componentes de la solución [1].
Para la puesta en marcha de la nueva planta de productos parenterales (PPP3) en BioCen , esta situación constituye una problemática, teniendo en cuenta que se prevé un aumento considerable en los volúmenes de producción de parenterales dedicado al consumo nacional e internacional.
Tomando en cuenta que la esterilización de soluciones puede realizarse en sistemas cerrados enchaquetados con ventajas y desventajas similares a la esterilización por calor húmedo realizado en una autoclave, se conciben sistemas conformados por tanques de acero inoxidable AISI 316L, enchaquetados, con sistemas de agitación para facilitar el movimiento forzado del líquido, propiciando la homogeneidad de la temperatura en poco tiempo.
MATERIALES DE EXTERILIZACION
Esterilización: Es el proceso de eliminación o de destrucción de toda forma de vida microbiana contenida en un objeto o sustancia, impidiendo su posterior contaminación; esto quiere decir que comprende todos los procedimientos físicos, mecánicos y químicos usados para destruir gérmenes patógenos [2, 3]. A diferencia de muchas especificaciones la esterilidad es un valor absoluto Un producto es estéril o no estéril.
Para lograr los procesos de esterilización existen varios métodos que pueden ser químicos o físicos; en la tabla se presentan las ventajas y desventajas de estos métodos.
Tabla
Métodos de esterilización. Ventajas y desventajas
| Método de esterilización | Ventajas | Desventajas |
| Óxido de etileno | Se puede esterilizar material sensible al calor, equipos electrónicos y otros [4]. | Es peligroso por ser altamente inflamable, explosivo y cancerígeno |
| Peróxido de hidrógeno | No deja ningún residuo toxico, se convierte en agua y oxígeno al final del proceso, material sin aireación [5]. | Es un método muy costoso |
| Calor Húmedo | Produce rápido calentamiento y penetración, destrucción de bacterias y esporas en poco tiempo, no deja residuos tóxicos [2, 6, 7]. | No se permite para emulsiones con agua, es corrosivo sobre algunos metales |
| Calor seco | No es corrosivo para metales e instrumentos, permiten la esterilización de sustancias en polvo y no acuosas [7]. | Mayor tiempo de esterilización, baja penetración del calor |
| Radiaciones ionizantes | Pueden esterilizar superficies [8]. | Son escasamente penetrantes |
| Filtración | Pueden esterilizarse aceites, pomadas, soluciones oftálmicas, entre otros [9]. | Los filtros no retienen virus ni micoplasma. |
Se desprende de lo mostrado anteriormente que solamente es conveniente utilizar el método de esterilización por calor húmedo para la esterilización soluciones para la formulación de parenterales.
Aspectos termodinámicos de los procesos de esterilización
Valores F, D, y Z
El proceso de esterilización involucra diversas variables interrelacionadas, cada una de las cuales opera bajo un conjunto único de circunstancias, es por esto que se han desarrollado relaciones matemáticas para entender los mecanismos involucrados en el proceso de esterilización. La esterilización es una función de probabilidad que depende de: El número de microorganismos del reto, la resistencia al calor de estos microorganismos y la cantidad de calor de exposición.
Los factores F, D y Z comparan la eficacia de los diferentes ciclos de esterilización usando un modelo matemático que permite la adecuación de los mismos.
Valor F . El valor de F (homólogo a la tasa de letalidad) se utiliza como una medida de la eficacia de la esterilización. El valor de F se cita como el tiempo equivalente a una temperatura dada entregado a un contenedor o unidad de producto calculada en función del valor Z. Si, por ejemplo, se declara a una temperatura base de 121 °C, F0 con un valor de 9, quiere decir que el proceso es equivalente exactamente a 9 minutos a 121,1 °C, independientemente de la temperatura del proceso y el tiempo utilizado en el ciclo [10]. Para todos los métodos de esterilización térmica, el valor de F se utiliza junto con la concentración de microorganismos incluidos en el reto biológico, el valor de Z y el valor D para determinar la eficacia microbiológica del ciclo de esterilización [3].
Cálculo de F0
En términos matemáticos, F 0 se expresa de la forma siguiente [3].

Calculo de F0 mínimo requerido
Conociendo la temperatura del proceso equivalente a 121°C, se necesita saber exactamente la tasa de letalidad mínima para un ciclo de esterilización que puede ser determinado por la evaluación del nivel que se desea para garantizar la esterilidad, junto con la carga y la resistencia de los microorganismos del reto microbiológico, mediante la fórmula [11]:

Valor Z. Número de grados de cambio de temperatura necesarios para cambiar el valor D por un factor de 10. El valor de Z es un componente necesario de los cálculos que permiten la comparación de la letalidad de esporas a diferentes temperaturas. Aunque el valor Z es una característica fundamental de un microorganismo, no es verdaderamente independiente de la temperatura, y es constante sólo para pequeñas diferencias de temperatura del orden de 20 °C a 25 °C. Los procesos de esterilización por calor, sin embargo, normalmente se llevan a cabo dentro de un pequeño intervalo de temperaturas, por ejemplo, de 110 °C a 135 °C, por lo tanto, el valor de Z se suele considerar constante. En ausencia de datos alternativos, la aceptación general de valores supuestos de
Z para: esterilización por vapor es de Z = 10 °C [3].
Valor D. Tiempo en minutos requerido para destruir el 90 % de una población a una temperatura específica. En otras palabras, es el tiempo para que disminuya la población en un logaritmo (10 veces).
Determinación del valor D
El valor D varia con la selección del microorganismo, se utiliza como una medida de la tasa de inactivación microbiana [3] y se puede estimar a partir de la ecuación siguiente:

Si se define t en la ecuación (3) como el tiempo equivalente de exposición a una temperatura T , la ecuación (3) se puede expresar como:

La ecuación (4) se puede arreglar para expresar el valor de la reducción microbiana Y n como:
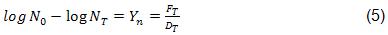
Así, por ejemplo, si F T = 8 min y D T = 1 min, el valor de la reducción microbiana Y n = 8. Esto significa que el proceso ha sido suficiente para reducir 8 logaritmos la carga microbiana con un valor de D =1 min a la temperatura especificada T.
Pflug [12] sugiere el término probabilidad de una unidad no estéril se adopte para definir productos libres de contaminación microbiana. Matemáticamente, este término se corresponde con N T de la ecuación (5). Por lo que:
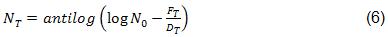
El valor de 10 -6 se usa comúnmente en estudios de validación para N T en la ecuación (6). Esto significa que después de un periodo de tiempo equivalente de F T unidades, la población microbiana con un valor inicial de N 0 se ha reducido a un valor final N T de 10 -6 . Estadísticamente, esto significa que teóricamente, una unidad en un millón del producto no es estéril después de una exposición de F T unidades. Por ejemplo, si 10 6 microorganismos con un valor de D de un min a 121 ºC se colocan en un contenedor y se exponen a 121 ºC por un tiempo equivalente de 12 min, se obtiene un valor de N T de 10 -6 como se muestra a continuación.

Por lo tanto, cualquier proceso de esterilización debe garantizar una letalidad acumulada F0que satisfaga un nivel aceptable de esterilidad.
Esterilización de líquidos en una autoclave
El proceso de esterilización en una autoclave puede resultar problemático en algunas ocasiones. Por ejemplo, cuando se esterilizan líquidos, este proceso puede requerir mucho tiempo, los frascos deben permanecer abiertos o ventilados y parte del líquido puede llegar a ebullición y evaporarse o incluso los frascos pueden estallar debido a esta ebullición. Otro problema a tener en cuenta es saber si el líquido del interior de los frascos ha alcanzado la temperatura requerida de esterilización (por ejemplo. 121 °C) o cuándo debería ser seguro sacar los frascos de la autoclave, una vez completado el proceso de esterilización [13].
La figura 1 muestra el proceso de esterilización para líquidos, el cual se divide en tres fases:
1. Fase de calentamiento hasta alcanzar el equilibrio (H)
2. Fase de esterilización, por ejemplo, a 121 °C durante 20 min (S)
3. Fase de enfriamiento hasta alcanzar una temperatura segura para retirar el material esterilizado (C)
En la figura 1, la línea azul representa la temperatura registrada en el recipiente situado en el interior de la autoclave; la línea roja representa la temperatura registrada en el líquido. Se puede apreciar claramente que el recipiente alcanza la temperatura deseada mucho más rápido, mientras que el líquido que permanece en el interior de los frascos, necesita más tiempo para alcanzar la temperatura de esterilización [7]. Durante la fase de calentamiento, la energía térmica del vapor se transfiere a los frascos, lo que conlleva una condensación del vapor. Dicho proceso de condensación y su consiguiente transferencia térmica requiere de tiempo, explicando así el intervalo de tiempo que existe entre el calentamiento del recipiente y el calentamiento de los líquidos en su interior.
Estudios de ciclos de esterilización de líquidos en autoclave
La penetración del calor dentro de un líquido está influenciada por diversos factores, los más importantes a considerar son: la naturaleza del líquido, propiedades físico químicas, y volumen a esterilizar. A continuación, se muestran estudios realizados por varios autores.
Caso de estudio Nº 1
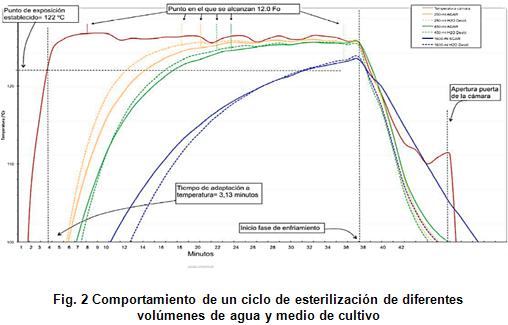
Se llevó a cabo usando dos tipos de líquidos: agua y medio de cultivo, dispensando diferentes volúmenes según se muestra en la figura 2 [14].
Los resultados evidencian la complejidad de llevar a cabo ciclos de esterilización de líquidos en una autoclave, donde influye negativamente el aumento en volumen y las propiedades químicas de los mismos.
Caso de estudio Nº 2
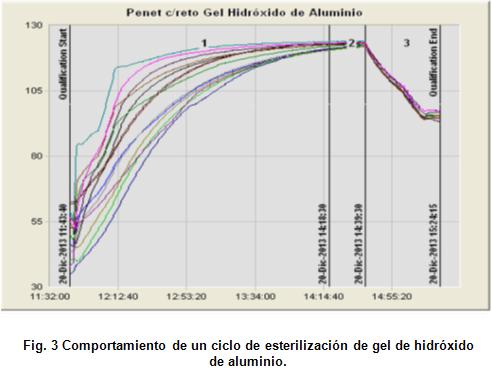
Ciclo de esterilización de gel de hidróxido de aluminio en el Instituto Finlay, año 2015 [15].
Para realizar este estudio se colocaron 6 botellones de 5 litros de capacidad con 1,8 litros de gel a una concentración de 20 g/L como Al (OH)3. Ver a continuación la figura 3.
Los resultados obtenidos demuestran que el tiempo en la etapa de calentamiento se extiende considerablemente (alrededor de 3 horas), para alcanzar la temperatura de esterilización, lo cual está influenciado por las propiedades físico – químicas de la solución y el volumen a esterilizar.
Caso de estudio Nº 3
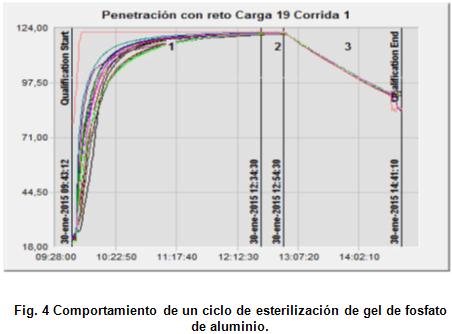
Ciclo de esterilización de gel fosfato de aluminio en BioCen, año 2015 [16].
El estudio se llevó a cabo colocando 3 botellones de 20 L de capacidad, cada uno con un volumen de 4 litros de gel a una concentración de 3 g/L como AlPO4. Ver a continuación la figura 4.
Los resultados obtenidos fueron muy similares a los realizados en el Instituto Finlay, se demuestra que este método no es eficiente para esterilizar volúmenes superiores a 5 L de suspensión, las cuales se caracterizan por su baja conductividad térmica.
Como resultado del análisis de los casos de estudio se desprende que se requiere utilizar otra tecnología diferente a la esterilización en una autoclave para lograr un proceso eficiente en un tiempo prudencial, si se desea, por ejemplo, obtener 80 L de solución estéril.
Aspectos de diseño de la tecnología de tanques para esterilización de líquidos
Los tanques de acero inoxidable, agitados y enchaquetados pueden ser usados para la esterilización de líquidos, si se tiene en cuenta que los procesos de calentamiento y enfriamiento ocurren en menor tiempo, debido a que ocurre una transferencia térmica por convección forzada, cuando entra en contacto el líquido con la pared del tanque, la cual posee una temperatura diferente.
Esta tecnología puede ser utilizada como contenedor multipropósito, condición que permite preparar soluciones con diferente composición química, siempre que se pueda demostrar que se garantiza la esterilidad y que son efectivos los procesos de limpieza para evitar la contaminación cruzada o mezcla de productos [17]
Material de construcción
El acero inoxidable es una aleación de hierro y carbono que contiene por definición un mínimo de 11 % de cromo. Algunos tipos de acero inoxidable contienen además otros elementos aleantes, los principales son el níquel y el molibdeno que los hace más resistentes a la corrosión, el cromo que contiene posee gran afinidad por el oxígeno y reacciona con él formando una capa pasivadora, que evita la corrosión del hierro contenido en la aleación. Sin embargo, esta película puede ser afectada por algunos ácidos dando lugar a un ataque y oxidación del hierro por mecanismos ínter granulares o picaduras generalizadas [18]. El acero inoxidable del tipo AISI 304 (15 % Cr – 8 % Ni) es el más representativo de este grupo de aleaciones. Posee una buena resistencia a la corrosión atmosférica y se emplea en forma significativa en la industria química, alimentaria y médica. Cuando las condiciones de servicio exigen una mayor resistencia a la corrosión por picaduras se emplea el acero inoxidable del tipo AISI 316 (16 % Cr – 12 % Ni – 2 % Mo) y el AISI 316L (con igual composición pero con menor contenido de carbono), que es empleado mayormente en procesos industriales como la elaboración del papel, en las industrias biofarmacéutica y alimentaria [19].
Agitación magnética
La agitación magnética en tanques tiene la función de generar la energía necesaria para producir una mezcla homogénea en el líquido y un régimen de agitación adecuado. La velocidad del impelente es el parámetro más importante, la cual varía de acuerdo a los requerimientos del proceso. La selección del impelente se hace de acuerdo a los parámetros siguientes: volumen del tanque y viscosidad del líquido [20]. Ver a continuación la figura 5.
CONCLUSIONES
1. La esterilización de soluciones se puede realizar sometiendo el contenedor a la acción de vapor húmedo.
2. Las experiencias previas recomiendan no utilzar autoclaves para la esterilización de soluciones.
3. Se logran tasas de letalidad aceptables si el contenedor se expone a valores superiores de F0 mínimo.
4. Es posible diseñar tanques agitados con chaquetas por donde circule vapor industrial para la esterilización de soluciones para la formulación de productos parenterales de forma eficiente.
BIBLIOGRAFIA
1. GARCÍA, I., "Penetración con reto esterilización de gel de hidróxido de aluminio". 2013. La Habana, Cuba.
2. AGALLOCO, J. P.; AKERS, J. E..; MADSEN, R. E. "Moist Heat Sterilization-Myths and Realities". PDA Journal of Pharmaceutical Science and Technology, vol 52. 1998.
3. AGALLOCO, J.P., "Moist Heat Sterilization in Autoclave Cycle Development, Validation and Routine Operation". 2000.
4. CAPUTO, R.A.; ROHN, K.J. MACOLI, C.C. "Biological validation of an ethylene oxide sterilization process". Dev Indus Microbio, 1981. vol 22: p. 357–362.
5. EDWARDS, L.M.; CHILDERS, R.W. "Hydrogen peroxide vapor sterilization: Applications in the production environment". 1995, p. 415–466.
6. PARENTERAL DRUG ASSOCIATION, Validation of Moist Heat Sterilization Processes: Cycle Design, Development, Qualification and ongoing Control. 2007.
7. PARENTERAL DRUG ASSOCIATION, Validation of Dry Heat Processes Used for Sterilization and Depyrogenation. 1981.
8. SILVERMAN, G.J., Sterilization by ionizing radiation. Philadelphia. 1991, p. 566–579.
9. SARTORIUS STEDIM, Bioprocess Catalogue Products and Solutions for the Biopharmaceutical Industry. 2006.
10. ISAACSON, R. Sterilization/validation, qualification requerimens. 2009.
11. MOTOLA, S., "Validation of Steam Sterilization Cycles" .
12. PFLUG, I.J., "Heat Sterilization", 1973.
13. ERNST, R.R.; WEST, K.L.; DOYLE, J.E., "Problem areas in sterility testing" . Bull Parenter Drug Assoc, 1969. vol 23, p. 290-039.
14. KRUSHEFSKI, G. "Esterilización por vapor de contenedores llenos de líquido". Spore News, 2010. vol 7, núm 5. 2010. p, 6-8.
15. VALLADARES, G., "Penetración con reto de la carga 9 Esterilización del gel de hidróxido de aluminio" . 2015, La Habana, Cuba.
Recibido: Noviembre 2016
Aprobado: Marzo 2017
Ing. Yanelys Montes-GonzálezI. Centro Nacional de Biopreparados, Bejucal, Mayabeque, Cuba