Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.38 no.1 Santiago de Cuba ene.-abr. 2018
ARTÍCULO ORIGINAL
Validación de sistemas de preparación de soluciones para productos parenterales
Validation of solution preparation systems for parenteral products
Ing. Yanelys Montes GonzálezI, Ing. Luis Carlos Hidalgo GuerreroI, Dr. Orestes Mayo AbadII
I: Centro Nacional de Biopreparados, Bejucal, Mayabeque, Cuba
II: Facultad de Ingeniería Química, Universidad Tecnológica de La Habana, La Habana, Cuba. omayo@quimica.cujae.edu.cu
RESUMEN
El desarrollo de la tecnología de sistemas de preparación de soluciones basado en tanques de acero inoxidable enchaquetados, interconectados por lazos de tuberías y un sistema de control automático soportado por PLC y SCADA, se implementó en BioCen con la finalidad de reemplazar el método tradicional de esterilización de grandes volúmenes de solución en autoclaves. Las soluciones preparadas para la formulación de medicamentos no pueden contaminarse químicamente y deben quedar estériles, previo al procesamiento aséptico. La validación de estos sistemas es un requerimiento de las buenas prácticas de producción farmacéutica, pues es la forma de comprobar que responde a los resultados de calidad esperados. La calificación del desempeño que incluye: calificación de los ciclos de limpieza, esterilización en el lugar, y esterilización de líquidos además de la simulación de los procesos con medios de cultivo, son estudios de validación que se realizan para demostrar la confiabilidad del sistema. Para la validación de la limpieza se tiene en cuenta la composición de cada solución, concentración del agente químico a usar, temperatura, volumen de agua y tiempo, para la esterilización del sistema vacío y esterilización de la solución se tienen en cuenta temperatura y tiempo. Los resultados obtenidos demuestran que las soluciones quedan estériles y que no hay riesgo de contaminación cruzada entre soluciones de diferente composición. Además, se realizaron durante la puesta en marcha, simulaciones del proceso con medio de cultivo, lo que define que el sistema es capaz de reproducir ciclos de esterilización consistentemente.
Palabras clave: validación, preparación de soluciones, esterilización, productos parenterales.
ABSTRACT
The development of solutions preparations systems technology, supported on stainless steel jacketed tanks, interconnected by pipe loops and an automatic control system supported by mean of PLC and SCADA was implemented at BIOCEN with the aim to replace the traditional sterilization of large volumes in autoclave. The prepared solutions for the formulation of parenteral products cannot be contaminated chemically and have to be sterile before aseptic processing. The validation of these systems is a requirement of the Good Manufacture Practices for Pharmaceutical products, since it is the way to prove that it is in accordance with the expected quality results. The performance qualification includes: qualification of the Cleaning in Place, Sterilization in Place, and Batch Sterilization in place, and the process simulation with culture media, are validation studies that must be carried out to demonstrate the reliability of the system. For the validation of cleaning, the composition of each solution, concentration of the chemical agent used, the temperature, the volume of water for injection and the time is considered. For the sterilization of the empty system and batch sterilization of the solution, the variables to take in considerations are temperature and time. The results demonstrated that the solutions remain sterile and there is no risk of cross contamination between the solutions of different composition. In addition, to confirm the previous results the process simulation with culture media was carried out. These results define that the solution preparation system is capable to reproduce sterilization cycles consistently.
Keywords: validation, solutions preparation, sterilization, parenterals products.
INTRODUCCION
Una de las tareas más importantes en la producción de productos parenterales es la relacionada con la esterilización de las soluciones usadas en la formulación. Para esta operación en BioCen se aplican dos métodos de esterilización de líquidos, dependiendo entre otros factores del volumen y la naturaleza de los mismos.
Uno de los métodos de esterilización es la filtración esterilizante, donde son removidos los contaminantes microbiológicos con el uso de filtros con una porosidad menor o igual a 0,2 µm. Este método es preferentemente usado para líquidos sensibles al calor (termolábiles), pero está limitado sólo a soluciones verdaderas y de bajo volumen porque los filtros se colmatan rápidamente y la velocidad de filtración a través de ellos es lenta.
Otro método de esterilización de líquidos es por calor húmedo en autoclave; su eficacia depende de dos factores: el tiempo de exposición y la temperatura. Este se aplica para esterilizar tanto las suspensiones como las soluciones verdaderas, pero está limitado para soluciones que sean termolábiles. Generalmente, se aplican ciclos de esterilización estándar descritos en la literatura de 30 min a 121 °C [1]. En el caso de la esterilización por calor húmedo en autoclave los estudios de validación arrojaron resultados desfavorables [2], demostrando que, para volúmenes de soluciones verdaderas superiores a 15 L y volúmenes de suspensiones superiores a los cinco litros, la temperatura no es uniforme en todo el líquido. Por lo tanto, no se alcanzan los parámetros establecidos para obtener una solución estéril. Ante esta situación, se decide incrementar la variable tiempo hasta lograr alcanzar la temperatura en el punto más frio, dando como resultado un considerable aumento del tiempo de duración de los ciclos. Además, el diferencial de temperatura entre el líquido cercano a la superficie del contenedor y el seno del líquido es demasiado grande ocasionando pérdidas por evaporación muy elevadas y en algunos casos afectación de las propiedades químicas de los componentes de la solución [3].
Para la puesta en marcha de la nueva planta de productos parenterales PPP3 en BioCen, esta situación constituye una problemática, teniendo en cuenta que se prevé un aumento considerable en los volúmenes de producción de parenterales dedicados al consumo nacional e internacional. El impacto que tiene la calidad de estos productos en la salud de la población y el aumento de los estándares de calidad en estas producciones, conducen a valorar el uso de tecnologías más apropiadas para realizar la preparación y esterilización de soluciones con el fin de garantizar un producto estéril.
Tomando en cuenta que la esterilización de soluciones puede realizarse en sistemas cerrados enchaquetados, con ventajas y desventajas similares a la esterilización por calor húmedo realizado en autoclave, se conciben sistemas conformados por tanques de acero inoxidable AISI 316L, enchaquetados, con sistemas de agitación para facilitar el movimiento forzado del líquido, propiciando la homogeneidad de la temperatura en poco tiempo [4].
El proceso de esterilización debe asegurar que la esterilización del producto sea siempre reproducible y la validación de los procesos se ha convertido en una materia importante a la hora de asegurar resultados reproducibles que puedan ser verificados. Para implementar el uso de estos sistemas es necesario realizar estudios de validación, mediante los cuales se obtienen evidencias documentadas de alto grado de seguridad que demuestran que puede producirse consistentemente un producto con las características requeridas según especificaciones [5-8]. Esto constituye una exigencia de las entidades regulatorias para la fabricación de productos estériles.
Descripción general del Sistema de Preparación de Soluciones
El sistema de preparación de soluciones está integrado por un tanque estacionario de 150 L de capacidad, el cuerpo interno y las conexiones de entrada y salida que entran en contacto con las soluciones están construidas de acero inoxidable del tipo 316L con una rugosidad relativa (Ra) menor o igual a 0,3 µm. Las tuberías de proceso que entran en contacto con dichas soluciones son de acero inoxidable AISI 316L cuya rugosidad relativa en su interior menor o igual a 0,5 µm, el diseño de las válvulas es sanitario y aséptico lo que facilita una fácil limpieza en su interior. Este sistema posee instrumentos interconectados (para indicación, control y registro), una bomba centrífuga de diseño aséptico para la limpieza del sistema y un panel de control basado en un PLC (Controlador Lógico Programable) y Sistema de Control y Adquisición de Datos, SCADA, (System Control and Data Acquisition).
El tanque cuenta con las características siguientes:
a) Componentes: Bola rociadora, agitación magnética autónoma, registrador de temperatura, chaqueta para el calentamiento/enfriamiento. Puertos de entrada para adiciones y puerto de muestreo.
b) Suministros: Aire de proceso, estación de limpieza y esterilización en el lugar, agua para inyección, vapor limpio, vapor industrial y agua de enfriamiento
c) Instalaciones: Drenajes, celdas de pesada.
d) Automática: Para la realización de la limpieza in sito del tanque, la adición de agua para inyección tiene que estar controlada por la pesada, por lo que la válvula de entrada tiene que ser automática, controlada por el autómata. El drenaje del agua de limpieza tiene que estar controlado por el autómata. Para efectuar la esterilización, la válvula debe abrirse automáticamente, controlar el tiempo de esterilización y la temperatura.
En la preparación de las soluciones se controla el volumen por pesada y la esterilización por tiempo y temperatura. Debe dar registros gráficos de las variables medidas: temperatura, presión y pesada. Las soluciones para la formulación se pasarán a través de un pase de pared y por la válvula de fondo hacia bolsas donde se terminará el procesamiento aséptico. La interacción entre el operario y el sistema se reflejan en el monitor de la computadora, que muestra como pantalla principal un esquema sinóptico del sistema. El sistema realiza las operaciones de limpieza y esterilización completamente automáticas, teniendo en cuenta que son las operaciones críticas dentro del procesamiento aséptico.
Resultan un total de tres modos automáticos de operación, los cuales son:
- Modo 1: Limpieza del tanque en el lugar.
- Modo 2: Esterilización del tanque en el lugar.
- Modo 3: Esterilización de soluciones en el tanque.
MATERIALES Y METODOS
Materiales
- Indicadores biológicos.
- Bolsas desechables Tridimensionales (3D) con sistema de agitación magnética, Hyclone.
- Bolsas desechables Planas (2D), Sartorius Stedim.
Materias primas
- Sodio hidróxido, fabricante Merck, Presentado en frascos de 5 kg.
- Gel de hidróxido de aluminio 2 %, fabricante Brentag Biosector, presentado en frascos de 25 kg.
- Agar triptona soya, fabricado por BIOCEN, presentado en frascos de 0,5 kg.
Equipos
- Bomba peristáltica Watson Marlow modelo 620 DuN, 4 rodillos, flujo máximo 20 L/min.
- Balanza técnica Sartorius modelo Combics CIS IS34EDE-H. Capacidad 34 kg; legibilidad 0,1 g.
Métodos
Para la validación del proceso de esterilización en tanques agitados fue necesario realizar las etapas previas de calificación: Calificación del Diseño, Calificación de la Instalación y Calificación de la Operación, sobre la base de las especificaciones de los requerimientos del usuario. Este trabajo se centra en la validación del proceso, una vez concluidas satisfactoriamente las calificaciones. Estas se pueden consultar en [9].
Validación del ciclo de limpieza del tanque en el lugar. Modo 1
Para validar la limpieza del tanque se utiliza el ciclo programado para el modo 1, los parámetros de operación de este modo automático se muestran en la tabla 1.
Tabla 1
Parámetros de operación para el Modo 1
| Parámetros | Punto de ajuste | UM |
| Peso de enjuague con API* | 45 | kg |
| Peso a añadir de NaOH 16 % (m/v) | 3 | kg |
| Peso a completar de API | 45 | kg |
| Temperatura de API durante la limpieza | 70 | °C |
| Tiempo de limpieza del sistema | 6 | min |
| Tiempo de tratamiento químico | 20 | min |
| Presión de recirculación | 1 | bar |
| Ciclos de enjuague | 3 | ciclos |
Los puntos de ajuste para este modo automático se fijan teniendo en cuenta: las características de las soluciones y su solubilidad. Entre las soluciones más utilizadas se encuentran la solución tampón de fosfatos, la solución de cloruro de sodio, el gel de hidróxido de aluminio y el gel fosfato de aluminio. Se define como peor caso la solución de gel de hidróxido de aluminio.
Para llevar a cabo la operación se realizan las actividades siguientes: Se preparan e identifican 25 L de una suspensión de gel de hidróxido de aluminio con cloruro de sodio, preparada a una concentración de gel AL(OH)3 10 g/L y NaCl 8 g/L. Se circula la solución durante 15 min por todo el sistema. Se transfiere la suspensión hacia botellones a partir del puerto de transferencia estéril, hasta vaciar completamente el tanque y el lazo, el sistema se mantiene sucio durante 24 h. Se realiza la limpieza del sistema de preparación de soluciones según los parámetros establecidos en el modo 1. Al realizar una inspección visual del tanque, no debe existir resto de producto u otro tipo de suciedad y el tanque debe estar drenado completamente. El sistema se deja en reposo durante 3 h (tiempo máximo en que debe realizarse la esterilización después de la limpieza), transcurrido este tiempo se circulan 35 L de agua para inyección. Finalmente, se realiza el muestreo a través del puerto correspondiente y se toman los volúmenes de muestra requeridos, según ensayos de validación, los cuales se relacionan en la tabla 2.
Tabla 2
Ensayos requeridos para la validación de la limpieza
| Ensayos | Volumen de muestra |
| Conductividad y pH | 250 mL |
| Endotoxinas | 5 mL |
| Carbono orgánico total | 50 mL |
Se realizan tres corridas consecutivas según la metodología descrita anteriormente.
Criterio de aceptación
En tres corridas consecutivas, los resultados del API del enjuague final (hora 0) y el API recirculada después de tres horas de realizada la limpieza, deben satisfacer los criterios que se reflejan en la tabla 3.
Tabla 3
Criterios de aceptación para el agua de enjuague
| Parámetro | Criterio de aceptación |
| pH | 5 - 7 |
| Conductividad | ≤ 1,3 µS/cm |
| Endotoxinas | ≤ 0,25 UE/mL |
| Carbono orgánico total | < 500 mg/L |
| Inspección visual | No debe quedar suciedad visible. |
Validación del ciclo de esterilización del tanque vacío. Modo 2
Para validar este ciclo se realiza el estudio de penetración con reto, se utilizan los parámetros establecidos para el modo 2, con el objetivo de verificar que el equipo es capaz de controlar y mantener la temperatura de operación programada, así como determinar el perfil de uniformidad temperatura e identificar además la presencia de puntos fríos o calientes. Ver tabla 4.
Para ejecutar el estudio se diseñó un protocolo en el cual se describen las pruebas, así como la metodología a seguir. Los pasos fundamentales se describen a continuación.
Cantidad y ubicación de termopares e indicadores biológicos
Para determinar la cantidad y ubicación de los termopares en el estudio de distribución de temperaturas con el tanque vacío, se tuvo en cuenta la capacidad del tanque, su geometría y la criticidad de puertos de conexión, tanto en el tanque como en el lazo de la tubería de proceso [10].La capacidad del tanque es de 150 L, para este volumen se utilizaron 10 termopares, distribuidos en el centro del tanque a diferentes alturas, como la zona más alejada del área de transferencia de calor, en los puertos de conexión de entrada de producto y muestreo, en la zona de salida del filtro de venteo y en las conexiones de salida del producto, teniendo en cuenta además que no entren en contacto con las paredes u otro material dentro del equipo. Los indicadores biológicos se colocan junto a los termopares ubicados en los puertos de conexión de entrada de producto y muestreo, en la zona de salida del filtro de venteo y en las conexiones de salida del producto.
Tabla 4
Parámetros de operación para el Modo 2
| Parámetro | Punto de ajuste |
| Temperatura de esterilización (°C) | 122 |
| Tiempo de esterilización (min) | 20 |
| Presión post-esterilización (bar) | 1,5 |
| Temperatura de enfriamiento (°C) | 60 |
Control biológico
Se utilizan indicadores con una población de 2,4 x 106 esporas de Geobacillus stearothermophilus .Al concluir las corridas se extraen los indicadores biológicos y se colocan en una incubadora a una temperatura de 55 °C durante 48 h, no se debe observar crecimiento en el medio de cultivo.
Determinación del valor F0 requerido y el del proceso
Los indicadores biológicos a utilizar tienen una población de 2,4 x 106 esporas por contenedor, el valor D es de 1,9 min y el nivel de aseguramiento de la esterilidad (SAL), deseado es 10-6, es decir, garantizar que no más de una unidad en un millón estarán no estériles. Por lo tanto, para lograr la destrucción de las esporas, todas las unidades del material sometido al proceso de esterilización deben recibir al menos 23,5 min a 121,1 °C, de acuerdo con:
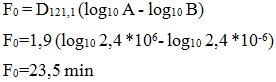
Se realiza el cálculo de F0 obtenido en el proceso, que al comparase con el requerido debe ser mayor, según la expresión siguiente:
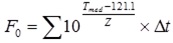
Cálculo de letalidad
Se calcula la letalidad durante el ciclo de esterilización para caracterizar la capacidad del proceso, según:
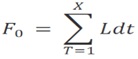
Validación del ciclo de esterilización de líquidos. Modo 3
Para validar este ciclo se realiza igualmente un estudio de penetración de temperatura con reto, con el objetivo de demostrar que el equipo tiene la capacidad de funcionamiento con condiciones controlables para reproducir el proceso de esterilización del patrón de carga, así como determinar el perfil de uniformidad temperatura e identificar la presencia de puntos fríos y calientes.
Los pasos fundamentales son:
Cantidad y ubicación de termopares e indicadores biológicos.
Se utilizan seis termopares, distribuidos en el interior del tanque a diferentes alturas y en los puertos de muestreo y adición. No se tiene en cuenta la ubicación de los indicadores biológicos en el puerto de muestreo porque este puerto queda por debajo del nivel del líquido, para extraerlo es necesario drenar el tanque.
Descripción del patrón de carga
El patrón de carga a utilizar se define teniendo en cuenta las soluciones que se utilizan en las diferentes formulaciones, su composición y volumen, determinando como peor caso, la carga constituida por 80 L de gel hidróxido de aluminio a una concentración de 10 g/L.
Parámetros de operación
Se toman como referencia los parámetros de operación de fábrica para la esterilización de líquidos en el tanque (Modo 3), los cuales se muestran en la tabla 5.
Tabla 5
Parámetros de operación para el Modo 3
| Parámetros | Punto de ajuste |
| Temperatura de esterilización (°C) | 122,0 |
| Tiempo de esterilización (min) | 20 |
| Temperatura de enfriamiento (°C) | 60 |
Simulación del proceso de esterilización de líquidos con medio de cultivo
Se realiza una prueba de simulación del proceso de esterilización de líquidos en el tanque utilizando 130 L de una solución de caldo triptona soya. Preparado a una concentración de 30 g/L. Se esteriliza bajo los parámetros validados durante el estudio de penetración de temperatura con líquidos para el modo 3. Al concluir el ciclo de esterilización se distribuye el medio a bolsas plásticas de etilvinilacetato. Pasadas las 24 h se toman 20 muestras, 10 se someten a un proceso de revisión manual, cinco se incuban por 14 días a 31±2,5 °C, junto a la bolsa. Pasado ese tiempo son sometidos al proceso de revisión. A las cinco muestras restantes se les verifican las propiedades de promoción de crecimiento de un grupo de cepas patrón y una selección de cepas endógenas.
Criterios para considerar la prueba satisfactoria
Las bolsas con los restos de medio de cultivo y los nuestras que se revisen trascurridas las 24 h y los 14 días después de incubados deben conservar el brillo y transparencia lo cual significa que no hay crecimiento de microorganismos y que el ciclo de esterilización fue satisfactorio.
- En las otras 10 muestras debe observarse crecimiento de las cepas utilizadas.
Análisis estadístico
Para el análisis estadístico se utilizan medidas de tendencia central como la media, de la dispersión como la desviación estándar y el coeficiente de variación.
Finalmente, se realiza una comparación múltiple de medias, por el método de la diferencia mínima significativa sugerida por Fisher [11], basada en la construcción de intervalos de distribución que reflejan la variación de temperatura en cada punto. Para la realización de las pruebas se utilizó el software estadístico Statgraphic Centurion versión XVI [12].
RESULTADOS
Validación de la limpieza en el lugar
Para analizar el comportamiento del estudio de validación del proceso de limpieza, se muestran los resultados en la tabla 6.
Tabla 6
Resultados del estudio de validación de la limpieza-Modo 1
| Parámetro | Criterio de aceptación | Resultados | ||||||||
| API (AIP 302) | API hora 0 | API hora 3 | ||||||||
| pH | 5 - 7 | - | - | - | 6,1 | 6,0 | 6,4 | 6,1 | 6,2 | 6,4 |
| Conductividad | ≤ 1,3 µS/cm | 0,9 | 0,9 | 0,8 | 0,5 | 0,5 | 0,6 | 0,6 | 0,5 | 0,7 |
| Carbono orgánico total (TOC) | < 500 ppb | 11,6 | 8,41 | 9,19 | 14,6 | 13,9 | 17,8 | 12,8 | 15,3 | 24,6 |
| Contenido de endotoxinas (LAL) | ≤ 0,25 UE/mL | < 0,1 | < 0,1 | < 0,1 | < 0,1 | < 0,1 | < 0,1 | < 0,1 | < 0,1 | < 0,1 |
| Inspección visual | No debe quedar suciedad visible | - | - | - | OK | OK | OK | OK | OK | OK |
| Cumple (SI/NO) | SI | SI | SI | |||||||
El resultado de las muestras tomadas al agua de enjuague a la hora cero y a las 3 h de realizada la limpieza, cumplen con los criterios de aceptación para todos los parámetros establecidos. Si se comprueba además el TOC del enjuague final y del API recirculada a las tres horas con los resultados del API del punto de muestro (AIP 302), se observa que los valores son similares y estos además son muy inferiores al límite de alerta (214,7 ppb) establecido para el sistema de agua para inyección de la PPP 3 [13].
Validación de la esterilización del tanque vacío. Modo 2
Se muestran resultados del estudio de validación realizado al ciclo de esterilización del tanque vacío correspondiente a la corrida 1, el comportamiento del resto de las corridas fue similar, evidenciado en el reporte de validación "Calificación de la operación y el desempeño del Reactor Marca PACKO-T6” [14].
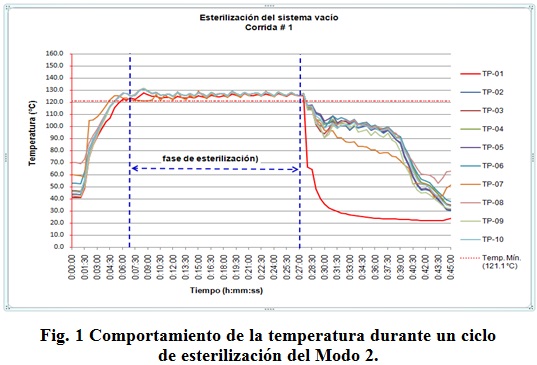
Monitoreo de temperatura
En la figura 1 se muestran los datos obtenidos en una de las corridas del estudio de penetración con el tanque vacío, registrando valores de temperatura cada 30 s, el ciclo tuvo una duración total de 45 min. El comportamiento de las dos corridas restantes fue similar.
La tabla 7 muestra la distribución de temperaturas medias durante la fase de esterilización.
Tabla 7
Resumen del estudio de penetración en las tres corridas del Modo 2
| Termopar No. | Media |
| TP-01 | 125,39 |
| TP-02 | 126,23 |
| TP-03 | 126,24 |
| TP-04 | 126,07 |
| TP-05 | 126,13 |
| TP-06 | 126,03 |
| TP-07 | 125,48 |
| TP-08 | 125,68 |
| TP-09 | 125,75 |
| TP-10 | 126,14 |
| Media - termopares de distribución de temperatura | 125,92 °C |
| Desviación estándar | 0,32 °C |
| Coeficiente de variación | 0,25 % |
En la tabla anterior se puede observar que existe una homogeneidad en los resultados obtenidos.
Los indicadores biológicos después de exponerlos al proceso de esterilización e incubarlos, no presentaron crecimiento, tras revisarlos a las 48 h.
Cálculo de letalidad
En la figura 2 se muestra el comportamiento de la letalidad durante el estudio de validación de la esterilización del tanque vacío, corrida 1, el resto de las corridas tuvo un comportamiento similar. Los datos de las tres corridas evidenciados en el reporte de validación [14].
La tabla 8 muestra la letalidad acumulada por termopar.
Tabla 8
Letalidad acumulada por termopar durante las corridas en el Modo 2
| Termopar Nº | Corrida 1 | Corrida 2 | Corrida 3 |
| TP-01 | 64,00 | 64,12 | 68,98 |
| TP-02 | 87,63 | 78,21 | 94,48 |
| TP-03 | 88,34 | 85,57 | 99,08 |
| TP-04 | 89,68 | 83,33 | 96,86 |
| TP-05 | 87,78 | 85,27 | 92,61 |
| TP-06 | 86,09 | 87,86 | 98,03 |
| TP-07 | 89,60 | 89,60 | 84,74 |
| TP-08 | 97,47 | 86,63 | 97,31 |
| TP-09 | 86,25 | 86,25 | 87,25 |
| TP-10 | 87,26 | 91,88 | 99,30 |
| Media | 87,38 min | ||
| Desviación Estándar | 7,98 min | ||
| Coeficiente de Variación | 9,14 % | ||
Los datos obtenidos en el monitoreo de temperatura registran un promedio de 125,92 °C con una desviación estándar de 0,32 °C respecto a la media y un coeficiente de variación de 0,25 %. El promedio de F0 acumulado en las tres corridas fue de 87,38 min, tres veces mayor al F0 mínimo de 23,5 min equivalentes a 121,1 °C.
No se apreció crecimiento de microorganismos en los indicadores biológicos sometidos al proceso de esterilización.
Validación de ciclo de esterilización de líquido. Modo 3
En la figura 3 se muestra la representación gráfica de los datos obtenidos en la primera corrida del estudio de validación de la esterilización de líquidos en el tanque, registrando valores de temperatura cada 30 s, el ciclo tuvo una duración total de una hora con 20 min. El comportamiento de las dos corridas restantes fue similar, los resultados se evidencian en el reporte de validación [14].
Los datos obtenidos del monitoreo de temperatura de los termopares registran un promedio de 122,18 °C durante la fase de esterilización, según se observa en la figura 3 y se reporta en la tabla 9. En las tres corridas no se evidencian diferencias significativas entre ellas. De los resultados obtenidos se interpreta que la temperatura es homogénea a lo largo del cuerpo interno del tanque, evidenciando que no existe diferencia significativa de temperatura en cada punto de monitoreo de los termopares.
Tabla 9
Resumen del comportamiento de temperatura durante el Modo 3
| Termopar No. | Media |
| TP-01 | 122,32 |
| TP-02 | 122,41 |
| TP-03 | 122,27 |
| TP-04 | 122,09 |
| TP-05 | 121,91 |
| TP-06 | 122,06 |
| Media | 122,18 °C |
| Desviación estándar | 0,19 °C |
Cálculo de letalidad
En la figura 4 se muestra el comportamiento de la letalidad acumulada durante el estudio de validación, corrida 1. El resto de las corridas tuvo un comportamiento similar. Los datos de las tres corridas evidenciados en el reporte de validación [14].
Tabla 10
Letalidad acumulada en los ciclos de esterilización del Modo 3
| No. de termopar | Corrida 1 | Corrida2 | Corrida3 |
| TP-01 | 31,25 | 31,83 | 36,48 |
| TP-02 | 31,88 | 32,75 | 36,74 |
| TP-03 | 31,70 | 32,64 | 34,29 |
| TP-04 | 30,72 | 29,66 | 35,86 |
| TP-05 | 28,00 | 29,41 | 33,05 |
| TP-06 | 29,12 | 31,17 | 34,94 |
| Medias | 30,45 | 31,24 | 35,23 |
| Media | 32,31 min. | ||
| Desviación Estándar | 1,29 min. | ||
| Coeficiente de Variación | 2,00 % | ||
Los valores de F0 acumulados fueron superiores a 23,5 min de acuerdo con el criterio establecido. Los valores obtenidos de letalidad van de 28,0 min hasta 32,31 min equivalentes a la temperatura base de 121,1 °C. Los resultados de las tres corridas fueron similares según se muestran en la tabla 10.
En los indicadores biológicos utilizados para las corridas tampoco se apreció crecimiento de microorganismos.
Simulación del proceso de esterilización con medio de cultivo
Durante la inspección visual realizada al medio contenido en las bolsas no se observó crecimiento de microorganismos, el medio se mantuvo transparente por lo que se cumplió con la condición de esterilidad después del tiempo de incubación previsto. Al analizar las muestras después de los 14 días de incubación se comprueba que el medio de cultivo utilizado en las tres corridas de validación promueve el crecimiento de un grupo de cepas patrón y de una selección de cepas endógenas, lo cual demuestra que el proceso de esterilización de líquido (Modo 3) no degrada las propiedades nutritivas del medio de cultivo empleado.
Análisis económico
Para realizar una valoración económica del proyecto se compararon los costos generados por la aplicación de los dos métodos de esterilización de líquidos, al esterilizar una solución de 80 L de hidróxido de aluminio a una concentración de 3 g/L en el tanque y 12 L en la autoclave (carga máxima según los estudios realizados en BIOCEN).
El costo del ciclo de esterilización en la autoclave es menor, pero sólo se esterilizan 12 litros de la solución, lo cual no es suficiente para cumplir con el tamaño de los lotes a formular. Si se hace la comparación teniendo en cuenta el volumen de solución requerido por lote, serían necesario realizar siete ciclos de esterilización en la autoclave para poder formular un lote. Desde ese punto de vista, el costo de producción aumenta considerablemente y se demora el proceso, ya que cada ciclo en la autoclave demora tres horas aproximadamente contra los 45 minutos en el tanque enchaquetado. Otro factor a tener en cuenta es que se pone en riesgo el mantenimiento de la esterilidad por el aumento de la manipulación de los contenedores estériles.
CONCLUSIONES
El sistema de preparación de soluciones produce ciclos de limpieza consistentes y reproducibles.
En la validación del ciclo de esterilización del tanque vacío, así como del lazo de tubería de proceso, la temperatura se mantuvo superior a los 121,1 °C durante los 20 minutos de esterilización, garantizando la letalidad total de los microorganismos.
En la validación del ciclo de esterilización de líquidos, la temperatura se mantuvo superior a los 121,1 °C durante los 20 minutos de esterilización, garantizando la letalidad total de los microorganismos.
Durante la simulación del proceso de preparación y esterilización de líquido, utilizando medio de cultivo como peor caso, se demostró que el sistema asegura la esterilidad de las soluciones.
La variante de tanques enchaquetados para esterilizar soluciones de gran volumen resultó económicamente factible, ya que permite esterilizar en un único ciclo el volumen requerido.
BIBLIOGRAFIA
1. AGALLOCO, J.P., Moist Heat Sterilization in Autoclaves "Cycle Development, Validation and Routine Operation". PDA Technical Report # 1, 2000.
2. MONTES Y., MAYO O., HIDALGO L.C., Esterilización de soluciones para productos parenterales. Análisis de la problemática. Tecnología Química, 2017. En edición.
3. GARCÍA, I., Penetración con reto. "Esterilización de gel de hidróxido de aluminio". Reporte de validación: Grupo Nacional de Validación, 2013.
4. G. KRUSHEFSKI, Esterilización por vapor de contenedores llenos de líquido. Spore News. vol 7, 2010.
5. CECMED, Principios generales para la validación de los procesos en la industria farmacéutica. Centro Estatal para el Control de Medicamentos y Equipos Médicos, La Habana, 1994.
6. ISAACSON, R. Sterilization validation, qualification requerimens. in Manufacture of sterile medicines Advanced workshop for SFDA GMP inspectors, 2009.
7. ISO 11134, Sterilization of Health Care Products: Requirements for Validation and Routine Control, in Biological Indicators for Moist Heat Sterilization. 1994.
8. PIC/S, Pharmaceutical Inspection Convention Scheme, Recommendations on Validation Master Plan, Installation and Operational Qualification. PI 006-1, 2001.
9. MONTES, Y., "Validación y puesta en marcha de sistemas de preparación de soluciones para productos parenterales", Trabajo de diploma, Dpto de Ing. Química. Universidad Tecnológica de La Habana, 2016.
10. PÉREZ, R., Política de validación del centro nacional de biopreparados, Centro Nacional de Biopreparados, 2012.
11. FISHER, R.A., Statistical Methods for reseach worker, Edimburg, Oliver and Boyd s. 1958.
12. STATPOINT TECHNOLOGIES INC., Statgraphics Centurion XVI. 2013.
13. SÍMIL, M.T., "Reporte de calificación del desempeño del Sistema de Preparación de Soluciones Validación de la limpieza en el lugar", BioCen, 2016.
14. MIRANDA, F.,"Calificación de la operación y el desempeño del Reactor Marca PACKO-T6, No. Serie 161804". Grupo Nacional de Validación, 2016.
Recibido: Septiembre 2017
Aprobado: Diciembre 2017
Ing. Yanelys Montes GonzálezI. Centro Nacional de Biopreparados, Bejucal, Mayabeque, Cuba