Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.38 no.3 Santiago de Cuba set.-dic. 2018
ARTICULO ORIGINAL
La corrosión en la unidad de reformación catalítica de nafta de una refinería de petróleo (II Parte)
Corrosion in the catalytic naphtha reforming unit of a petroleum refinery (Part II)
MSc. Katiuska Santos-Cedeño 1 , Dr. Jorge Alberto Domínguez-Domínguez 2 , Dr. Rigoberto Marrero-Águila 2 , Ing. Yuselkys Cordero-Zamora 3
1 Universidad de Oriente, Santiago de Cuba, Cuba. 2 Universidad Tecnológica de la Habana, La Habana, Cuba. 3 Central Termoeléctrica ¨Máximo Gómez Báez¨, Mariel, Artemisa, Cuba. e-mail: katiuska@uo.edu.cu
Resumen
L a acción de los gases ácidos, que se generan durante la etapa de cloración del proceso de regeneración del catalizador Pt/Re en base alúmina, es la causa que provoca el intenso deterioro corrosivo de intercambiadores de calor en el sistema de enfriamiento de la unidad de reformación catalítica de nafta de una refinería del occidente del país. En este trabajo se realizó un estudio para determinar, si la presencia en el sistema de los gases ácidos se debe a una insuficiente cantidad de sosa añadida para su neutralización o a una baja velocidad de transferencia de masa entre las fases gaseosa ácida y la líquida básica. Se calculó la cantidad de sosa necesaria para lograr la neutralización y se concluyó que el flujo de sosa inyectada es suficiente para lograr la neutralización de los gases ácidos. Se determinó la velocidad aproximada de los gases en el sistema y el tiempo de contacto entre las fases resultando un valor muy pequeño, que unido a un área interfacial muy reducida impide que no se pueda producir correctamente la neutralización de los gases ácidos. Como resultado s e concluyó que la causa de la presencia de los gases ácidos en el sistema es la baja velocidad de transferencia de masa entre las fases lo cual provoca que el proceso de neutralización sea muy lento. Se proponen soluciones en el sistema que permitan desde un punto de vista técnico minimizar los efectos de la corrosión.
Palabras Claves: corrosión, reformación catalítica, refinería de petróleo.
Abstract
The action of the acid gases, which are generated during the chlorination stage of the Pt/Re catalyst regeneration process on alumina base, is the cause that causes the intense corrosive deterioration of heat exchangers in the cooling system of the cooling unit. catalytic reforming of naphtha from a refinery in the west of the country. In this work, a study was carried out to determine whether the presence of acid gases in the system is due to an insufficient amount of added soda for neutralization or to a low mass transfer rate between the acid gas and the basic liquid phases. The amount of soda needed to achieve neutralization was calculated and it was concluded that the flow of injected soda is sufficient to achieve the neutralization of acid gases. The approximate velocity of the gases in the system and the contact time between the phases were determined, resulting in a very small value, which, together with a very small interfasial area, prevents the neutralization of the acid gases from being correctly produced. As a result, it was concluded that the cause of the presence of acid gases in the system is the low mass transfer speed between the phases, which causes the neutralization process to be very slow. Solutions are proposed in the system that allow from a technical point of view to minimize the effects of corrosion.
Keywords : corrosion, catalytic reforming, petroleum refinery .
INTRODUCCION
Como es conocido, el proceso de reformación de la nafta pesada se realiza con el objetivo de aumentar el octanaje de la gasolina y producir hidrógeno, obteniéndose la denominada nafta reformada que es el componente principal de la gasolina [ 1,2 ] .
En un artículo anterior se determinó la causa que provoca el deterioro corrosivo del equipamiento del sistema de enfriamiento de la unidad de reformación catalítica de la nafta de la refinería objeto de estudio, al cargarse en el reformador de lecho fijo, un catalizador de última generación serie RG 682A de Pt/Re, en base alúmina. El severo deterioro por corrosión de los materiales metálicos (acero al carbono, aluminio y latón) de construcción de los equipos del sistema de enfriamiento perteneciente al circuito de reacción del reformador, se debe a la acción corrosiva de los gases ácidos, que se generan durante la etapa de cloración del proceso de regeneración del catalizador, los cuales no son neutralizados [ 3 ] .
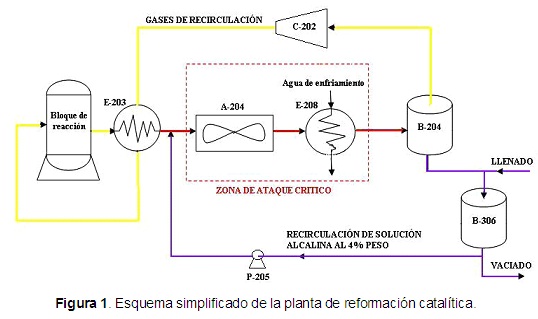
La figura 1 muestra un esquema simplificado de la planta de reformación catalítica.
Mediante los resultados experimentales obtenidos se puedo constatar que logrando una neutralización parcial de los gases ácidos se evitaría el intenso deterioro por corrosión. Sólo hay dos causas probables de que la neutralización no sea efectiva:
1. que la cantidad de sosa añadida sea insuficiente y en tal caso se necesita conocer la cantidad requerida para reducir el ataque a valores admisibles,
2. que la velocidad de transferencia de masa entre la fase gaseosa ácida y la líquida básica sea muy pequeña y por tanto el proceso de neutralización sea muy lento.
Este trabajo tiene como objetivo realizar el análisis y discusión de ambas variantes y proponer alternativas para una solución al problema, considerando las vías posibles de aplicación de los diferentes métodos de protección anticorrosiva conocidos.
MATERIALES Y MÉTODOS
Para un mejor análisis de la problemática se procederá al cálculo y discusión de de las variantes antes mencionadas.
Estimación de la cantidad de sosa inyectada y de la cantidad necesaria para lograr la neutralización
Los cálculos se realizaron a partir de las concentraciones reportadas en la tabla 1 [ 4 ] .
La información disponible abarca intervalos, en ocasiones, bastante amplios por lo que se emplearon los valores promedios y máximos, lo que permitió comparar los resultados para situaciones normales y críticas.
Tabla 1. Intervalo de concentraciones de los componentes de la corriente de salida del reformador
| Componente de la corriente | N 2 | O 2 | CO | CO 2 | SO 2 | HCl | H 2 S | H 2 O |
| Intervalo de concentraciones | % en volumen | (mL/m 3 ) | ||||||
| 0-100 | 0-20,9 | 0-20 | 0-25 | 0-200 | 0-200 | 0-200 | 0-5000 | |
Las reacciones ácido-base ajustadas estequiométricamente, presentes en el sistema son:
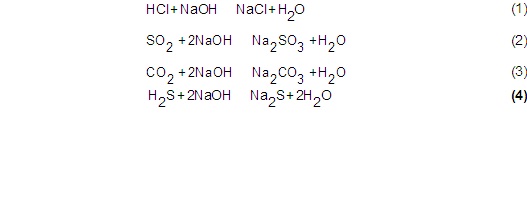
Se puede ver que la cantidad de moles de sosa necesaria para la neutralización total de los gases ácidos es:
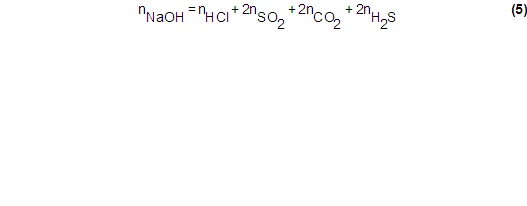
Siendo n la cantidad de moles de cada componente.
El caudal de gas del proceso es variable pero su promedio es de 19102,05 m 3 /h normalizado, o sea, a 273 °C y 101,3 kPa, y el de la solución de sosa cáustica al 4 % en peso debe ser de 22 m 3 /h. Por dificultades en el bombeo, el flujo real de sosa promedio oscila entre 14 y 16,76 m 3 /h. Como estas magnitudes son muy variables , a los efectos del cálculo se redondearán los valores a 19000 y 15 m 3 /h, respectivamente.
Tomando como base de cálculo 1 hora de operación y considerando la corriente gaseosa como mezcla de gases ideales, la cantidad de moles totales y por componentes podrá ser calculada por la ecuación de los gases ideales. Como el volumen entregado está normalizado, se obtuvo un valor de 84800 moles totales, resultado que también puede obtenerse aplicando el principio de Avogadro, es decir, dividiendo el volumen del gas entre 22,4 L/mol. De esta manera para cada uno de los componentes ácidos de la corriente gaseosa se determina su flujo molar. Los valores obtenidos se muestran en la tabla 2. Como se ve, el dióxido de carbono constituye más del 99 % de todos los gases ácidos.
Tabla 2 . Flujo molar de cada uno de los componentes ácidos de la corriente gaseosa calculado a partir del valor promedio de las concentraciones reportadas en la Tabla 1
| Gas ácido | CO 2 | SO 2 | HCl | H 2 S |
| Concentraciones promedio | 12,5 % volumen | 100 mL/m 3 | 100 mL/m 3 | 100 mL/m 3 |
| Flujo Molar (mol/h) | 106000 | 84,8 | 84,8 | 84,8 |
Entonces la cantidad de moles totales de sosa requerida para neutralizar totalmente los gases ácidos presentes según (5) es 212424 moles/h. Como la masa molar del hidróxido de sodio es 40 g/mol, el flujo másico requerido para la completa neutralización de los gases será igual 8496,96 kg .
Es posible estimar el valor mínimo aproximado de pH que cada gas ácido puede alcanzar al absorberse en la humedad condensada. Si bien la temperatura de los gases a la entrada de los A-204 es de 160 ºC aproximadamente y el porcentaje de agua no supera el valor de 5, la condensación es posible debido a las presiones operativas (0,75-1,5 MPa), lo que eleva correspondientemente la presión parcial del vapor de agua en la mezcla de gases. Para estas presiones, las temperaturas de ebullición son de 166ºC y 196 ºC respectivamente. Además, se produce determinada evaporación del agua de la solución de sosa cáustica. En las zonas frías de los intercambiadores condensa agua con gases disueltos [5].
La determinación del pH que el HCl puede alcanzar al disolverse en la humedad condensada se realizó a partir del cálculo de la actividad de los iones H + . Para el cálculo de la molalidad se empleó el valor medio del intervalo de concentraciones reportado para el agua en la Tabla 1, obteniéndose un valor de 2,22 molal. El valor del coeficiente de actividad reportado en la literatura, es 0,765, por lo que el pH aportado por el HCl será de -0,23. La actividad de los H+ para (SO 2 , H 2 S, CO 2 ), se obtiene de la ecuación para la constante de disociación del primer ión H+, considerando la molaridad igual a la molalidad y el coeficiente de actividad cercano a 1. La tabla 3 resume los valores de pH aportados por cada gas ácido a la disolución. [6]
Tabla 3. Valores de pH aportados por cada gas ácido a la disolución
| Gas | H 2 S | CO 2 | SO 2 | HCl |
| pH que aporta | 3,4 | 3 | 0,73 | -0,23 |
Evidentemente, la corrosión ácida que para el acero se manifiesta de forma sensible a pH inferiores a 3, indica que los gases corrosivos son el HCl y SO 2 . El H 2 S y el CO 2 pudieran o no reforzar la acción de los primeros, pero no son los responsables del ataque. En la práctica estos pH deben ser menores en las zonas donde se inicia la condensación del agua, o sea, en las placas y los tubos de los A-204, y mayores en los E-208, siendo menor la corrosión en estos últimos ya que llegan a él ligeramente neutralizados.
Para calcular los moles de sosa que se inyectan al sistema por hora, se tomó la densidad de la disolución de NaOH al 4 % en peso a 30°C como 1,039 g/cm 3 , se multiplicó por el flujo volumétrico, y se dividió por la masa molar, obteniéndose un valor de 389625 moles, o sea, aproximadamente 390000 moles. El pH inicial de la sosa, se calculó mediante su actividad, siendo su coeficiente de actividad de 0,679 y la molalidad 1, obteniéndose un valor de 13,83. [6, 7]
Como el número de moles de sosa requerido para la neutralización total de los gases ácidos es 212424 moles, el flujo que se inyecta es 1,8 veces mayor. Para el caso del CO 2 este es 3,7 veces mayor que el requerido, mientras que para los restantes gases ácidos este exceso es de 1540 moles.
Es conocido que en una mezcla de ácidos fuertes y débiles son neutralizados primero los fuertes, por lo que los ácidos clorhídrico y sulfuroso serán neutralizados rápidamente y luego los restantes. Esto indica de forma evidente que el problema estriba en la lentitud del proceso de neutralización por la insuficiente velocidad de transferencia de masa desde la fase gaseosa a la líquida antes de su entrada a los A-204.
El pH del NaOH al alcanzar la condición final de equilibrio es posible estimarlo si se simplifica el sistema. La solución final es un sistema tampón conformado por sales de hidrólisis básica y algún ácido débil disuelto. Como la cantidad de CO 2 es 1000 veces mayor que la del resto de los gases, este será el responsable principal de neutralizarla. Como el CO 2 está en amplio exceso, la sosa neutralizará sólo el primer hidrógeno del ácido carbónico para formar la sal mono-básica NaHCO 3 (bicarbonato de sodio). La concentración máxima de esta sal cuando se agote la sosa será, en correspondencia, 1 mol/L aproximadamente, ya que se desprecia la formación de otras sales minoritarias (NaCl, NaHSO 3 , NaHS). A esto hay que agregar que una vez neutralizada la sosa, se disolverán gases ácidos excedentes, fundamentalmente el CO 2 . La constante de hidrólisis del bicarbonato se representa por (6):
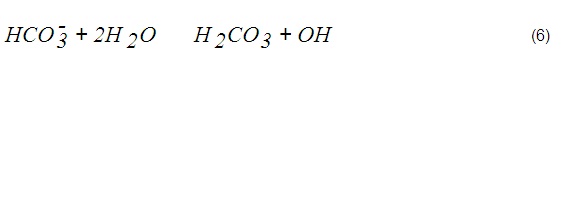
Puede ser calculada mediante (7):

La concentración del ión hidrógeno-carbonato es de 1 mol/L, la del ácido carbónico se toma de forma aproximada como la de saturación del agua que está alrededor de los 0,01 mol/L y la del hidroxilo será x . El valor calculado de la concentración de hidroxilos es de 2,25·10 -6 mol/L, es decir, que el pH de la solución neutralizada de sosa estará alrededor de 8,4, valor muy cercano al promedio medido en el tambor separador B-204 igual a 8,6. Esto confirma que la sosa ha sido totalmente neutralizada al final del ciclo, pero no brinda información alguna sobre el punto del circuito donde ocurre la neutralización de manera significativa, ni tampoco sobre la proporción en que los diferentes gases ácidos son neutralizados. Estos dos aspectos son decisivos para la comprensión del proceso de deterioro y sólo se podrán esclarecer mediante mediciones analíticas en distintos puntos del circuito.
Cálculo aproximado de la velocidad media del gas en la tubería donde se inyecta la sosa
Se conoce que la tubería donde se inyecta la sosa posee aproximadamente 0,4 m de diámetro interior por lo que el área de flujo será de 0,126 m 2 . Como el flujo es de 19000 m 3 /h normalizado, en condiciones operativas reales (403 K y 0,75 MPa), se obtiene un valor de 1,04 m 3 /s y la velocidad media de los gases, considerando el área de flujo todo el interior de la tubería, se calcula mediante (8):
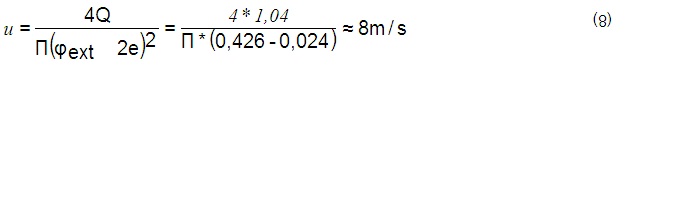
Donde Q es el flujo de gas en (m 3 /s), f ext y e son el diámetro exterior de los tubos y su espesor en metros (m), respectivamente.
Si se considera que la longitud del recorrido de los gases sobre la solución de sosa desde el punto de inyección hasta la entrada a los A-204 es aproximadamente de 12 m , el tiempo de contacto de los gases ácidos con la solución de sosa antes de entrar a los intercambiadores es aproximadamente 1,5 s. En la realidad, este tiempo es aún menor ya que antes de la mitad del recorrido el diámetro interior de la tubería se reduce a 0,3m y además, el área seccional de las tuberías es compartida con la fase líquida como se muestra en la figura 2 . El área de contacto entre fases resulta difícil de estimar pero es mucho menor de 0,4 * 12 = 4,8 m 2 . Un tiempo de contacto tan breve con un área interfacial tan reducida permiten una insignificante transferencia de masa entre fases.
Análisis de posibles propuestas de soluciones en el sistema que permitan desde un punto de vista técnico minimizar los efectos de la corrosión.
Como se conoce se dispone de cuatro direcciones básicas para el combate anticorrosivo y cada una comprende una variedad amplia de métodos de protección. Normalmente una situación como esta se resuelve por vía químico-tecnológica, ya que no se justifican el empleo de recubrimientos, ni las protecciones electroquímicas, ni los cambios de material.
En sistemas análogos de la refinación de petróleo, donde se presentan gases ácidos corrosivos como los presentados en este sistema (cloruro y sulfuro de hidrógeno, ácidos orgánicos ligeros) se emplea la neutralización con bases volátiles como amoniaco o aminas ligeras, complementadas con la adición de inhibidores orgánicos de adsorción (fílmicos) como aminas, amidas, imidazoles o imidazolinas, compuestos sulfurados variados, etc. Además, se emplean materiales metálicos de mayor resistencia química que los aceros al carbono o bajo aleados, como son el monel y los latones de aluminio, como por ejemplo en el sistema de tope de las columnas de destilación atmosférica.
Sin embargo, en este caso no es posible el uso de neutralizantes volátiles con nitrógeno amínico, ni los inhibidores fílmicos. Esto es debido a que todo compuesto orgánico cuyo grupo funcional, múltiple enlace o heteroátomo posea algún par de electrones no compartidos, podrá adsorberse específicamente (químicamente) como un par ácido-base de Lewis sobre los centros activos del catalizador impidiendo su acción transformadora, por lo que constituyen venenos catalíticos y afectan el catalizador de Pt/Re clorado empleado en este sistema. Tampoco resulta procedente la aplicación de recubrimientos y se considera muy costoso el cambio del material de los tubos de intercambio.Otra vía sería el aumento del área de intercambio para favorecer la transferencia de masa entre el gas y el líquido. En la figura 3 se observa el sistema de inyección de álcali actualmente empleado.
Aunque no se dispone de total información acerca de sus dimensiones, puede observarse que el flujo de sosa que se alimenta no se dispersa completamente. Podría valorarse el empleo de un sistema que permita dividir este flujo en pequeñas gotas y con un flujo uniforme, como los sistemas spray. Para este último caso debe tomarse en consideración que los orificios de pequeño diámetro pueden taponarse con frecuencia, considerando que la disolución de sosa que se alimenta se prepara con agua cruda y que las uniones son soldadas, lo cual dificultaría su mantenimiento con frecuencia.
Para el caso de los intercambiadores E-208 se puede valorar el recambio de los tubos y la placa por materiales más resistentes como los latones estabilizados contra el descincado, los cuales son más costosos, pero más resistentes a este medio corrosivo.
CONCLUSIONES
• Se comprobó que la adición de sosa cáustica es suficiente para neutralizar todos los gases ácidos, sin embargo se observa el deterioro corrosivo de los metales que conforman el equipamiento.
• Se obtuvo un valor aproximado de velocidad de los gases de 8 m/s Esto permite determinar que el tiempo aproximado de contacto entre las fases es menor que 1,5 segundos, el cual resulta demasiado breve y además con un área interfacial muy reducida. lo que impide que no se pueda producir correctamente la neutralización de los gases ácidos.
• Se concluye que la causa de la presencia de los gases ácidos en el sistema es la baja velocidad de transferencia de masa entre la fase gaseosa ácida y la líquida básica lo cual provoca que el proceso de neutralización sea muy lento.
• Considerando los métodos de protección anticorrosiva que las condiciones del sistema permiten emplear, se sugiere el uso de un sistema que logre una transferencia de masa adecuada entre las fases, como la posible instalación de un sistema spray que permita disminuir el tamaño de las gotas de hidróxido de sodio y mantener un flujo uniforme.
• En el caso de los intercambiadores E-208 se propone valorar el recambio de los tubos y la placa de acero por latones estabilizados contra el descincado. Inicialmente los E-208 estaban construidos con latón. Aunque de mayor costo que el acero al carbono, los latones estabilizados son más resistentes a este medio corrosivo, lo que disminuiría las pérdidas económicas por recambio del material metálico.
BIBLIOGRAFÍA
1. LLUCH URPÍ, J. ¨Tecnología y Margen de refino¨. Instituto Superior de la Energía. Curso para CUPET. Ciudad de la Habana. 2009. 335 pp.
2. DELGADO, Alisbel. ¨Evaluación Energética de la Planta de Tratamiento de crudos de Boca de Jaruco¨. Directores: Osvaldo Gozá y María de Zayas. Tesis de diploma. Instituto Superior Politécnico José Antonio Echeverría, Ciudad de La Habana , 2007.
3. SANTOS, Katiuska, DOMINGUEZ, Jorge Alberto, MARRERO, Rigoberto, CORDERO Yuselkys. La corrosión en la unidad de reformación catalítica de nafta de una refinería de petróleo (I Parte), Revista Tecnología Química , Vol.37, Nº 3. 2017
4. PÉREZ, Irenaldo. ¨Análisis del proceso de regeneración llevado a cabo en la unidad de reformación catalítica¨. Cienfuegos. 2010. 10 pp. Informe inédito.
5. KEENAN. J H. Steam Table. Edición Revolucionaria. 1998.
6. DOMINGUEZ, Jorge A., CASTRO, Dulce M. etal. Introducción a la corrosión y protección de materiales . 2 da Ed. Ciudad de la Habana : Editorial Félix Varela. 2006.
7. Perry, Robert H. Perry's Chemical Engineers Handbook . Physical and Chemical Data . 7 ma edición. 1999.
Recibido: Marzo 2018
Aprobado:Julio 2018
MSc. Katiuska Santos-Cedeño. Universidad de Oriente, Santiago de Cuba