Introducción
La contaminación por petróleo crudo y sus derivados en ecosistemas acuáticos constituye un grave problema en la actualidad, sobre todo cuando se asocia a derrames accidentales a gran escala. Existen muchas fuentes de generación de contaminación por estos compuestos, entre las que destacan: accidentes de buques tanques, fugas en equipos de perforación marina y operaciones de trasiego de combustibles.1,2 Los ecosistemas marinos contaminados por compuestos derivados de la refinación del petróleo, tales como el diesel y en especial en los estuarios, requieren de 10 o más años para su recuperación.3
Casi todo el hidrocarburo que llega a las aguas superficiales es vertido directamente en las bahías debido a que en éstas se localizan complejos industriales. La mayoría de los hidrocarburos flotan y se diseminan sobre la superficie del mar por amplias zonas por el efecto del oleaje, las corrientes marinas y el viento, en cuyos casos puede llegar hasta las zonas costeras afectando las playas cercanas al derrame.4
El proceso más importante para eliminar los hidrocarburos no volátiles presentes en el medio acuático es la biodegradación, en la cual, mediante la acción de algunos microorganismos, se degradan los compuestos hasta la mineralización, obteniéndose oxígeno, dióxido de carbono y agua.5,6
En este sentido, existen numerosos trabajos en los cuales se han aislado y evaluado diferentes microorganismos con capacidad degradativa, utilizándose como inoculantes para la biorremediación de ecosistemas contaminados.7,8,9 Además, se han diseñado sistemas ingenieriles para la biorremediación de ecosistemas contaminados por petróleo y sus derivados.10,11
Aun así, el estudio de microorganismos con potencialidades de degradar petróleo y sus derivados ha aumentado notablemente, más si se trata de la búsqueda de cepas capaces de degradar compuestos recalcitrantes.
Al suroeste de la provincia de Santiago de Cuba se encuentra la zona industrial en la cual están enclavadas diversas industrias que utilizan petróleo y sus derivados para sus actividades, con el riesgo de contaminación tanto para suelos como para cuerpos de agua. Por la cercanía a la zona industrial se escogió el agua de la playa de Mar Verde, persiguiendo como objetivos su caracterización y la degradación de diesel empleando un consorcio bacteriano.
Métodos utilizados y condiciones experimentales
Origen y toma de las muestras
La toma de muestra se realizó en la playa Mar Verde, ubicada al oeste en la provincia de Santiago de Cuba, entre las 9:00 am y 11:00 am, en los meses de febrero y abril, a una profundidad de 1 m de la superficie y a 10 m de la orilla del mar. La temperatura del agua estuvo entre los 23 - 25 °C. La conservación de las muestras dependió del análisis posterior.
Determinación de parámetros en el agua de mar
Determinación de oxígeno disuelto, contenido de nitrato y fosfato Para la determinación del oxígeno disuelto en el agua de mar, se siguió el método de Winkler con modificación de azida, según APHA.12 El contenido de nitrato y fosfato se cuantificó espectrofotométricamente según APHA.12
Determinación de pH El pH se determinó por potenciometría.
Determinación de la cantidad de cloruros La determinación se realizó según Norniella-Rodríguez y Hernández-Monzón13 con la modificación siguiente: Se tomaron 30 mL de muestra y se llevaron a un volumétrico de 250 mL, completándose con agua destilada. Se tomaron tres alícuota de 12,5 mL y se llevaron a matraces de 50 mL. La valoración se realizó con AgNO3 (0,025 mol L-1) previamente normalizado con tiosulfato de sodio (0,1 mol L-1). La cantidad de cloruros se calcula por la ecuación siguiente:
Donde: c (AgNO3): es la concentración de la solución de Nitrato de Plata, M (Cl): Masa Molar del Cloruro, Vc: Volumen consumido de Nitrato de Plata en la valoración y Vm: Volumen de muestra.
Determinación de salinidad La salinidad de la muestra se determinó a partir de la clorinidad según APHA.12)
Determinación de población microbiana heterótrofa y degradadora de diesel La población microbiana heterótrofa se determinó por conteo de viables en placas Petri con agar nutriente, las placas se incubaron a 30 °C y el conteo de las colonias se realizó después de 48 h. El crecimiento microbiano se expresó como Unidades Formadoras de Colonia (UFC mL-1). La población degradadora de diesel presente en el agua de mar se determinó empleando 1 % de hidrocarburo. Las muestras con diesel se incubaron por 48 h a 180 rpm y 30 °C. Posteriormente se realizó el conteo de viables bajo iguales condiciones que para la población heterótrofa. Cada experimento se realizó por triplicado.
Cinéticas de degradación por el consorcio bacteriano.
Se empleó un consorcio bacteriano integrado por cuatro cepas Gram negativas (Xanthomonas sp., Acinetobacter bouvetii; Shewanella sp.; Defluvibacter lusatiensis) aisladas de la rizósfera de Cyperus laxus Lam, contaminada con petróleo en Veracruz (México), con la colaboración de la Universidad Autónoma Metropolitana - Iztapalapa y actualmente depositadas en la Colección de Cultivos del CEBI. Los estudios de degradación se desarrollaron en botellas con 50 mL de agua de mar. Se siguieron dos experimentos: con el agua de mar estéril, ME (1 atm durante 15 min) y agua de mar sin esterilizar, MSE. Se añadió a cada botella el 10 % de diesel comercial como fuente de hidrocarburo, el cual fue filtrado (filtro microbiológico de tamaño de poro 0,45 µm) para eliminar microorganismos presentes en este compuesto. Se inoculó con las cuatro cepas en proporción 1:1:1:1 (concentración inicial de 106 UFC mL-1, las cuales crecieron en caldo nutriente (30 °C, 180 rpm, 48 h). Los cultivos fueron incubados en una zaranda y se tomaron muestra los 3, 7, 10, 14, 21 y 30 días. Los análisis se realizaron por triplicado y botellas sin inóculo fueron empleadas como control abiótico.
Métodos analíticos
Crecimiento bacteriano El crecimiento bacteriano fue determinado por conteo de viables en placas Petri con agar nutriente; las cajas se incubaron a 30°C y el conteo de las colonias se realizó después de 48 h. El crecimiento bacteriano se expresó como Unidades Formadoras de Colonia.
Determinación del diesel residual como hidrocarburos totales Las muestras fueron lavadas dos veces con diclorometano en embudos de separación. Se dejó reposar hasta la separación visible de las fases acuosa y orgánica. Los hidrocarburos residuales del diesel se determinaron por método gravimétrico. Capacidad de Emulsificación El índice de emulsificación (E24) se determinó según Satpute et al .14 Para ello se vertieron en probetas 2 mL de caldo y 4 mL de diesel, posteriormente se mezcló con la ayuda de un vórtex por 2 min y se dejó reposar 24 h. El índice de emulsificación fue calculado como el cociente entre la altura de la capa emulsionada y la altura total, el mismo se expresó como porciento (%).
Resultados
Caracterización del agua de mar de la playa Mar Verde
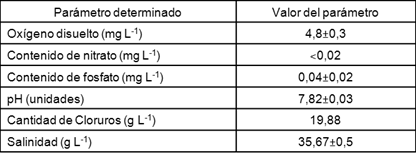
Las características del agua de mar de la playa Mar Verde, determinadas por sus parámetros físicos y químicos, se muestran en la tabla 1.
Para conocer la diversidad de microorganismos presentes en el agua de mar de la playa de Mar Verde, se determinó la población microbiana heterótrofa, arrojando como resultado un promedio de 87 UFC mL-1 con diversidad de morfología. Las características morfológicas de las colonias presentes fueron:
Colonia 1: colonias amarillas - anaranjadas, con bordes lisos, redondas, poco elevadas, brillantes y grandes.
Colonia 2: colonias amarillas, medianas, bordes lisos, redondas y abultadas.
Colonia 3: colonias blanco-amarillentas, redondas, bordes lisos, medianas, cremosas y opacas.
Con el propósito de conocer, cuáles de las colonias presentes en el agua de mar poseían la capacidad de crecer, tolerar y/o degradar diesel como única fuente de carbono, se añadió este compuesto según las técnicas descritas por Núñez.15 Se observaron 30 UFC mL-1, las cuales coincidían con las características morfológicas de las colonias 1 y 3.
Parámetros de respuesta de la cinética de degradación por el consorcio bacteriano
Crecimiento del consorcio bacteriano Se determinó el crecimiento microbiano mediante el conteo de viables para corroborar la asimilación de los hidrocarburos del diesel comercial por el consorcio. En la figura 1 se presentan los valores de Unidades Formadoras de Colonias durante la cinética.
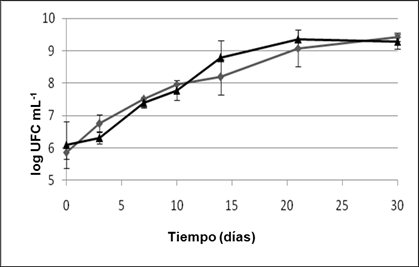
Fig. 1 Crecimiento del cultivo bacteriano en función del tiempo para ME (-♦-) y MSE (-▲-). Cada valor es la media de tres réplicas (barras de error).
Para ambos medios (ME y MSE) se observa el crecimiento del consorcio hasta alcanzar valores en el orden de 109 UFC mL-1 el día 21, valor que se mantuvo constante hasta el día 30. Según apreciaciones visuales, el crecimiento de las cepas A. bouvetii y Xanthomonas sp., predominó durante la cinética para ambos experimentos. Defluvibacter lusatiensis fue observada el día 21 y sólo una colonia de Shewanella sp. se observó en el experimento con el medio MSE el día 30. No fueron observadas, en el experimento con medio MSE, bacterias autóctonas degradadoras de diesel con las características morfológicas correspondientes a las colonias 1 y 3.
Diesel residual Para conocer si el diesel ha sido consumido por el consorcio bacteriano se determinó el diesel residual por gravimetría. La figura 2 muestra el comportamiento durante la cinética del consumo de diesel para los medios ME y MSE. El mayor consumo de diesel ocurrió en los primeros 10 días en ambos medios, para luego permanecer prácticamente constante, alcanzando porcentajes de degradación de más del 50 %. Se observó, precisamente entre estos días, un cambio de coloración en el diesel tratado pasando de amarrillo parduzco a amarillo claro.
Al final de la cinética, para el medio ME quedó aproximadamente 2,00 g de diesel, alcanzándose el 53 % de remoción del hidrocarburo. Sin embargo, en el medio MSE quedó 1,59 g de diesel, para el 62 % de remoción.
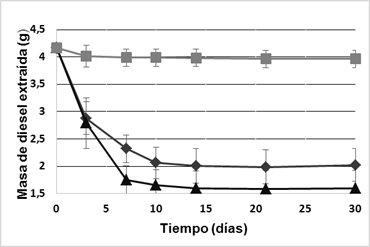
Fig. 2 Masa de diesel en función del tiempo para ME (-♦-), MSE (-▲-) y control abiótico (-■-). Cada valor es la media de tres réplicas (barras de error).
Capacidad de emulsificación por el surfactante
En la figura 3 se muestra el comportamiento del índice de emulsificación correspondiente a los experimentos con los dos medios de cultivo (ME y MSE). En ambos medios existió un comportamiento similar, donde crece el índice de emulsificación para luego disminuir el día 21 y permanecer prácticamente igual hasta el final de la cinética. El mayor valor de índice de emulsificación se logró el día 14 con 68,4 % para el MSE y 65,7 % para el ME.
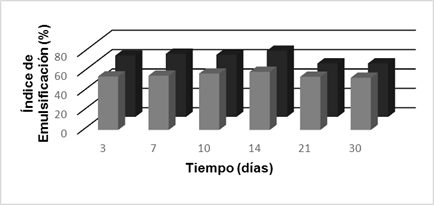
Fig. 3 Comportamiento del Índice de Emulsificación, durante 21 días de la cinética para MSE (■) y ME (■).
No se observaron diferencias estadísticamente significativas para un nivel de confiabilidad de 95 % (p-valor>0,05) al evaluar cada parámetro de respuesta de la cinética para ambos medios.
Discusión de los resultados
En los procesos de degradación aerobios, el oxígeno juega un papel fundamental. Durante la degradación de los hidrocarburos, la activación de las diferentes enzimas que llevan a cabo el proceso catabólico es provocada por el oxígeno molecular, 16 el cual activa las diferentes enzimas. Además, el crecimiento celular y la formación de biomasa celular en procesos de degradación de hidrocarburos, dependen en gran medida de la cantidad de oxígeno presente en el medio y que pueda ser asimilado por las bacterias. 15,17
En un rango de temperaturas de 20 a 50 °C la solubilidad del oxígeno disuelto en agua de mar varía de 4,3 a 9 mg L-1, 18, y según la norma cubana NC 25:1999, 19, los valores de oxígeno disuelto en agua marina de buena calidad son mayores de 5 mg L-1, parámetro similar al mostrado en este trabajo.
El nitrógeno, es un elemento necesario para la producción de aminoácidos, proteínas, enzimas, ácidos nucleicos y otros constituyentes celulares. Por otro lado, el fósforo interviene en la formación de compuestos energéticos dentro de las células y es requerido para la síntesis de ácidos nucleicos y fosfolípidos en los procesos de reproducción y degradación.16 Los valores de nitrato y fosfato fueron similares a los establecidos en la NC 25:1999 (nitrato <0,01 mg L-1 y fosfato <0,05 mg L-1) 19, demostrando que esta agua tiene buena calidad.
En ecosistemas marinos los niveles de nitrato y fosfato se encuentran limitados por la cantidad de sales que poseen los mismos, además a la baja solubilidad de gases. Las sales presentes en al agua de mar tienden a excluir las moléculas gaseosas por la reducción de espacios intermoleculares reduciendo así el área superficial, lo cual trae como consecuencia que los niveles de estos nutrientes en el agua de mar sean bajos. 5 Cantidades similares fueron descritas por Carmenate et al.20 en un tramo costero cercano a un complejo industrial en la Bahía de Las Habana, cuantificando 0,012 mg L-1 de nitrato y 0,06 mg L-1 de fosfato.
El pH es un factor abiótico que regula procesos biológicos mediados por enzimas. En el agua de mar, debido al gran volumen que las mismas representan, el pH no suele variar significativamente, presentando valores entre 7 y 8,5 unidades.18 La norma cubana NC 22:1999 21, refiere que para fines recreativos los valores de pH deben estar entre 6,1 y 8,9 unidades. En cualquiera de los casos, el valor de pH mostrado en este trabajo se encuentra en el rango permisible.
Las bacterias presentan valores máximos de actividad enzimática a ciertos valores de pH que varían entre cada género bacteriano, pero se conoce que su efectividad requiere de condiciones de pH entre 6 y 8 unidades. 22
La salinidad que tiene el agua de Mar Verde (35,67 ±0,5 g L-1) clasifica como aguas polihalinas (34 a 38 g L-1) y se corresponde tanto con los valores de salinidad típicos para aguas del Mar Caribe (34 a 36 g L-1) como a los establecidos por la NC 22:1999 (36 g L-1). 21 Cambios en la salinidad inducen cambios estructurales y fisiológicos en muchos microorganismos. Las variaciones en salinidad se pueden producir como resultado de la mezcla de masas de agua con salinidades diferentes, la formación de precipitados insolubles y la difusión de una masa de agua a otra. 18
Existen muchas investigaciones en las cuales se han aislado y encontrado diversos microorganismos degradadores de derivados del petróleo en distintos ambientes, incluidos los ecosistemas marinos. Éstos son capaces de utilizar los hidrocarburos del petróleo como única fuente de carbono y energía y, mediante procesos catabólicos, transformarlos en formas inocuas o menos tóxicas al medio ambiente. 23,24 Aunque fueron detectadas tres morfologías diferentes de colonias de bacterias en el agua de Mar Verde, sólo las colonias 1 y 3 fueron capaces de crecer con 1 % de diesel, lo cual sugiere que éstas pueden metabolizar o tolerar concentraciones similares del hidrocarburo. Sin embargo, estas colonias no fueron observadas en medio no estéril (MSE) cuando se realizaron los experimentos de degradación del diesel comercial (10 %), evidenciándose que no interfieren con el crecimiento de las cepas del consorcio, lo cual fue corroborado estadísticamente para un 95 % de confiabilidad.
En los experimentos de degradación del diesel comercial, el crecimiento bacteriano observado en ambos medios (ME y MSE) sugirió que el consorcio bacteriano empleado utilizó los hidrocarburos como fuente de carbono. La fase estacionaria de crecimiento observada, pudo estar condicionada por (i) la baja disponibilidad del diesel hacia las cepas del consorcio bacteriano, (ii) que se produjeran metabolitos intermediarios durante la degradación de los hidrocarburos que pudieran inhibir el crecimiento o (iii) a la baja cantidad de nutrientes esenciales presentes en el agua de mar.
Estudios previos de degradación, empleando el consorcio bacteriano, demuestran la capacidad de crecer en hexadecano (13 g L-1), donde Shewanella sp. y D. lusatiensis utilizan los metabolitos excretados por A. bouvetii y Xanthomonas sp.25 Este crecimiento no fue observado para Shewanella sp. en agua de mar sin esterilizar, lo cual puede deberse a que se necesite más tiempo de metabolización del hidrocarburo o que se haya inhibido el crecimiento de la bacteria. Pucci et al.26 demuestran que el género Shewanella ha sido empleado en procesos de biodegradación por poseer un importante rol en el cometabolismo de compuestos halogenados y del petróleo.
La degradación del diesel ocurrió en los primeros 10 días, sin embargo, el crecimiento bacteriano permaneció constante luego de los 21 días de la cinética. El aumento de las poblaciones bacterianas luego del décimo día y la poca degradación del diesel pudiera deberse a que el consorcio estuviera consumiendo el biosurfactante excretado por A. bouvetii como fuente preferencial de carbono.27
En este trabajo se obtuvo un porciento de degradación de 62 %. Usualmente las investigaciones relacionadas con la degradación de diesel se dirigen a suelos, existiendo poca información en agua de mar. Sin embargo, Cleber et al.28 reportan un porcentaje máximo de degradación del 35 % en medio salino para el diesel (200 mg L-1) empleando cepas de Acinetobacter baumannii en 21 días de experimentación.
Araujo et al.29 estudiaron la degradación de concentraciones de petróleo crudo entre 7,467 y 8,265 g L-1 alcanzando un 80 % de remoción empleando un cultivo mixto.
Otros estudios de degradación, reportan un porciento de degradación del 90 % de petróleo crudo en playas y costas cubanas empleando BIOIL-FC, producto que contiene cinco cepas bacterianas aisladas en ambientes marinos. 15
La baja solubilidad y disponibilidad de los contaminantes hidrocarbonados hacia los microorganismos puede mejorarse mediante el uso de biosurfactantes por el aumento en la biodisponibilidad del hidrocarburo para los microorganismos y por la interacción con la superficie celular que permite que los sustratos hidrofóbicos se asocien más fácilmente con las células bacterianas. 30
Es conocido que A. bouvetii es capaz de producir biosurfactante que no reduce significativamente la tensión superficial pero es capaz de formar emulsiones estables 25 El biosurfactante excretado por A. bouvetii es un emulsificante tipo Lipo-heteropolisacárido. 31
La disminución del índice de emulsificación a los 21 días coincide con el crecimiento constante del consorcio, lo que indica es fuente preferencial de carbono y energía para mantener viabilidad. La degradación de biosurfactantes es un fenómeno frecuente durante la degradación de hidrocarburos. Las cepas del consorcio A. bouvetii y D. lusatiensis son capaces de degradarlos como fuente de carbono preferencial, 25 debido a que favorece el intercambio de metabolitos entre las cepas fácilmente cuando en el medio no existen compuestos más simples para ser degradados por los microorganismos, lo cual influye en la disminución de los valores del Índice de emulsificación. 14
Cepas del género Acinetobacter producen emulsificantes durante la fase estacionaria de crecimiento, en particular, el emulsan de Acinetobacter calcoaceticus RAG-1 puede ser detectado en el cultivo después de las 10 h de crecimiento, y la máxima producción ocurre en la fase estacionaria. Por el contrario, los ramnolípidos de Pseudomonas aeruginosa GL1, son producidos durante todo el cultivo. 25
Por otra parte, estudios con cepas del género Bacillus revelan que los exopolímeros producidos por éstas, presentan actividad emulsificante, variando entre 2 y 90 %. La cantidad de sales no influyen con la actividad emulsificante de las cepas del consorcio, lo cual coincide con los resultados de este trabajo. 29
Conclusiones
Los parámetros químicos, físicos y microbiológicos evaluados en la playa Mar Verde se encontraron dentro de las regulaciones de las normas cubanas (NC 25:1999 y NC 22:1999). El consorcio bacteriano degradó un 62 % del diesel comercial en el medio MSE, a los 30 días del proceso, pudiendo emplearse para futuros procesos de biorremediación en los ambientes costeros de Santiago de Cuba.