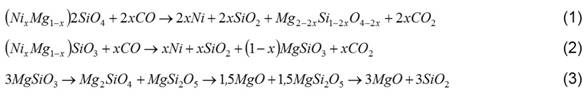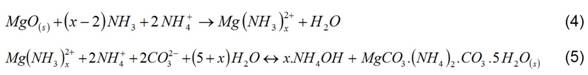Introducción
La deposición de incrustaciones de magnesio es una debilidad de la tecnología de lixiviación carbonato amoniacal, para la recuperación del níquel y cobalto de minerales lateríticos. El magnesio alimentado al proceso proviene fundamentalmente de la serpentina, durante la reducción en los hornos incrementa el contenido de olivino y piroxeno, respectivamente (1), (2) y se obtiene el óxido de magnesio y la sílice (3). 1,2
La lixiviación comienza en el tanque de contacto del mineral reducido y el licor carbonato amoniacal (4), (5). 3
El magnesio sobresatura el licor y posteriormente precipita, trayendo consigo afectaciones al proceso tales como: se incrusta en equipos y accesorios causando obstrucciones; disminuye el diámetro efectivo de tuberías, la capacidad de bombeo y la eficiencia de enfriamiento del licor; incrementa los costos de mantenimiento por las labores de limpieza y el vertimiento de escombros al entorno, entre otras.
Las incrustaciones son depósitos adherentes y duros que se forman en soluciones acuosas sobresaturadas, por procesos de deposición de compuestos inorgánicos, debido a la alteración del estado de equilibrio termodinámico y químico, como se explica a continuación:
A partir de monómeros (átomos o moléculas) inestables, se forman pequeños cristales provocados por fluctuaciones locales en el equilibrio de la concentración de iones en las soluciones sobresaturadas, a continuación, los cristales crecen por adsorción de iones sobre las imperfecciones de su superficie, a este proceso se le denomina nucleación homogénea. Durante la nucleación, es necesario remontar una barrera de energía a un tamaño crítico del cristal, cuando el trabajo de formación del conglomerado alcanza un máximo. 4,5
El crecimiento de cristales también tiende a iniciarse sobre una superficie preexistente de límite de fluidos, proceso denominado nucleación heterogénea. Los sitios en que se produce la nucleación heterogénea incluyen los defectos en las superficies, como las asperezas de los tubos y por la presencia de partículas sólidas. Un alto grado de turbulencia también puede favorecer el depósito de sedimentos.
Un caso especial de nucleación heterogénea es la formación de núcleos sobre centros activos donde la barrera de nucleación es baja, así la formación de núcleos es más probable. Por lo general, el origen de los centros activos donde se inicia el proceso de transición de fase es difícil de detectar, en algunos casos, los centros activos se agregan artificialmente al sistema. 5
El carbonato de magnesio posee disímiles aplicaciones en la industria del caucho, la farmacéutica, de cosméticos y perfumería, manufactura de papel; en la fabricación de pinturas, resinas, tintas, entre otras. Los factores que influyen en la lixiviación son fundamentalmente: concentración de amoníaco, dióxido de carbono, pH del licor, tiempo de retención, temperatura, relación líquido - sólido y características del mineral reducido. 6,7,8
Este trabajo tuvo como objetivo, determinar la influencia de los factores concentración de amoníaco, dióxido de carbono, temperatura y magnesio libre en el mineral reducido, sobre la cinética de reacción y la concentración de sobresaturación del magnesio en el licor carbonato amoniacal.
Métodos y materiales
Los experimentos se realizaron con mineral procesado en la planta productora de níquel en Nicaro (1942-2012), Cuba, procedente de dos frentes de minería, Pinares de Mayarí y Mina Martí. La caracterización del mineral alimentado a los hornos de reducción se realizó de una muestra compósito de 8 horas, obtenida de un muestreador de flujo continuo y dividida por los métodos cortador de chutes, cono y cuarteo. En el caso del mineral reducido, la muestra se tomó spot en matraces kitasato, metálicos, con capacidad de 500 g en atmósfera inerte de argón, a la descarga de los enfriadores de mineral del proceso industrial.
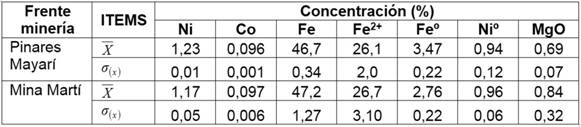
El mineral de alimentación, frente Pinares de Mayarí, tuvo una concentración de níquel (Ni) de 1,2%, cobalto (Co) 0,102%, hierro (Fe) 43,1%, sílice expresado como óxido de silicio (SiO2) 10,6% y magnesio expresado como óxido (MgO) 5,5%. Por su parte, del frente Mina Martí, tuvo Ni 1,17%, Co 0,106%, Fe 45,1%, SiO2 8,0%, MgO 4,5%. Se caracterizó el mineral reducido de cada kitazato y se expresó según el valor promedio (X) +/- desviación estándar (σ) de los componentes (tabla 1).
El licor de lixiviación se preparó por balance de masa de amoníaco, a partir de hidróxido de amonio (NH4OH) al 24 % en peso, agua destilada y Licor Fresco carbonato - amoniacal con 120 g/L de amoníaco y relación NH3/CO2=1,7.
La muestra de mineral reducido se extrajo del matraz hacia un sinfín rotatorio con alimentación de gas argón, para evitar la re oxidación de las muestras y se pesó sobre el licor.
La lixiviación del magnesio, sistema líquido - sólido, se realizó en un reactor cilíndrico de 2,5 L, los factores de formas se muestran en la tabla 2, donde D: diámetro del reactor; d: diámetro del impelente (45 mm); H: altura útil del reactor; I: ancho de los bafles; w: ancho del impelente; A: separación del impelente del fondo; Nh: número de hojas del impelente; Nb: número de bafles.
El análisis químico del mineral reducido y de los componentes metálicos lixiviados, se realizó por espectrofotometería de absorción atómica; y el resto de los elementos, por métodos volumétricos y gravimétricos. En el caso del magnesio libre o amorfo, se determinó por lixiviación con sulfato de cobre, según procedimiento (UPN-PG-V MRL-02) del Centro de Investigaciones del Níquel (CEDINIQ) en Nicaro.
El magnesio lixiviado en el laboratorio, se determinó pipeteando del reactor 4 mL de alícuota cada 3 min en los primeros 21 min y posteriormente, más espaciado hasta completar el tiempo de retención de 65 min, cada vez se colocó en la punta de la pipeta un filtro. En el proceso industrial, se pipeteó la alícuota en el sitio del muestreo, seguidamente de tomar la muestra en un frasco de 250 mL.
La variable independiente fue la concentración de magnesio, expresado como MgO según la práctica industrial; y las independientes fueron: concentración de amoníaco, relación NH3/CO2, temperatura y magnesio libre. Se mantuvo fija la relación líquido - sólido 5:1 y el volumen de licor de 1,25 L.
La sobresaturación absoluta se calculó por la ecuación (5)
Donde C es la concentración de la sustancia en el instante dado (mg/L) y Csat la concentración de la solución saturada (mg/L) a una temperatura específica.
El análisis cinético se realizó aplicando el método integral de análisis de datos. Los parámetros se ajustaron aplicando el StatGraphic 5.1 y el Microsoft Excel, la mejor calidad de ajuste se decidió por el mayor coeficiente de determinación (R2). Los modelos más representativos de los datos, en dos etapas, resultaron: para la etapa de lixiviación, la ecuación cinética de orden cero (6) cuya función integrada es una recta (7); y para la precipitación, la ecuación cinética de primer orden (8), cuya función integrada es exponencial (9). 9,10,11
Donde k0 es la constante de velocidad de reacción de orden cero (g/L·min-1) y k1 de primer orden (min-1).
Resultados y discusión
Se realizó la lixiviación del magnesio del mineral reducido de Pinares de Mayarí, se calculó la sobresaturación absoluta a tres niveles de concentración de amoníaco (60, 70 y 80 g/L), manteniendo fija la relación NH3/CO2 igual a 1,8 y la temperatura de 42 ºC (figura 1 a).
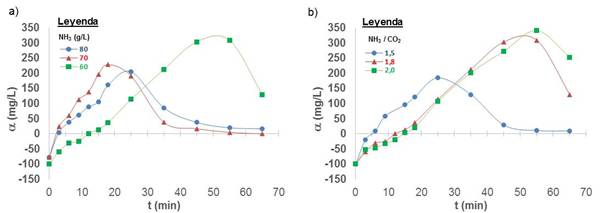
Fig. 1 Sobresaturación absoluta del magnesio, lixiviación del mineral reducido frente de minería Pinares de Mayarí a 42 ºC. a) Variación del NH3 a relación NH3/CO2 = 1,8; b) Variación de la relación NH3/CO2 a 60 g/L de NH3
Se obtuvo que un incremento de la concentración de amoníaco en el licor de lixiviación, disminuye la sobresaturación (Cssat) del magnesio. Al aumentar el NH3 de 60 a 70 g/L, incrementó la resultante de velocidad de lixiviación del magnesio por la reacción de orden cero (k0) favoreciendo la nucleación y disminuyó Cssat; pero a 80 g/L, hay un cambio en el comportamiento cinético del proceso al disminuir la solubilidad y por efecto combinado de la nucleación, disminuyó la constante cinética k0 y Cssat (Tabla 3).
Tabla 3 Efecto del amoníaco sobre la concentración de sobresaturación del magnesio y las constantes cinéticas a 42ºC y NH3/CO2 = 1,8, mineral reducido de Pinares de Mayarí
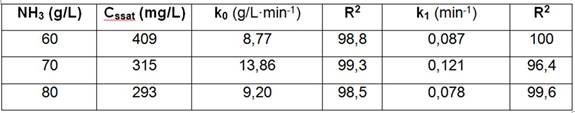
La precipitación del magnesio se puede representar con calidad de ajuste superior a 96,4 %, por una reacción de primer orden, cuya resultante de velocidad (k1) aumentó al incrementar el NH3 de 60 a 70 g/L; pero a 80 g/L disminuye la solubilidad y k1 decreció, al depender, además, de la concentración de magnesio inicial de la etapa.
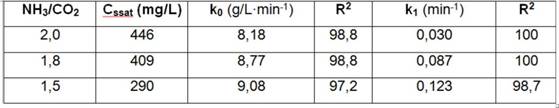
La carbonatación del licor amoniacal disminuyó la concentración de sobresaturación (ver figura 1 b). Cuando la relación NH3/CO2 disminuye desde 2,0 a 1,5, la resultante de velocidad de lixiviación (k0) aumenta, se favorece la nucleación y disminuye la sobresaturación, también incrementa la velocidad de precipitación (k1) con relación inversamente proporcional a Cssat. En ausencia de dióxido de carbono el magnesio no se lixivia (ver tabla 4).
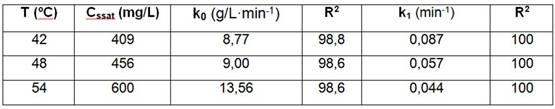
Por su parte, al aumentar la temperatura de lixiviación de 42 a 54 ºC, incrementó la resultante de velocidad de lixiviación del magnesio k0 de 8,77 a 13,56 g/L·min-1 y disminuyó k1 de precipitación de 0,087 a 0,044 min-1, aumentando la concentración de sobresaturación de 409 a 600 g/L. Luego, al elevar la temperatura la solubilidad aumenta y el fenómeno de disolución a temperatura constante es endotérmico (Ver figura 2 a y tabla 5).
Tabla 4 Efecto de la relación NH3/CO2 sobre la concentración de sobresaturación del magnesio y las constantes cinéticas a 42ºC y 60 g/L de NH3, mineral reducido de Pinares de Mayarí
Para favorecer las extracciones de níquel y cobalto, se ha recomendado operar el proceso de lixiviación a elevada concentración de amoníaco entre 85 y 90 g/L, relación NH3/CO2 entre 1,5 y 1,7 y temperatura de 40 a 45 ºC; luego, estas condiciones de operación también son propicias para disminuir la concentración del magnesio en el licor y la deposición de incrustaciones. 3,12
Tabla 5 Efecto de la temperatura sobre la concentración de sobresaturación del magnesio y las constantes cinéticas a 60 g/L de NH3, relación NH3/CO2 igual a 1,8, mineral reducido de Pinares de Mayarí
Se realizó la lixiviación del magnesio a 42 ºC, 60 g/L de NH3 y baja concentración de dióxido de carbono para una relación NH3/CO2 igual a 2,3, con mineral reducido del frente de minería Mina Martí (ver tabla 1). Se obtuvo que a menor contenido de magnesio libre, menor la concentración de sobresaturación; a valores tan bajos como 0,66 %, se obtuvo una concentración de equilibrio de 146 mg/L y a 0,48 %, de 43 mg/L (Ver figura 2 b). Luego, se deben considerar las características físico - químicas del mineral reducido y la concentración de MgO, para posteriores análisis de cinética de reacción y solubilidad. Se ha investigado que la concentración de magnesio libre en el mineral reducido, depende del tiempo de retención del mineral en el horno, la temperatura de reducción y la interacción entre ésta y el por ciento de petróleo aditivo. 13
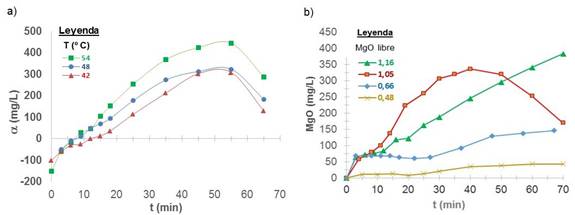
Fig. 2 Lixiviación del magnesio a) Sobresaturación absoluta a 60 g/L de NH3, NH3/CO2 = 1,8 y mineral de Pinares de Mayarí b) Concentración a 42 ºC, NH3 de 60 g/L, NH3/CO2=2,3, mineral de Mina Martí
Se tomó una muestra de incrustaciones removida de las tuberías del proceso tecnológico en Nicaro, la cual tuvo una composición de 20,2 % de magnesio (expresado como MgO según la práctica industrial), 4,1 % de hierro (Fe) y 0,64 % de níquel (Ni). Se alimentó al reactor de lixiviación (tabla 2) por fracciones granulométricas a una dosis de 8 kg / t de mineral reducido. La fracción +0,15 mm (+100 mesh) resultó efectiva para disminuir la concentración de sobresaturación del magnesio, al propiciar la formación de centros de cristalización.
Se realizó un perfil de magnesio en el proceso tecnológico en Nicaro, en los equipos: tanque de contacto (TQ) del mineral reducido con el licor, reactores (R) y sedimentadores (S) de primera a tercera etapa de lixiviación (Figura 3).
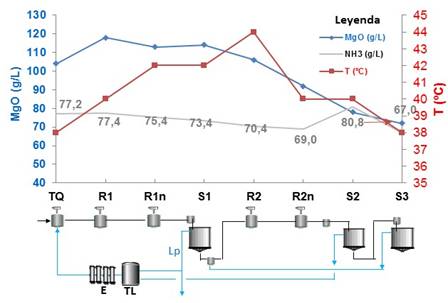
Fig. 3 Perfil de magnesio en la fábrica de níquel en Nicaro, en los equipos: tanque de contacto (TQ), reactores (R) y sedimentadores (S) en las etapas de lixiviación 1, 2 y 3, mineral de Mina Martí.
El perfil de amoníaco fue favorable para la recuperación de níquel y cobalto, alcanzando en el licor producto (Lp) 73,4 g/L, la temperatura se mantuvo entre 38 ºC y 44 ºC. La concentración de magnesio incrementó desde el tanque de contacto (TQ) hasta el primer reactor de lixiviación (R1) y luego comenzó a disminuir desde 118 mg/L hasta 72 mg/L.
Conclusiones
Al incrementar la concentración de amoníaco y la carbonatación del licor, aumenta la resultante de velocidad de lixiviación del magnesio, se propicia la nucleación y posterior precipitación, disminuyendo la concentración de sobresaturación.
El incremento de la temperatura de lixiviación propicia la lixiviación del magnesio, disminuye la velocidad de precipitación y aumenta la concentración de sobresaturación.
A menor contenido de magnesio libre en el mineral reducido, menor la concentración de magnesio disuelto del licor de lixiviación.
Nomenclatura
A: Separación del impelente del fondo
C: Concentración de la sustancia en el instante dado (mg/L)
Cssat: Concentración de sobresaturación a la temperatura dada (mg/L)
d: Diámetro del impelente
D: Diámetro del reactor
E: Banco de enfriadores de licor, figura 3
H: Altura útil del reactor
I: Ancho de los bafles
k0: Constante de velocidad de reacción de orden cero (g/L·min-1)
k1: Constante de velocidad de reacción de primer cero (min-1)
Nh: Número de hojas del impelente
Nb: número de bafles
R: Reactores de lixiviación
S: Sedimentadores de lixiviación
TL: Tanque de licor
TQ: Tanque de contacto
w: Ancho del impelente
α (Alfa): Sobresaturación absoluta (g/L)
σ (sigma): Desviación estándar