Introducción
El uso convencional, así como el fomento de nuevas aplicaciones le confieren gran importancia al cultivo de microalgas, el que comenzó en la década de 1960 en Japón, con el desarrollo del cultivo de Chlorella.1,2 Ya en 1890 el microbiólogo holandés Beijerinck obtuvo por primera vez cultivos puros de la microalga de agua dulce Chlorella vulgaris, y a partir de entonces se trabajó en la obtención de cultivos con alta densidad celular, lo que fue logrado por Otto Warburg en 1919 3, quien introdujo la idea de utilizar suspensiones densas de microalgas como instrumento en las investigaciones sobre fotosíntesis.4,5,6,7
Chlorella vulgaris ha sido la especie de microalga más estudiada.8 Su cultivo presenta múltiples ventajas debido a su alta velocidad de crecimiento y la habilidad de adaptarse a diferentes ambientes,9 lo que facilita su desarrollo en áreas pequeñas y en regiones sustentables para el desarrollo de cultivos agrícolas.
A partir de su biomasa pueden obtenerse disímiles productos: suplementos nutricionales, 10 lípidos, 11 enzimas, 12 proteínas, 13 almidón, 14 polímeros, 15 pigmentos, vitaminas 2,16,17,18,19, antioxidantes 13, isótopos bioquímicos estables, estimuladores del crecimiento 2 y biocombustibles, 20,21,22,23,24, destacando además entre sus usos convencionales la producción de biofertilizantes, y la alimentación animal; 25,26,27 además de la obtención de productos de interés químico-farmacéutico 2 como el omega 3, 28,29,30,31, hidrolizados proteicos 10, y en general, suplementos nutricionales para humanos, 32,33,34,35, así como importantes servicios ambientales en el tratamiento de aguas residuales 15,36,37,38,39,40; siendo la producción de biocombustibles uno de sus usos relevantes. 41,42,43,44
Muchos esfuerzos se dedican hoy a abaratar y mejorar la producción de biomasa de Chlorella vulgaris, desde el establecimiento de inóculos hasta la obtención del producto final. Entre estas investigaciones destaca el manejo de diferentes parámetros de cultivo 2,45,46, hasta la aplicación de tecnologías alternativas como el uso del campo magnético. 47,48,49 Otra tendencia ha sido el aislamiento de especies locales en función de lograr su fácil adaptación a las condiciones de cultivo y valorizar especies autóctonas.
En el cultivo masivo, el rendimiento alcanzado depende tanto de la concentración celular como del grado en que las células desarrollan su potencial de crecimiento. Por tanto, para conseguir un cultivo de microalgas en crecimiento activo son necesarios: un inóculo viable de tamaño mínimo, suministro de nutrientes y micronutrientes, así como adecuadas condiciones físico-químicas (temperatura, pH) y energía. 2,50,51
El objetivo de este trabajo fue evaluar el efecto del pH en el rango de 5 a 8 sobre el crecimiento y viabilidad de células en cultivo de una especie local de C. vulgaris.
Fundamentación teórica
La variación de las condiciones de cultivo y de factores clave como el pH, intensidad luminosa, concentración de nutrientes, temperatura, fotoperíodo, régimen de cosecha, entre otros, ha contribuido al manejo de sistemas de cultivo para la obtención de biomasa microalgal para diferentes propósitos, siendo el pH, la presión de O2 y CO2, algunos de los parámetros críticos a la hora de diseñar fotobiorreactores.52
La respuesta de las microalgas al pH varía ampliamente, debido a que este factor determina la solubilidad del dióxido de carbono y de los minerales en los cultivos e influye directa o indirectamente en el metabolismo. Al igual que la temperatura no solo afecta las reacciones celulares, sino también los requerimientos nutricionales y la composición de la biomasa, así como la solubilidad de los gases en el agua.50,53
La selección del valor de pH es importante en el cultivo de las microalgas ya que un valor poco favorable podría afectar la eficiencia en la absorción de nutrientes y la producción de metabolitos, lo que muestra una clara dependencia de las células en cultivo al pH del medio de cultivo, siendo importante considerar que cada microalga presenta un rango de pH óptimo para su cultivo.53
El pH se ve afectado por la capacidad tampón y composición del medio de cultivo, cantidad de dióxido de carbono disuelto, temperatura, que a su vez controla la solubilidad de CO2 y actividad metabólica de las células microalgales.54,55 El pH de un cultivo varía con el desarrollo de este, aun en el caso de aquellos cultivos fuertemente tamponados; siendo los valores de pH óptimo descritos para Chlorella vulgaris el rango comprendido entre pH 7,5 y 8,28.56,57
Si bien el efecto del pH sobre especies de Chlorella ha sido explicado por varios autores, ( , , ) en muchas ocasiones este factor no es bien manejado tanto en los cultivos a escala de laboratorio como a gran escala, o bien se asume un rango o se considera un mismo valor de pH óptimo para varias especies del género, y para especies aisladas en diferentes regiones.
Métodos utilizados y condiciones experimentales
Descripción de la especie: Chlorella Vulgaris Beijerinck
La cepa utilizada fue aislada del medio local, específicamente en un estanque dedicado al cultivo de ciprínidos en la estación de acuicultura de Maffo, Contramaestre, y mantenida en el cepario del Laboratorio de Ecotoxicología del CNEA con el código F010102-N, donde se conserva en condiciones adecuadas desde el 2002, tanto en el Banco Maestro como en el Banco de Trabajo, en medio Bristol sólido y líquido (figura 1).
Condiciones experimentales
Los cultivos unialgales axénicos de C. vulgaris fueron desarrollados en una instalación con un valor de interferencia electromagnética en el rango de 0,03 a 0,23 µT. Para eliminar interferencias electromagnéticas en la instalación experimental, los cultivos fueron ubicados en lugares con exposición menor que 0,25 µT.59
La temperatura en la cámara de cultivo se mantuvo alrededor de 22 ±2,3 °C, con una humedad relativa del 62,5 ±3,1%. Los cultivos se mantienen en régimen de luz continua, con cuatro lámparas fluorescentes Daylight TL-D 36W/ 54-765 Philips, a una densidad de flujo fotónico (DFF) de 3 000 lux (58,59 µE m-2s-1), la que se ajusta diariamente utilizando una estación meteorológica portátil TP LM 8000 4 en 1, con sensor de luz con filtro para la corrección del color en el rango de la radiación fotosintéticamente activa (PAR), fotópico (0-20 000 lx, E: ±8), instalado permanentemente, con un fotodiodo integrado exclusivo. La DFF se expresa en µEm-2s-1, utilizando el factor de conversión 51,2.60
A cada tratamiento se le ajustó el pH dos veces por día. El pH fue medido y ajustado convenientemente con un pH-metro Mettler Toledo SevenGo Duo (Alemania), con un error de 0,1%. Una vez concluido este experimento se selecciona el pH que permite mayores concentraciones celulares y viabilidad, para el desarrollo de cultivos unialgales axénicos aireados a mayor volumen (1L).
Desarrollo de los cultivos experimentales
Preinóculos e inóculos: Se establecen cultivos a partir de un subcultivo matriz monoalgal de C. vulgaris obtenido a partir de un cultivo sólido en cuña de agar. Este cultivo matriz se desarrolla de forma asincrónica (discontinuo) en condiciones de fotoautotrofía con aireación, sin suministro extra de CO2 y con un régimen de luz continua (DFF=19,5 µE m2s-1). Los cultivos fueron aclimatados, aumentando progresivamente la intensidad de la luz, en tres cultivos sucesivos hasta que la cepa estuvo completamente adaptada a 75 µE m-2s-1. A partir de este cultivo matriz de C. vulgaris durante su fase exponencial, se desarrollan cultivos sin airear (100 mL) y aireados (1 000 mL) para los diferentes experimentos.
Desarrollo de cultivos no aireados: Los minicultivos no aireados, se prepararon con un volumen de 100 mL a una concentración inicial (Ci) equivalente a 215 x 104 célmL-1, utilizando un rango de pH de 5 a 8 con los siguientes valores: 5, 6, 7 y 8. Los cultivos se desarrollan por triplicado durante 168 h (7 días), agitándolos manualmente dos veces por día, para favorecer su homogenización.
Desarrollo de cultivos aireados: Se establecen cultivos permanentemente aireados de 1L a partir del cultivo matriz en fase exponencial, con una Ci=215 x 104 célmL-1. La aireación se logró mediante burbujeo de aire filtrado con pre-filtros de jeringa de microfibra de vidrio MIDISART 2000 de 0,20 µm. El flujo de aireación se mantuvo relativamente constante a 0,47 L.min-1.
Las condiciones establecidas permiten un crecimiento uniforme y aporta a los cultivos una cantidad mínima de CO2, que les favorece, al actuar como fuente de carbono y colaborar con el tamponamiento de los cultivos.2,50 Se establecen cultivos al valor de pH que mejores resultados permite y a 7,5, que es el que normalmente se recomienda al formular el medio Bristol, que fue el medio utilizado para el desarrollo de estos experimentos.
Medio de cultivo y ajustes del pH: El medio utilizado para el mantenimiento y desarrollo de los cultivos fue el sugerido por Bristol con modificaciones; 2 este se utiliza además para la formulación del medio sólido a partir del que se realizan los subcultivos (tabla 1). Se utiliza el nitrato de sodio (NaNO3) como principal fuente de nitrógeno.
El pH fue ajustado a 7,5 en los cultivos controles, ajustándose convenientemente post-inoculación con soluciones esterilizadas de NaOH 1M y HCl 1M en cada ensayo.
Evaluación de la cinética de crecimiento
El crecimiento se midió a través del recuento diario directo de una alícuota con una cámara de recuento hematológico Neubauer mejorada, utilizando un microscopio óptico Motic B Profesional (Alemania), expresándose los resultados de la concentración celular en célmL-1. Se realizaron diluciones con agua destilada siempre que fue necesario, de forma tal que el número de células por campo de recuento en 1 mm2 estuviera entre 10 y 100.
Análisis de la viabilidad celular
La viabilidad se determinó a través de tres parámetros:
Recuento de autósporas viables
tasa de crecimiento máxima
concentración de clorofila a al inicio y al final del experimento
Siguiendo el procedimiento antes descrito para el recuento de células, se realizó el recuento diferenciado de las autósporas, para lo que se utilizó tinción con Lugol neutro al 1%. A partir de estos datos se calculó el porcentaje de autósporas respecto al total de células.
A partir de los valores del recuento celular se calcula la tasa de crecimiento que corresponde al inverso del tiempo de duplicación (td), tiempo necesario para que N células se transformen en 2N células durante la fase de crecimiento exponencial, y se calcula mediante la expresión:
donde:
Nt y N0 son las densidades celulares (célmL-1) a los tiempos tt y t0 respectivamente.
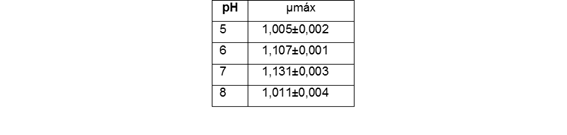
Para el cálculo de la tasa de crecimiento media o exponencial (μmed), t0 y tt son el primer y el último día de la fase logarítmica, en el orden que se mencionan.2 Es de gran valor la determinación de la tasa de crecimiento máxima (μmáx) que se calcula considerando los valores del crecimiento celular obtenidos cuando el cultivo alcanza la máxima pendiente. El resultado se expresa en divisiones por día (div.día-1).
La concentración de clorofila a in vivo se determinó a través de un fluorímetro digital Aquafluor Turner Design (0-300 µg.L-1, E: ±0,30 µg.L-1) utilizando el factor de corrección 6,9025 ±0,0001.61 La concentración de clorofila in vivo se expresa en ngcél-1.
Análisis estadísticos
Se utilizó el estadígrafo t para comparar muestras dependientes, y seleccionar el valor de pH que permite mejor crecimiento y viabilidad, utilizando un test t simple pareado con un porcentaje de confiabilidad del 99,95 %, seleccionando los valores de cada serie que corresponden a máximos crecimientos (48 y 72 h).
Este mismo análisis se utilizó para comparar las curvas de crecimiento, teniendo en cuenta para la comparación de las series, las diferentes fases o estadios del cultivo.
Se realizaron análisis de varianza (ANOVA) de clasificación simple, de dos factores con una sola muestra por grupo, para una p=0.05 con el objetivo de comparar medias. Se realizaron análisis de correlación (Kendall) para evaluar la relación de la viabilidad con la concentración celular (p=0,05).
Resultados y discusión
Variación de parámetros de crecimiento con el pH en C. Vulgaris
El estudio taxonómico, fisiológico y ecológico de microalgas aisladas de represas es de sumo interés para determinar su utilización como bioindicadores de calidad de aguas, su potencial nutricional y producción de sustancias de interés biotecnológico a nivel comercial.62,63 El estudio de los valores óptimos de parámetros de cultivo a escala de laboratorio de la cepa de C. vulgaris aislada a partir del embalse Chalón, permitirá un mejor manejo de los cultivos de esta con fines biotecnológicos.
Los resultados obtenidos en función de determinar el valor de pH que permite mejor crecimiento y viabilidad en los cultivos de una cepa local de C. vulgaris, se presentan en la figura 2.
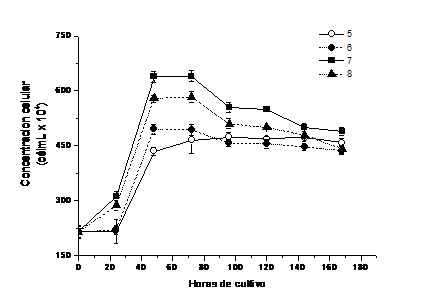
Fig. 2 Variación de la concentración celular con el pH en minicultivos no aireados de Chlorella vulgaris establecidos a 3000lx (58,59 µE m-2s-1)
El crecimiento se constata en todos los cultivos, aparte del valor de pH, lo que indica un amplio rango de tolerancia de la especie; sin embargo, los pH ácidos parecen ralentizar su cinética de crecimiento.
El pH 7 resultó ser la mejor alternativa, ya que permitió una mejor cinética y máximo crecimiento a las 72 h de establecidos los cultivos (640,5 ±1,5 x 104 célmL-1), valores diferentes al resto de los cultivos establecidos en el rango de 5 a 8 u de pH (p=0,05).
La concentración máxima a pH 5 se obtiene a las 96 h (474,00 ±12 x 104 célmL-1), mientras que a pH 6 esta se obtiene a las 72 h con valores similares (493,50 ±15 x 104 célmL-1). A pH 8 los valores de crecimiento son mayores que para los valores de pH ácidos, pero significativamente menores que para el pH 7 (583,5 ±11 x 104 célmL-1) (figura 3).

Fig. 3 Variación de la concentración celular máxima con el pH (5 a 8) en minicultivos no aireados de Chlorella vulgaris establecidos a 3000lx (58,59 µE m-2s-1). Letras diferentes corresponden a valores con diferencia estadísticamente significativas (p=0,05)
A las 168h, cuando casi todos los cultivos han declinado, aún siguen siendo mayores las concentraciones celulares obtenidas a pH 7 (p=0,05).
En cultivos unialgales el pH es un factor de importancia que afecta el crecimiento y la incorporación de amonio del medio, por lo que está estrechamente relacionado con el metabolismo del nitrógeno.2 Algunos autores afirman que cada especie necesita un rango determinado de pH que permita un crecimiento óptimo, 63 siendo el pH 8 el más indicado para especies dulceacuícolas.64 Se ha explicado que por encima o debajo de éste valor, se presenta un descenso en la productividad, que no solo afecta el crecimiento algal, sino también la capacidad de remover el nitrógeno.( 2, 50 Sin embargo, algunos autores explican que, a altas concentraciones de amonio hay descenso del pH y que a valores bajos de este se produce la formación de amonio gaseoso, lo que favorece la existencia de las formas iónicas, que son menos tóxicas para las microalgas.63
Estudios reportados sobre la variación del crecimiento con el pH en el rango de 6 a 9, en una especie de Chlorella aislada de una represa en Venezuela, muestra resultados diferentes a los obtenidos en esta investigación. La máxima densidad celular se obtuvo a pH 9 y 8 con valores de concentración de 323,43 ±74,18 y 309,88 ±59,79x106 célmL-1, respectivamente, lo que indica la necesidad de conocer los valores óptimos para cada especie aislada a partir del medio local, ya que estas se han aclimatado y/o adaptado a condiciones ambientales determinadas y no tienen por qué ser coincidentes los valores óptimos aun siendo la misma especie.
Es importante significar que, el hecho de que esta cepa de Chlorella fuese capaz de tolerar condiciones axénicas resulta de interés fisiológico y biotecnológico. En estas condiciones la cepa pudo presentar mecanismos fisiológicos intrínsecos capaces de regular condiciones ambientales, donde su crecimiento se mantuvo en el rango de pH ensayado, lo que indica un nivel de tolerancia importante, a diferencia de otras especies. Influencia del pH en la viabilidad de C. vulgaris
Influencia del pH en la viabilidad de C. Vulgaris
Respecto a la viabilidad analizada a través del número de autósporas, obtenidas por recuento diferencial diario, es importante señalar que la reproducción por autósporas es característica de Chlorella; esta se realiza cuando las células alcanzan un tamaño máximo, el núcleo se divide en 4 y 8 células pequeñas, idénticas a la célula parental, que son luego liberadas por dehiscencia de la pared de dicha célula.
Los resultados muestran que el pH 7 favorece la formación de autósporas (figura 4). Esta resultó ser máxima a las 24h para los cultivos establecidos a pH 7.
Las concentraciones de clorofila in vivo por célula varían en todo el rango ensayado (figura 5). Los valores oscilan entre 0,75 y 1,10 ng de clorofila a por célula, estos tienen una relación directa con el número de células (r=1, Kendall, p=0,05), siendo mínimos los valores a pH 7, a expensas de un aumento drástico de la concentración celular. A las 168h, los cultivos establecidos a pH 7 presentan la menor concentración de clorofila por célula, lo que pudiera ser indicador de eficiencia fotosintética.

Fig. 4 Variación del número de autósporas con el pH (5 a 8u) durante las 168 h de cultivo (Serie 1: 0h, Serie 2: 24h, Serie 8: 168 h). Letras diferentes corresponden a valores con diferencia estadísticamente significativas (p=0,05)
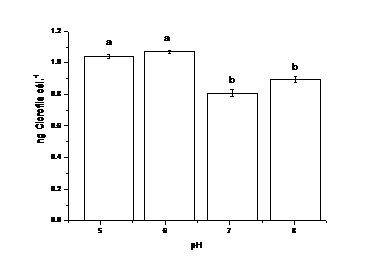
Fig. 5 Variación de la concentración de clorofila in vivo por célula a las 168h de cultivo. Letras diferentes corresponden a valores con diferencia estadísticamente significativas (p=0,05)
El pH de un cultivo está influenciado por varios factores como la productividad algal, la respiración, la alcalinidad y composición iónica del medio de cultivo, la actividad microbiana autotrófica y heterotrófica, y la eficiencia del sistema de adición de CO2.66 El pH tiene relación general con la absorción de nutrientes por lo que definir el pH óptimo de una cepa es relevante para obtener un crecimiento máximo y desarrollar futuras aplicaciones.
El último indicador para el estudio de viabilidad es la tasa de crecimiento máxima, la que se calcula, a partir de la cinética de los cultivos establecidos a diferentes pH (tabla 2).
Los resultados indican que según la comparación de las medias a través del estadígrafo t con p=0,05, no existen diferencias significativas entre los valores medios obtenidos para la tasa de crecimiento máxima, lo que complementa los resultados obtenidos.
Se puede afirmar que la viabilidad se mantiene en todo el rango ensayado, mostrando la alta tolerancia de la especie al pH (5-8). En el caso de la cepa de C. vulgaris estudiada se confirma que el valor que permite mayor crecimiento y viabilidad es el pH 7.
Validación de los resultados en cultivos de 1L
Los resultados obtenidos fueron validados en cultivos de 1L considerando que el pH del medio de cultivo casi siempre se ajusta a valores de pH 7,5 por lo que se compara la cinética de crecimiento con un cultivo establecido a pH 7, que es el óptimo para la especie según resultados previos (figura 6).
La concentración celular máxima obtenida en los cultivos establecidos a pH 7 fue superior a los cultivos control (5398 ±125 x104 célmL-1 vs 4201±10 x104 célmL-1, confirmándose que es el pH 7 el óptimo para la especie, independientemente del efecto del volumen del cultivo.
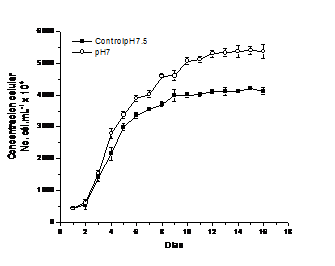
Fig. 6 Cinética de crecimiento en cultivos de 1L establecidos a pH 7 y 7,5 (Control) con la cepa local de Chlorella vulgaris
La variación de las condiciones de cultivo, tales como pH, intensidad luminosa, el tipo y concentración de nutrientes, temperatura, fotoperíodo, régimen de cosecha de cultivos discontinuos, continuos o semicontinuos, entre otros ha contribuido a establecer sistemas dirigidos hacia la obtención de biomasa microalgal como fuente para la obtención de valiosos productos para diferentes industrias.
La respuesta de las microalgas al pH varía, debido a que este factor determina la solubilidad del dióxido de carbono y de los minerales en los cultivos e influye directa o indirectamente en su metabolismo; al igual que la temperatura no solo afecta las reacciones celulares, sino también los requerimientos nutricionales y la composición de la biomasa, así como la solubilidad de los gases en el agua.50,53
Las microalgas muestran una clara dependencia respecto al pH del medio de cultivo; diferentes especies varían ampliamente en su respuesta al mismo. Cada microalga presenta un rango de pH óptimo para su cultivo. Un descenso de pH suele ser letal, en cambio soportan mejor los incrementos del pH,4,6 de aquí la importancia de determinar los valores óptimos y la influencia del pH en cada cepa aislada a nivel local con potenciales aplicaciones biotecnológicas.
Conclusiones
La concentración celular máxima y la viabilidad celular en cultivos a escala de laboratorio de la cepa local de C. vulgaris objeto de esta investigación, varía con el pH; esta cepa resultó ser tolerante al rango de pH ensayado (5-8); siendo el valor que permite concentraciones celulares máximas y mayor viabilidad en cultivos densos a escala de laboratorio, el pH 7.
Esta microalga autóctona, bajo condiciones axénicas presenta un gran potencial biotecnológico por su capacidad de crecimiento y viabilidad en el intervalo de pH ensayado.