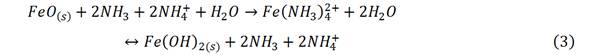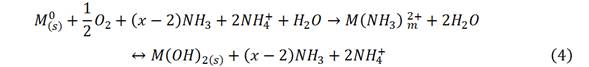Introducción
En la tecnología de lixiviación carbonato - amoniacal para la extracción del níquel y cobalto de minerales lateríticos, se han realizado estudios que proponen la aplicación de la variable potencial redox (Eh), para el control de las operaciones de reducción y lixiviación.1,2,3,4,5
La extracción potencial de níquel y cobalto (Ex), o extractable, se utiliza como indicador de la calidad del proceso de reducción. Se determina experimentalmente por la prueba QT (por sus siglas, Tanque de Contacto) y expresa la extracción máxima de los metales que es posible obtener en el proceso de lixiviación.1,3
En pruebas de reducción realizadas a escala de bancoe industrial, con mineral laterítico cubano de los frentes de minería “Pinares de Mayarí” y “Mina Martí”, respectivamente, se obtuvo una interacción entre el potencial redox (Eh), la concentración de hierro (II) en el mineral reducido y el extractable, lo que sugirió utilizar esta variable para estimar la calidad del mineral que se entrega al proceso de lixiviación, asumiéndolo como un ensayo físico.1,2,3
Por su parte, en pruebas de lixiviación a escala de laboratorio e industrial, se ha determinado que controlar la aireación por medición de Eh, beneficia la eficiencia de recuperación de los metales, al disminuir las pérdidas por segregación en la superficie de los oxihidróxidos de hierro que se forman durante la lixiviación. Específicamente, en la prueba QT, se ha recomendado aplicar un flujo de aire según el potencial redox medido en condiciones anaerobias.3,4,5
Investigaciones reportan la aplicación de la prueba QT para el análisis de los parámetros de operación de los hornos de reducción e incrementar la extracción potencial de los metales;otros autores utilizan el grado de reducción, el cual se obtiene por determinación analítica del Ni, Co y Fe metálicos, por lixiviación con Br2-CH3OH o con Cu2SO4; los resultados se contrastan con los cambios en las fases minerales, la morfología y la composición química utilizando técnicas como ICP-OES, XRD, SEM/EDS;8,9,10,11,12,13 pero la variable potencial redox ha sido poco aplicada en las investigaciones.
El potencial redox es una medida de la propiedad que tienen las especies químicas,de adquirir o perder electrones a través de la ionización. Sigue la ecuación de Nerst, en la cual R es la constante universal de los gases; n, el número de electrones; F, la constante de Faraday; a, la actividad de las especies y Eº, es el potencial estándar de electrodo, definido como el potencial a una temperatura (T) absoluta de 298 K y actividad unitaria de todas las especies.La fuerza iónica, el pH y la temperatura pueden afectar el Eh. Considerando el equilibrio para compuestos complejos metal (Mn+) ligando (L) amina, se plantean, en las ecuaciones. (1), (2).14,15
Al mezclarse el mineral laterítico reducido con el licor carbonato-amoniacal inicia la lixiviación del óxido de hierro (II),formando amino complejos, ecuación. (3).
Pero bajo aireación, el hierro metálico (y el sulfuro que se forma en los hornos por combinación con el azufre del petróleo), se lixivia y precipita por reacciones competitivas de oxihidrólisis, de orden cero y primer orden, resultando un residuo del proceso, las colas negras, ecuación (4).6
Luego, para licor fresco carbonato amoniacal (sin metales disueltos) se planteala dependencia del potencial redox de la concentración de amino complejos de hierro (II). Para el proceso anaerobio, el potencial alcanza valores de -550mV y bajo aireación, aerobio, se reportan un incremento hasta -50mV,ecs. (5) y (6).4,6,7
El propósito de este trabajo fue determinar experimentalmente el extractable de níquel y cobalto con mineral del frente de minería Pinares de Mayarí; determinar las interacciones entre las características del mineral reducido, los extractables y el potencial redox a escala de planta piloto e industrial; y comprobar las interacciones obtenidas con el mineral procesado en el horno selas a escala de banco.
Métodos y materiales
La interacción entre las características del mineral reducido, los extractables y el potencial redox, se determinó utilizando mineral reducido en los hornos de la planta piloto y la industria, en Nicaro; además, se compararon los resultados con mineral procesado en el horno selas.3
El horno de reducción de la planta piloto tiene la misma geometría que los hornos de la industria. Tienen 17 hogares, denotados (H-0) alimentación y (H-16) descarga, el eje centralrota a 1,33 rpm. En la planta piloto se alimentan 8 t/h de mineral, representando un 30 % de la productividad de un horno industrial, disponen de una y diez cámaras de combustión respectivamente. El tiempo de retención es de aproximadamente 70 min. La composición de la atmósfera reductora CO2/CO es de un 1,2 % molar máximo en H-10. La temperatura en el hogar H-15 fue de 750ºC y se dosificóun 3% de petróleo aditivo,(figura 1a,b).

Fig. 1 Instalación, a) Quemador horno de planta piloto b) Quemador - cámara de combustión horno industrial c) Enfriador rotatorio industrial
El mineral se alimenta a los hornos de la planta piloto y la industria, mediante un sistema de dosificación y pesaje, donde se mezcla con el petróleo aditivo. Laoperación de reducción dispone del Sistema de Supervisión y Control de Procesos Tecnológicos EROS (SCADA EROS).
El muestreo del mineral reducido se realiza aprovechando la atmósfera reductora que hay en los hornos y en los enfriadores rotatorios (figura 1c), se descarga mediante toma-muestras, del tipo tornillo sinfín, a kitasatos metálicos previamente purgados con argón. En el caso del muestreo en los hogares del horno, se introduce uncolector cilíndrico, (figura 2a).
La suspensión de mineral reducido y licor carbonato amoniacal, se preparó bajo campana de laboratorio y atmósfera inerte de gas argón (ver figura 2 b). Una masa de 100 g de mineral reducido se pesó directamente en 1,4 L de licor, para un 6,6 % en peso de sólidos.
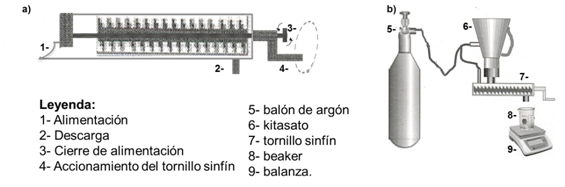
Fig. 2 Implementos para operar el mineral reducido, a) Colector en los hogares del horno, b) Preparación de la suspensión
La lixiviación se realizó a una temperatura entre 25 y 28ºC, tiempo de retención 180 min, concentración de amoníaco (NH3) 90 g/L y relación amoníaco - dióxido de carbono (NH3/CO2) 1,8. Se utilizó un banco de reactores, modelo mezclado perfecto, cada uno con capacidad de 2,5 L.11,16
Las corridas experimentales se realizaron suministrando el flujo de aire (Qa) según el potencial redox (Eh) de la suspensión.
Si Eh ≤ -455 mV, K: 1,3 m3·t-1·min-1, Qa: 130 mL/min.
Si Eh > -455 mV, K: 1,8 m3·t-1·min-1, Qa: 180 mL/min.
Posteriormente, la suspensión lixiviada se filtró con un embudo Büchner conectado a un kitasato y a una bomba de vacío, la cola(o cake) se lavó con solución amoniacal de concentración 30 g/Lpara despojar el licor embebidoen el sólido hasta que el color azul del filtrado se tornara transparente.
Para medir el potencial redox (Eh), se pesaron entre 5 y 6 g de mineral reducido en atmósfera inerte directamente en un beaker de 100 mL, enrazado a 80 mL de licor carbonato amoniacal, con90 g/Lde amoníaco y relación NH3/CO2 igual a 1,8. Luego de agitarcon una varilla de vidrio se leyó el potencial con un pHmetro/mVCrisonPH25, L-429, electrodo 5055 combinado Platino-Calomel. El punto de lectura de Eh fue análogo al punto crítico de la velocidad de sedimentación.
Los análisis químicos se realizaron en el laboratorio de la Unidad de Proyecto Nicaro del Centro de Investigaciones del Níquel, Cuba, aplicando los métodos: volumétrico, gravimétrico, potenciométrico y Espectrofotometría de Absorción Atómica.
Las extracciones (Ex) de los metales se determinaron por la ecuación (7).
Resultados y discusión
Extracción potencial en los hornos de planta piloto e industrial
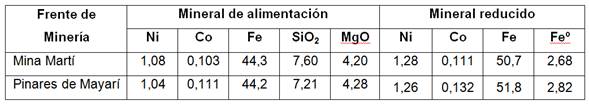
El potencial redox se relaciona con la concentración de hierro ferroso (FeO) en el mineral reducido (MR), tal como una función inversa con alta calidad de ajuste,según el coeficiente de determinación (R2). Se obtuvo dicha interacción, con muestras de mineral reducido de los frentes de minería: Mina Martí y Mina Pinares de Mayarí, de la planta productora en Nicaro, (tabla 1).
El mineral reducido del frente Pinares de Mayarí, procesado en el horno industrial (R2: 95,2%), tuvo un potencial redox semejante a la muestra tecnológica procesada en el horno de la planta piloto(R2: 98,6%), y fueron más electropositivos que el obtenido en el horno selas (R2: 98,4%); y a su vez, estos resultaron más electronegativos que el mineral de Mina Martí (R2: 99,0%) procesado en el horno industrial. Los valores diferentes de potencial redox, para una misma concentración de FeO, pueden deberse a fases de partículas que se forman en la reducción con diferentes características químicas-físicas como: tamaño promedio, porosidad, cristalinidad, microestructura y reactividad.
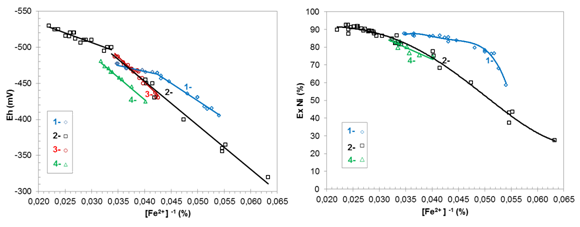
Fig.3 Interacción del hierro (II) en el mineral reducido con: a) potencial redox b) extractable de níquel
Por otra parte, los extractables de níquel se relacionan con el inverso de la concentración de Fe(II)en el MR. Las muestras de ambos frentes de minería aportaron semejantes extractables para el mismo Fe(II); aunque se debe considerar la incidencia de otros factores como: la composición química y distribución granulométrica del mineral, el perfil térmico, la dosis de aditivo utilizado, el tiempo de retención, la composición de la atmósfera reductora, condiciones técnicas de los hornos y el accionar del hombre.
En el horno selas se obtuvieron mayores extractables de níquel para el intervalo comprendido del Fe(II); aunque en planta piloto, para potencial redox entre -520≤Eh≤-500 mV, se alcanzaron los superiores extractables entre 89 % y 92,4 %.
La figura 3 sugirió considerar las variables potencial redox y concentración de hierro (II) en el mineral reducido muestreado en los enfriadores de mineral, para el escalado de los resultados de procesamiento en el horno selas y los hornos de planta piloto e industrial.
Perfiles de extractable en el horno industrial
Durante la arrancada y puesta a punto deun horno de la planta productora de níquel en Nicaro, con mineral de Pinares de Mayarí, se tomaron muestras en los hogares para realizar la caracterización y determinar perfiles de extractables y de potencial redox, (figura 4).
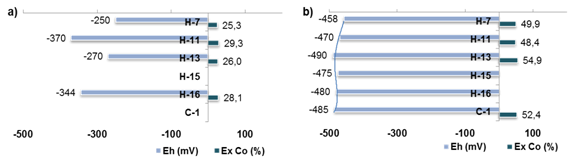
Fig. 4 Perfil de extractable de cobalto y potencial redox en los hogares (H) y el enfriador de mineral (C-1), horno industrial en Nicaro,a) arrancadab) operación
Los resultados obtenidos pueden ser de interés para las investigaciones y la operación industrial, al apreciarse un cambio en los extractables de cobalto en correspondencia con la variación del potencial redox, en la medida que el mineral desciende de un hogar a otro; sin embargo, deben considerarse otras variables como las fases formadas y la reactividad. En cuanto al extractable de níquel, se debe destacar la relación directamente proporcional con el níquel metálico.
Elementos para la medición del potencial redox
El potencial redox es una variable de interés para el análisis del proceso en las plantas de hornos de reducción y de lixiviación; pero la toma de la muestra, la preparación de la suspensión y el punto de lectura de Eh, deben realizarse rigurosamente para que los resultados sean repetibles y reproducibles. Es esencial evitar la re-oxidación del mineral reducido; y se deben mantener aproximadamente constantesla relación líquido-sólido y la concentración de iones en el licor.
Al realizar la medición en la suspensión de mineral laterítico reducido, muestra spot, se pudo apreciar:
a) Un valor mínimo (potencial más electronegativo) estable durante un tiempo razonable y se obtuvo la lectura del instrumento.
b) Un valor mínimo que comenzó a aumentar, a intervalos aproximadamente constantes, hasta estabilizarse, por ejemplo, de -450 mV a -400 mV, y,
c) El potencial se fue haciendo más electronegativo en los primeros 10 a 20s; posteriormente, continuó disminuyendocon una variación cada vez menor, debido a las reacciones competitivas de oxihidrólisis del hierro (FeO y Feº) en el licor carbonato - amoniacal, bajo el efecto del oxígeno ambiental y el O2 disuelto en la muestra, por ejemplo, de -405mV a -475 mV a los 20 s, y luego hasta -515 mV a los 130 s, (figura 5a).
Entonces, es recomendable registrar las mediciones de potencial para la toma de decisiones con respecto al punto de lectura, ya sea el valor mínimo apreciado en el instrumento, o considerando el valor análogo al punto de velocidad de sedimentación crítica, de acuerdo a la situación c), (-478 mV, figura 5a).
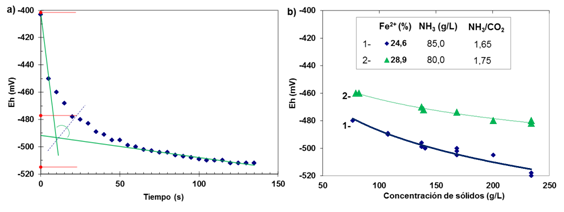
Fig. 5 El potencial redox, a) lecturas cada 5 s en una suspensión de mineral laterítico del método QT, Mineral de Mina Martí, b) Dependencia de la concentración de sólidos
La concentración de sólidos que incrementa el Fe(II) en solución, entreotros iones disueltos en el licor de lixiviación, varían en potencial redox, luego, estas variables también deben considerarse para realizar las mediciones y obtener regularidades para el control del flujo de aire en el proceso de lixiviación, (figura 5b).
Conclusiones
Se obtuvieron extractables de níquel entre 89 % y 92 % para potencial redoxmenor que -500 mV, con mineral laterítico del frente de minería“Pinares de Mayarí” reducido en el horno de planta piloto.
La relación entre el inverso de la concentración de hierro ferroso en el mineral reducido, con el potencial redox y el extractable, sugiereasumir la medición de potencial como un ensayo físico para estimar la extracción potencial que se entrega a lixiviación; lo cual resultó válidoal procesar el mineral en horno selas, a escala de planta piloto e industrial.