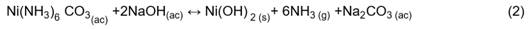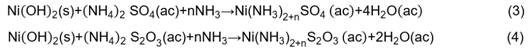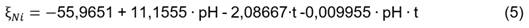Introducción
La demanda de hidróxido de níquel(II) como precursor del óxido para baterías recargables es cada vez mayor, debido al incremento del uso de vehículos eléctricos e híbridos que reducen el consumo de combustible fósil y la emisión de gases perjudiciales al medio ambiente.1,2,3
Este hidróxido, además se emplea en la producción de las baterías que se utilizan en los teléfonos inalámbricos y computadoras portátiles. En su forma hidratada se emplea comúnmente en la producción de sales y óxidos de níquel.4,5,6,7
El hidróxido de níquel (II), Ni(OH)2, se obtiene por precipitación química cuando reacciona una sal de níquel acuosa con una base y se caracteriza por tener contenidos de níquel superiores a 55 % con bajos porcentajes de impurezas aniónicas. A partir del tratamiento de minerales mediante la lixiviación ácida a alta presión, HPAL, también se logra un hidróxido, pero su contenido de níquel es alrededor del 40 %.8,9,10
Así mismo, en la tecnología de lixiviación carbonato amoniacal de minerales lateríos, o proceso Caron, se obtienen fluidos atractivos para la síntesis de hidróxido de níquel (II). Dicha tecnología consta de las etapas fundamentales siguientes: 11
Preparación y reducción del mineral laterítico.
Lixiviación del mineral reducido, obtención del licor producto rico en compuestos complejos de níquel y cobalto.
Precipitación del cobalto y obtención del licor producto purificado.
Destilación del licor producto purificado y producción del Carbonato Básico de Níquel (CBN).
Calcinación del CBN y sinterización.
A partir del licor efluente generado durante la producción de CBN, algunos autores reportan la síntesis del Ni(OH)2: Mediante la precipitación con NH4OH y NaOH, se obtuvo un hidróxido con una concentración de níquel entre 52,0 y 60,7 %. Por otro lado, a través de la electrocoagulación, el producto presentó un 35,71 ±2,13 % de níquel y 6,05 ±0,83 % de aluminio. En ambos procesos (precipitación y electrocoagulación), se estudió la influencia del pH y el tiempo de reacción sobre la eficiencia de precipitación y se logró precipitar entre 61,4 y el 99,6 % del níquel.4,12,13,14
La preparación de hidróxido de níquel (II) a partir del licor producto de la lixiviación carbonato amoniacal es un tema poco abordado. La patente US 2,879,137 refiere fundamentalmente el uso de dos etapas en el esquema tradicional de la tecnología de lixiviación carbonato amoniacal, consistentes en la predestilación del licor de lixiviación y precipitación de hidróxido de níquel, con el empleo de un hidróxido de metal alcalino o alcalinotérreo como agente precipitante. Este esquema muestra las ventajas técnicas de separar los iones de cobalto presentes en el licor producto; pero refiere un consumo de agente precipitante que varía en un amplio intervalo (3,6 a 27 g de precipitante / g de níquel), no especifica la duración del proceso, ni la calidad del producto.15
La obtención de hidróxido de níquel para la fabricación de baterías recargables mediante la tecnología carbonato amoniacal, es una de las alternativas que se estudian para diversificar la producción en la Empresa Productora de Níquel Ernesto Che Guevara (ECG), Cuba; sin embargo, las investigaciones previas no contemplan las potencialidades del licor producto purificado para su aplicación como materia prima base.16
De acuerdo con los antecedentes de la investigación, este trabajo tuvo el propósito de determinar los parámetros para la pre-destilación del licor producto y su acondicionamiento para la síntesis del hidróxido de níquel (II) a escala de laboratorio; así como analizar la influencia del pH y el tiempo de reacción en la eficiencia de precipitación del níquel con hidróxido de sodio. El precipitado se caracterizó para comprobar la precipitación del níquel.
Materiales y métodos
Materiales
Se tomó una muestra de licor producto purificado, luego de la precipitación de cobalto en la planta de Lixiviación de la Empresa Productora de Níquel (ECG) de Cuba. El licor tuvo una densidad de 1,012 kg/m3, pH 9,92, concentración de níquel 7,83 g/L, amoníaco 53,49 g/L, y otras especies metálicas en baja concentración, similar a la reportada por otros autores (tabla 1).17,18
Para la precipitación química de Ni(OH)2 se preparó una disolución de hidróxido de sodio con agua destilada a concentración de 88 g/L.
Equipos
La destilación se realizó en una instalación experimental compuesta por un reactor encamisado provisto de un agitador y un termostato (figura 1a); por su parte, para la precipitación del hidróxido de níquel se utilizaron fundamentalmente un reactor con agitación, el medidor de pH y una bomba peristáltica (figura 1b).
a) pre-destilación del licor descobaltizado: 1- Termostato, 2- Agitador, 3- Impelente, 4- Reactor encamisado; b) Precipitación de hidróxido de níquel: 1- Agitador, 2- Impelente, 3- Reactor, 4- Medidor de pH, 5- Bomba peristáltica, 6- Probeta para colectar la pulpa de Ni(OH)2, 7-Embudo, 8- Kitasato, 9-Bomba de vacío
La composición química de la materia prima, productos sólidos y líquidos se determinó mediante la técnica de absorción atómica. La medición de pH se realizó con un equipo portátil marca Hanna con electrodo combinado de doble unión, relleno de gel y provisto de sonda de acero inoxidable para medir la temperatura.
Procedimiento experimental
Se siguieron los procedimientos de Bare (1959) y Revé (2018), como se refiere a continuación: (15,19)
El amoníaco se removió parcialmente del licor carbonato amoniacal descobaltizado mediante pre-destilación y se obtuvo el licor para la síntesis del Ni(OH)2. Luego, se efectuó la precipitación química con hidróxido de sodio de la cual se obtuvo el hidróxido de níquel (II) y un licor residual (figura 2).
Pre-destilación de licor producto descobaltizado
Se realizó a 85 ºC durante 45 y 60 min, con el objetivo de disminuir la concentración de amoníaco, según los pasos siguientes:
Filtrar el licor descobaltizado (solución) y realizar análisis químicos para determinar el contenido de: Ni, Co, Fe, Cu, Zn, Mg, Mn y NH3.
Verter en el reactor 1,5 litros de solución y agitar a una temperatura de 85 0C.
Interrumpir la predestilación a los 45 min de haberse alcanzado la temperatura de trabajo.
Enfriar la solución.
Envasar 25 mL de licor para análisis químico.
Precipitación de hidróxido de níquel
Verter en el reactor 1,5 L el licor de síntesis. Agitar.
Adicionar solución de hidróxido de sodio a 88 g/L mediante una bomba reguladora de flujo para precipitar el contenido de níquel.
Medir pH continuamente hasta alcanzar el pH de trabajo.
Al alcanzar el pH de trabajo, suspender la alimentación de hidróxido de sodio hasta lograr el tiempo de trabajo. Medir el pH cada 10 min.
Filtrar la suspensión.
Lavar la torta en cuatro etapas con agua destilada, con una relación agua/sólido de 4/1 a 70 0C.
Pesar la torta. Envasar 25 mL de licor para análisis químico.
Secar la torta a 80 0C. Pesar.
Envasar 5 g para análisis químico.
Medir el consumo de hidróxido de sodio.
Diseño de experimentos
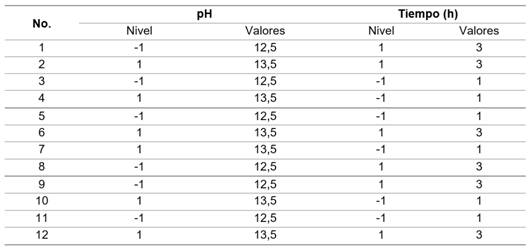
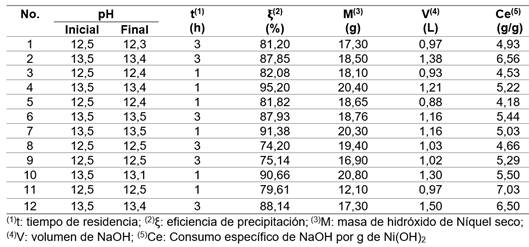
La precipitación de níquel se realizó mediante un diseño experimental factorial multinivel, dos factores (pH y tiempo de retención), dos niveles y dos réplicas, para un total de 12 corridas experimentales (tabla 2). 4,20 El orden de los experimentos fue aleatorio, se utilizó el programa Statgraphics XV.II.
Variable respuesta: Eficiencia de precipitación del hidróxido de níquel (%)
La eficiencia de precipitación de níquel se calculó mediante la ec. (1):
donde:
ξ: Eficiencia de precipitación de Ni, %
xNi: Concentración de níquel en el precipitado, fracción masa
M: Masa de sólido seco precipitado, g
VD: Volumen de licor inicial (licor producto descobaltizado), L
CNi: Concentración de Ni en el licor inicial, g/L
Resultados y discusión
Caracterización de los productos de síntesis
La pre-destilación del licor carbonato amoniacal, a 85 ºC durante 45 min, produjo una remoción del amoníaco (NH3) en un 39 %; el hierro (Fe) 73 %, manganeso (Mn) 24 % y el magnesio (Mg) 17,6 %. El licor de síntesis presentó una concentración de NH3 32,58 g/L, níquel 8,92 g/L y concentraciones de otros iones metálicos o impurezas inferiores a 0,1 g/L (tabla 3).
Para un tiempo de pre-destilación de 60 min, la concentración de amoníaco se redujo hasta 18,79 g/L; lo que no resultó favorable para la investigación. La eliminación de la mayor parte del NH3 presente en la solución propicia el aumento de la precipitación de impurezas como hierro y manganeso, que llevan consigo pequeñas cantidades de níquel y afectan la recuperación total de níquel.15
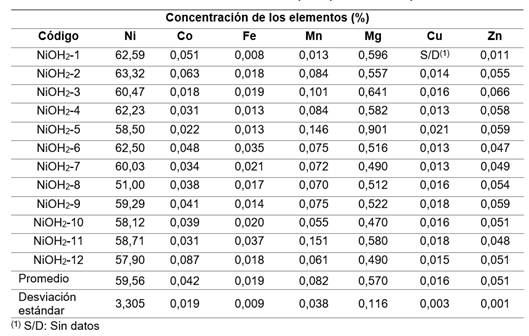
Como resultado del proceso de precipitación se obtuvo un hidróxido cuya concentración promedio de níquel (+/-desviación estándar) fue de 59,56 (+/- 3,305) % (tabla 4).
La concentración de níquel resultó inferior al valor teórico del 63,4 %.21
Este hecho se atribuye a la presencia de otras especies metálicas de cobalto, manganeso, hierro, magnesio, cobre y zinc o a la probable existencia de impurezas aniónicas. La concentración de níquel promedio del hidróxido fue de 59,56 % y de Mn 0,082 %, en comparación con la alcanzada por Cisneros (2015) y Revé (2018) es mayor en el caso del níquel; 56,39 % y 52,59 % y menor en el caso del Mn; 0,52 % y 0,22 %.4,19
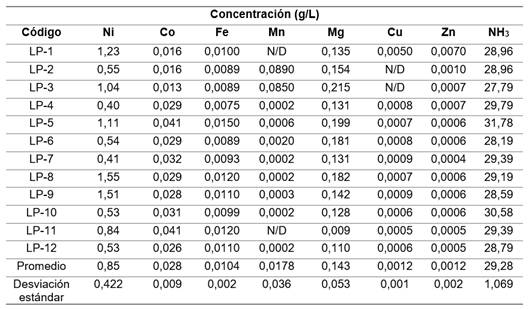
Por su parte, el licor residual luego de la precipitación del hidróxido, presentó una concentración promedio (+/-desviación estándar) de níquel de 0,85 (+/- 0,422) g/L (tabla 5).
Como se puede observar en la tabla 5, el licor residual de la precipitación de hidróxido de níquel(II) presentó concentraciones remanentes de especies metálicas menores o iguales que 1,55 g/L, por lo que resulta conveniente realizar un tratamiento secundario para la recuperación, como es la electrocoagulación 12, adsorción 22, coagulación-floculación 23 o su posible reincorporación a la precipitación química con hidrosulfuro de amonio.
La mayor eficiencia de precipitación de níquel de un 92,41 (+/- 2,44) % se obtuvo a un pH igual a 13,5 y tiempo 1 h, para un consumo específico de 5,25 (+/- 0,24) g NaOH por g de Ni(OH)2 precipitado (tabla 6).
Sin embargo, a pH 12,5 y tiempo de una hora se alcanzó una eficiencia entre 79 y 82 %.
El consumo específico de NaOH fue superior al estequiométrico (Ce=1,16 g/g) que se determinó a partir de la reacción (2).
La diferencia entre el consumo real y teórico de NaOH puede estar asociada a la presencia de compuestos oxidados de azufre, formados durante los procesos de lixiviación y precipitación de cobalto, estos compuestos presentes en el licor aumentan los gastos por consumo de reactivo de precipitación.11,24
Por otro lado, para un tiempo igual a 3 h, la eficiencia de precipitación resultó baja para ambos valores de pH (entre 74 y 88 %, respectivamente).
Influencia de las variables principales sobre la eficiencia de precipitación
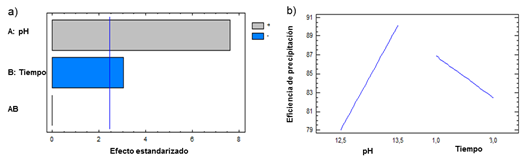
El pH es la variable independiente que más influye en la precipitación del níquel, con una relación directa. Al aumentar la concentración de iones hidróxido provenientes del NaOH, aumenta la eficiencia de precipitación (Figura 3a).
En cambio, el tiempo de reacción tiene influencia negativa en la precipitación de níquel, probablemente debido a que con el transcurso del tiempo ocurre la disolución del níquel en presencia de iones sulfato (SO4 2-) y tiosulfato (S2O3 2-), por la formación de compuestos complejos en presencia de sulfato de amonio (reacciones 3 y 4).11
El modelo ajustado para el cálculo de la eficiencia de precipitación de níquel en función del pH y el tiempo se muestra en la ecuación (5):
De acuerdo con el valor del estadístico R-Cuadrado, el modelo explica el 88,83 % de los valores de eficiencia de precipitación de níquel.
Se optimizó la ecuación (5) y se determinó la combinación de los niveles de los factores que maximiza la eficiencia de precipitación sobre la región indicada, ratificando que se obtienen los mejores resultados a pH=13,5 y t=1 h con una eficiencia de precipitación máxima igual a 92,4 %.
Los resultados demostraron que en el proceso de obtención de hidróxido de níquel, mediante predestilación y precipitación con hidróxido de sodio, a partir del licor producto descobaltizado de la ECG, es posible lograr una eficiencia de precipitación de níquel superior al 90 %; que puede estar limitada por la presencia de especies iónicas de azufre.