Introducción
La reproducción canina ha experimentado un aumento de interés en los últimos años a nivel mundial, a tal punto que la inseminación artificial con semen fresco es una práctica rutinaria; sin embargo, los resultados de la crioconservación de semen de perro (Canis lupus familiaris) no cubren las expectativas esperadas, pues factores externos como el procesamiento, dilución y congelación de la muestra (Sánchez et al., 2017), así como, factores propios de la especie; cantidad, fracción y pureza del eyaculado (Strzezek y Fraser, 2009), afectan la calidad seminal post descongelación.
Esta calidad de la muestra seminal colectada expresada en pureza es esencial en el proceso de crioconservación, la cual se ve complicada pues el perro eyacula tres fracciones, la primera y tercera procedentes de la glándula prostática que no poseen espermatozoides, pero contienen componentes que interfieren en el proceso de congelación. La segunda fracción es rica en espermatozoides y es la que se debería colectar (Goericke et al., 2011).
Separar estos componentes nocivos del eyaculado (primera y tercera fracción) de la porción rica en espermatozoides (segunda fracción), ha sido motivo de varios estudios, algunos de ellos han utilizado la centrifugación mecánica, que si bien ha permitido obtener mayor cantidad de espermatozoides, su calidad sigue siendo baja (Chatdarong et al., 2010). En busca de mejorar la calidad espermática Morrell y Rodriguez (2016), aplicaron centrifugación coloidal para separar espermatozoides vivos de aquellos en diferentes etapas de madurez, muertos y células no espermáticas. Concluyeron que esta técnica permitía obtener una muestra seminal post centrifugación coloidal con alto grado de espermatozoides viables y puros, lo cual puede contribuir a mejorar los resultados de crioconservación.
Otro de los factores que puede afectar la calidad del semen post descongelación son los crio-protectores. El glicerol es el más usado en las diferentes especies de interés zootécnico y se agrega en dos formas diferentes: en un solo paso, seguido de un enfriamiento en 4° C durante 1 a 2 h (Rota et al., 1999) o en dos fases durante un período total de 1,5 a 2 h (Peña y Linde, 2000). Sin embargo, el glicerol al tener un peso molecular alto es tóxico en concentraciones elevadas y si bien en otras especies ha sido muy estudiado, en el perro los datos descritos son contradictorios (Belala et al., 2016); por lo tanto, es necesario investigar la dosis adecuada de glicerol que se debería utilizar para la criopreservación de semen del perro.
El objetivo del presente trabajo fue valorar la centrifugación coloidal como método de selección y purificación espermática, aplicado previo al proceso de crio preservación con tres concentraciones diferentes de glicerol (4; 6 y 8 %) en semen de perros.
Materiales y métodos
La investigación se realizó en el laboratorio de Biotecnología de la Universidad de Cuenca-Ecuador, coordenadas 3° 4’ 53,93’’ latitud sur y 79° 4’ 39,59’’ longitud oeste. Altitud 2 671 m s.n.m., pluviosidad anual es de 800 y 2 000 mm, humedad relativa del 80 % y temperatura de 7 y 12° C .
Se colectaron 12 muestras seminales provenientes de 6 perros, mestizos, de talla mediana, clínicamente sanos, condición corporal (CC) de 5 escala 1-9 (Baldwin et al., 2010), edad entre 3 a 5 años, cuyos eyaculados cumplieron con los parámetros mínimos determinados para que la muestra fuese crioconservada (Restrepo et al., 2009). La colecta de semen se realizó mediante compresión mecánica (manipulación digital). Se recolectó las dos primeras fracciones del eyaculado. Estas 12 muestras seminales fueron divididas en dos alícuotas, una para cada grupo experimental (Grupo 1 y Grupo 2).
Se realizaron dos experimentos, en el primero se evaluaron dos tipos de centrifugaciones previa al proceso de congelación de la muestra seminal colectada (Grupo 1; Grupo 2):
Grupo 1: La muestra seminal fue centrifugada convencionalmente a 700 g/10 min.
Grupo 2: La alícuota de la muestra seminal de este grupo fue colocada en una columna de Percoll (60 %) y centrifugada en un primer momento a 700 g/10 min . Luego el pellet se suspendió en medio de fecundación in vitro y centrifugado a 350 g/10 min .
En el experimento 2 se probaron tres concentraciones de glicerol (4; 6 y 8 %) como crioprotector para la congelación de las muestras seminales de los grupos 1 (centrifugación convencional) y grupo 2 (centrifugación coloidal) del experimento 1. Se empaquetaron 12 pajuelas de 0,25 cm3 por cada grupo de glicerol (G1a; G1b; G1c; G2a; G2b; G2c) (Fig. 1), lo cual permitió evaluar post descongelación 72 muestras en total.
Diluyentes
Se preparó diluyente A con 0,13 g de ácido cítrico; 0,24 g de tris; 0,1 g de fructuosa; 2 ml de yema de huevo y 8 ml de agua ultra pura. El diluyente B fue preparado agregando al diluyente A glicerol hasta tener las concentraciones de 4; 6 y 8 %.
Preparación de las dos alícuotas
Al volumen total del eyaculado se le adicionó diluyente A en relación 1:1. De esta dilución se tomó 100 μl para la valoración microscópica. El volumen restante fue dividido en 2 alícuotas similares, la primera para el grupo 1 (centrifugación convencional) y la segunda para el grupo 2 (centrifugación con Percoll 60 %).
Columna de Percoll 60 %
Se tomó 900 μl de Percoll puro atemperado (37° C) y se colocó en un tubo eppendorf, luego se añadió 100 μl de medio TALF 10 x. De la mezcla anterior se aspiró 335 μl y se depositó en un tubo eppendorf, al cual se incorporó 165 μl de medio FIV-SOF, esto permitió tener Percoll al 60 %.
Centrifugación
La alícuota del grupo 1 (muestra seminal) fue centrifugada a 700 g/10 min, luego se tomó el pellet (250 μl) y se adicionó diluyente A en relación 1:1.
La alícuota del grupo 2, fue sometida a un proceso de selección espermática mediante centrifugación en una columna de Percoll (60 %) preparada con anterioridad, esta centrifugación se realizó a 700 g/10 min . Se tomó el pellet (250 μl) y se colocó en 500 μl de medio de fertilización (FIV), se procedió a centrifugar a 350 g/10 min, esta permitió retirar los residuos del Percoll. Finalmente, se tomó 250 μl de pellet y se le adicionó diluyente A en relación 1:1.
Evaluación de la calidad seminal
Una vez diluida la muestra inicial en relación 1:1 se tomó 100 μl y se realizó la valoración de la calidad espermática pre congelación de acuerdo a lo descrito por Restrepo et al., (2009), los parámetros evaluados fueron:
Movilidad individual progresiva (MIP): Se tomó 10 μl de la muestra seminal diluida 1:1 y se observó al microscopio con aumento 40X. La valoración se expresó en por ciento.
Vitalidad: Se valoró mediante la tinción de eosina nigrosina, colocando 5 μl de muestra seminal y 5 μl de eosina-nigrosina, se mezcló y se procedió a realizar un frotis, luego se observó en microscopio 40x.
Morfología: Se evaluaron 100 espermatozoides y se clasifican en normales y anormales. Fueron considerados anormales aquellos que presentaron alteraciones en la cabeza, pieza media y cola.
Concentración: Se extrajo 5 µl de la muestra seminal y se colocó en un tubo eppendorf, se añadió 95 μl de agua y se mezcló. Luego se tomó 10 μl de la mezcla y se colocó en la cámara de Neubauer, se dejó reposar un minuto y se procedió a contar 5 cuadrantes.
Integridad y funcionalidad de membrana (HOS): Para la evaluación de este parámetro se aplicó el test de HOS; que consiste en tomar 20 µl de semen diluido y 100 µl de solución de Host en tubos eppendorf, se homogenizó la mezcla y se mantuvo en baño María por 30 min, finalmente se colocó una gota del preparado en un portaobjetos y se observó al microscopio, valorando cuántos espermatozoides presentaban colas dobladas o enrolladas.
Fase de equilibrio
Las tres alícuotas (G1a; G1b; G1c) del grupo 1 (centrifugación convencional) y las tres (G2a; G2b; G2c), del grupo 2 (centrifugación coloidal), fueron ubicadas en un recipiente con agua a 15° C/30 min, luego se colocadas en la refrigeradora a 5° C/1 h . Con este procedimiento se logró bajar la temperatura a 5° C manteniendo las muestras seminales únicamente con el diluyente A.
Adición del crioprotector (diluyente B)
Las alícuotas de diluyente B que contenía glicerol al 4; 6 y 8 % fueron colocadas 1 h en el refrigerador para que bajen su temperatura a 5° C .
Luego del tiempo de equilibrio de las alícuotas de los grupos 1 y 2 que contenían las muestras seminales con diluyente A, se les adicionó el total del diluyente B que correspondía, pero fraccionado en cuatro partes cada 20 min .
Empaquetamiento
Se utilizaron pajillas de 0,25 cm3, las cuales fueron colocadas 30 min antes en la refrigeradora para que se encuentren a 5° C antes de empaquetar. Se cargó manualmente las pajuelas dentro del refrigerador para mantener la cadena de frío. El sellado se realizó con balines metálicos.
Congelación
Las pajuelas fueron colocadas en una rejilla a 5 cm de altura de nitrógeno líquido por 10 min . Luego fueron introducidas en nitrógeno líquido a -196° C .
Análisis estadístico
Se utilizó un experimento bifactorial de 2x3, en diseño de bloques al azar (DBA), donde los 6 bloques estaban constituidos por cada perro, del cual se le extrajo dos muestras seminales. El análisis estadístico fue realizado en el programa estadístico SPSS para Windows versión 25®. Se analizaron los datos por análisis de varianza y la prueba de rango de Tukey al 5 % de significancia. En el primer momento se consideraron las tres instancias de valoración seminal (inicial, pre y pos congelación). En un segundo se valoró las tres concentraciones de glicerol (4; 6 y 8 %), como crioprotector en las muestras seminales que previamente fueron centrifugadas por dos métodos diferentes, convencional (G1) y columna de Percoll (G2).
Resultados y discusión
En el presente trabajo al aplicar centrifugación convencional (Grupo 1) la concentración espermática obtenida no difiere estadísticamente de la muestra seminal inicial (P > 0,05). Sin embargo, el Grupo 2 (centrifugación con Percoll 60 %), presentó menor cantidad de espermatozoides luego del proceso de centrifugación comparado con la muestra inicial y el grupo 1 (P < 0,05) (Fig. 2A). Esta reducción del número de espermatozoides al realizar centrifugación coloidal se encuentra descrita por Gharajelar et al. (2016) quienes afirman que la presión de selección espermática es mayor y el número de espermatozoides recuperados luego del proceso es menor, pero de mejor calidad. Similares resultados fueron obtenidos por Macías et al. (2009), al aplicar centrifugación coloidal observando que la concentración inicial de 100 x 106/ml disminuyó a 20 x 106 espermatozoides/ml.
En la actualidad la centrifugación convencional se emplea para eliminar la fracción prostática del eyaculado, pero esta podría causar daños estructurales en el acrosoma y en la membrana plasmática del espermatozoide, reduciendo considerablemente el movimiento espermático (Rijsselaere et al., 2002). Este concepto podría explicar por qué la motilidad individual progresiva (MIP), de los espermatozoides del grupo 1 (convencional) valorada luego del proceso de centrifugación disminuyó en un 30 %, aproximadamente en relación a la muestra seminal inicial y la del grupo 2 (Percoll 60 %) (Fig. 2B). Estos resultados concuerdan con lo mencionado por Dorado et al. (2013) quienes expresan que la aplicación de centrifugación coloidal en semen de canino mejoró significativamente (P < 0,001) la MIP. El incremento de la motilidad en G2 podría atribuirse al coloide empleado para la centrifugación, el cual según Morrell y Rodriguez (2016), permite seleccionar una subpoblación de espermatozoides móviles con morfología normal y membranas intactas. Sin embargo, otros autores como Varela et al. (2015), expresan que la centrifugación per se genera disminución en el movimiento espermático, lo que pudo haber afectado a los espermatozoides del grupo 1 de este experimento (Fig. 2B).
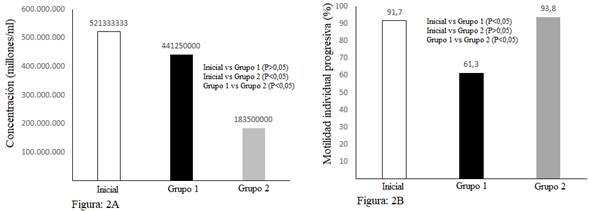
Fig. 2A. Promedios de la concentración inicial vs grupo 1 (convencional) y grupo 2 (Percoll 60 %) luego del proceso de centrifugación. Fig. 2B. Promedio del porcentaje de la motilidad individual progresiva (MIP) inicial vs la del grupo 1 y grupo 2 post centrifugación. Prueba de Tukey al 5 %.
El tipo de centrifugación utilizado en el experimento G1 (convencional) y G2 (Percoll 60 %) no incidió sobre el número de espermatozoides vivos obtenidos (P > 0,05) (Fig. 3A). Resultados similares de vitalidad espermática fueron reportaron por Restrepo et al. (2011) al valorar diferentes concentraciones de coloides utilizados durante la centrifugación. En contraposición existen trabajos que describen valores mayores de vitalidad espermática cuando se utiliza Percoll durante la centrifugación (Crespo et al., 2015; Dorado et al., 2013; Gálvez et al., 2015).
Comportamiento similar se observó al valorar malformaciones (anormalidades) en las muestras iniciales y las obtenidas en los G1 (convencional) y G2 (Percoll 60 %) (Fig. 3B). Datos que concuerda con lo expresado por Gálvez (2015); pero difieren con lo descrito por Dorado et al. (2013) quienes determinaron que el método convencional de centrifugación incrementa el número de anormalidades espermáticas al comparar con una centrifugación coloidal (P < 0,05). Si bien, en el presente trabajo no existe diferencia estadística entre los grupos 1 y 2, se pudo observar que los del grupo 2 presentaban menor por ciento de malformaciones.
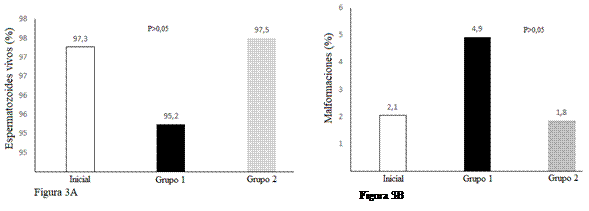
Fig. 3A. Porcentaje de espermatozoides vivos comparados en las muestras: inicial, grupo 1 (convencional) y grupo 2 (Percoll 60 %), luego del proceso de centrifugación. Fig. 3B. Porcentaje de malformaciones presentes en la muestra inicial, grupo 1 y grupo 2 luego del proceso de centrifugación. Prueba de Tukey al 5 %.
La motilidad individual progresiva (MIP) post descongelación en el Grupo 1 (centrifugación convencional) no presenta diferencias estadísticas (P > 0,05) entre los grupos con diferentes concentraciones de glicerol utilizado como crioprotector (G1a=4 %; G1b=6 %; G1c=8 %) (Fig. 4A), datos similares a los descritos por Silva et al. (2002); Herrera et al. (2012); Carlotto et al. (2011) y Uribe et al. (2011) quienes obtuvieron resultados no significativos (P > 0,05), respecto al porcentaje de motilidad individual progresiva post descongelación cuando se evaluó el uso de diferentes concentraciones de glicerol.
En contraposición, las muestras seminales que recibieron centrifugación con Percoll 60 % (Grupo 2), y que fueron congeladas con diferentes concentraciones de glicerol (G2a=4 %; G2b=6 %; G2c=8 %) sí presentaron diferencias estadísticas (P < 0,05), esto concuerda con lo descrito por Restrepo et al. (2011), quienes obtuvieron diferencias estadísticas al aplicar dos concentraciones distintas de glicerol. Además, mantiene concordancia con lo expresado por autores como Mota et al. (2011) y Gharajelar et al. (2016), quienes afirman que la adición de glicerol al proceso de crioconservación, aumenta significativamente el porcentaje de motilidad post descongelación.
Al valorar el porcentajes de espermatozoides vivos post descongelación se determinó que difieren estadísticamente (P < 0,05) entre los grupos con diferentes concentraciones de glicerol de las muestras seminales que fueron centrifugadas previamente en forma convencional (G1) y aplicando Percoll al 60 % (G2) (Fig. 4B). Estos datos son concordantes con los obtenidos por Uribe et al. (2011) y Cheuquemán et al. (2018) que consiguieron resultados estadísticamente significativos al aplicar tres concentraciones distintas de glicerol, afirmando que el proceso de crioconservación disminuye la vitalidad espermática post descongelación. Sin embargo, están en contraposición a lo descrito por Cardoso et al. (2003) quienes al aplicar tres concentraciones (4; 6 y 8 %) de glicerol lograron porcentajes de vitalidad similares.
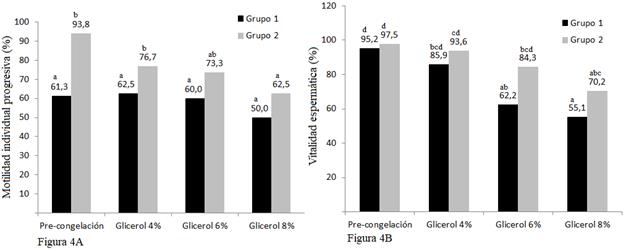
Fig. 4A. Promedio de la motilidad individual progresiva (MIP) valorada post descongelación al utilizar tres concentraciones diferentes de glicerol (G1a=4 %; G1b=6 %; G1c=8 %) en las dos muestras seminales centrifugadas previamente en forma diferente: Grupo 1 (convencional) y Grupo 2 (Percoll 60 %). Fig. 4B. Promedio de espermatozoides vivos valorados pos descongelación al utilizar tres concentraciones diferentes de glicerol (G1a=4 %; G1b=6 %; G1c=8 %) en las dos muestras seminales centrifugadas previamente en forma diferente: Grupo 1 (convencional) y Grupo 2 (Percoll 60 %). Prueba de Tukey al 5 %. ab= diferencia entre grupos
Los porcentajes de anormalidades obtenidos en los Grupos 1 y 2 presentan diferencias estadísticas (P < 0,05) entre sí (Fig. 5A), valores análogos a los obtenidos por Silva et al. (2002) y Cardoso et al. (2003), donde compararon concentraciones de glicerol al 4; 6 y 8 % presentando diferencias estadísticas (P < 0,05), al igual que el estudio realizado por Restrepo et al. (2011), todo esto en contraposición con Uribe et al. (2011), que en su estudio obtuvo un valor de P > 0,05 en la aplicación de distintas concentraciones de glicerol.
La prueba de HOS proporcionó porcentajes similares (Fig. 5B) de espermatozoides que reaccionaron positivamente entre los diferentes grupos (P > 0,05), estos resultados son similares a los determinados por Carlotto et al. (2011), quienes no obtienen diferencias estadísticas al aplicar distintas concentraciones de glicerol en diversos tiempos de congelación. Sin embargo, son valores contrarios a los obtenidos por Restrepo et al. (2011), que al aplicar diferentes concentraciones de glicerol encontraron diferencias significativas, al igual que lo descrito por Sánches et al. (2002), al utilizar el glicerol como crioprotector.
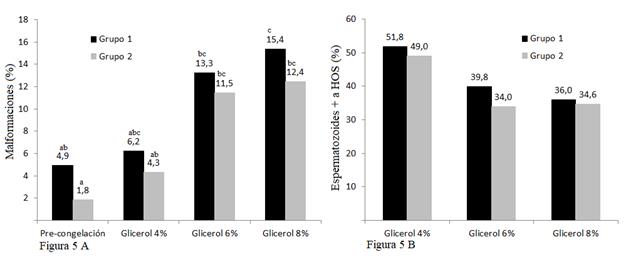
Fig. 5A. Promedio de malformaciones espermáticas valoradas pre congelación y post descongelación al utilizar tres concentraciones diferentes de glicerol (G1a=4 %; G1b=6 %; G1c=8 %) en las dos muestras seminales centrifugadas previamente en forma diferente: Grupo 1 (convencional) y Grupo 2 (Percoll 60 %). Fig. 5B. Porcentaje de espermatozoides que reaccionaron positivo a la prueba de HOS post descongelación en las tres concentraciones diferentes de glicerol (G1a=4 %; G1b=6 %; G1c=8 %) en las dos muestras seminales centrifugadas previamente en forma diferente: Grupo 1 (convencional) y Grupo 2 (Percoll 60 %). Prueba de Tukey al 5 %. ab= diferencia entre grupos.
Conclusiones
La centrifugación de la muestra seminal colectada con Percoll 60 %, previo al proceso de congelación es una técnica que permite mayor selección y purificación espermática. Además, la adición de glicerol al 4 % como crioprotector brinda mayores porcentajes de protección celular post descongelación.















