Introducción
La existencia de las abejas es amenazada en la actualidad por múltiples factores, como el uso de pesticidas en los cultivos, la fragmentación y la pérdida de hábitats, así como la presencia de patógenos y parásitos (Sánchez-Bayo et al., 2016). Entre los parásitos, la presencia del ácaro Varroa destructor es probablemente el principal enemigo de las abejas, y constituye la principal amenaza para la apicultura en Las Américas (Gutiérrez y Bautista, 2016; Reyes, 2016; Giménez et al., 2017), lo cual es extensivo a otras partes del mundo (van Der Zee et al., 2015; Smart et al., 2016; Steinhauer et al., 2018). La varroa reduce drásticamente la producción de miel y de los demás productos de las colonias (Khongphinitbunjong et al., 2016), lo que provoca el deterioro y colapso a mediano plazo.
No obstante, luego del impacto desfavorable para Apis mellifera de los primeros encuentros con el ácaro, las abejas desarrollaron algunos mecanismos de defensa. En este sentido, el objetivo de la reseña es actualizar la información sobre la Varroasis en Apis mellifera y de algunos mecanismos de defensa de las abejas en su coevolución con el parásito.
Desarrollo
La Varroasis de las abejas
La Varroasis es una parasitosis causada por el ácaro V. destructor (Anderson y Trueman, 2000), originalmente estaba restringido solo a su huésped natural Apis cerana (Nazzi y Le Conte, 2016) pero se extendió a colonias de A. mellifera luego de la introducción en Asia. Es considerado el agente etiológico más importante de los colmenares, por el daño que causa y su amplia distribución mundial (Roberts et al., 2015), además afecta los indicadores productivos (Khongphinitbunjong et al., 2016). La importancia de las pérdidas en poblaciones silvestres y domesticadas (Smith et al., 2014; Kielmanowicz et al., 2015) en Europea y América del Norte por parte del ácaro, atrajeron la atención de muchas investigaciones (Steinhauer et al., 2018).
Mediante estudios moleculares, se demostró que las abejas europeas estaban parasitadas por otra especie de ácaro distinta a la especie descrita por Oudemans en 1904, y recibió el nombre de V. destructor (Rodriguez, 2016). Este parásito se considera como uno de los factores más influyentes en el síndrome de despoblamiento de colmenas (Forfert et al., 2015; Lightbody et al., 2016). En la abeja A. cerana, el ácaro no causa daños graves, debido a que sólo se reproduce en celdas de cría de zángano, pero en A. mellifera lo hace tanto en celdas de zángano como de obreras (Beaurepaire et al., 2015). Se conoce la existencia de dos haplogrupos capaces de infectar a las abejas melíferas, denominados coreano (K1) y japonés (J1) (Locke, 2016b).
Varroa destructor daña el tegumento de las abejas, de esta forma se convierten en susceptibles al desarrollo de enfermedades bacterianas, fúngicas, virales (Kuster et al., 2014) entre otras. Se describe una disminución de las respuestas inmunitarias (Abbo et al., 2017), lo que afecta a las abejas melíferas física y fisiológicamente (Annoscia et al., 2015).
Biología del ácaro varroa (Varroa destructor)
El ciclo de vida del ácaro está estrechamente ajustado y altamente dependiente del de la abeja (Mondet et al., 2014). Varroa destructor presenta aspectos morfológicos que demuestran su alta adaptación al parasitismo: su forma esférica aplanada; la situación de las extremidades en la mitad anterior para una mejor sujeción en su hospedador; la maduración de los espermatozoides que ocurre en las espermatecas del aparato reproductor femenino; los órganos sensoriales, que algunos extractos químicos de la cutícula de las larvas y de su alimento, estimulan la ovoposición y atracción de los ácaros (Dietemann et al., 2013).
Cepero (2016) señala que existe un marcado dimorfismo sexual (haplodiploidía) entre los ácaros V. destructor; las hembras son diploides y los machos son haploides. El tamaño adulto del ácaro hembra es de 1,0 a 1,2 mm de largo y de 1,5 a 1,6 mm de ancho, visible para el ojo (cutícula esclerótica marrón rojizo), aplanado, de forma ovalada y tiene ocho patas (Rosenkranz et al., 2010).
El tamaño adulto del ácaro varroa macho son relativamente más pequeños en comparación con la hembra (0,7 mm de largo por 0,7 mm de ancho), son pálidos o de color marrón claro. Generalmente, están presentes sólo en crías operculadas, antes de morir copulan con las hembras adultas dentro de las celdas de cría (Cassian et al., 2014).
En las colonias de insectos sociales los procesos de reconocimiento se basan en la expresión y percepción de compuestos químicos específicos, ésteres de ácidos grasos (Cappa et al., 2016) y predominantemente hidrocarburos cuticulares (HC). Los HC cubren la superficie corporal de cada individuo y sirven como señales para comunicarse entre los diferentes miembros de la colonia (Nazzi y Le Conte, 2016); por lo que, si la presencia del parásito afecta a los HC de su hospedero, puede ser una señal para detectar individuos parasitados.
El ácaro emplea las señales químicas de su hospedero para promover su reproducción dentro de una colonia y su transmisión entre colmenas de abejas, utiliza los HC del hospedador para encontrar el estadio larvario más adecuado para infestar (Pernal et al., 2005). El sistema altamente adaptativo es la estrategia que permite al ácaro optimizar su búsqueda para encontrar la larva más indicada, para infestar y seleccionar el portador adecuado durante su fase forética (Xie et al., 2016).
El ácaro también muestra un mimetismo químico, respecto al perfil químico del hospedero con los HC del parásito, que parecen ser cualitativamente similares a los de su hospedero (Le Conte et al., 2015).
El ciclo biológico del ácaro se compone de dos fases: forética (externa), y reproductiva (interna) (Fig. 1).
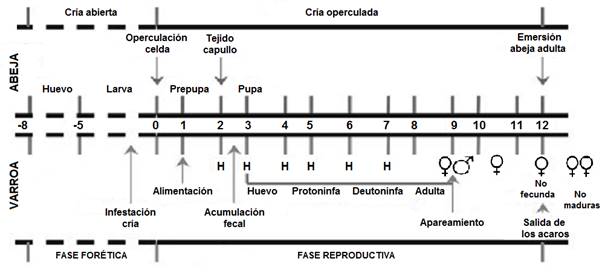
Fig. 1. Sincronización del ciclo de desarrollo de varroa con el ciclo de desarrollo de la abeja. Entre las dos líneas al centro se indica el número de días, tomando como día 0 la operculación de la celda. En la parte superior se presenta el desarrollo de la abeja. En la parte inferior, el desarrollo de varroa. H = puesta de los huevos (Vandame, 2001).
La etapa forética es el período de tiempo en que una hembra fecundada está sobre las abejas adultas o zánganos, con una duración de 7-8 días, hasta varios meses, depende principalmente de la presencia o ausencia de cría en los panales (Nazzi y Le Conte, 2016).
La etapa reproductiva se inicia cuando una o varias hembras fecundadas del ácaro entran en la celda de obrera o zángano antes de ser operculada. Los factores que provocan que varroa se instale en las celdas, se cree pueden depender por componentes químicos de naturaleza hormonal propia de las larvas, que inciden en la penetración del ácaro al interior de la celda (Salamanca et al., 2012). Esta infestación interfiere con el desarrollo de la cutícula del hospedero, lo que afecta el perfil de HC de abejas obreras emergentes, que se desarrollan junto con el parásito (McDonnell et al., 2013).
Una varroa fundadora puede producir un promedio de tres crías en la larva de obrera, y de cuatro a cinco en los zánganos, que generalmente depende del genotipo de las abejas melíferas (Khongphinitbunjong et al., 2014). La primera ovoposición ocurre entre 60 y 70 h después de operculada la celda; los siguientes huevos se colocan con intervalos de 30 h entre cada uno (Calderón et al., 2014). Del primer huevo emerge un macho y del resto hembras, los machos alcanzan la madurez sexual antes que las hembras y se localizan en el lugar de acumulación fecal hasta que la primera hembra llegue al estado adulto (Rosenkranz et al., 2010).
El ácaro pasará por varias fases de desarrollo: huevo, larva, pre-pupal, pupa y adulto joven; el tiempo de desarrollo es de aproximadamente 5,8 y 6,6 días para los ácaros hembras y machos, respectivamente (Rehm y Ritter, 1989). Las formas inmaduras del ácaro no pueden atravesar la superficie del cuerpo de la pupa para succionar su hemolinfa. Por lo que utilizan “una zona de alimentación”, que consiste en un único orificio localizado en la parte ventral del quinto segmento de la cutícula de la pupa, perforado por la hembra fundadora. Esto provoca la organización de los ácaros para alimentarse por turnos dentro de la celdilla (Garrido-Bailón, 2012).
La reproducción del ácaro sólo se puede producir en el interior de la celda de cría, por ello los machos comienzan a aparearse tan pronto como se desarrolle la primera hembra (Cepero, 2016). Por lo tanto, la duración de la etapa posterior al operculado de las celdas de crías, y la mortalidad de la descendencia de los ácaros en estas celdas son factores que pueden influir en el éxito reproductivo (Ardestani, 2015). Los ácaros se consideran no reproductivos cuando mueren en la celda sin reproducirse, no producen descendencia, producen solo descendencia masculina, o producen descendencia que no alcanza la madurez antes de que la pupa de abeja en desarrollo nazca como adulto (Harbo y Harris, 1999).
Varroa destructor se alimenta de la hemolinfa de las pupas en desarrollo y causa modificaciones en la morfología y fisiología (Genersch y Aubert, 2010), después que la fundadora emerge de las celdas junto con la descendencia femenina madura continúan alimentándose de la abeja melífera adulta, aunque Ramsey (2018) menciona que el ácaro se alimenta principalmente del tejido corporal graso de la abeja melífera, un órgano en los insectos que cumple una función similar al hígado humano. La infestación se caracteriza por reducción en el peso de las abejas que emergen, disminución del tiempo de vida de las abejas, deformaciones de las alas, patas, tórax, abdomen, reducción del volumen de las glándulas hipo faríngeas de las abejas adultas (Froylán et al., 2011).
Impacto actual de la Varroasis en las abejas (Apis mellifera)
En los últimos años, las poblaciones de abejas experimentan grandes fluctuaciones y declinaciones regionales (Dietemann et al., 2013); y es un problema para las producciones que requieren polinización de insectos, así como sostenibilidad de los negocios apícolas (van Der Zee et al., 2015).
Los ácaros pueden dispersarse de abeja a abeja, colonia a colonia y distancias de largo alcance de varias maneras; movimiento de las colonias de abejas melíferas, manipulaciones normales del apiario y a través de las abejas a la deriva (Cassian et al., 2014). Además, la expansión de la plaga es favorecida por la dificultad que presenta su erradicación, la mala manipulación de las abejas, y su rápida reproducción. Por otra parte, el ácaro es vector de varios agentes infecciosos.
Se conoce que la mortalidad de colonias inducida por varroa se deben al resultado de virus secundarios e infecciones transmitidas por el ácaro (Locke et al., 2014). Las enfermedades son las causas probables del desorden del colapso de las colmenas. Las colonias de abejas melíferas europeas en Europa, Asia y América del Norte sufren grandes pérdidas de poblaciones, en comparación con abejas de ciertas partes del mundo que logran sobrevivir satisfactoriamente al patógeno (Coelho et al., 2015).
Los híbridos de diferentes especies de abejas exhiben comportamientos diferenciados, con cierta resistencia y tolerancia al ácaro, lo que sugiere que algunas abejas son capaces de utilizar mecanismos de defensa para enfrentarse satisfactoriamente contra la infestación (Harbo y Harris, 2005). Se desconoce la severidad del impacto causado por varroa sobre los haplotipos de abejas de una zona determinada; algunos estudios que correlacionan los genotipos, indican que están en función de la fertilidad del parásito en diferentes entornos (Salamanca et al., 2012).
Akinwande et al. (2014) señalan que la utilización de productos químicos en el manejo de las enfermedades y parásitos de las abejas tiene efectos negativos. Se informan la pérdida de la inmunidad natural, incremento de la susceptibilidad a la toxicidad agroquímica y efectos sinérgicos de las enfermedades y los productos insecticidas químicos, dentro y fuera de la colmena, como también la varroa en interacción con insecticidas reducen la capacidad de vuelo de las abejas (Blanken et al., 2015).
Cruzat y Baasch (2016) comentan que los acaricidas químicos pueden contaminar los productos de la colmena, como la miel y la cera, con residuos que pueden afectar la salud del consumidor. La adquisición de estos productos representa un valor elevado para los apicultores, lo que aumenta los costos de producción.
Sin embargo, la industria apícola necesita alguna solución para mantener productivas sus colonias con bajos niveles de infestación. Una solución puede ser métodos de manejo integrado para el tratamiento de varroa, con la finalidad de reducir la aplicación de acaricidas químicos.
De esta forma, la única solución posible contra la Varroasis es la identificación y uso de poblaciones resistentes de abejas melíferas. Su selección para una mayor resistencia a esa enfermedad, que podría ser adquirida con estimulación de los comportamientos higiénicos y aseo; sin perder las características productivas y reproductivas de las colonias de abejas (Vaziritabar et al., 2016).
Reportes recientes evalúan la tolerancia de las abejas melíferas hacia el ácaro y atribuyen su tolerancia a su alto comportamiento higiénico (Coelho et al., 2015). Es importante encaminar estudios detallados de las interacciones ecológicas del parásito y trazar estrategias para manejar de manera sostenible este parásito, como métodos para interrumpir la capacidad del ácaro para detectar la abeja.
Factores que influyen en la tasa de infestación
La tasa de invasión del ácaro a la cría todavía es un tema que necesita investigación; sin embargo, el conocimiento de las tasas de invasión es muy valiosa en las simulaciones de crecimiento de la población de V. destructor y, por lo tanto, podría ser incluida en los programas de selección de las abejas para resistencia a los ácaros (Vaziritabar et al., 2016).
Varios son los factores que pueden influir en la tasa de infestación. Entre ellos el manejo, susceptibilidad de las especies, la ubicación regional, que incluyen no solo las condiciones de temperatura y humedad, sino también el uso de la tierra, la carga de pesticidas o la disponibilidad de recursos (Giacobino et al., 2014; Beaurepaire et al., 2015).
Además, se describe que la abeja melífera europea es dos veces más atrayente para V. destructor que la abeja africanizada (Coelho et al., 2015). Sin embargo, estas últimas son más resistentes a ciertas enfermedades debido a factores como el comportamiento higiénico (Nganso et al., 2017), el cual es cuatro veces mayor que en las europeas. Los híbridos africanizados son más eficientes en el acicalamiento de ácaros, así como una menor susceptibilidad a la invasión (Medina-Flores et al., 2014), menor atracción de la cría hacia el ácaro, el número de ácaros hembras infértiles en las celdas de obreras, y el tiempo de operculado de las celdillas de obreras (Bahreini y Currie, 2015).
Por su parte, Vaziritabar et al. (2016) indicaron que las condiciones ambientales desempeñan un papel en el desarrollo de la población de ácaros de varroa. No obstante, es más probable que esto sólo se observe a través del efecto indirecto de factores ambientales que regulan las cantidades de cría de abejas o la actividad de ciertos comportamientos de defensa del anfitrión. Se informa en algunos países que las infestaciones de ácaros crecen de una manera más lenta, como en el caso de las abejas de Sudáfrica en donde hay ausencia del uso de acaricidas (Seeley y Smith, 2015; Peck et al., 2016).
Mecanismos biológicos o estrategias de defensa de la abeja melífera
Se conoce que algunas poblaciones de A. mellifera muestran mecanismos que le permiten coexistir con el ácaro durante períodos más largos, sin requerir ningún tratamiento acaricida en la colmena (Strauss et al., 2016). Estos coadyuvan a reducir la prevalencia de enfermedades infecciosas y mantener bajos índices de infestación de ectoparásitos como el ácaro varroa.
Los mecanismos más útiles para los programas de selección y mejoramiento son el comportamiento higiénico, la baja atractividad de la cría, la supresión de la reproducción del ácaro, aunque existen otros de más difícil evaluación e incierta heredabilidad (Verde et al., 2013). Los comportamientos de defensa de las abejas son muy variables entre las especies de abejas y las razas y la cuantificación del rasgo depende exactamente de los métodos utilizados.
En el acicalamiento las abejas se defienden de la varroa que tiene adheridas con sus patas, mandíbulas o movimientos, mordiéndola, dañándola y quitándosela de encima o al frotarse con otra superficie (Pritchard, 2016).
El comportamiento higiénico es un rasgo genético heredable y suficientemente alto (> 0,5) para ser tomado en cuenta en los programas de crianza de A. mellifera para mejorar la vitalidad de las estirpes (Lin et al., 2016). Este comportamiento es la habilidad que tienen las obreras para detectar debido a su mayor sensibilidad olfatoria (Plettner et al., 2017), con lo cual logran discriminar entre crías normales y anormales a una baja intensidad de estímulo (Xonis et al., 2015), desopercular y remover crías enfermas (muertas o parasitadas) del interior de las celdas de un panal desde la cámara de cría hacia el exterior de la colonia (Rothenbuhler, 1964a; Vaziritabar et al., 2016).
La velocidad con la que una colonia elimina la cría muerta se correlaciona con su capacidad de eliminar el brote enfermo y del parásito (Akinwande et al., 2014). Sin embargo, la remoción de la cría infestada de ácaros no incluye necesariamente la muerte del ácaro y la mayoría de los ácaros escapan durante el proceso de remoción (Vaziritabar et al., 2016), por lo que resulta en una interrupción del ciclo reproductivo, del ácaro que en última instancia podría retrasar el crecimiento de la población de ácaros en la colonia.
Arathi et al. (2000) indicaron que el comportamiento higiénico se realiza predominantemente por las abejas obreras de mediana edad que aún no pecorean, y que el 18 % de las abejas en la colonia están realmente involucradas en la tarea en un momento dado. El comportamiento higiénico según Rothenbuhler (1964b) es controlado por dos genes recesivos independientes: uno responsable de desopercular la cría enferma (gen u) y el otro responsable de remover la cría enferma fuera del nido de cría (gen r), la homocigosis permite que las abejas sean higiénicas.
Posteriormente, Arechavaleta-Velasco et al. (2011), con marcadores moleculares tipo RAPD, mostraron siete loci de rasgos cuantitativos (QTL), que influyen sobre la expresión de dicho rasgo conductual a nivel de colmena.
Sin embargo, todavía existen preguntas sin responder relacionadas con la higienización, las que incluyen la influencia de factores extrínsecos, tales como la condición de la colonia, alimento disponible, tipo de panal. Además, la expresión del comportamiento higiénico puede estar influenciado por factores como el requerimientos de espacio de la colonia, estructura, composición de la edad de las obreras, factores medio ambientales, técnicas de manejo apícola (Büchler et al., 2013), proporción y edad de las abejas que realizan tareas higiénicas, la entrada de néctar y polen colectados por las obreras y la fortaleza de la colonia. Sin embargo, algunos autores indican que el factor más importante es su componente genético (Medina-Flores et al., 2014).
Algunas investigaciones revelan que las abejas son dependientes de la autodefensa o la resistencia natural para contrarrestar las enfermedades y plagas (Akinwande et al., 2014), por lo que la evaluación del comportamiento higiénico es la clave de la tolerancia y resistencia general de las abejas a las mismas.
El comportamiento higiénico se evalúa mediante varios métodos, entre ellos la remoción de la cría artificialmente infestada con V. destructor (Vaziritabar et al., 2016), el congelamiento con nitrógeno líquido de una sección del panal con la cría operculada (Spivak y Downey, 1998), mediante el sacrificio de la cría con el pinchazo de una aguja o alfiler (Newton y Ostasiewski, 1986). Este último método es recomendado en Europa como estándar en programas de selección, pues muestra una correlación significativa con la eliminación de las crías infestadas de varroa. Puede estandarizarse y es fácil de manejar por los apicultores (Büchler et al., 2013); además la punción es el más eficiente, pues además de pinchar la larva, el fluido corporal que se derrama constituye el estímulo que induce la desoperculación y remoción de la cría.
La supresión del éxito reproductivo del ácaro varroa en las celdas de cría por parte de las poblaciones de A. mellifera es otro mecanismo que se considera crucial en la resistencia adaptativa (Mondragón et al., 2006). Este mecanismo se traduce en baja fertilidad, fecundidad y éxito reproductivo de los ácaros, y explica la resistencia de las abejas melíferas hacia los ácaros en varias poblaciones. Así tenemos, A. m. scutellata en Sudáfrica (Strauss et al., 2016), abejas africanizadas en Brasil (Giacobino et al., 2014) y poblaciones de abejas de origen europeo de ciertas partes del mundo como: en la isla de Fernando de Noronha en el noreste de Brasil la Apis m. ligustica; la abeja rusa de la región de Primorsky (Rinderer et al., 2001), en la región de Gotland-Suecia (Lattorff et al., 2015; Locke, 2016a), poblaciones de abejas melíferas noruegas (Oddie et al., 2017).
Conclusiones
La solución para el control y tratamiento de varroa de forma sostenible está ligada al conocimiento de la biología del ácaro y de los mecanismos innatos de defensa que les permiten a las abejas tolerar la presencia del parásito.
Las poblaciones de abejas resistentes al ácaro proporcionan información valiosa y brindan esperanza para una solución sostenible a través de la resistencia al parásito. Estos mecanismos de defensa de las abejas, deben ser considerados en los programas de selección y mejoramiento genético para obtener abejas tolerantes o resistentes a la plaga















