INTRODUCCIÓN
La Paramfistomosis es una enfermedad parasitaria ocasionada por trematodos que afectan a rumiantes y diversas especies silvestres, especialmente en regiones tropicales (Rojas et al., 2015). Puede causar una gastroenteritis aguda y anemia con alta morbilidad especialmente en animales jóvenes (Kifleyohannes et al., 2015). Este trematodo puede causar cuantiosas pérdidas económicas que se enmarcan en reducciones en la producción de lana, carne y leche.
Rangel-Ruiz, Albores-Brahms y Gamboa-Aguilar (2003) y Silva (2006) resaltan que se trata de una enfermedad emergente puesto que se conoce de su extensión. Este incremento puede ser debido a una sobreestimación de la prevalencia de Fasciola hepatica en regiones con geografía donde coexisten simultáneamente ambos trematodos. Así como, a la no disponibilidad de fármacos eficaces en el tratamiento de la paramfistomosis en nuestro medio (Pinedo et al., 2010).
El diagnóstico clínico de Paramphistomum es muy difícil debido a la falta o parecido de signos con otras parasitosis. Los métodos inmunológicos y la detección de anticuerpos en el suero todavía no son concluyentes para el diagnóstico del parásito (Rieu et al., 2007). Asimismo, el diagnóstico de este parásito se hace de forma rutinaria y consiste en la demostración de huevos en las heces de los bóvidos infestados, con la técnica coprológica de sedimentación (Piña, 2013; Silva, 2006).
McMaster es una técnica muy utilizada en los laboratorios veterinarios ya que es posible variarla por el volumen de las heces a examinar (Bosco, 2014). Mini-Flotac es una nueva técnica de la familia de las FLOTAC (Godber et al., 2015) y fue introducida en los últimos tiempos como una alternativa a McMaster (Cringoli et al., 2010). Para nuestro conocimiento no existen informes del empleo de Mini-Flotac en el diagnóstico de Paramphistomum spp.
El diagnóstico de trematodos digeneos que existe en Cuba es escaso, a esto se le añade el hecho que existen pocos estudios específicos para el tratamiento y control de esta trematodiasis en rebaños bovinos afectados por este parásito en nuestro país (Vázquez et al., 2015). Si tenemos en cuenta además que el método de diagnóstico usado en Cuba para la detección de huevos de trematodos es el de sedimentación simple, método coprológico cualitativo de baja fiabilidad, se hace necesario buscar métodos alternativos más fiables.
Por lo anteriormente expuesto en el trabajo nos proponemos como objetivo comparar el desempeño de las técnicas coprológicas McMaster y Mini- FLOTAC en el diagnóstico de Paramphistomum spp. de muestras provenientes de bovinos.
MATERIALES Y MÉTODOS
Para cumplir los objetivos del presente trabajo se realizaron dos experimentos. En el primero se evaluó la recuperación de huevos de Paramphistomum spp. en muestras de heces fecales con cantidades conocidas de huevos por gramos de heces, con el empleo de diferentes soluciones de flotación. En el segundo se tomaron muestras de heces fecales de bovinos destinados al sacrificio y bovinos provenientes de rebaños lecheros, para comparar las técnicas de McMaster y Mini- Flotac en el diagnóstico de Paramphistomum spp.
Toma de muestras
Las muestras de heces fecales de bovinos destinados al sacrificio se obtuvieron en el matadero sanitario Guanamaquilla del municipio de Camagüey, se tomaron un total de 40 muestras directamente del recto de los animales. Además, se tomaron muestras de heces, de 155 rebaños de vacas en ordeño, provenientes de la Empresa Pecuaria Triángulo 3 del municipio Camagüey. De cada rebaño se colectaron al azar heces de 20 vacas en ordeño y se unieron cantidades iguales en peso para formar la muestra del rebaño.
Todas las muestras fueron selladas en bolsas de polietileno, identificadas y refrigeradas. Posteriormente se trasladaron al Laboratorio de Parasitología de la Facultad de Ciencias Agropecuarias de la Universidad de Camagüey.
Colecta de huevos y preparación de muestras conocidas.
Directamente del rumen de los bovinos sacrificados se tomaron aproximadamente 15 Paramphistomum spp. adultos vivos. Se lavaron con NaCl al 0,9 % y se colocaron en vasos de precipitado de cristal de 400 mL, con solución de PBS 1X (KH2PO4 1,8 mmol/L; Na2HPO4 8,4 mmol/L; KCl 12,6 mmol/L y NaCl 136,8 mmol/L, pH 7,2).
Los trematodos se mantuvieron a temperatura ambiente durante su traslado al Laboratorio de Parasitología de la Universidad de Camagüey. Posteriormente se realizó un último lavado con PBS 1X para eliminar restos de sangre y contenido ruminal. Se incubaron en vaso precipitado con 100 mL de PBS 1X durante 4 horas a 37 ºC para la ovoposición. Luego se retiraron los individuos, y los huevos se obtuvieron por decantación del sobrenadante, hasta un volumen final de 10 mL de solución de PBS 1X. El conteo de huevos se realizó con cinco réplicas de 100 µL.
Preparación de las muestras de heces con cantidades conocidas de huevos del tremado.
El contenido en el vaso precipitado con los huevos de Paraphistomum spp. se decantó hasta 5 mL y se volvió a realizar el conteo de huevos. La concentración de huevos se ajustó a 1000 hpg en heces (previamente esterilizadas en autoclave a 121 ºC y 1 atm durante 15 minutos) libres de huevos del parásito. Se realizaron diferentes diluciones con heces libres de huevos para concentraciones conocidas de 5, 25, 125, 250, 500 y 1000 de hpg.
Comparación de soluciones de flotación para la detección de huevos de Paraphistomum spp.
Se tomaron tres gramos de heces de cada concentración conocida de hpg y se le añadieron 27 mL (dilución 1:10) de una de las siguientes soluciones de flotación: ZnSO4 1,45 g/mL, ZnCl2 1,45 g/mL, ZnCl2 1,5 g/mL y ZnCl2 + Sacarosa 1,5 g/mL. Posteriormente se mezclaron y se filtraron en un tamiz 1 mm. La suspensión se homogenizó y se llenaron las cámaras de Mini-Flotac y McMaster. Las cámaras se dejaron reposar al menos por 10 minutos y se observaron al microscopio (10X) para el conteo de huevos. Los factores de dilución fueron de 5 para Mini-Flotac y 10 para McMaster. Se consideró como muestra positivala que tuviera al menosun huevo de Paramphistomum spp.
Determinación de Paramphistomum spp. por conteo de hpg en bovinos destinados al sacrificio y rebaños lecheros.
A las 40 muestras de heces fecales de bovinos destinados al sacrificio, y las 155 de rebaños de vacas en ordeño, se les realizaron tres réplicas de cada una de las técnicas coprológicas en estudio, para un total de seis conteos por muestras. Se tomaron tres gramos de materia fecal de cada grupo por unidad o réplica de las heces de los animales sacrificados, y se diluyeron en 27 mL de solución saturada de sacarosa con ZnCl2 con una densidad de 1,52 g/mL. Posteriormente, se desarrolló el procedimiento descrito en la sección anterior.
Análisis estadístico.
Se utilizó el paquete estadístico Graphpad Prism 7.0 (2016) para los análisis de regresión entre McMaster y Mini-Flotac, y de hpg conocido y observado. Para la comparación de los CV (%) se utilizó el ANOVA bifactorial, los factores estudiados fueron la técnica utilizada y la densidad. El valor de exactitud se obtuvo según el valor de recuperación de las pendientes de la regresión lineal entre el hpg conocido y el observado. El porciento de precisión para cada técnica se calculó por la sustracción al 100 por ciento del CV (%). La Sensibilidad, Especificidad, Valor Predictivo Negativo (VPN), Valor Predictivo Positivo (VPP) y la prevalencia se determinaron mediante el software online MedCalc Software bvba, Ostend, Belgium.
RESULTADOS
Análisis de recuperación de huevos de Paramphistomum de muestras de heces
Las técnicas coprológicas como McMaster (McM) y Mini- FLOTAC (MF) mostraron una amplia gama de posibilidades para el diagnóstico de Paramphistomum spp. en bovinos a diferentes concentraciones de hpg (5, 25, 125, 250, 500 y 1000) y densidades (1,45 y 1,5 g/mL) como muestra la Fig. 1.
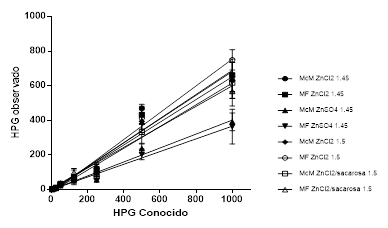
Fig. 1 Determinación de huevos de Paramphistomum spp. en muestras de heces fecales con cantidades conocidas de huevos del parásito (hpg conocido, en el rango de 5- 1000). McM (McMaster), MF (Mini- FLOTAC).
Las pendientes indican similares valores de recuperación en las técnicas McMaster y Mini-Flotac. Sin embargo, las soluciones de ZnSO4 en la densidad de 1,45 g/mL presentaron valores más bajos de recuperación con ambas cámaras, que el resto de las soluciones. Los porcientos de recuperación de las soluciones de ZnCl2 estuvieron entre el 59 y 70 % (Tabla 1).
Tabla 1 Ecuaciones que describen la detección de huevos de Paramphistomum spp. en heces con cantidades conocidas de huevos del parásito.
| Solución de flotación | Densidad (g/mL) | Ecuación | R2 |
|---|---|---|---|
| McM ZnCl2 | 1,45 | Y= 0,69*X - 3,81 | 0,94 |
| MF ZnCl2 | 1,45 | Y= 0,70*X - 8,15 | 0,97 |
| McMZnSO4 | 1,45 | Y= 0,40*X - 1,43 | 0,97 |
| MF ZnSO4 | 1,45 | Y= 0,37*X - 0,74 | 0,98 |
| McM ZnCl2 | 1,50 | Y= 0,66*X - 4,98 | 0,97 |
| MF ZnCl2 | 1,50 | Y= 0,77*X - 20,15 | 0,98 |
| McM ZnSO4 | 1,50 | Y= 0,69*X - 12,68 | 0,96 |
| MF ZnSO4 | 1,50 | Y = 0,59*x - 7,19 | 0,98 |
MF: Mini- FLOTAC, McM: McMaster Y= Cantidad de huevos por gramos de heces observados, X = cantidad de huevos por gramos de heces conocidos.
Los coeficientes de variación (CV) para las técnicas en estudio fueron similares (Tabla 2).
Tabla 2 Coeficiente de variación (CV) y precisión de McMaster y Mini- FLOTAC con diferentes soluciones de flotación.
| Solución | Densidad (mg/mL) | CV (%) | Precisión (%) |
|---|---|---|---|
| McM ZnCl2 | 1,45 | 21,32 | 78,68 |
| MF ZnCl2 | 1,45 | 22,02 | 77,98 |
| McMZnSO4 | 1,45 | 16,93 | 83,07 |
| MF ZnSO4 | 1,45 | 25,05 | 74,95 |
| McM ZnCl2 | 1,50 | 21,72 | 78,28 |
| MF ZnCl2 | 1,50 | 17,83 | 82,17 |
| McM ZnSO4 | 1,50 | 25,83 | 74,62 |
| MF ZnSO4 | 1,50 | 19,01 | 80,99 |
MF: Mini- FLOTAC, McM: McMaster.
Comparación
Los valores de hpg detectados por ambas técnicas presentaron relación lineal (R2 = 0,93). La pendiente de la regresión mostró un valor de 1,36 lo que indica que Mini-Flotac logró detectar un 36 % más de huevos que McMaster (Fig. 2).
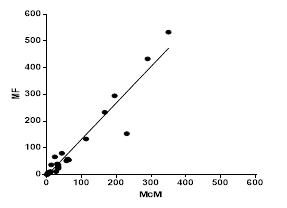
Fig. 2 Detección de huevos por gramos de heces de Paramphistomum spp. con McMaster (McM-X) y Mini- FLOTAC (MF-Y) en la solución de flotación: ZnCl2 (1,45 g/mL), MF = 1,36*McM - 4,11. R2 =0,93 (n=40).
En la solución de flotación de ZnCl2 y la densidad de 1,5 se encontraron valores similares para sensibilidad, especificidad y valores predictivos positivos y negativos en la detección de huevos de Paramphistomum spp. por ambos métodos (Tabla 3).
Tabla 3 Sensibilidad, especificidad y valores predictivos de la detección del conteo de huevos determinados con McMaster y Mini- FLOTAC.
| McMaster ZnCl2 1,50 g/mL | Mini- FLOTAC ZnCl2 1,50 g/mL | |
|---|---|---|
| Sensibilidad | 77,38% [66,95% -85,80%] | 77,38% [66,95%- 85,80%] |
| Especificidad | 91,67% [77,53%- 98,25%] | 91,67% [77,53- 98,25%] |
| Valor Predictivo Negativo | 63,46% [53,60%- 72,31%] | 63,46% [53,60%- 73,61%] |
| Valor Predictivo Positivo | 95,59% [53,60%- 98,47%] | 95,59% [¨87,93%-98,47%] |
[Intervalo de confianza 95 %]
La Fig. 3 representa el análisis de regresión lineal para las muestras provenientes de rebaños lecheros, la ecuación que lo describe es: MF = 0,76*McM + 1,38, (R2= 0,71). La pendiente indica que detectó Mini- FLOTAC un 24 % menos que McMaster.
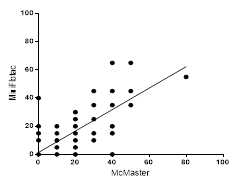
Fig. 3 Detección de huevos de Paramphistomum spp. por gramos de heces bovinas (muestras de rebaños lecheros). McMaster (McM) y Mini-Flotac (MF), Solución de flotación ZnCl2 (1,50 g/mL), MF = 0,76*McM + 1,38 (R2= 0,71) (n=155).
Los valores de prevalencia en la detección de huevos de Paramphistomum spp. para rebaños lecheros fue para McMaster 42,9 y para Mini- FLOTAC 43,5. Ambas técnicas coprológicas mostraron alta sensibilidad, aunque Mini-Flotac mostró una tendencia a mayor por ciento (91,1 %) comparada con McMaster (87 %). De igual forma el valor predictivo negativo fue superior en Mini-Flotac (91,9 %) que McMaster (88,7 %). No se detectaron falsos positivos en el análisis de las muestras (Tabla 4).
Tabla 4 Sensibilidad, especificidad y valores predictivos de la detección del conteo de huevos determinados con McMaster y Mini-FLOTAC de Paramphistomum spp. en muestras heces bovinas de rebaños lecheros.
| MacMaster | Mini- FLOTAC | |
|---|---|---|
| Sensibilidad | 86,99% [80,57% -91,51%] | 91,1% [85,36%- 92,74%] |
| Especificidad | 100% [97,49%- 100%] | 100% [97,49- 100%] |
| Valor Predictivo Negativo | 88,69% [83,01%- 92,64%] | 91,98% [86,76%- 95,25%] |
| Valor Predictivo Positivo | 100% [97,06%- 100%] | 100% [¨97,19%-100%] |
[Intervalo de confianza al 95 %]
DISCUSIÓN
Los estudios para evaluar la exactitud y precisión en la detección de huevos de parásitos en animales se basan en muestras de heces de individuos infestados natural o experimentalmente (Ojeda-Robertos et al., 2014). Por esta razón el número real de huevos podría ser incorrecto. En nuestro trabajo las muestras se prepararon con un número conocido de huevos del parásito, lo que permitió determinar la verdadera precisión y exactitud de las técnicas en el diagnóstico de Paramphistomum spp. en bovino.
La exactitud en los conteos de huevos es imprescindible al evaluar el fenómeno de resistencia parasitaria frente a los antihelmínticos (Eysker y Ploeger, 2000). El incremento de la exactitud ayuda, además, a la predicción positiva en muestras con pocas cantidades de huevos, con menor variabilidad (Barda et al., 2013; De Castro et al., 2017). Métodos de conteo de huevos más exactos y precisos permiten obtener diagnósticos más fiables y evaluar mejor la efectividad de los tratamientos antiparasitarios.
En el presente trabajo ambas técnicas mostraron similares exactitud y precisión, con muestras conocidas de hpg, independientemente de la solución de flotación. Los bajos CV y alta precisión en McMaster pueden estar dados porque se empleó 10 como factor de dilución y las lecturas incluyeron toda el área de las cámaras. Se conoce que la exactitud y precisión en McMaster están directamente relacionada con el área de lectura (Cringoli et al., 2004).
Existen evidencias de estudios que comparan las técnicas de Mini-Flotac y McMaster en el diagnóstico de huevos de nematodos en ganado bovino y helmintos en humanos (Bosco, 2014; Glinz et al., 2010). Silva et al. (2013) detectaron que la exactitud de McMaster y Mini-FLOTAC son similares. Sin embargo, se reportan menores coeficientes de variación en Mini-Flotac comparado con McMaster, en la detección en parásitos gastrointestinales para equinos (Noel et al., 2017).
La recuperación de huevos de Paramphistomum spp. en bovinos detectados en nuestro estudio con el uso de las técnicas McMaster y Mini-Flotac fueron similares a los reportados por Rinaldi et al. (2014). Los autores evaluaron estas técnicas en muestras de heces agrupadas de ovinos en la detección de huevos de strongylus gastrointestinales. Asimismo, nuestros resultados de recuperación de huevos de parásitos comparando ambas técnicas son superiores a los descritos en otros estudios (Noel et al., 2017). Estudios similares en ovinos demostraron que Mini-Flotac resultó mejor en la detección de huevos de parásitos gastrointestinales en esta especie (Rinaldi et al., 2014; Silva et al., 2013).
La técnica McMaster es el método de diagnóstico coprológico más utilizado universalmente en parasitología veterinaria (Vadlejch et al., 2011). En experimentos de comparación entre McMaster y Mini- FLOTAC en el diagnóstico de huevos de Eimeria spp. en ovinos infestados de forma natural, Mini-Flotac proporcionó valores más altos de hpg (P< 0,05), que McMaster (Silva et al., 2013). Los valores de hpg con Mini-Flotac obtenidos en nuestro estudio parecen un poco contradictorios, en el caso de las muestras de los bovinos a sacrificio fue mayor en Mini-Flotac; sin embargo, en muestras agrupadas de rebaños lecheros los conteos de McMaster fueron superiores. La densidad de la solución de flotación empleada, así como el tipo y/o consistencia de las heces pueden influir en el diagnóstico parasitológico (Cringoli et al., 2010). Las muestras provenientes de los rebaños lecheros tuvieron menos carga parasitaria, atribuible a que fueron agrupadas, lo cual pudiera reducir la precisión del diagnóstico y similitud entre ambas técnicas.
Experimentos de comparación entre conteos fecales de huevos de nematodos gastrointestinales a través del empleo de McMaster y Mini-Flotac para equinos y bovinos muestran resultados de hpg similares en ambas técnicas. Sin embargo, los CV fueron significativamente más bajos para Mini-Flotac; por lo que los autores recomendaron esta técnica en animales con conteo fecales bajos (De Castro et al., 2017). Las dificultades con los métodos coprológicos reclaman la necesidad de métodos más sensibles que permitan un diagnóstico más certero de la infestación de Paramphistomum en vacas y su impacto económico (Rieu et al., 2007).
Existe un aumento del número de estudios sobre la prevalencia de Paramphistomum spp. debido a la reducción que ocasiona el parásito en la productividad ganadera. En el distrito de Moyabamba, Perú, las prevalencias del parásito fueron de un 55 % en rebaños lecheros (Rojas et al., 2015). De igual manera, en Holanda detectaron prevalencias entre el 82,6 y el 83,3 % (Ploeger et al., 2015), valores superiores a los detectados en el presente trabajo. La alta prevalencia de Paramphistomum spp. encontrada en nuestro estudio puede estar relacionada con la presencia de biotopos en las áreas de pasturas; además, todas las categorías de animales pastan juntas, sin embargo, es necesario realizar un estudio de riesgo que permita la toma de medidas en el control de la paramfistomosis.














