INTRODUCCIÓN
En América Latina y el Caribe se produce un poco más del 23% de la carne bovina y de búfalo a nivel mundial, con un enorme crecimiento de estas producciones, especialmente en los países de América del Sur, convirtiéndose en la región que más exporta carne bovina a nivel mundial (FAO, 2021).
En los últimos años en la región se ha incorporado la producción de búfalos, con posibilidades de desarrollo en modelos rentables y sostenibles (Bertoni et al., 2021), incrementado su relevancia dentro de los sistemas de producción de carne y leche (Fosgate et al., 2011). En el año 2007 se reporta un ritmo de crecimiento explosivo de esta especie con crecimientos del 12,7% anual, muy por encima de todos los demás continentes (Zava, 2007), ritmo que se mantiene hasta nuestros días cuando se analizan los datos de diferentes países como Colombia, Argentina, Venezuela y Cuba (Naveena et al., 2020).
La producción bovina y bubalina se ve afectada por enfermedades de origen infeccioso que influyen negativamente en la reproducción, algunas de las cuales son zoonóticas y provocan problemas de salud pública (Contreras et al., 2012). Estas enfermedades son un obstáculo para el buen desempeño productivo y reproductivo del ganado, lo que resulta en enormes pérdidas económicas (Fosgate et al., 2011; Alves et al., 2015; Fuentes et al 2015 Villanueva et al., 2018).
Entre estas enfermedades de origen infeccioso que afectan al ganado bovino y bubalino, la brucelosis cobra gran importancia, ya que además de las pérdidas que produce en la ganadería, esta enfermedad es una zoonosis que afecta a la mayoría de los países en desarrollo (Avila-Granados et al., 2019), fundamentalmente a países del Mediterráneo, Asia, África y América Latina (Gioia et al., 2019) y se presenta de forma endémica en los países de Centroamérica y el Caribe y Sudamérica (Cárdenas et al., 2019).
Múltiples especies del género Brucella pueden afectar a los animales y al hombre sin embargo B. abortus, B. melitensis y B. suis son las tres especies más importantes que infectan a los animales productores de alimentos (Poulsen et al., 2014).
En Latinoamérica, la enfermedad se encuentra distribuida ampliamente en todo el continente, reportándose variaciones en su prevalencia asociadas a la implementación de programas de control (Ojeda Gutierrez y Roman Cárdenas, 2018).
Numerosos aspectos, dentro de los cuales se incluyen el estatus de la vacunación y la prevalencia de la enfermedad, se consideran factores importantes al adoptar y evaluar el impacto de programas de control y/o erradicación de la brucelosis (Mirnejad et al., 2017).
La compilación de los resultados de diferentes estudios fragmentados por área y tiempo permite mostrar la situación de una enfermedad a nivel de país o región geográfica dentro de un período de tiempo (Tesfaye et al., 2021). En las regiones referidas se reportan diversas investigaciones sobre la temática con resultados muy variables. En América, estudios en Uruguay reportan una prevalencia del 0,4% (Aznar et al., 2015), otros realizados en Brasil reportan una prevalencia del 65,5% (Chiebao et al., 2015), por lo que se requiere un análisis que permita la combinación de los resultados y llegar a conclusiones.
El metaanálisis es un método que permite obtener un promedio ponderado de los resultados de varios estudios y estimar las frecuencias de las enfermedades, como es el caso de la prevalencia (Barendregt et al., 2013), es por ello que nos proponemos como objetivo de este estudio estimar con el uso de este método la prevalencia combinada de brucelosis para los bovinos y búfalos de las regiones de Centroamérica y el Caribe y Sudamérica en el periodo 2010-2021 y analizar posibles diferencias en su comportamiento en el tiempo así como entre ambas regiones y especies.
MATERIALES Y MÉTODOS
Estrategia de búsqueda de literatura
Para el estudio se utilizó la información que brindan artículos y tesis de maestrías y doctorado publicados en los idiomas español, portugués e inglés en las bases de datos electrónicas PubMed / PubMed Central, Science Direct, Scielo, Ebsco y Google Scholar en el período 2010-2021. La búsqueda de artículos se realizó siguiendo los términos del encabezado de materia médica (MeSH). Los términos de búsqueda clave fueron: (Brucelosis OR Brucella) AND (Bovino OR Búfalo) AND (Seroprevalencia OR Prevalencia OR Seroepidemiología) AND (Sudamérica OR Centro América OR Caribe OR País en específico).
Criterios de inclusión
Se utilizaron en el estudio los artículos: 1) publicados entre 2010 y 2021; 2) de investigación originales revisados por pares y tesis de posgrado realizados en Sudamérica y Centroamérica y el Caribe; 3) que informen la seroprevalencia de la brucelosis en las especies bovina y/o bubalina dentro de cualquiera de los sistemas de manejo (intensivo o extensivo); 4) que estén disponibles los textos completos; 5) que utilizaron en el diagnóstico las técnicas serológicas recomendadas por la Organización Mundial de Sanidad Animal (OIE) para el tamizaje y la confirmación (OIE, 2021); 6) que proporcionan el tamaño de la muestra y el número de casos positivos.
Análisis de calidad
Para el análisis de calidad se seleccionaron dos personas y se utilizó la metodología “Fortalecimiento de la notificación de estudios observacionales en epidemiología” (STROBE), que incluye 22 aspectos, dentro de los cuales se encontraban los objetivos, los diferentes componentes de los materiales y métodos como son: el diseño del estudio, tamaño de la muestra, población del estudio, sesgo, métodos de calibración, resultados y limitaciones. Los puntajes asignados se determinaron de 0 a 44 y los artículos buscados se 3 grupos: baja calidad (<15.5), buena calidad (15.5-29.5) y alta calidad: (30.0-44.0) (Von Elm et al., 2007) y se incluyeron en el estudio los artículos que cumplían con los criterios Alta y Buena calidad, eliminándose aquellos clasificados de Baja calidad.
Selección de estudios y extracción de datos
Los registros identificados de varias bases de datos electrónicas, se indexaron utilizando el software BIVET (Romero, 2019). Se identificaron, documentaron y eliminaron registros duplicados. Se examinaron de forma independiente el título y los resúmenes con criterios de inclusión predefinidos, se recopilaron de forma independiente los textos completos y se evaluó su elegibilidad para su inclusión final.
Se elaboró un formato de extracción de datos con base en el primer autor, año de publicación, año de estudio, ubicación geográfica (países), diseño del estudio, método de muestreo, tamaño de muestra, prueba diagnóstica, especie, cantidad de casos positivos y negativos tanto a nivel individual, como de hatos. Se calculó la seroprevalencia de brucelosis dividiendo el número de casos positivos por el número total de individuos examinados en el estudio, en una población y período determinado, y multiplicado por 100. El tamaño del efecto del estudio y sus correspondientes intervalos de confianza (IC) se calcularon a partir de los datos extraídos. Se utilizó una hoja de datos de Microsoft Excel para codificar y gestionar toda la información extraída de los estudios relevantes.
Para informar los resultados del estudio se utilizó la metodología PRISMA (Shamseer et al., 2015).
Análisis estadístico
Se realizó un metaanálisis para estimar la prevalencia combinada de brucelosis mediante la fórmula proporcionada por Barendregt et al. (Barendregt et al., 2013). En un diagrama se presentaron las variaciones entre los estudios, los resultados de las estimaciones de la seroprevalencia y sus IC correspondientes de todos los estudios incluidos junto con el tamaño del efecto agrupado. De manera similar, se realizó un análisis por subgrupos para determinar el efecto de las regiones geográficas (Sudamérica y Centro América y el Caribe), la especie animal (bovinos y búfalos) y el período de publicación de los artículos (2010-2016 y 2017- 2021) de la prevalencia combinada de brucelosis.
Se calcularon Estadísticas Q de Cochrane y varianza inversa índice (I2) para determinar la heterogeneidad e inconsistencia respectivamente. De manera similar, se consideraron los valores de I2 de 25, 50 y 75% como heterogeneidad baja, media y alta, respectivamente (Higgins y Thompson, 2002).
Se evaluó la varianza de las estimaciones del tamaño del efecto en la población del estudio utilizando la estadística tau (τ2). También se construyó el diagrama de gráfico de Galbraith para evaluar las heterogeneidades de las estimaciones del nivel de estudio. Con base en el resultado de la evaluación de la heterogeneidad, se utilizó el método de efectos aleatorios de Der Simonian y Laird (si el valor p de la prueba Q era <0.05 e I2 era> 50%), o el método de efectos fijos de Mantel-Haenszel para agrupar las estimaciones (Tufanaru et al., 2015).
A continuación, se visualizaron los efectos del estudio pequeño y la presencia de sesgo de publicación utilizando diagramas de gráfico de embudo y pruebas de asimetría de Egger y Begg (Borenstein et al., 2009). Se elaboró un gráfico de embudo utilizando el logaritmo del tamaño del efecto y su correspondiente error estándar del tamaño del efecto.
Para realizar el metaanálisis se utilizó el programa meta versión 4.18-1 del software R (R Development Core Team, 2020)
La heterogeneidad entre los subgrupos se probó además utilizando un análisis de metarregresión, comprobándose también mediante esta prueba la relación de la prevalencia con la región geográfica, el período de estudio y la especie animal. También se realizó para cada variable incluida en el estudio por separado y las variables con valores de P<0,1 se analizaron mediante una metarregresión multivariada.
RESULTADOS Y DISCUSIÓN
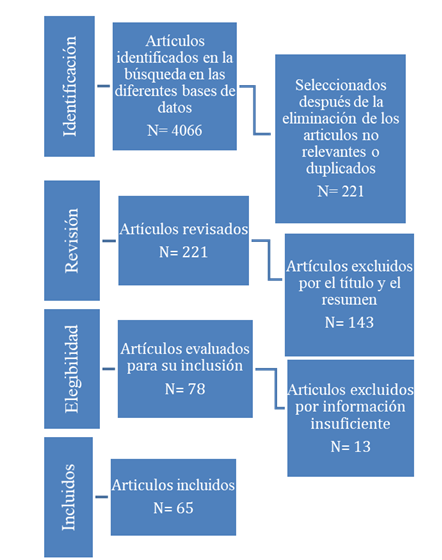
En la búsqueda realizada se identificaron 78 artículos que cumplían con los criterios de inclusión, seleccionándose definitivamente 65, artículos que cumplimentaban los parámetros de calidad definidos (Fig. 1). Los principales aspectos de calidad que limitaron la selección de los artículos fueron los problemas en el diseño y el uso de pruebas diagnósticas reconocidas internacionalmente.
Solo se reportan estudios con respecto a la prevalencia de brucelosis en 18 países y territorios de las regiones estudiadas, 10 de la región de Centroamérica y el Caribe y 8 de Sudamérica, el 31,25% y 61,53% respectivamente de los países que conforman estas regiones (Tabla 1), concentrándose el 75% de los mismos en 4 países, Ecuador, Brasil, México y Colombia. Esta situación se puede convertir en una limitante para lograr resultados en el programa de control de la enfermedad en estos territorios, ya que el conocimiento de la prevalencia y distribución de la enfermedad es un factor primordial para evaluar el impacto de estos programas y realizar los ajustes requeridos a los mismos (Mirnejad et al., 2017).
Tabla 1 Distribución de los artículos incluidos por países y región geográfica.
| Región y País | Artículos Incluidos | Animales Investigados | Positivos | Positivos (%) | IC 95% |
| Centroamérica y el Caribe | 13 | 604171 | 4557 | 0.75 | 0,73-0,78 |
| Belice | 1 | 14606 | 0 | 0,00 | 0,00-0,03 |
| Costa Rica | 2 | 547863 | 1173 | 0,21 | 0,20-0,23 |
| Dominica | 1 | 95 | 0 | 0,00 | 0,00-3,89 |
| Granada | 2 | 154 | 9 | 5,84 | 3,10-10,73 |
| Guatemala | 1 | 31038 | 2890 | 9,31 | 8,99-9,64 |
| México | 7 | 9915 | 485 | 4,89 | 4,48-5,33 |
| Montserrat | 1 | 12 | 0 | 0,00 | 0,00-24,25 |
| Puerto Rico | 1 | 184 | 0 | 0,00 | 0,00-20,50 |
| San Cristobal y Nieves | 1 | 131 | 0 | 0,00 | 0,00-28,50 |
| Santa Lucia | 1 | 173 | 0 | 0,00 | 0,00-21,70 |
| Sudamérica | 52 | 2081452 | 12006 | 0.58 | 0,57-0,59 |
| Argentina | 3 | 10387 | 227 | 2,19 | 1,92-2,48 |
| Brazil | 17 | 743685 | 8787 | 1,18 | 1,16-1,21 |
| Chile | 1 | 400 | 0 | 0,00 | 0,00-0,95 |
| Colombia | 6 | 2365 | 140 | 5,92 | 5,04-6,94 |
| Ecuador | 19 | 88469 | 2257 | 2,55 | 2,45-2,66 |
| Perú | 2 | 4296 | 2 | 0,05 | 0,01-0,17 |
| Uruguay | 1 | 1230897 | 517 | 0,04 | 0,04-0,05 |
| Venezuela | 3 | 953 | 76 | 7,97 | 6,42-9,87 |
| Total | 65 | 2685623 | 16563 | 0.62 | 0,61-0,63 |
Se conoce la necesidad de disponer datos actualizados como parte de la estrategia de control de brucelosis (Zambrano Aguayo y Pérez Ruano, 2015), por lo que es necesario desarrollar investigaciones con diseños y esquemas diagnósticos recomendados para determinar con un mayor grado de certeza la seroprevalencia de esta enfermedad, como base para el establecimiento de estrategias para su control en los animales y reducir su impacto en la salud pública.
Según la especie animal se pudo comprobar que, de los 65 artículos disponibles, en 56 se informan datos sobre la prevalencia de brucelosis en bovinos, y en 11 de búfalos (Tabla 2), por lo que consideramos deben ser una prioridad para las regiones estudiadas el desarrollo de estudios en esta última especie debido a que la misma un elevado ritmo de crecimiento en la región (Naveena et al., 2020) y es identificada como un riesgo, tanto para la ganadería bovina como para los humanos, ya que aunque se considera que esta especie es más resistente a la enfermedad, juega un papel de reservorio (Barbosa da Silva et al., 2014b) y elimina el agente en la leche, lo cual es un grave riesgo para la salud pública (Rosales-Zambrano et al., 2015).
Tabla 2 Distribución de los artículos incluidos por especie animal.
| Especie | Artículos Incluidos | Animales Investigados | Positivos | Positivos (%) | IC 95% |
| Bovinos | 56 | 2672009 | 16026 | 0.60 | 0,59-0,61 |
| Búfalos | 11 | 13614 | 537 | 3.94 | 3,63-4,28 |
| Total | 65* | 2685623 | 16563 | 0.62 | 0,61-0,63 |
* En dos artículos se proporcionan datos de las dos especies
De los artículos recuperados en la búsqueda 36 se corresponden con el periodo 2010-2016 y 29 al periodo 2017-2021 (Tabla 3).
Tabla 3 Distribución de los artículos incluidos en el análisis por período de estudio.
| Período | Artículos Incluidos | Animales Investigados | Positivos | Positivos (%) | IC 95% |
| 2010-2016 | 36 | 124747 | 2468 | 1.98 | 1,90-2,06 |
| 2010 | 3 | 1331 | 156 | 11.72 | 10,10-13,56 |
| 2011 | 2 | 873 | 71 | 8.13 | 6,50-10,13 |
| 2012 | 2 | 732 | 210 | 28.69 | 25,53-32,07 |
| 2013 | 4 | 1889 | 91 | 4.82 | 3,94-5,88 |
| 2014 | 5 | 15715 | 553 | 3.52 | 3,24-3,82 |
| 2015 | 10 | 51881 | 573 | 1.10 | 1,02-1,20 |
| 2016 | 10 | 52326 | 814 | 1.56 | 1,45-1,67 |
| 2017-2021 | 29 | 2560876 | 14095 | 0.55 | 0,54-0,56 |
| 2017 | 11 | 589076 | 4752 | 0.81 | 0,78-0,83 |
| 2018 | 6 | 3923 | 157 | 4.00 | 3,43-4,66 |
| 2019 | 7 | 1255253 | 1054 | 0.08 | 0,08-0,09 |
| 2020 | 4 | 690032 | 7634 | 1.11 | 1,08-1,13 |
| 2021 | 1 | 22592 | 498 | 2.20 | 2,02-2,40 |
| Total | 65 | 2685623 | 16563 | 0.62 | 0,61-0,63 |
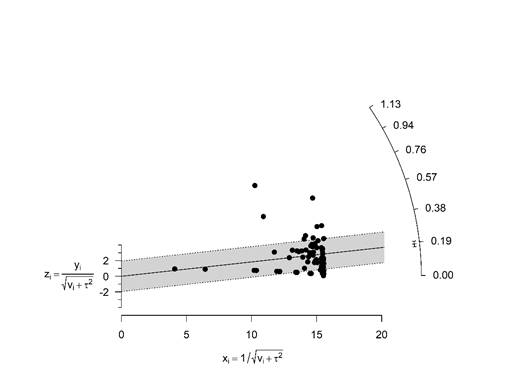
Al evaluar el sesgo y los efectos de los estudios pequeños mediante la observación del gráfico de embudo y la prueba de Egger y Begg para dichos efectos, se determinó que existía evidencia de sesgo de publicación en los estudios que informaron la prevalencia de brucelosis en bovinos y búfalos en las regiones estudiadas (Fig. 2), lo que puede estar relacionado con el hecho de que estaban disponibles muy pocos artículos sobre la prevalencia de brucelosis en Bovinos y Búfalos y los mismos estaban limitados a muy pocos países dentro de la región.
El metaanálisis de efectos aleatorios indicó que la variabilidad entre estudios fue alta (τ 2 = 0,0041; I2 = 100%, Q-test = 30409,47, gl = 72 y P<0,001). Los estudios se ponderaron aproximadamente igual que los estudios individuales que variaron del 0,1% al 1,6% debido a la alta heterogeneidad entre los mismos, en la figura 3 presentan el diagrama de bosque derivado del metaanálisis.
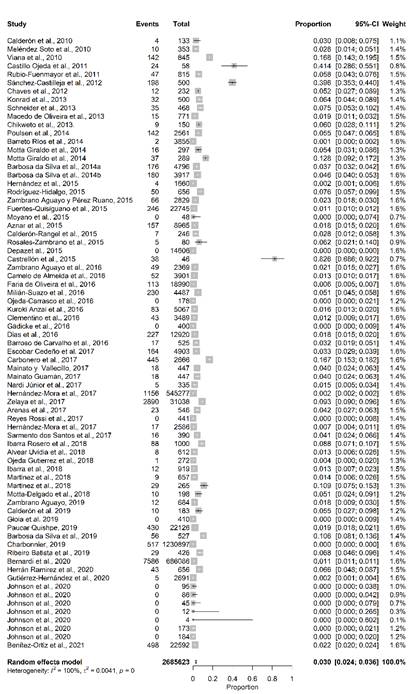
Fig. 3 Diagrama de bosque de la revisión sistemática y el metaanálisis basado en la prevalencia combinada general según los registros incluidos en el estudio.
Al analizar el gráfico de Galbraith (Figura 4) se pudo comprobar que el grado de heterogeneidad era tan elevado que la eliminación de los casos atípicos habría dejado muy pocos estudios para calcular estimaciones requeridas, esta situación se ha reportado por otros autores y se constituye en una de las principales limitaciones de este tipo de estudios (Adetunji et al., 2019).
Las prevalencias estimadas en los estudios individuales oscilaron entre el 0,0% y el 82,6%, con una prevalencia combinada general del 3,0% (IC 95%: 2,4-3,6), este resultado indica que, a pesar de todas las medidas tomadas en los diferentes países, como la vacunación, el diagnóstico y eliminación de los reactores positivos, la vigilancia epidemiológica entre otras, la enfermedad aun constituye un problema sanitario. Este resultado coincide con reportes realizados en México (Ordóñez-Velázquez et al., 2021) donde se concluye pese a la campaña de vacunación y la difusión de la información, el 71,12% del territorio nacional presenta la enfermedad de forma activa, asociando esta situación al incumplimiento de las medidas establecidas en el programa de control.
Reportes similares se presentan en países de otras regiones, como los realizados en Etiopia, donde se determinaron prevalencias combinadas del 3,0 (Asmare et al., 2014; Tesfaye et al., 2021). En Iran se informan elevadas prevalencias combinadas de la enfermedad en bovinos con un 34,4% (Moosazadeh et al., 2016).
En el metaanálisis por subgrupos se observó una prevalencia combinada en Sudamérica de 3,1% (IC 95%: 2,6 - 3,7) y en Centroamérica y el Caribe del 3,0% (IC 95%: 0,2 - 7,6) (Tabla 4), sin embargo, al realizar la evaluación a partir de la metarregresión multivariada (Fig. 5), no se comprobaron diferencias de la prevalencia combinada entre las regiones estudiadas, resultados similares a los reportados en estudios previos (Cárdenas Contreras, 2018).
Tabla 4 Comparación de la prevalencia combinada individual de brucelosis en bovinos y búfalos en las regiones de Centro América y el Caribe y Sudamérica.
| Regiones | Prevalencia (IC 95%) | I2 | Q | Prueba de Heterogeneidad | |
|---|---|---|---|---|---|
| GL | P | ||||
| Centroamérica y el Caribe | 0.030 (0.002 - 0.076) | 99.7% | 4862.77 | 15 | 0.000 |
| Suramérica | 0.031 (0.026 - 0.037) | 99.7% | 20750.48 | 56 | 0.000 |
| General | 0.030 (0.024 - 0.036) | 99.8% | 30409.47 | 72 | 0.000 |
Leyenda: IC: Intervalo de Confianza, GL: Grados de libertad, I2: Índice de varianza inversa, Q: Estadísticas Q de Cochrane, P: P-valor
Se constató una mayor prevalencia combinada en los búfalos, 5,2%, (IC 95%: 3,4 - 7,4) con respecto a los bovinos, 2,7% (IC 95%: 2,1 - 3,3) (Tabla 5).
Tabla 5 Análisis por subgrupos comparando la prevalencia combinada individual de brucelosis en las diferentes especies.
| Especies | Prevalencia (IC 95%) | I2 | Q | Prueba de Heterogeneidad | |
|---|---|---|---|---|---|
| GL | P | ||||
| Bovinos | 0.027 (0.021 - 0.033) | 99.8% | 29231.85 | 61 | 0.000 |
| Búfalos | 0.052 (0.034 - 0.074) | 95.3% | 214.17 | 10 | 0.000 |
| General | 0.030 [0.024 - 0.036) | 99.8% | 30409.47 | 72 | 0.000 |
Leyenda: IC: Intervalo de Confianza, GL: Grados de libertad, I2: Índice de varianza inversa, Q: Estadísticas Q de Cochrane tics, P: P-valor
Otros autores (Martínez et al., 2018), informan que esta situación puede estar relacionada al hecho de que los búfalos, por lo general, se han incluido en los programas de control y erradicación de la enfermedad en fechas más recientes en los países de las regiones estudiadas y es por ello que presentan una mayor prevalencia de la misma que el ganado bovino. Este comportamiento también puede estar relacionado con diferencias en la eficacia de las vacunas existentes entre el ganado bovino y bubalino, ya que en este último no se conoce bien la respuesta inmune a la vacunación (Rivera et al., 2016).
Si bien existen reportes que informan que los búfalos presentan un mayor grado de resistencia a la enfermedad (Fosgate et al., 2011), el contacto entre los rebaños bovinos y bufalinos, sea por su crianza mixta o por la presencia de búfalos de vida libre sin control veterinario, como por el crecimiento acelerado de su población, constituye un riesgo para lograr el control y erradicación de la enfermedad (Barbosa da Silva et al., 2014b) e indica la necesidad de atención especial a su desarrollo para la producción de carne y leche.
En el periodo de 2010 al 2016 se reportó una mayor prevalencia combinada, 4,3% (IC 95%: 3,2-5,6) con respecto al período 2017-2021, 2,0% (IC 95%: 1,3-2,7) (Tabla 6).
Tabla 6 Análisis por subgrupos comparando la prevalencia combinada individual de brucelosis en bovinos y búfalos en los periodos estudiados.
| Períodos | Prevalencia (IC 95%) | I2 | Q | Prueba de Heterogeneidad | |
|---|---|---|---|---|---|
| GL | P | ||||
| 2010 - 2016 | 0.043 (0.032 - 0.056) | 98.9% | 3318.95 | 36 | 0.000 |
| 2017 - 2021 | 0.020 (0.013 - 0.027) | 99.9% | 25229.96 | 35 | 0.000 |
| General | 0.030 [0.024 - 0.036) | 99.8% | 30409.47 | 72 | 0.000 |
Leyenda: IC: Intervalo de Confianza, GL: Grados de libertad, I2: Índice de varianza inversa, Q: Estadísticas Q de Cochrane, P: P-valor
Esta reducción en la prevalencia combinada de la enfermedad puede estar relacionada con la presencia de restricciones al comercio para aquellos países con infecciones activas por Brucella spp. (Carbonero et al., 2017), lo que ha conllevado a que en los últimos años muchos países de las regiones estudiadas presten especial atención a los programas de control de esta enfermedad, sobre todo aquellos dedicados a la exportación de ganado o productos ganaderos, como los de Sudamérica y México.
En trabajos previos se reporta que en países donde la brucelosis se presenta de forma endémica se ha constatado una tendencia a su reducción de la prevalencia en el período 1996-2014, a la vez que se reporta que las regiones de Centroamérica y Sudamérica se encuentran entre las más afectadas por la enfermedad a nivel global (Cárdenas Contreras, 2018).
En las regiones de Centroamérica y el Caribe y Sudamérica la mayoría de los más de 40 países que las conforman, a pesar de que hay programas de control establecidos, la enfermedad se presenta de forma endémica (Cárdenas Contreras, 2018) y aunque se comprueba una reducción general en la prevalencia combinada de la enfermedad en los últimos cinco años, la prevalencia combinada se mantiene alta, lo que es un indicador de la necesidad de incrementar las medidas para el control de la misma.
En el análisis de metarregresión multivariada se pudo comprobar que de las variables estudiadas resultaron significativas (P<0,01) el período de estudio y la especie animal (Fig. 5).
A partir de una revisión sistemática y el metaanálisis de los resultados, podemos proporcionar hallazgos bien fundamentados que se pueden utilizar en la formulación de políticas sanitarias y proponer sugerencias para futuras investigaciones (Mirnejad et al., 2017), el estudio realizado nos permitió comprobar una prevalencia combinada de la enfermedad mayor en búfalos, una disminución de la misma en los últimos cinco años y que no se presentaron diferencias entre las dos regiones estudiadas.
El estudio presentó como limitaciones la concentración de los estudios disponibles en cuatro países y la poca disponibilidad de estudios donde se evalúe la prevalencia en la especie bufalina, aspectos que se deben tener en cuenta en futuros trabajos.