INTRODUCCIÓN
Las aves de traspatio no demandan grandes costos de inversión y manutención para su crianza, por lo que los productores aprovechan al máximo la relación suelo-planta-agua-animal para mantenerlas y obtener de las aves una fuente de proteína (carne y huevos) para los consumidores y un ingreso monetario adicional para quien produce. Estas aves son las que comúnmente se explotan en zonas rurales ya que presentan características muy favorables para la crianza a nivel familiar, por ser resistentes a las condiciones locales de humedad y temperatura, pues han experimentado un proceso de selección natural a través de muchos años. Se alimentan de insectos, moluscos, frutas, residuos de cosechas, desechos de cocina y otros alimentos alternativos, son más resistentes a las enfermedades que cualquier otro tipo de gallinas (Andrade et al., 2018).
La crianza de gallos de lidias criollos cubanos desde el inicio de la nacionalidad cubana es parte inseparable de las familias campesinas a lo largo de toda la Isla, manteniendo sus crías por varios cientos de años, convirtiéndose en una tradición cultural arraigada en el tiempo hasta nuestros días, las actividades asociadas a los gallos generan fuente de empleo para muchas personas y es el sustento activo de muchas familias por los ingresos que se generan por la venta de sus animales, además de que los excedentes en carne y huevos son utilizados en el autoconsumo familiar a pesar de que esta no es su principal finalidad (Estatutos y Reglamento Nacional, 2020).
La avicultura es una actividad de importancia por constituirse en una fuente de alimento de las familias campesinas, por su aporte a la economía familiar y por brindar un importante recurso zoogenético al país. Dada la amplia variabilidad genética de la gallina criolla, se han desarrollado diversos estudios sobre este genofondo, que parten de una identificación y caracterización de las variedades criollas para llegar a determinar el potencial genético asociado a producción y resistencia a enfermedades (Villacís et al., 2016).
La avicultura es una actividad de importancia por constituirse en una fuente de alimento de las familias campesinas, por su aporte a la economía familiar y por brindar un importante recurso zoogenético al país. Dada la amplia variabilidad genética de la gallina criolla, se han desarrollado diversos estudios sobre este genofondo, que parten de una identificación y caracterización de las variedades criollas para llegar a determinar el potencial genético asociado a producción y resistencia a enfermedades (Villacís et al., 2016).
Uno de los problemas más alarmantes que se presenta hoy a nivel mundial es la extinción de especies y razas por diferentes razones; una de las más importantes es de carácter natural, ocasionada por la pérdida o disminución de la resistencia a algunas enfermedades, así como la
incapacidad para adaptarse a ciertos tipos de clima. Otros factores son la pérdida de recursos genéticos ocasionados por explotaciones intensivas de producción, selección genética, especies ajenas introducidas a un nuevo hábitat, así como los costos tanto de criopreservación de material genético como para el análisis molecular que ocasionan dificultad para preservarlo y realizar sus estudios futuros de caracterización genética (Zinovieva et al., 2019; Roh et al., 2020).
Algunas poblaciones animales poseen características que son únicas en ambientes específicos y que sufren una dilución genética o extinción, sin que puedan ser caracterizadas ni morfológica ni genéticamente. Por esto se hace necesario evaluar animales provenientes de un mayor número de regiones agroecológicas y sistemas de producción (Dhorne, 2020).
La conservación de los recursos genéticos resulta un tema de suma importancia por su incidencia directa sobre el bienestar y la supervivencia de la especie humana. En Cuba se trabaja en la caracterización de varios de estos recursos. El gallo de lidia criollo cubano (GLCC) formar parte indisoluble de nuestras tradiciones campesinas, no obstante, no se conocen estudios de caracterización de su sistema de crianza, de su morfológica, ni de la diversidad genética en este recurso zoogenetico, que son indispensables para la elaboración de programas de conservación y mejora en estas aves, por lo que el presente trabajo tiene como objetivo caracterizar la faneróptica del gallo de lidia criollo cubano (GLCC).
MATERIALES Y MÉTODOS
El trabajo se desarrolló en las regiones occidental, central y oriental de Cuba, entre los 23°17', 19°50' de latitud norte y los 74°08', 84°58' de longitud, en criaderos particulares pertenecientes a criadores asociados a la Empresa Nacional para la Protección de la Flora y la Fauna (ENPFF).
Características climáticas
El clima de Cuba se clasifica como subtropical húmedo, con dos estaciones claramente definidas, la seca de noviembre a abril y la lluviosa de mayo a octubre con brisas continuas el año entero que refrescan sustancialmente. La temperatura media anual es de 24°C, la media en invierno es de 20°C y la de verano es de 26-27°C. Las temperaturas mínimas varían entre 1°C y 8,5°C en el occidente del país y entre 3°C y 12,5°C en la región oriental; las temperaturas máximas medias oscilan entre 27,7 °C y 32,8 °C, las máximas registradas están entre 36°C y 38°C. El promedio histórico de la humedad relativa media es del 78 %. Los acumulados de lluvia anual registran como promedio un total de 1450,3 mm, correspondiendo al período lluvioso un total de 1003,5 mm y 446,8 mm al poco lluvioso (INSMET, 2015).
Animales y mediciones
Para la caracterización faneróptica el muestreo se realizó a 1 514 aves adultas, 1 227 hembras y 287 machos, pertenecientes a criadores de gallos de lidia criollos cubanos de las regiones occidental, central y oriental del país, asociados a la ENPFF quienes informan que las aves utilizadas en la investigación son criollas.
Caracteres fanerópticos evaluados: Color del plumaje, color de los tarsos, color de los ojos, color del pico y tipo de cresta.
Analisis estadisticos
Se determinaron las frecuencias para cada sexo, de color del plumaje, color de ojos, tipo de cresta, color de pico y color del tarso, mediante el procedimiento FREQ del paquete estadístico SPSS versión 25®. Para evaluar el efecto del sexo en el color de los ojos, tipo de cresta y color del tarso se utilizó la prueba de Chi cuadrado con el método exacto y comparaciones por pares de proporciones con la corrección de Bonferroni y para el tipo de cresta la prueba binomial.
RESULTADOS Y DISCUSIÓN
Frecuencias observadas para las características fanerópticas por sexo (hembras/h y machos/m)
En la tabla 1 se muestran los valores de frecuencia y el porcentaje que se observó para los colores en la población de gallos de lidia criollos cubanos estudiados.
Los colores del plumaje del GLCC presentan una alta variabilidad fenotípica que caracteriza a las aves locales por la manifestación de diferentes tipos de tonalidades e innumerables combinaciones de colores que deriva de la presencia de genes multialélicos (Toalombo et al., 2019a). Esta es una cualidad apreciable en su ancestro el gallo español de combate, según lo refiere Méndez el al. (2010) y que es una característica que las diferencian de las líneas comerciales y de otras razas.
Tabla 1 Frecuencias observadas para el color del plumaje.
| Color | Frecuencia | Porcentaje | |||
| H | M | H | M | ||
| Indio | 672 | 154 | 54,76 | 53,60 | |
| Cenizo | 103 | 33 | 8,39 | 11,40 | |
| Amarillo | 26 | 6 | 2,11 | 2,09 | |
| Canelo | 118 | 22 | 9,61 | 7,66 | |
| Giro | 133 | 28 | 10,85 | 9,85 | |
| Blanco | 63 | 14 | 5,15 | 4,90 | |
| Pinto | 112 | 30 | 9,13 | 10,50 | |
El color de plumaje predominante para ambos sexos fue el indio, con un 54,76 % de presentación para las hembras y un 53,60 % para los machos, muy superior al resto de los colores, los valores más bajos correspondieron a las aves con plumajes blancos y amarillos. Estos resultados son semejantes a los descritos por Larrea (2012) al estudiar una población de gallinas locales en Santiago de Cuba, con un 88,33% de presentación para los colores oscuros. Los resultados obtenidos para el GLCC concuerdan con los obtenidos por Lázaro et al. (2012) en el trabajo realizado en el estado de Puebla, donde tanto en gallos como en gallinas predominan los colores negro y rojo, cuestión esta muy importante para los animales que se crían en áreas rurales y en sistemas semi-extensivos por la posibilidad que le brindan los plumajes oscuros para camuflarse de los depredadores tanto aéreos como terrestres.
Valdés et al. (2010) al estimar por el método de observación la frecuencia de aparición de algunos rasgos de apariencia fenotípica de la gallina Criolla (Gallus Gallus) en tres zonas del valle San Andrés del municipio La Palma, en la provincia de Pinar del Río, informan resultados similares a los nuestros, donde los caracteres dominantes para el color de la pluma son: plumaje negro (25 %), negro y rojo (22 %) y giro (15 %) siendo el gris y blanco (3 %) los menos representados. Las aves con plumajes oscuros acumulan el 75 % de la muestra.
Los resultados de esta investigación son similares a los expuestos por Méndez (2011) al estudiar líneas jerezanas y sevillanas de combate que exhiben gran variedad de colores, con mayor preponderancia para los colores oscuros coincidiendo también con Marshall et al. (2021) en los reportes de su investigación referente a la amplia gama de colores presentados por las aves.
Varios autores informaron resultados similares, en gallinas criollas de México tanto Zaragoza et al. (2013), en la región Batsi Alak de Chiapas, como Hernández et al. (2017), en Veracruz, observaron un predominio de tonalidades oscuras, al igual que Revelo et al. (2017) en Colombia y Toalombo et al. (2019a) en Ecuador. En gallinas finas, sólo existe el trabajo de Vázquez et al. (2015) que reportaron, en una población de gallinas finas en la provincia de Camagüey, Cuba, el indio como el color del plumaje predominante.
El color de los ojos se ha descrito muy poco en la literatura, aunque el mismo puede ser de utilidad para inferir la influencia de razas exóticas de combate sobre los animales criollos. Los resultados de esta investigación arrojan que el color de ojos rojos fue el de mayor porcentaje de presentación para las gallinas con un 56,20 %, seguidos de naranjas y negros con un 26,5 % y 17,3 % (Fig. 1). Estos son valores superiores a los obtenidos por Revelo et al. (2017), quienes describen frecuencias que corresponden a ojos negros 26,70 %, ojos rojos 32,90 % y perla 40,5 %, respectivamente. En el caso de los gallos incluidos en este trabajo los colores de ojos observados fueron rojo, naranja y verde con los siguientes valores porcentuales: 69, 70 %, 24, 70 % y 5, 60 %, respectivamente, sin que se identificaran animales con ojos negros.
Los resultados muestran que el mayor porciento es de animales de ojos rojos para ambos sexos, cualidad esta apreciable en su ancestro el gallo español de combate; así lo refiere Méndez (2010) en estudios realizados en esta raza, donde el color del iris debe ser rojo o anaranjado.
Hernández et al. (2017) para el color de los ojos describe resultados diferentes a los nuestros, donde el color predominante fue el naranja tanto en hembras como en machos al evaluar gallinas criollas en Veracruz, México. Aunque este color se observó en los ojos de nuestras aves, tanto en hembras como en machos, los valores son inferiores.
En la bibliografía consultada no hay reportes de la existencia de relación entre el color de los ojos y el color del plumaje. Al parecer el color de los ojos no está relacionado con el color de las plumas.
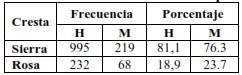
Sólo se presentaron animales con cresta sierra y rosa con los mayores porcentajes en ambos sexos para la primera. Para cresta en sierra se obtuvieron valores de 81,10 % en hembras y 76,30 % en machos, mientras para la cresta en rosa los valores fueron 18,90 % en hembras y 23,70 % en machos (Tabla 2). Estos resultados coinciden con Revelo et al. (2017) y Galíndez (2020) quienes obtuvieron los mayores porcentajes de presentación para las aves con cresta en sierra o simple, al evaluar las características simples, guisante, rosa y nuez. Se encontró un 86,4 %; 5,5 %; 4,5 % y 3,6 % para los gallos, mientras que las gallinas registraron frecuencias correspondientes a un 83,3·%; 8,8 %; 1,0 % y 6,9 % respectivamente. Los animales con cresta rosa presentaron menor porcentaje de presentación para ambos sexos que en nuestros animales.
Tabla 2, Frecuencias observadas para el tipo de crestra
| Cresta | Frecuencia | Porcentaje | |||
| H | M | H | M | ||
| Sierra | 995 | 219 | 81,1 | 76.3 | |
| Rosa | 232 | 68 | 18,9 | 23.7 | |
Valdés et al. (2010) describen resultados similares a los nuestros con los mayores porcentajes para cresta sencilla 82 %, en rosa 11 %, y también refiere la presencia de cresta en nuez 5 % y en guisante 2 %, estas últimas no se presentan en los animales evaluados en nuestro trabajo. Varios trabajos asocian la cresta en rosa con una baja fertilidad, especialmente en los machos en estado homocigótico (RR), atribuible a un decremento en la viabilidad espermática en comparación con los otros fenotipos y es importante por ser una vía para la pérdida de calor en las aves, por lo que a mayor tamaño se garantiza un medio eficiente para la disipación del calor (Toalombo et al., 2019b).
De igual forma los resultados de la presente investigación coinciden con Tovar et al. (2014), quienes describen que la forma más frecuente de las crestas, en hembras y machos fue simple que está presente en el 100 % de las gallinas rojas marrones, el 90 % de las gallinas blancas y en el 78 % de las gallinas negras y barradas utilizadas en su investigación. Igualmente, Toalombo et al. (2019a) describen que la forma más frecuente de las crestas fue la sencilla (76,74 %), no observaron crestas en rosa, pero sí de tipo nuez (8,20 %), esta última no está presente en los animales que se muestrearon, pues tanto la cresta en nuez como en guisante son rasgos distintivos de aves de origen asiático.
Parés y Berenger (2020), al estudiar las características morfológicas y variaciones en gallinas autóctonas del grupo mediterráneo, destacan con mayor frecuencia el tipo de cresta sencilla y con menor valor las restantes, lo que coincide con los resultados de este trabajo.
Para el color del pico los resultados obtenidos en el presente trabajo revelan que en ambos sexos el color predominante fue amarillo-marrón con 51,10 % para las gallinas y 44,90 % para los gallos (Fig.2), lo que no coincide con Valdés et al. (2010) quienes informan en su trabajo que en el 78 % de los machos es amarillo y negro en el 54 % de las hembras. En el caso del color blanco el porcentaje fue el más bajo con un 8 %, similar a los resultados obtenidos en esta investigación, donde los picos blancos aparecen en el 10,10 % en hembras y 10,20 % en machos; el color negro no se presenta en las aves muestreadas en esta investigación.
En aves mediterráneas los colores del pico predominante son blancos, negros, amarillos, azul grisáceo y blanco rosado en frecuencia descendente (Parés y Berenger, 2020); el presente trabajo coincide solo en el color amarillo lo que en opinión del autor demuestra la diversidad de colores del pico en animales de origen europeo.
Los tarsos de color amarillo son los de mayor porcentaje de presentación para las hembras con un 77,10 % y para los machos con un 88,20 %, seguido de tarsos blancos con un 18,80 % en hembras y 11,80 % en machos; en menor proporción aparecen los de color verde con 4,10 % para las hembras, este último no se presentó en los machos (Tabla 4), Tovar et al. (2014) al evaluar gallinas criollas de Colombia encontraron que el color amarillo de los tarsos fue el de mayor presentación con 49,80 % y 16,00 % para el color blanco y el resto fueron negro y marrón que no se observaron en nuestra investigación.
Tabla 4 Frecuencias observadas para el color del tarso.
| Color | Frecuencia | Porcentaje | |||
| H | M | H | M | ||
| Amarillo | 946 | 253 | 77,1 | 88,2 | |
| Blanco | 231 | 34 | 18.8 | 11,8 | |
| Verde | 50 | 0 | 4.1 | 0 | |
Revelo et al. (2017) informan que los tarsos amarillos fueron los de mayor presentación en ambos sexos, aunque inferiores a los nuestros para tarsos amarillos y blancos en machos con valores de 80,60 % y 1,90 %, mientras que en gallinas se encontraron frecuencias correspondientes a un 41,40 % y 2,0% respectivamente, también inferiores a los identificados en este trabajo. En gallinas no encontraron tarsos de color verde, mientras que en los animales incluidos en este estudio sí se observaron, con un 4,10 % de presentación.
Características fanerópticas por sexo
El color de ojos predominante, tanto para hembras como para machos, es el rojo seguido del naranja (Tabla 5), a diferencia de lo descrito por Hernández et al. (2017) quien observó que el color de ojos predominante en ambos sexos fue el naranja. En los GLCC estudiados no se observan diferencias significativas entre estos dos colores para ambos sexos, aunque sí existen diferencias significativas con el color de ojos negros en el caso de las gallinas y con el verde para el caso de los gallos (Tabla 5). En las hembras no hubo presencia de ojos de color amarillo y en los machos no se presentó el color de ojos negros.
Tabla 5 Relación entre el sexo y el color de los ojos.
| Color ojo | Total | |||||
|---|---|---|---|---|---|---|
| Rojo | Naranja | Negro | Amarillo | |||
| Hembras | Recuento | 689a | 326a | 212b | 0c | 1227 |
| Recuento esperado | 720,5 | 264,2 | 229,4 | 13,0 | 1227,0 | |
| % dentro de Sexo | 56,2% | 26,6% | 17,3% | 0,0% | 100,0% | |
| % dentro de Color ojo | 77,5% | 74,9% | 100,0% | 0,0% | 81,0% | |
| Machos | Recuento | 200a | 71a | 0b | 16c | 287 |
| Recuento esperado | 168,5 | 53,6 | 61,8 | 3,0 | 287,0 | |
| % dentro de Sexo | 69,7% | 24,7% | 0,0% | 5,6% | 100,0% | |
| % dentro de Color ojo | 22,5% | 25,1% | 0,0% | 100,0% | 19,0% | |
| Total | Recuento | 889 | 283 | 326 | 16 | 1514 |
| Recuento esperado | 889,0 | 283,0 | 326,0 | 16,0 | 1514,0 | |
| % dentro de Sexo | 58,7% | 18,7% | 21,5% | 1,1% | 100,0% | |
| % dentro de Color ojo | 100,0% | 100,0% | 100,0% | 100,0% | 100,0% | |
Cada letra del superíndice denota un subconjunto de color de ojo cuyas proporciones de columna difieren de forma significativa entre sí en el nivel 0,05.
Los resultados obtenidos en esta investigación indican un predominio significativo (P < 0,001) de la cresta en sierra o simple tanto para hembras (Fig. 3), como para machos (Fig. 4), seguida de animales con cresta en rosa (Tabla 6). Estos resultados coinciden con los descritos por Revelo et al. (2017) y Toalombo (2019a) quienes identificaron animales de cresta en sierra con el mayor porcentaje de presentación
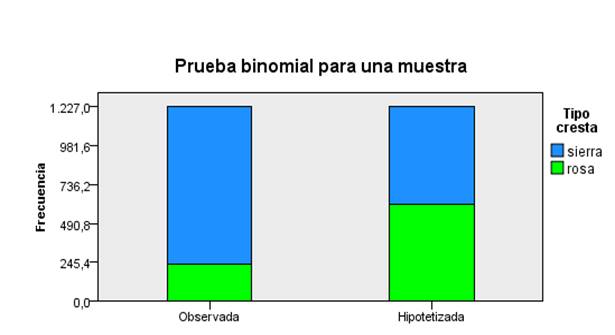
Fig 3 Tipo de cresta (hembras). (N= 1227; Estadístico de contraste= 995,000; Error estándar= 17,514; Estadístico de contraste estandarizado=21,754; Sig. asintótica (prueba bilateral= 0,000)

Fig. 4 Tipo de cresta (machos). (N= 287; estadístico de contraste= 219,000; Error estándar= 8,471; Estadístico de contraste estandarizado= 8,854; Sig. asintótica (prueba bilateral= 0,000)
Tabla 6 Relación entre el sexo y el tipo cresta.
| Tipo de cresta | Total | |||
|---|---|---|---|---|
| Sierra | Rosa | |||
| Hembras | Recuento | 995a | 232b | 1227 |
| Recuento esperado | 983,9 | 243,1 | 1227,0 | |
| % dentro de Sexo | 81,1% | 18,9% | 100,0% | |
| % dentro de Tipo cresta | 82,0% | 77,3% | 81,0% | |
| Machos | Recuento | 219a | 68b | 287 |
| Recuento esperado | 230,1 | 56,9 | 287,0 | |
| % dentro de Sexo | 76,3% | 23,7% | 100,0% | |
| % dentro de Tipo cresta | 18,0% | 22,7% | 19,0% | |
| Total | Recuento | 1214 | 300 | 1514 |
| Recuento esperado | 1214,0 | 300,0 | 1514,0 | |
| % dentro de Sexo | 80,2% | 19,8% | 100,0% | |
| % dentro de Tipo cresta | 100,0% | 100,0% | 100,0% | |
Cada letra del superíndice denota un subconjunto de tipo cresta cuyas proporciones de columna no difierende forma significativa entre sí en el nivel 0,05.
El color del pico predominante fue la combinación de amarillo-marrón tanto para hembras como para machos, con diferencias significativas con el resto de los colores descritos (Tabla 7). Esto no coincide con Valdés et al. (2010) quien describe en su trabajo que el 78 % de los machos presentaron pico amarillo y negro el 54 % de las hembras; en esta investigación se presentan en menor proporción picos blancos, amarillos y marrón para ambos sexos.
Tabla 7 Relación entre el sexo y color pico.
| Color del pico | Total | ||||||
|---|---|---|---|---|---|---|---|
| Amarillo- marrón | Blanco | Blanco- marrón | Amarillo | Marrón | |||
| Hembras | Recuento | 627a | 126b | 121c | 353ab | 0d | 1227 |
| Recuento esperado | 612,7 | 125,6 | 102,9 | 377,7 | 8,1 | 1227,0 | |
| % dentro de Sexo | 51,1% | 10,3% | 9,9% | 28,8% | 0,0% | 100,0% | |
| % dentro de Color pico | 82,9% | 81,3% | 95,3% | 75,8% | 0,0% | 81,0% | |
| Machos | Recuento | 129a | 29 b | 6c | 113ab | 10d | 287 |
| Recuento esperado | 143,3 | 29,4 | 24,1 | 88,3 | 1,9 | 287,0 | |
| % dentro de Sexo | 44,9% | 10,1% | 2,1% | 39,4% | 3,5% | 100,0% | |
| % dentro de Color pico | 17,1% | 18,7% | 4,7% | 24,2% | 100,0% | 19,0% | |
| Total | Recuento | 756 | 155 | 127 | 466 | 10 | 1514 |
| Recuento esperado | 756,0 | 155,0 | 127,0 | 466,0 | 10,0 | 1514,0 | |
| % dentro de Sexo | 49,9% | 10,2% | 8,4% | 30,8% | 0,7% | 100,0% | |
| % dentro de Color pico | 100,0% | 100,0% | 100,0% | 100,0% | 100,0% | 100,0% | |
Cada letra del superíndice denota un subconjunto de color del pico cuyas proporciones de columna difieren de forma significativa entre sí en el nivel 0,05.
El color de tarso predominante tanto para hembras como para machos fue el amarillo seguido del blanco (Tabla 8), similar a lo obtenido por Tovar et al. (2014) quienes al evaluar gallinas criollas identificaron que el color amarillo de los tarsos es el de mayor presentación. En nuestro caso se observan diferencias significativas entre este y el resto de los colores descritos para ambos sexos; en los machos no se identificó la presencia de tarsos de color verde
Tabla 8 Relación entre el sexo y el color del tarso.
| Color del tarso | Total | ||||
|---|---|---|---|---|---|
| Amarillo | Blanco | Verde | |||
| Hembras | Recuento | 946a | 231b | 50c | 1227 |
| Recuento esperado | 971,7 | 214,8 | 40,5 | 1227,0 | |
| % dentro de Sexo | 77,1% | 18,8% | 4,1% | 100,0% | |
| % dentro de Color del tarso | 78,9% | 87,2% | 100,0% | 81,0% | |
| Machos | Recuento | 253a | 34b | 0c | 287 |
| Recuento esperado | 227,3 | 50,2 | 9,5 | 287,0 | |
| % dentro de Sexo | 88,2% | 11,8% | 0,0% | 100,0% | |
| % dentro de Color del tarso | 21,1% | 12,8% | 0,0% | 19,0% | |
| Total | Recuento | 1199 | 265 | 50 | 1514 |
| Recuento esperado | 1199,0 | 265,0 | 50,0 | 1514,0 | |
| % dentro de Sexo | 79,2% | 17,5% | 3,3% | 100,0% | |
| % dentro de Color del tarso | 100,0% | 100,0% | 100,0% | 100,0% | |
Cada letra del superíndice denota un subconjunto de color del tarso cuyas proporciones de columna difieren de forma significativa entre sí en el nivel 0,05.
CONCLUSIONES
Como características fanerópticas del gallo de lidia criollo cubano se encontró un predominio del plumaje indio, la cresta en sierra, los ojos rojos, el pico amarillo-marrón y los tarsos amarillos, aunque existen otras variedades fenotípicas. Los colores oscuros son el resultado de la preferencia de cada criador y de la adaptación al medio, que les permite camuflarse con facilidad.
Se dispone de diversos datos que, al ser estudiados en forma metódica, dejan claramente visible un verdadero y efectivo fenotipo del gallo de lidia criollo cubano muy semejante a las razas españolas que le dieron origen