Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Ciencias Informáticas
versión On-line ISSN 2227-1899
Rev cuba cienc informat vol.9 no.2 La Habana abr.-jun. 2015
ARTÍCULO ORIGINAL
Controlador Predictivo para la Infusión Subcutánea de Insulina en un Páncreas Artificial
Predictive Controller for the Subcutaneous Infusion of Insulin in an Artificial Pancreas
Dainelys Toledo Enriquez1*, Ana Isabel González Santos2, Abel Toledano Hernández1, Adrián Iglesias Benitez1, Jorge Gentile Martínez-Casado1, Dennys Julián González Aguilera1
1 Centro de Inmunoensayo. Calle 134 y Ave. 25 Cubanacán, Playa. CP 11600. Ciudad de La Habana, Cuba.
2 Departamento de Automática y Computación –Facultad Eléctrica, ISPJAE. Calle 114 No. 11901, Marianao, La Habana, Cuba.
*Autor para la correspondencia: dainelys.toledo@cie.cu
RESUMEN
En este trabajo se presenta la síntesis y ajuste de un controlador predictivo vía simulación para la administración de insulina en un páncreas artificial. El trabajo requirió del estudio del comportamiento de la concentración de insulina en el páncreas humano, la adquisición de datos experimentales en pacientes diabéticos, la obtención de modelos para describir dicho comportamiento en diferentes etapas del metabolismo y la simulación y sintonía de un controlador avanzado para la administración de insulina en dosis adecuadas a pacientes que sufren de la enfermedad de diabetes.
Palabras clave: modelado de sistemas continuos, identificación de sistemas y estimación de parámetros, control predictivo basado en modelos, simulación de sistemas, control de variables fisiológicas y clínicas.
ABSTRACT
In this paper the synthesis and tuning of a predictive controller of insulin administration in an artificial pancreas, by simulation, are presented. This work required the study of the behavior of insulin’s concentration in the human pancreas, the obtaining experimental data in diabetic patients, the modeling and identification of this behavior in the different metabolic faces and the simulation and tuning of advanced controller for the insulin administration in exact doses for diabetic patients.
Key words: continuous system modelling, systems identification and parameters estimation, model predictive control, simulation, physiologic and clinic variables control.
INTRODUCCIÓN
La diabetes representa un gran problema de salud pública y es una enfermedad común en los países industrializados. Esta enfermedad afecta a ambos sexos y a todas las razas sin respetar límite de edad. Según datos de la Federación Internacional de Diabetes (IDF) la previsión a medio plazo es un aumento de la población mundial afectada. Se estima que el número de diabéticos en el mundo subirá de 284.6 millones en 2010 a 438.4 millones en 2030, correspondiendo respectivamente al 6.6% y 7.8% de la población mundial adulta entre 20 y 79 años (IDF, 2014).
La diabetes mellitus (del griego diabainein, “pasar a través” y del latín mellitus, “endulzado con miel”, de ahora en adelante se referirá como diabetes), es conocida desde tiempos muy antiguos. (Guyton, A.C., & Hall, J.E, 2001). Se define como el trastorno del metabolismo de los carbohidratos, resultante de una producción insuficiente de insulina, o de una sensibilidad reducida a ésta. También se entiende como una colección de síndromes que tienen en común una hiperglucemia de diversa severidad con una peculiar tendencia a lesionar los macro y micro vasos del organismo y/o del sistema nervioso. A medio o largo plazo da origen a las complicaciones de la diabetes que originan múltiples problemas médicos: oftalmológicos, renales, neurológicos, cerebrovasculares, cardiovasculares, entre otros, (Goderich, 2002), (Roselló, 2011).
Los tres constituyentes más importantes en la alimentación de una persona son los carbohidratos, las grasas y las proteínas. Cuando se realiza una ingesta, de los nutrientes se obtiene la glucosa y esta depende de la insulina para poder ser aprovechada por las células. Los carbohidratos se descomponen en pequeños azúcares, entre ellos la fructosa, de la que se obtiene la glucosa (transformada en el hígado).
La glucosa es el último eslabón de los carbohidratos ingeridos y tiene tres destinos principales: almacenarse en forma de glucógeno en hígado y músculos, convertirse en grasa o ser utilizada directamente. En este sentido, el hígado es el único órgano productor de glucosa ya que el glucógeno muscular se utiliza como fuente de energía en el mismo músculo.
La regulación glucémica natural tiene por objetivo asegurar un perfecto equilibrio entre la producción de glucosa y su consumo, donde las principales hormonas implicadas en el control son la insulina, el glucagón, la hormona del crecimiento, los glucocorticoides, la adrenalina y la tiroxina.
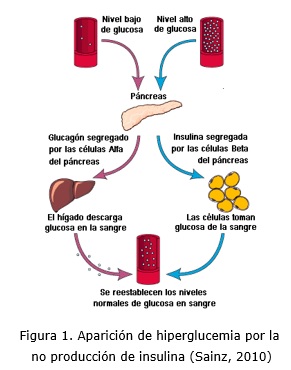
El principal órgano encargado de que se realice la regulación glucémica es el páncreas. El páncreas es el responsable de la digestión de las grasas, las proteínas y los carbohidratos de cadena larga, mediante enzimas (función exocrina) y la regulación del nivel de glucosa sanguínea (función endocrina), mediante el glucagón (hormona hiperglucemiante) y la insulina (hormona hipoglucemiante), (UNED, 2014), (Sainz, 2010). Ver figura 1.
La diabetes es una enfermedad crónica cuyas complicaciones solo pueden mitigarse con terapias con insulina. En las terapias actuales con insulina el paciente mide su glucosa y en función a esa medida, a su actividad física e ingestas toma la decisión de cuánta insulina administrarse. El objetivo de todas las formas de tratamiento de la diabetes Tipo 1 es mantener el nivel de glucosa en sangre dentro de los límites normales y de esta forma reducir las complicaciones. Para conseguirlo se intenta reproducir fielmente los perfiles administrados por un páncreas no patológico.
Una terapia con insulina es el control de la glucemia, entendido como la restauración cualitativa y cuantitativa de los niveles normales de glucosa. En la diabetes Tipo 1, la falta de secreción de insulina por parte de las células β del páncreas es absoluta, por tanto la administración exógena de insulina es inevitable e imprescindible para conseguir un estado normoglucémico artificial que no es una tarea sencilla. Esto es debido a que el sistema glucorregulatorio está afectado por un amplio número de factores como son la dieta, el ejercicio físico y la educación del paciente sobre su propia enfermedad, pero no son los únicos. Estos factores hacen difícil la elección de las acciones terapéuticas más adecuadas ya que modifican el efecto de la insulina y el metabolismo de la glucosa en un mismo paciente sometido a un mismo tratamiento.
Es necesario asegurar que la dosis de insulina se mantenga en el rango establecido para los que padecen diabetes Tipo 1. Cuando no se garantizan los valores adecuados se puede afectar por un lado la eficiencia del tratamiento y por otro la vida de la persona que lo recibe. Todo lo anterior hace constante la investigación científica alrededor de esta enfermedad, sus tratamientos y sistemas biomédicos de apoyo (Bondia et al, 2010), (Dassau et al, 2008), (El-Kathib et al, 2010), (El-Youssef et al, 2009), (Hovorka, 2005), (Hyunjin, 2008), (Jean-Jacques, 2002), (Kovacs and Kulcsar, 2010), (Raimondo, 2010), (Rodríguez, 2010). En tal sentido este trabajo propone la síntesis de un controlador avanzado para la administración óptima de la insulina, un controlador predictivo basado en modelo.
MATERIALES Y MÉTODOS
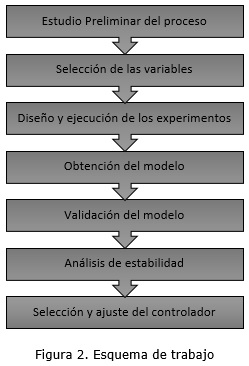
Para tratar los temas del modelado y el control se siguió el esquema de trabajo que se muestra en la figura 2.
La técnica de control predictivo requiere de un modelo del proceso a controlar. En su forma más general como plantean (Camacho y Bordons, 1998) ese modelo garantiza las predicciones de las variables de interés del proceso y por consiguiente el comportamiento del proceso en el futuro. Con las predicciones del modelo y las referencias se formaliza una función objetivo y se resuelve un problema de optimización a lo largo de una ventana de predicción. La solución de este problema permite calcular las variables de control óptimos que permiten alcanzar las referencias deseadas. Siguiendo una estrategia de horizonte deslizante sólo al proceso se aplica la primera de todas las acciones de control óptimas calculadas y se retroalimenta el efecto de esa acción a través de las mediciones de las variables controladas al modelo.
Modelo matemático experimental que representa el ciclo metabólico glucosa-insulina.
Atendiendo a la complejidad de este proceso metabólico y a su naturaleza cíclica natural se decidió describir el comportamiento no lineal que lo caracteriza a través de un multimodelo que fuera capaz de describir dinámicamente el proceso en diferentes regímenes de trabajo.
En cada régimen de operación fue obtenido un modelo lineal mediante ecuaciones relacionales de las variables características del sistema. Estas relaciones fueron sacadas del Tratado de Fisiología (Guyton y Hall, 2001).
De las gráficas relacionales que se mostrarán en la figura 3 para cada régimen, se realizó un ajuste polinómico con la ayuda de la herramienta de ajuste de curvas en Matlab2013a (MathWorks, 2013) y se obtuvo una expresión matemática aproximada.
Las expresiones en el tiempo se llevaron al dominio de la frecuencia a través de la transformada de Laplace obteniendo los modelos en el tiempo y en el dominio de la frecuencia compleja s. En el anexo 1 se resumen los modelos en ambos dominios y el porciento de ajuste.
De los regímenes de operación anteriormente tratados, se determinó que desde el punto de vista de ajustar el controlador, el que se utilizará es el régimen con o durante ingesta.
En el mismo se puede palpar la necesidad de la presencia de insulina ante un aumento del nivel de glucosa, objetivo fundamental del control.
Modelo matemático experimental que representa el ciclo metabólico insulina-glucosa
En estadística y procesamiento de señales, un modelo auto-regresivo es una representación de un tipo de proceso aleatorio, como tal, que describe ciertos procesos variables en el tiempo ya sea en la naturaleza, la economía, etc.
El modelo auto-regresivo especifica que la variable de salida depende de sus propios valores anteriores. Es un modelo expresado mediante una ecuación en diferencias, debido a que estos han demostrado ser una aproximación al proceso lo suficientemente precisas y sencillas si de controlar el mismo se trata.
Contando con datos experimentales y haciendo uso de la toolbox “Ajuste de curvas” de Matlab2013a, se pudo obtener una expresión matemática gaussiana de orden 2, con R2 de 0.987 que representa el comportamiento del régimen con o durante ingesta. Dicha relación matemática se muestra en la ecuación (1).
![]()
Posteriormente se tomaron datos reales de pacientes diabéticos, cuyo principal objetivo fue conocer el comportamiento de su nivel de glucosa durante siete días realizando las actividades normales de su vida cotidiana. Estos datos permitieron conocer cómo se comportan generalmente los valores de glucosa y cómo responden a las dosis de insulina indicadas por los médicos y la dieta.
Con el estudio preliminar del proceso, se logró determinar las variables fundamentales dentro del mismo y definir cuáles se utilizarían para la modelación. Se tomaron todos los valores posibles de glucosa medida y se generó una señal sinusoidal con el objetivo de estimular el sistema (ecuación 1) en el mayor rango posible de la variable de entrada (glucosa), que fisiológicamente se corresponde con este tipo de señal. Estos datos de entrada se le introdujeron a la ecuación (1) y arrojó como resultado un grupo de valores de la variable de salida (insulina). Precisamente, lo que se persigue con la obtención de este modelo es utilizarlo para predecir el valor de insulina óptimo que necesita administrársele al paciente ante un determinado valor de glucosa medida.
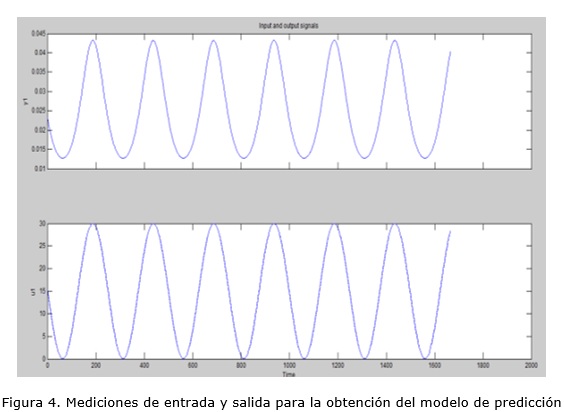
Se recolectaron los datos con un período de muestreo de 60 segundos, pues la concentración de glucosa en sangre es una variable con dinámica lenta. Las gráficas de la figura 4 muestran los datos de entrada y salida para la obtención del modelo.
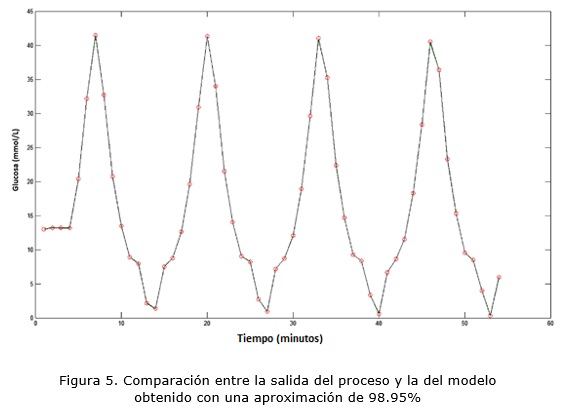
A partir de ello y haciendo uso de la toolbox de “Identificación de Sistemas” de Matlab2013a, se obtuvo una representación autoregresiva. Para la construcción del modelo se escogió el tipo ARX por sus cualidades de sencillez con respecto al resto de las representaciones existentes, por su posibilidad de implementación computacional de forma sencilla y por su buen comportamiento en la descripción matemática del sistema planteado, logrando un ajuste de 98.95%. La estructura seleccionada fue [na, nb, nk] = [4, 4, 1], se define mediante la ecuación general (2) donde u(t) es la dosis de insulina a suministrar, y(t) es la concentración de glucosa en sangre capilar y e(t) la señal de ruido blanco.
![]()
donde:

Con el objetivo de comprobar el modelo obtenido, se utilizaron criterios de validación admitidos para estos fines: se comparó gráficamente la salida estimada y la salida real; se calculó la media del error del modelo y del error de simulación, comparándose que ambos fueran inferiores que el 2.5% de la media de la salida real; se obtuvo el gráfico de los polos y ceros del sistema y finalmente se realizó un análisis de los residuos.
Para validación por comparación de datos, se realizó una comparación de la salida estimada y la salida real obteniéndose un gráfico de la salida del modelo, evaluado para los datos reales de la entrada y se comparó su forma con el gráfico de los datos de entrada / salida reales. Dicho gráfico se muestra en la figura 5.
Se puede notar una cierta igualdad en la tendencia de ambas curvas, la real y la simulada. Para determinar si es posible utilizar el modelo obtenido como una representación del sistema, se calcularon la media y la varianza del error del modelo y se determinó el porciento que representaba de la salida real. Se concluyó que el modelo obtenido es utilizable para representar al sistema real. Se realizó finalmente un análisis de estabilidad utilizando la Prueba de Jury, obteniéndose un sistema estable y de fase mínima.

A partir de los criterios de aceptación examinados, es posible concluir que el modelo obtenido describe convenientemente el comportamiento dinámico de la glucosa en el organismo, para los fines de obtener un regulador que mantenga dicho parámetro entre los límites establecidos.
Modelo matemático no lineal que representa el ciclo metabólico glucosa-insulina
El modelo biomédico que emula el funcionamiento endocrino presentado en este trabajo es basado en el conocimiento. Fue implementado a través de balances de masas y de energía. Se encuentra descrito completamente en el trabajo de doctorado de Davide M. Raimondo (Raimondo, 2013). La implementación computacional se realizó en Matlab-Simulink (Matlab, 2013).
Este modelo representado en las ecuaciones (5)-(16) es capaz de reflejar el comportamiento no lineal del sistema mediante simulación dinámica frente a diferentes posibilidades de cambio en las entradas. Además de ello brinda la posibilidad de particularizar a un individuo en específico, al variar adecuadamente sus parámetros. Se utilizó para simular el comportamiento no lineal del proceso.

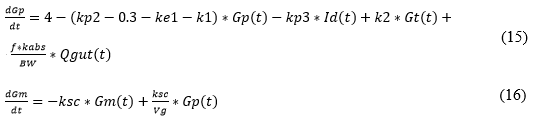
En la tabla 2 se resumen todos los parámetros y variables de dicho sistema de ecuaciones.
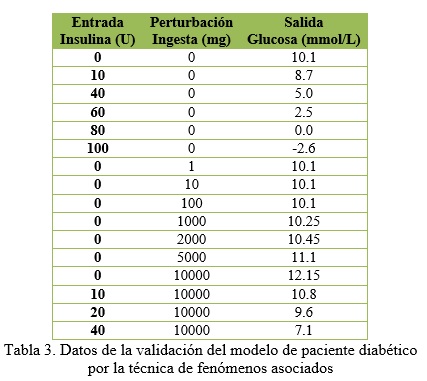
La figura 6 muestra la validación del modelo. Se utilizaron varias técnicas de validación como son: fenómenos asociados, comparación de datos y verificaciones basadas en el conocimiento. En la validación por fenómenos asociados se fueron probando algunas entradas y se recogió el valor que daba la salida del modelo y se comprobó que el funcionamiento del mismo es semejante al sistema real. En la tabla 3 se recogen dichos resultados.
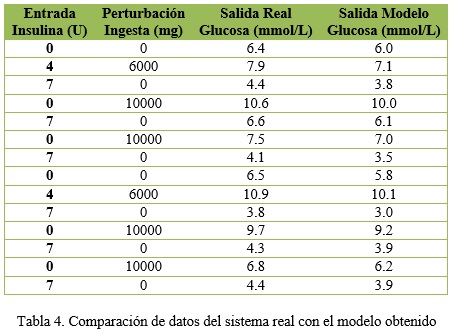
En la figura 6 se evidencia la comparación entre la salida del sistema real y la del modelo obtenido. La línea azul representa el comportamiento de la glucemia en una persona diabética y la línea roja es la representación de la misma persona mediante el modelo matemático obtenido. Esto permite asegurar que el modelo representa en simulación a un paciente diabético de forma correcta. Se evidencia además cómo el modelo se comporta ante cambios en las entradas. Se ve cómo para un aumento del suministro de insulina el valor de glucosa disminuye con respecto a su valor inicial. Se muestra además que manteniendo la entrada de insulina nula y presentándose una ingesta el modelo responde consecuentemente al suministro de alimento. Por último se observa que para un valor fijo de ingesta, el aumento del suministro de insulina provoca una disminución en el valor de la glucosa, demostrando de esta forma la veracidad del modelo obtenido.En paralelo a esta comprobación se fueron comparando datos reales de personas que se sometieron a un régimen de medición frecuente que permitiese chequear el comportamiento de un paciente diabético. Los datos recopilados de un individuo se introdujeron como entradas del modelo y en la tabla 4 se muestran los mismos y la salida del modelo y la del sistema real.
En la tabla 4 se vio cómo los resultados del modelo obtenido son satisfactorios. Finalmente se sometió el modelo ante un análisis por verificaciones basadas en el conocimiento de algunos especialistas en endocrinología y el resultado fue igualmente satisfactorio. Este modelo obtenido permite representar en simulación a un paciente diabético.
RESULTADOS Y DISCUSIÓN
Uso del modelo como parte del algoritmo de control.
Las principales limitantes actuales en el control de la glucosa son el retardo de la acción de la insulina por la vía subcutánea y la imperfecta estabilidad en el comportamiento de los sensores continuos de glucosa.
El control predictivo presenta una serie de ventajas sobre otros métodos, entre los que se encuentran: es aplicable para procesos complejos con retardos de tiempo y no lineales, su carácter predictivo lo hace compensar intrínsecamente los tiempos muertos, introduce un control anticipativo y la ley de control resultante es fácilmente implementable. El problema fundamental a resolver en el MPC es minimizar la función objetivo haciendo uso del modelo de predicción para calcular las predicciones.
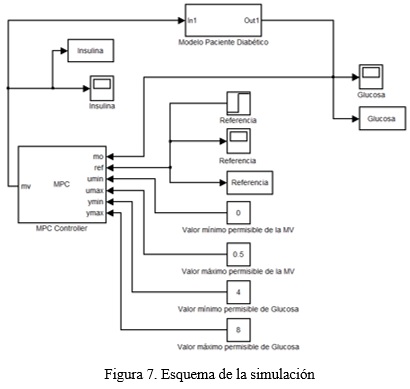
El esquema de la figura 7 muestra la simulación llevada a cabo en este trabajo:
Los siguientes parámetros de sintonía se utilizaron para ajustar el controlador en la simulación.
- Intervalo de control: 1
- Horizonte de predicción: 20
- Horizonte de control: 2
- Peso de las entradas=0.7
- Peso de las salidas=0.3
En la tabla 5 se muestran los resultados de la simulación del diseño presentado. De esta tabla se puede sacar como conclusión la efectividad del algorito de control ante perturbaciones de entrada y que el suministro de insulina se mantiene constante cuando la medición de glucosa se mantiene por encima del valor de referencia (6.5 mmol/L).
En función de todo el ajuste realizado a lo largo del trabajo y haciendo uso de los datos de pacientes reales con que se cuenta, se muestra la diferencia de cómo es la terapia de insulina en régimen ambulatorio cuando el paciente se inyecta en sus horarios habituales (Dosificación real de insulina en régimen ambulatorio) y cómo sería con el equipo automático (Dosificación continua de forma automática de insulina como respuesta al comportamiento de la glucemia real del paciente).
Con el objetivo de establecer una comparación entre ambos métodos, se mantuvo el mismo comportamiento del perfil de glucosa (Comportamiento real de la glucemia) y se fue calculando el valor óptimo de insulina a suministrar, se obtiene la figura 8 que muestra el comportamiento del sistema. Además se muestra cómo hubiese sido el comportamiento de la glucemia del paciente en el mismo escenario si su método de control fuese el propuesto (Comportamiento de la glucemia bajo el efecto del algoritmo de control).
En la figura 8 se puede asegurar que el ajuste del controlador obtenido es adecuado. El algoritmo diseñado permite mantener la glucemia del paciente entre 6 y 8 mmol/L, que evita daños importantes a la salud de las personas. Se muestra la acción de control que se manifiesta de forma continua y en muy pocas cantidades, haciendo de éste un control suave y efectivo, muy parecida a la dosificación fisiológica de insulina por el páncreas humano.
CONCLUSIONES
En este trabajo se obtuvo un algoritmo de control predictivo basado en el modelo de la dinámica glucosa/insulina para ser utilizado en escenarios ambulatorios, cuya entrada es la glucosa subcutánea y su salida la dosis de insulina que se ha de administrar por la vía subcutánea. Se cumplió con el objetivo general que fue la obtención de un algoritmo de control predictivo basado en el modelo de la dinámica glucosa/insulina, que analice continuamente el nivel de glucosa (variable controlada) y en función del mismo determine las dosis de insulina que ha de administrar una bomba de infusión continua (acciones de control) para conseguir la normo glucemia en un paciente con diabetes mellitus Tipo 1.
REFERENCIAS BIBLIOGRÁFICAS
BONDIA, J., VEHÍ, J., PALERM, C.C., & HERRERO, P. (2010). El Páncreas Artificial: Control Automático de Infusión de Insulina en Diabetes Mellitus Tipo 1. Revista Iberoamericana de Automática e Informática Industrial, 7, 20.
BRANDAN, N. (2008). Interrelaciones metabólicas. Ensayo. Universidad Nacional del Nordeste Facultad de Medicina Cátedra de Bioquímica.
DASSAU, E., BEQUETTE, B.W., BUCKINGHAM, B.A., & DOYLE, F.J. (2008). Detection of a Meal Using Continuous Glucose Monitoring. DIABETES CARE, 31(2).
EL-KHATIB, F., RUSSELL, S.J., NATHAN, D.M., SUTHERLIN, R.G., & DAMIANO, E.R. (2010). A Bihormonal Closed-Loop Artificial Pancreas for Type 1 Diabetes. Science Translational Medicine, 2(27).
EL-YOUSSEF, J., CASTLE, J., & WARD, W.K. (2009). A Review of Closed-Loop Algorithms for Glycemic Control in the Treatment of Type 1 Diabetes. algoritms.
GODERICH, R.R. (2002). Temas de Medicina Interna Vol. 3. E. C. Médicas (Ed.) (pp. 656).
GONZÁLEZ SANTOS, A.I. (2011). Obtención de modelos de sistemas: Generalidades y metodologías Paper presented at the Modelado y Simulación, La Habana.
GUYTON, A.C., & HALL, J.E. (2001). Insulina, glucagón y diabetes mellitus. In M. G. H. Interamericana (Ed.), Tratado de Fisiología Médica (10ma ed. ).
HOVORKA, R. (2005). Continuous glucose monitoring and closed-loop systems. Diabetic Medicine, 23, 12.
HYUNJIN, L. (2008). A Closed-loop Artificial Pancreas based on MPC: human-friendly identification and automatic meal disturbance rejection. Paper presented at the The International Federation of Automatic Control, Seoul, Korea.
IDF. (2014). International Diabetes Federation. WEB site: URL:www.idf.org, Brussels
Belgium.
JEAN-JACQUES, R. (2002). Continuous Monitoring of Blood Glucose. Hormone Research, 84.
KOVÁCS, L., & KULCSÁR, B. (2010). Robust and Optimal blood glucose control in diabetes using linear parameter varying paradigm. From In-Tech.
LJUNG, L. (1999). System Identification: Theory for the User P. H. PTR (Ed. )
NELSON, D.L., & Cox, M.M. (2009). Principios de Bioquímica (C. Cuchillo, Trans. 5 ed. ).
OGATA, K. (1993). Ingeniería de Control Moderna P. Hall (Ed. )
RAIMONDO, D. M. Nonlinear Model Predictive Control: Stability, Robustness and Applications. Departamento de Informática y Sistemas, Universidad de Pavía. PhD: 260.
RODRÍGUEZ HERRERO, A. (2010). Propuesta de un algoritmo de control en lazo cerrado para la diabetes tipo 1. (Ingeniero PhD), UNIVERSIDAD POLITÉCNICA DE MADRID, Madrid.
UNED, (2014). Guía de alimentación y salud: alimentación en enfermedades: Diabetes Mellitus. Manual de consulta. Facultad de Ciencias, nutrición y dietética.
ROSELLÓ, M.T.O. (2011). Influencia de la Diabetes. MedlinePlus.
SAINZ., M. (2010). Un páncreas artificial que suministra dos hormonas: insulina y glucagón, El Mundo.
Recibido: 21/05/2014
Aceptado: 21/04/2015