Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Ciencias Informáticas
versión On-line ISSN 2227-1899
Rev cuba cienc informat vol.11 no.3 La Habana jul.-set. 2017
ARTÍCULO ORIGINAL
Sistema de análisis de imágenes de placas de HPTLC
Analysis System of HPTLC plate images
Evelio Báez Pérez 1*, Janet Quiñones Gálvez 1, Cosme Santiesteban Toca1 , Jorge Molina Torres2
1Centro de Bioplantas. Ciego de Ávila. Cuba. {ebaez, jquinones, cosme}@bioplantas.cu
2Cinvestav IPN Unidad Irapuato. Irapuato. México.
*Autor para la correspondencia: ebaez@bioplantas.cu
RESUMEN
La técnica analítica de Cromatografía de Capa Fina de Alta Resolución (HPTLC) es una de las técnicas instrumentales más utilizadas actualmente para el análisis de sustancias. En este trabajo se desarrolló un sistema basado en técnicas de procesamiento y análisis de imágenes digitales para procesar las placas de HPTLC. El sistema permite de forma automática eliminar los ruidos presentes en la imagen de la placa y detectar la región de interés, las líneas y las bandas. La línea base se detecta y elimina del perfil de las líneas usando operadores morfológicos antes de detectar las bandas. Para la detección de las bandas se utilizan los canales R, G y B del color, lo que permite una detección precisa de las mismas. El usuario puede realizar correcciones de forma fácil de todo este proceso. Para cada banda se calcula el factor de retardo (FR), el área y el color y se correlaciona la concentración de sustancias patrones con el área de las bandas para determinar la concentración relativa de las sustancias detectadas. Las líneas se comparan de acuerdo a la presencia o ausencia de bandas y a su FR, concentración relativa y color. Es de destacar que se determina el color tanto de forma cuantitativa como cualitativa, utilizando el modelo de color HSV. El sistema se validó en imágenes de HPTLC de extractos de hojas, semillas y flores de clones de T. cacao con resultados satisfactorios.
Palabras clave: análisis de imágenes, hptlc, detección línea base, modelos de color, morfología matemática.
ABSTRACT
The analytical technique of High Performance Thin-layer Chromatography (HPTLC) is one of the most widely used instrumental techniques for the analysis of low molecular mass compounds of complex environmental, pharmaceutical and food samples. In this work, a system based on digital image processing and analysis techniques to process the HPTLC plates was developed. The system automatically allows to eliminate the noises present in the image of the plate and to detect the region of interest, lines and bands. The baseline is detected and removed from the profile of the lines using morphological operators before detecting bands. For the detection of the bands the color channels R, G and B are used, allowing an accurate detection of the bands. The user can make easy corrections of this whole process. For each band, the delay factor (FR), area and color are calculated and the concentration of standard substances is correlated with the area of the bands to determine the relative concentration of the substances detected. The lines are compared according to the presence or absence of bands and their FR, relative concentration and color. It is noteworthy that the color is determined both quantitatively and qualitatively using the HSV color model. The system was validated in HPTLC images of extracts of leaves, seeds and flowers of T. cacao clones with satisfactory results.
Key words: Image analysis, hptlc, baseline detection, color models, mathematical morphology.
INTRODUCCIÓN
La técnica analítica de Cromatografía de Capa Fina de Alta Resolución (HPTLC) es una de las técnicas instrumentales más utilizadas en la actualidad para el análisis de compuestos de baja masa molecular de complejas muestras ambientales, farmacéuticas y alimenticias (PRIYAMVADA, 2010; KUMAR, 2014; DOMÍNGUEZ, 2015; KERR, 2016). Esta técnica es flexible, simple, accesible y menos costosa comparada con la Cromatografía Líquida de Alta Resolución (HPTLC) y la Cromatografía de Gases (GC). El desarrollo de capas de absorbentes de alta resolución y sofisticada instrumentación para la aplicación de las muestras, entre otros factores, aumentó el uso de la HPTLC en los últimos años (RISTIVOJEVIC, 2017). Al igual que otras cromatografías, consiste de una fase estacionaria y una fase móvil y el principio de separación es el mismo: la sustancia de interés se adherirá a la fase estacionaria o se moverá con la fase móvil, viajando una distancia que es inversamente proporcional a la afinidad por la fase estacionaria.
Desafortunadamente, el equipamiento para el análisis cuantitativo es costoso. Un scanner de HPTLC CAMAG 3 con el software que se necesita para el trabajo analítico cuesta alrededor de 30 000 $. Este equipamiento ocupa un nicho en el mercado correspondiente a las grandes compañías que necesitan equipamiento automatizado para el análisis de alimentos o fármacos. Sin embargo, este equipamiento no es factible para pequeñas compañías, laboratorios y centros educacionales que no cuentan con este financiamiento.
La tendencia actual para la cuantificación de la densitometría cromatográfica planar es el empleo de los sistemas de análisis de imágenes. Aunque los instrumentos comerciales integrados técnicamente están basados en el análisis de imágenes, este término se refiere al uso de una cámara digital o un scanner convencional para obtener la imagen de la placa y el análisis cuantitativo y cualitativo del mismo por un programa de análisis de imágenes, sin la necesidad de comprar los instrumentos comerciales (POPOVIC, 2014).
Entre los programas más utilizados están: ImageJ, MATLAB, Sorbfil TLC, ImageDecipher:TLC, JustTLC, Sorbfil, ImageQuant TL, Adobe Photoshop, CP Atlas GelAnalyzer. Estos están disponibles de forma gratuita o a un precio asequible. Una descripción detallada de cada una de estas posibilidades puede encontrarse en (Popovic, 2014). Existen además varias publicaciones donde se describe la metodología y los algoritmos empleados para analizar las placas de HPTLC (AMBER, 2007; TIE, 2008; JIRAPORNCHAI, 2014; CHEWCHINDA, 2014; FAQERYAR, 2016)
El color en las placas de HPTLC (fig. 1) es de vital importancia, ya que a través de éste se pueden identificar visualmente las sustancias presentes en las placas. Sin embargo, los sistemas anteriormente mencionados no hacen uso de esta información para detectar las bandas en los carriles de las placas, aspecto clave para poder detectar bandas muy cercanas o con cierto nivel de solapamiento. Estos sistemas convierten la imagen a color a tonos de grises o utilizan la información de una sola componente (R, G, B). En (RISTIVOJEVIC, 2013 Y RISTIVOJEVIC, 2017) utilizan la información del color, pero no para detectar las bandas. En estos trabajos los perfiles completos de cada componente del color en los carriles conforman el vector característico para clasificar diferentes muestras. En (Silva, 2013) utilizan el histograma de los colores de las bandas, entre otras características, para su clasificación.
Para cada banda detectada estos sistemas calculan una serie de características tales como: Rf (factor de retardo), concentración relativa, área, ancho, alto, las componentes R, G y B del color, entre otras. Sin embargo, no brindan la información del color de la banda de forma cualitativa (rojo, verde, azul amarillo, cyan, magenta, etc). Las componentes numéricas R, G, y B del color por si sola le dicen muy poco a los especialistas de qué color es. La información cualitativa del color es definida por los especialistas.
La apreciación del color es muy subjetiva y dependiente del observador y puede verse afectada por fatiga en los ojos, cambios de iluminación, tipo de monitor en el que se observa la placa, entre otras. Este problema puede afectar considerablemente la comparación de los resultados obtenidos en diferentes momentos, condiciones y evaluadores. En experimento desarrollado en nuestro laboratorio, tres biotecnólogos que trabajan con las técnicas de HPTLC clasificaron 100 bandas de diferentes colores de forma independiente. Solo 12 bandas fueron clasificadas con el mismo color por los tres especialistas, en 25 bandas coincidieron dos de ellos y en 63 no coincidieron ninguno. Esto confirma la necesidad de definir el color de las bandas de forma precisa y objetiva.
El objetivo de este trabajo es implementar un sistema de análisis de imágenes para procesar placas de HPTLC que permita la detección de las bandas en los carriles utilizando las tres componentes del color y que determine cualitativamente el color de las bandas.
MATERIALES Y MÉTODOS
El sistema se implementó en MATLAB R2016a utilizando fundamentalmente los toolbooks de procesamiento de imágenes y señales y la utilidad para el desarrollo de interface gráfica de usuario GUIDE. Los pasos a seguir para procesar una placa de HPTLC son los siguientes:
-
Captura y mejora de la imagen.
-
Detección de la región de trabajo.
-
Detección de los Carriles.
-
Sustracción del fondo de los carriles.
-
Detección de las bandas en cada carril y cálculo de sus propiedades.
-
Ajuste de las concentraciones conocidas.
- Cálculo de las concentraciones relativas.
1. Captura y mejora de la imagen.
La Captura de la imagen consiste en digitalizar a color la imagen de la placa (fig. 1a), utilizando una cámara digital o un scanner convencional. En esta investigación se utilizó un scanner convencional. En caso de utilizar una cámara digital es importante establecer de manera apropiada las condiciones de iluminación para obtener una imagen con calidad. El sistema acepta imágenes en los formatos: bmp, jpg, tiff, gif. Para eliminar ruidos introducidos en el proceso de captura de la imagen o ruidos inherentes al proceso químico, se le aplica a la imagen un filtro de la mediana con una ventana 5x5. La utilización de una ventana mayor provoca perdida de información.
2. Detección de la región de trabajo.
El área de trabajo consiste en la región comprendida desde la aplicación de la muestra hasta el frente del disolvente, incluyendo todas las muestras aplicadas (fig. 1a). Para la detección del área de trabajo la imagen a color se convierte a tonos de grises (fig. 1b). Como se puede apreciar en la imagen, en el área de trabajo existen variaciones en los niveles de grises. Todo lo contrario, ocurre en la región restante, donde existe homogeneidad en los niveles de grises. En base a esta idea se calcula la varianza por filas y por columna de la imagen. (fig. 2a). Las flechas verdes indican los límites de la región de interés. Estos límites son detectados fácilmente a través de un umbral de corte.
3. Detección de los Carriles.
Los carriles, dentro del área de trabajo, se determinan de manera similar, a través de la varianza de las columnas en la región de interés (fig. 2b). Las flechas de color verde indican el inicio del carril y las de color cyan el final. Los carriles son entonces etiquetados con un número consecutivo de izquierda a derecha para su identificación (fig. 2b).
4. Sustracción del fondo de los carriles.
Antes de detectar las bandas presentes en cada carril es necesario eliminar la información delfondo de la imagen contenida en el carril mediante el cálculo de la línea base. En (PÉREZ, 2010) se desarrolló un método basado en la aplicación de la morfología matemática para la eliminación del fondo que mostró mejores resultados que los métodos polinomiales. La dificultad de los métodos basados en la morfología matemática está en la detección automática del tamaño apropiado del elemento estructurante. En (PÉREZ, 2010) se comienza con un elemento estructurante pequeño y éste se incrementa hasta que el resultado de aplicar una operación de apertura a la señal no cambie en tres incrementos sucesivos, lo que hace el proceso lento.
En este trabajo se sustrajo el fondo en los carriles mediante una operación morfológica top-hat:la diferencia entre la imagen del carril y su apertura. Se utilizó un elemento estructurante en forma de disco. Se detectó el máximo local en el perfil del carril con mayor ancho en su base y se tomó como radio del elemento estructurante la mitad de este valor. Esto garantiza que la operación de apertura elimine todos los picos del perfil, quedando solo la información correspondiente al fondo de la imagen del carril. En la fig. 3a se puede apreciar el perfil del carril 2 antes de sustraer el fondoy en la fig. 3b el mismo perfil con la sustracción del fondo. En la fig. 3b se muestras las bandas detectadas con unas flechas azules y el área bajo la curva de la banda señalada con una flecha verde. A continuación, se explica cómo se realiza esta etapa.
5. Detección de las bandas en cada carril y cálculo de sus propiedades.
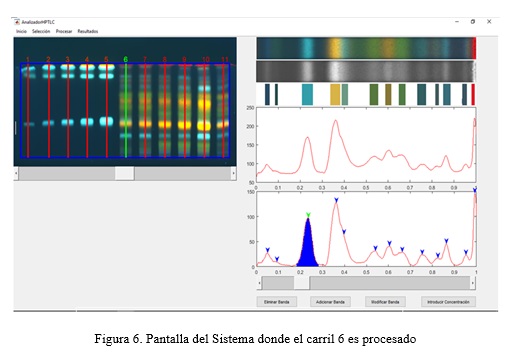
Para explicar esta etapa, tomaremos como ejemplo el carril 6 (fig. 4). En primer lugar, se analiza la imposibilidad de detectar bandas solapadas convirtiendo la imagen del carril a tonos de grises. El perfil de un carril se calcula promediando los valores por columna. En la fig. 4a se muestran los perfiles obtenidos del carril 6 por los tres métodos de conversión de una imagen en color a tonos de grises más usados:
-
Tono de gris = 0.2899*R + 0.5870*G + 0.1140*B
-
Tono de gris = Media(R, G, B)
-
Tono de gris = Máximo(R, G, B)
La mejor separación de las bandas se obtiene con la conversión a grises por el método 3. Esto puede apreciarse mejor en las regiones encerradas por llaves de color verde en la fig. 4a, donde las bandas están cercanas o no bien definidas. Con este método de conversión los máximos locales correspondientes a las bandas en estas regiones pueden ser detectados, lo que no ocurre con los dos métodos restantes. Sin embargo, cuando existe solapamiento, región comprendida por la llave de color azul en la fig. 4a, por ninguno de los tres métodos se obtienen máximos locales definidos en el perfil que permitan detectar las bandas en esta región. El perfil obtenido por el método 3 muestra una pequeña variación (zona señalada por la flecha azul en la fig. 4b), pero es insuficiente para poder detectar la banda de forma automática. Esto ocurre porque la luminancia de los colores solapados es muy similar.
Se puede observar en la región de solapamiento que existen dos bandas correspondientes a compuestos diferentes, una de color amarilla y otra de color cyan. Es de esperar entonces que si se hace uso de la información del color estas bandas pueden ser detectadas. En la fig. 4b se muestran los perfiles de las componentes R, G, y B de la imagen en color y el perfil en tonos de gris por el método 3 del carril 6. Se aprecia que en la región de solapamiento la banda de color cyan puede detectarse en el perfil correspondiente a la componente azul (ver flecha de color azul en la fig. 4b) y la banda amarilla puede detectarse en el perfil correspondiente a la componente roja o a la verde (ver flechas de color verde y roja en la fig. 4b).
El algoritmo para detectar las bandas consiste de dos pasos:
-
Detectar los máximos locales en cada uno de los tres perfiles: R, G, B. (para detectar los máximos locales se utilizó la función findpeaks() del toolbook de procesamiento de señales.
-
Los máximos locales con igual desplazamiento en dos o tres perfiles son unificados. Se mantiene el máximo local con mayor valor.
Las propiedades de cada banda se calculan de la siguiente forma:
-
Rf
Para calcular el Rf se divide el desplazamiento de la banda (posición en el perfil del máximo local) entre la distancia recorrida por el frente del disolvente. Es un valor entre 0 y 1.
-
Ancho
El Ancho es la diferencia del fin de la banda menos el inicio de la misma. Sea P(i) el perfil de un carril determinado. i = 1..n y n la longitud en pixeles desde el punto de aplicación de la muestra hasta el frente del disolvente. El inicio de la banda se determina recorriendo el perfil a partir del máximo local hacia la izquierda mientras P(i) – P(i-1) > 0. El fin de la banda se determina recorriendo el perfil a partir del máximo local hacia la derecha mientras P(i) – P(i+1) < 0.
-
Alto
El Alto es el valor del perfil P en el máximo local de la banda.
-
Área
El Área es la sumatoria de los valores de P(i), donde i va desde el inicio hasta el fin de la banda.
-
Color
El modelo de color RGB es ideal para la generación de imágenes a color; pero no es útil para describir los colores en términos prácticos para la interpretación humana. Por ejemplo, una persona no se refiere al color de una fruta dando porcentajes del contenido de cada uno de sus colores primarios R, G y B, sino que lo describe en términos de su matiz (H), saturación (S) y su brillo o valor de la intensidad (V). El modelo de color HSV es el más cercano a la forma en que los humanos describimos e interpretamos los colores. Y es la herramienta ideal para desarrollar algoritmos de procesamiento digital de imágenes basados en la descripción del color. (GONZALEZ, 2008).
Cada color tiene su apariencia distintiva basada en tres elementos: matiz, croma y brillantez. Para describir un color se usan estos tres atributos y se identifica con precisión un color particular de otro.
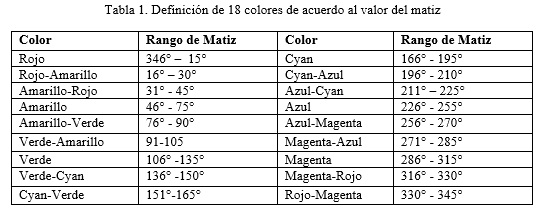
El matiz del color, es simplemente un sinónimo de color. Por ejemplo, el matiz de la sangre es rojo. Según su tonalidad se puede decir que un color es rojo, amarillo, verde, etc. El matiz se define como un atributo de color que nos permite distinguir el rojo del azul, y se refiere al recorrido que hace un tono hacia uno u otro lado del círculo cromático, por lo que el verde amarillento y el verde azulado serán matices diferentes del verde. Este valor varía de 00 a 3600. El color rojo se corresponde con 00, el amarillo con 600, el verde con 1200, el cyan con 1800, el azul con 2400 y el magenta con 3000.
La saturación del color indica la concentración de color en el objeto. Puede ser definida por la cantidad de gris que contiene un color. Mientras menos gris, más saturado es el color y viceversa. Cuando un color no tiene ningún nivel de gris adicionado, decimos que es un color puro. La saturación varía entre 0 y 255.
La intensidad de un color alude a la claridad u oscuridad de un matiz. La luminosidad puede variar añadiendo negro o blanco a un tono. Mientras mayor es la luminosidad, más claro es el color y viceversa. La intensidad varía entre 0 y 255.
La imagen a color del carril se convierte del modelo de color RGB al modelo de color HSV. La conversión se realiza con la función rgb2hsv() del toolbook de procesamiento de imágenes de MATLAB. A partir de esta información se definen 18 colores como se muestra en la tabla 1.
A su vez, estos 18 colores, se clasifican atendiendo a su saturación e intensidad. Un color puede tener una saturación baja, media o alta. Si el valor S se encuentra en el rango de 0 a 84, el color tiene saturación baja. Si está en el rango de 85 a 169, una saturación media, y si está en el rango de 170 a 255, una saturación alta. Por último, el color se clasifica de acuerdo a su intensidad, en un color oscuro o claro. Un color es oscuro si V está en el rango de 0 a 127 y claro si está en el rango de 128 a 255.
Para determinar el color de una banda se promedian los valores H, S y V comprendidos dentro de la misma y se clasifican de acuerdo a lo expuesto anteriormente. Por ejemplo, si el valor HSV de una banda es (25, 200, 70) decimos que el color de la banda es: Rojo-Amarillo oscuro de baja saturación.
6. Ajuste de las concentraciones conocidas.
Para determinar las concentraciones relativas de las bandas detectadas en cada carril de las muestras desconocidas, patrones de concentración conocida se eluyen en carriles de la misma placa (fig. 1a). El área de estos patrones se calcula y se determina la curva de calibración. La curva de calibración se obtiene por un ajuste polinomial de orden 2 a través de la función polyfit() de MATLAB. En la fig. 5 se observa el ajuste realizado para los patrones de concentración de clorogénico (ACl) (0,125; 0,25; 0,5; 1,0 y 2,0 µg).

7. Cálculo de las concentraciones relativas.
Las concentraciones relativas desconocidas de una banda se obtienen evaluando su área en el polinomio de segundo grado obtenido: y = 7.437e-08*x2 -2.695e-04*x + 0.341.
RESULTADOS Y DISCUSIÓN
El Sistema desarrollado se evaluó procesando 6 imágenes de placas de HPTLC de metabólicos de extractos de hojas, flores y semillas de T. cacao. Las 6 imágenes fueron evaluadas por 5 especialistas en HPTLC.
Ellos detectaron el número de bandas presentes auxiliándose de un editor de imágenes que les permitió realizar ampliaciones y observar el perfil de las zonas dudosas. Como resultado se obtuvo que en estas imágenes existen 432 bandas en 36 carriles. De estas 432 bandas, 242 se encuentran muy cercanas a una o dos bandas, 144 se encuentran solapadas y 46 están bien separadas.
Al procesar las imágenes con el Sistema se obtuvieron los siguientes resultados: de las 242 bandas cercanas, 2 no fueron detectadas; de las 144 solapadas 4 no fueron detectadas y las 46 bien separadas fueron detectadas. La causa de que no fueran detectadas estas 6 bandas es que son muy similares al fondo del carril. El Sistema detectó también 3 bandas que no son reales, provocadas por ruidos presentes en las imágenes que no se eliminaron con el filtro de mejora de la mediana. El Sistema cometió en total 9 errores: 6 bandas no fueron detectadas y se detectaron 3 bandas que son ruido. El Sistema tiene una efectividad total del 97.9 %. La efectividad en la detección de bandas unidas es del 99,1 % y en la detección de bandas solapadas es del 97,2 %. El Sistema permite a los investigadores corregir los errores manualmente con solo unos click del mouse.
El Sistema determina para cada banda el Rf, Ancho, Alto, concentración relativa y el color, tanto de forma cuantitativa como cualitativa. La determinación automática de la información cualitativa del color permitió homogenizar el criterio diverso de los especialistas a la hora de definir el color de una banda. En la fig. 6 se muestra una pantalla del Sistema donde el carril 6 es procesado.
El sistema permite además que los carriles sean comparados numéricamente de acuerdo a la presencia o ausencia de bandas y a su Rf, concentración relativa y color (cuantitativo y cualitativo). La comparación puede realizarse de manera gráfica a través de los perfiles o por las bandas detectadas en cada carril.
CONCLUSIONES
En este trabajo se desarrolló un sistema basado en técnicas de procesamiento y análisis de imágenes digitales para procesar las placas de HPTLC. El sistema permite de forma automática eliminar los ruidos presentes en la imagen de la placa y detectar la región de interés, los carriles y las bandas. La línea base es detectada y eliminada del perfil de las líneas usando operadores morfológicos antes de detectar las bandas. Para la detección de las bandas se utilizan los canales R, G y B del color, lo que permite una detección precisa de las mismas. El usuario puede realizar correcciones de forma fácil de todo este proceso. Para cada banda se calcula el factor de retardo (Rf), el área y el color y se correlaciona la concentración de sustancias patrones con el área de las bandas para determinar la concentración relativa de las sustancias detectadas. Los carriles pueden ser comparados de acuerdo a la presencia o ausencia de bandas y a su Rf, concentración relativa y color. Es de destacar que se determina el color tanto de forma cuantitativa como cualitativa, utilizando el modelo de color HSV. El sistema se validó en imágenes de HPTLC de extractos de hojas, semillas y flores de clones de T. cacao con resultados satisfactorios.
REFERENCIAS BIBLIOGRÁFICAS
AMBER, V. Digitally Enhanced Thin-Layer Chromatography. Massachusetts Institute of Technology, Cambridge, J. CHEM. Educ, 2007, 84(5):842.
CHEWCHINDA, S.; RUANGWISES, N. Y GRITSANAPAN, G. Comparative Analysis of Rhein Content in Cassia fistula Pod Extract by Thin-Layer Chromatographic-Densitometric and TLC Image Methods. JPC - Journal of Planar Chromatography - Modern TLC, 2014, 27(1): p. 29-32.
DOMÍNGUEZ, A.; JARNE, C.; ET. AL. A Hyphenated Technique based on High-Performance Thin Layer Chromatography for Determining Neutral Sphingolipids: A Proof of Concept. Chromatography. 2015, 2, p. 167-187.
FAQERYAR, N.; MORI, Y. High performance thin-layer chromatography and image processing analysis of some essential oils from Perovskia atriplicifolia leaves extracted by microwave assisted heating. Natural Science Report, Ochanomizu University, 2016, 67: 1, p. 1-11.
GONZALEZ R.C. Y WOODS R.E. Digital Image Processing, 3rd Edition, Harlow: Pearson Prentice Hall, 2008, p. 976.
JIRAPORNCHAI, S.; MONTON, C. Y PATHOMPAK, P. Development and quantitative determination of barakol in senna siamea leaf extract by tlc-image analysis method. International Journal of Pharmacy and Pharmaceutical Sciences, 2014, 6 (3): p. 267-270.
KERR, E.; WEST, C. Y KRADTAP S. Quantitative TLC-Image Analysis of Urinary Creatinine Using Iodine Staining and RGB Values. Journal of Chromatographic Science, 2016, 54: 4,p. 639–646.
KUMAR, V.; KAMLE, P.; MITHAL, A. High Performance Thin Layer Chromatography (HPTLC): A Review. International Journal of Analytical and Bioanalytical Chemistry, 2014, 4(2): p.42-44.
PEREZ, R; SONEIRA, M. J. Y RUIZ S. Morphology-Based Automated baseline Removal for Raman Spectra of Artistic Pigments. APPLIED SPECTROSCOPY, 2010, 64(6), p. 595-600.
POPOVIC, N. Y SHERMA, J. Comparative study of the quantification of thin-layer chromatograms of a model dye using three types of comercial densitometers and image analysis with ImageJ. Trends in Cromatography, 2014, 9: p. 21-28.
PRIYAMVADA, S.; SRINIVAS, B.; PRATIMA, M. Qualitative high performance thin layer chromatography (HPTLC) analysis of cannabinoids in urine samples of Cannabis abusers. Indian J Med Res, 2010, 132, p. 201-208.
RISTIVOJEVIĆA, P.; ANDRIĆB F.; ET. AL. Pattern recognition methods and multivariate image analysis in HPTLC fingerprinting of propolis extracts. Journal of Chemometrics, 2014, 28, p. 301–310.
RISTIVOJEVIĆA, P.; TRIFKOVIĆB, J.; ET. AL. Comparative study of different approaches for multivariate image analysis in HPTLC fingerprinting of natural products such as plant resin. Talanta, 2017, 162, p. 72–79.
SILVA, F.; PORRO, D.; TALAVERA, I.; ET.AL. El procesamiento de imágenes de TLC como una nueva vía para la identificación de sustancias. Revista Cubana de Química, 2013, 25(3): p. 295-306.
TIE, T. Y HONG, W. An Image Analysis System for Thin-Layer Chromatography Quantification and Its Validation. Journal of Chromatographic Science, 2008, 46: p. 560-564.
Recibido: 20/05/2017
Aceptado: 25/06/2017