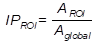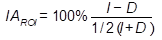Introducción
Algunos métodos han sido propuestos para la evaluación cuantitativa de los estudios por tomografía por emisión de fotón único (SPECT) (Matsuda 2021; Sánchez-Catasús et al. 2002). También en los programas de procesamiento de algunos equipos de SPECT se proponen herramientas básicas para la cuantificación. No obstante, los métodos propuestos presentan algunas limitaciones relacionadas con la pobre resolución espacial propia de la técnica, o con la selección de las regiones de interés, o la región de referencia utilizada para la cuantificación relativa, entre otros. El objetivo del presente trabajo es proponer una metodología para la cuantificación relativa de la perfusión cerebral a partir del co-registro de la SPECT con la imagen de resonancia magnética (IRM) y utilizando atlas anatómicos para la definición de las regiones de interés (ROIs). La metodología es implementada en dos patologías distintas: epilepsia farmacorresistente y enfermedad de Parkinson (EP).
Adquisición de las imágenes de resonancia magnética (IRM) y de tomografía por emisión de fotón único (SPECT)
Cada paciente fue estudiado en un equipo de resonancia magnética Magnetom Aera SIEMENS de 1.5 Tesla. El protocolo utilizado incluye imágenes sagitales T1-MPRAGE 3D. Para la adquisición de la SPECT, a cada paciente se le administró una dosis de 630 MBq y se utilizó una cámara gamma de doble cabezal MiE (ECAM, Siemens). Se empleó un colimador de tipo baja energía y alta resolución (LEHR), matrices de 128x128 píxeles, 128 proyecciones en órbita circular de 360° y con una ventana energética del 20%.
Metodología para la cuantificación de la perfusión cerebral
La metodología incluye tres pasos principales: pre-procesamiento espacial, corrección del volumen parcial, y cálculo de los índices de perfusión.
Pre-procesamiento de las imágenes
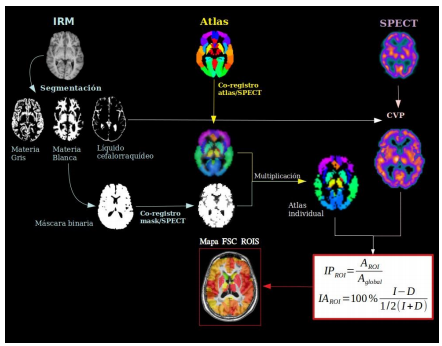
El pre-procesamiento espacial incluye el co-registro IRM-SPECT y definición de las ROIs:
Delimitación del encéfalo a partir de la IRM anatómica T1 eliminando las estructuras que rodean al cerebro utilizando la herramienta BET del programa FSL (Jenkinson et al. 2012).
Segmentación de la IRM en mapas de sustancia gris, sustancia blanca y líquido cefalorraquídeo utilizando la herramienta FAST (Zhang, Brady, and Smith 2001) del FSL.
Multiplicación del atlas co-registrado con la máscara obtenida de la IRM de cada paciente.
Co-registro de la IRM anatómica, las máscaras de sustancia gris y sustancia blanca y el atlas individual de cada paciente con la SPECT utilizando FLIRT (Greve and Fischl 2009) del FSL.
Para el análisis de pacientes con enfermedad de Parkinson, el atlas se construyó co-registrando el atlas AAL (Automated Anatomical Labeling) (Rolls et al. 2020) con un atlas de estructuras subcorticales (Pauli, Nili, and Tyszka 2018) para incluir el núcleo subtalámico (STH) y la segregación del pallidum (externo e interno) en el análisis. Para el análisis de los pacientes con epilepsia, se utilizó el atlas propuesto por Oishi y col. (Oishi et al. 2009) porque incluye el tronco encefálico, una región que ha sido relacionada con la muerte súbita en la epilepsia.
Corrección parcial del volumen (CVP)
Para la CVP de las imágenes de SPECT se utilizó un método que utiliza la información de las segmentaciones de la IRM y calcula los valores de actividad media del ROI utilizando el método de matriz de transferencia geométrica, y luego realiza una corrección voxel a voxel (Thomas et al. 2011).
Cálculo de los índices de perfusión
El índice de perfusión (IP) se calcula dividiendo la actividad media en una región (AROI) por la actividad media del resto de la materia gris (Aglobal) (ecuación 1). También se utilizó el índice de asimetría (IA), donde los valores positivos indican dominancia del hemisferio izquierdo y los valores negativos del derecho (ecuación 2).
I representa la actividad media de los voxeles de la región de interés en el hemisferio izquierdo y D representa la actividad media de la región de interés en el hemisferio derecho.Figura 1
Selección de sujetos
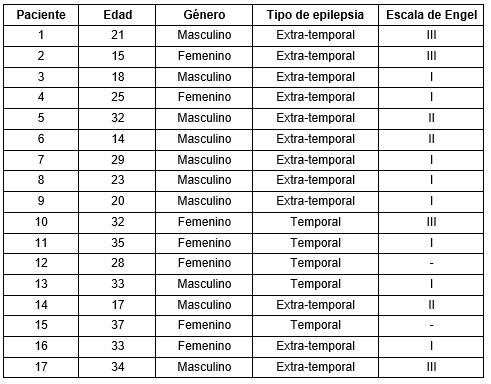
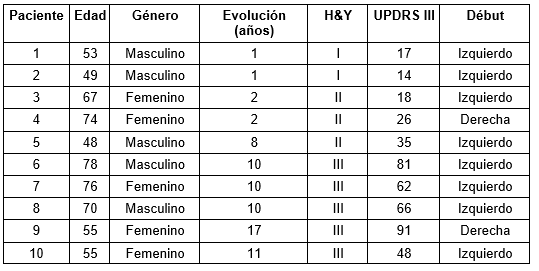
La metodología propuesta fue aplicada retrospectivamente a 17 pacientes con epilepsia farmacorresistente (Tabla 1). Estos pacientes pertenecen al Programa de Cirugía en la Epilepsia de Cuba dirigido por el Centro Internacional de Restauración Neurológica (CIREN, Cuba) (Morales Chacon et al. 2018). La metodología también se aplicó de forma retrospectiva en 10 pacientes con EP (Tabla 2) provenientes del servicio de Mediciana Nuclear del CIREN.
Resultados y discusión
El presente trabajo propone una metodología para la cuantificación relativa de la perfusión cerebral por SPECT. La metodología se basa en cuantificación por regiones integrando información estructural y funcional y utilizando atlas anatómicos. El co-registro de la IRM con la SPECT y la CVP son muy útiles en aras de tratar con el problema de la baja resolución de la SPECT. Los límites de las ROIs son definidos a partir de un atlas anatómico que se seleccione a priori para el estudio y, como parte de la metodología, se propone un pre-procesamiento para ajustar dicho atlas a la anatomía individual del sujeto. Con la utilización del atlas se eliminan las diferencias que se daban al dibujarlas por distintos usuarios en la rutina clínica. Las regiones de referencia más utilizadas son el cerebelo, tronco encefálico, puente, lóbulo temporal, materia gris y materia blanca. La no estandarización y la heterogeneidad para la normalización de la intensidad tiene un efecto en la cuantificación de la SPECT y en la comparación de los resultados de distintos estudios. En la metodología propuesta se utiliza como región de referencia la materia gris pero la metodología no restringe la selección de la misma. Un aspecto determinante en la cuantificación es la calidad de las imágenes, tanto de la SPECT y la IRM, y de cada uno de los métodos empleados en el procesamiento de ambas. Un elemento crucial lo constituye el efecto de volumen parcial y los métodos de corrección de dicho efecto (CVP), al punto de que métodos distintos arrojan diferentes resultados (Greve et al. 2016). La calidad de la IRM también es determinante, dado que para la metodología que se propone, influye en la definición de las regiones de interés y en la corrección del efecto de volumen parcial. No obstante, evaluaciones adicionales serán requeridas para determinar la influencia de los distintos métodos de CVP y de segmentación en la metodología que se propone. La metodología se implementó en 17 pacientes con epilepsia farmacorresistente, y 10 pacientes con EP. Para cada uno de estos trastornos se utilizaron distintos atlas anatómicos. Como parte de la evaluación pre-quirúrgica, se aplicó una metodología (Batista García-Ramó et al. 2019) que combina la estimación de las fuentes generadoras del EEG ictal (ESI) y la sustracción del SPECT interictal del ictal co-registrado con la IRM (SISCOM). Los resultados sugieren que la zona epileptógena (ZE) está localizada en lóbulo occipital derecho. La metodología para cuantificar el FSCr fue aplicado al SPECT ictal e interictal (Figura 2). Los IP muestran hiperperfusión en el estudio ictal con respecto al interictal en las ROI del lóbulo occipital derecho (Figura 2B), que corresponden a la ZE. Esto también se refleja en el IA mostrando una mayor asimetría en el estudio ictal. En la Figura 2C, observamos una superposición del SISCOM (rojo), ESI (azul) e IP (verde), esta última con mejor definición anatómica de la ZE. Este primer resultado refleja la capacidad de la metodología como una herramienta adicional para la localización de la ZE.
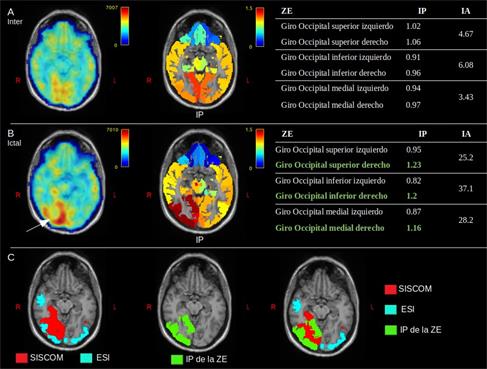
Fig. 2 Paciente 4. A) y B) son los estudios inter ictal e ictal, respectivamente. De izquierda a derecha: Co-registro de la IRM con estudio SPECT, co-registro de IRM con mapa de los IP para cada ROI y tabla con métricas de cuantificación del FSC en la ZE. C) Rojo: ZE estimada a través de la metodología SISCOM; Azul: ZE estimada por la solución inversa del EEG ictal (ESI). El mapa de IP para la ZE se representa en verde.
A partir del método de k-medias se obtuvieron las regiones caracterizadas por una hiperperfusión (Figura 3) e hipoperfusión (Figura 4) en la epilepsia del lóbulo temporal. En ambas figuras se aprecian diferencias entre los distintos estados, ictal e interictal. Este resultado contribuye al enfoque de la epilepsia como trastorno de redes neurales permitiendo identificar cuáles serían las regiones que conforman la red epileptógena. Para ello se requeriría de un grupo de control.
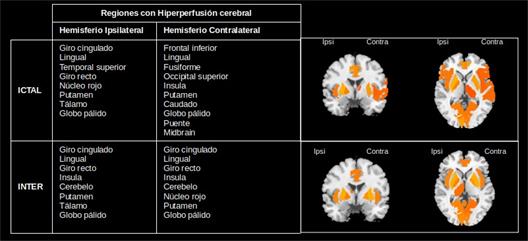
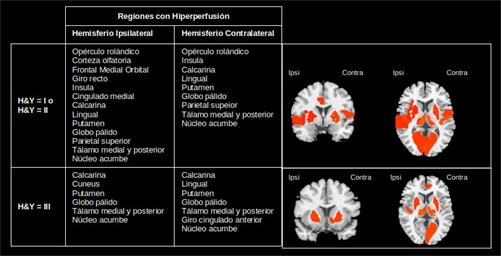
Fig. 3 Patrones de hiperperfusión en el estado ictal e interictal de pacientes con epilepsia del lóbulo temporal.
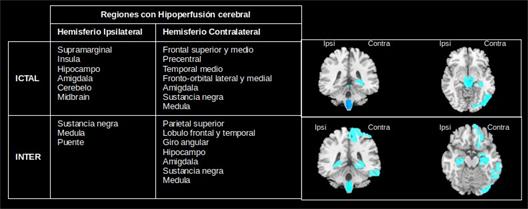
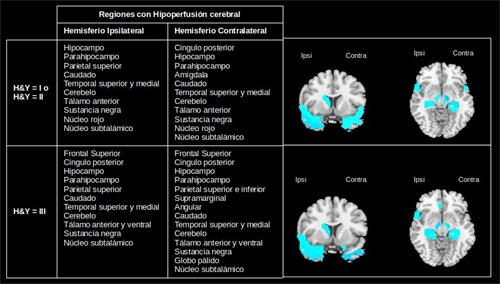
Fig. 4 Patrones de hipoperfusión en el estado ictal e interictal de pacientes con epilepsia del lóbulo temporal.
De los 10 pacientes con EP, 5 pacientes se encuentran en los estadios iniciales y 5 en un estadio avanzado con evidencia de deterioro cognitivo. A partir del método de agrupamiento se identificaron las regiones con hipoperfusión (Figura 5) e hiperperfusión (Figura 6). Un resultado interesante es la hipoperfusión en el lóbulo frontal en ambos hemisferios para un estadio avanzado de la enfermedad. Esto pudiera estar en correspondencia con la presencia de deterioro cognitivo en estos pacientes.
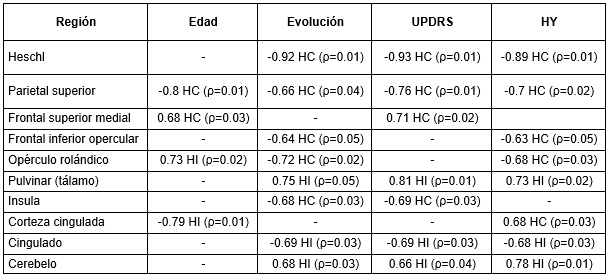
En la Tabla 3 se muestran las regiones con coeficientes de correlación de Spearman significativos entre los IP y las distintas variables clínicas.
HC: hemisferio contralateral. HI: hemisferio ipsilateral
Llaman la atención regiones que no tienen correlación significativa con la edad pero sí con los años de evolución, la UPDRS y el H&Y. Según la Tabla 3, existe una correlación negativa entre la evolución de la EP y la perfusión en el giro de Heschl y el cingulado, no asociadas al envejecimiento. Estudios previos han encontrado diferencias significativas en esta región entre pacientes con EP y sujetos controles en estudios por neuroimágenes tanto funcionales como estructurales (Deng et al. 2021). Sin embargo, la correlación es positiva para el núcleo pulvinar del tálamo y el cerebelo. Owens-Walton y col. (Owens-Walton et al. 2019) reportan un aumento de la conectividad funcional en los núcleos del tálamo en los pacientes con EP con respecto al grupo control. Estos resultados sugieren que la cuantificación del FSC por SPECT pudiera contribuir a la búsqueda de biomarcadores basados en imágenes para el estudio de la EP.
Conclusiones
El presente trabajo propone una metodología para la cuantificación relativa de la perfusión cerebral por SPECT. La metodología se basa en cuantificación por regiones integrando información estructural y funcional y utilizando atlas anatómicos. La novedad del presente trabajo consiste en el enfoque multimodal de la metodología y en su capacidad para describir patrones de perfusión. En la bibliografía consultada no se encuentran estudios previos que describan los patrones de perfusión a partir de la SPECT ni en la epilepsia ni en la EP. La principal limitación se debe al pequeño número de pacientes estudiados. Este impide llegar a conclusiones sobre las patologías estudiadas pero permiten mostrar las bondades de la metodología y sirven como prueba de concepto para fundamentar estudios futuros con mayor número de pacientes.