Introducción
Las oligosacarinas (OGA) son poli- y oligosacáridos de diferente estructura y origen, que se caracterizan por causar respuestas biológicas en las plantas, relacionadas con el crecimiento, el desarrollo y la protección contra estreses bióticos y abióticos. Informadas hace más de 30 años como componentes de las paredes celulares de plantas y hongos, por razones prácticas, sus fuentes actuales de obtención la constituyen los subproductos de la industria citrícola y de la pesca de crustáceos. 1,2
Entre las OGA, los oligosacáridos pécticos (u oligogalacturónidos) presentes en la estructura péctica de las paredes celulares de las plantas pueden obtenerse de la pectina cítrica comercial, mediante hidrólisis ácidas y enzimáticas y los oligosacáridos resultantes, con tamaños entre 3 y 20 residuos de galactosa, se han informado con actividad promotora del crecimiento, del enraizamiento, la sustitución de hormonas en el cultivo in vitro y el aumento de los rendimientos mediante aplicación exógena a los cultivos. 2,3,4
El quitosano es un reconocido bioestimulante agrícola de origen natural, no tóxico a los cultivos y biodegradable. 5,6 Es un polímero lineal de glucosamina soluble en ácidos diluidos, lo cual le permite su utilización en la agricultura. En esta rama, el polímero de quitosano y sus derivados de menor masa molar, pueden tener una amplia aplicación, a partir de las potencialidades biológicas que se les han demostrado a estos compuestos, como son, una importante actividad antimicrobiana sobre el crecimiento y desarrollo de hongos, bacterias y oomycetes, la inducción de resistencia en plantas contra patógenos potenciales y la promoción del crecimiento y desarrollo de múltiples cultivos. 6,7,8
A diferencia de las OGA anteriores, los factores de nodulación son estructuras sintetizadas y excretadas por bacterias de la familia Rizobiaceae durante la simbiosis que establecen con leguminosas. En el intercambio de señales que ocurre entre ambos simbiontes, los factores de nodulación provocan cambios en las células corticales de las raíces que terminan en la formación del nódulo, en el cual se establecerá el microorganismo para fijar el nitrógeno atmosférico. De esta forma, una adecuada inclusión de inductores en el medio de cultivo de estas bacterias permite aumentar la excreción de factores de nodulación al medio y potenciar la fijación biológica de nitrógeno. 9
Dado el contexto actual de la agricultura cubana, es de gran importancia contar con productos de origen natural, no tóxicos, que se obtengan de materias primas nacionales, mediante metodologías que reduzcan los costos de producción y aumenten los rendimientos en igual área cultivable y con las mismas o menores aplicaciones de fertilizantes y plaguicidas químicos importados a precios elevados. Por lo anterior, el Grupo de Productos Bioactivos (GPB) del Instituto Nacional de Ciencias Agrícolas (INCA), en colaboración con grupos de investigación de otras universidades del país, se propusieron el diseño y desarrollo de bioestimulantes microbianos y no microbianos, a base de oligosacarinas, para cultivos de importancia nacional como hortalizas, tubérculos y granos.
Por lo anterior, en este trabajo se resumen los principales resultados que permitieron demostrar las potencialidades de los oligogalacturónidos, los quitosanos y los factores de nodulación, como estimuladores del crecimiento y del rendimiento de los cultivos; así como su efectividad como protectores de las plantas ante condiciones de estrés, lo cual permitió el desarrollo, la validación, extensión, generalización y el registro de los productos Pectimorf®, Quitomax® y Azofert-F® en la agricultura cubana.
Métodos
Oligosacarinas como estimuladoras del crecimiento y del rendimiento de las plantas
Efecto del quitosano en el crecimiento de posturas de tomate
A partir de experimentos realizados en condiciones controladas con la variedad Amalia, donde se evaluaron cuatro y ocho horas de imbibición de las semillas en diferentes soluciones de quitosano, cuyos resultados indicaron que podía reducirse el tiempo de imbibición, 10,11 se estudió la imbibición de semillas de la variedad Hazare 3019 durante dos horas en soluciones de Quitomax® (formulado a base de polímeros de quitosano y sales de formulación) a concentraciones de 0, 0,1, 0,5 y 1 g L-1 (VA) y se colocaron en placas de Petri con papel de filtro húmedo a pregerminar, en condiciones de oscuridad, durante 72 h. Transcurrido este tiempo, las semillas germinadas se transfirieron a recipientes (2 semillas por envase para un total de 26 envases por tratamiento) conteniendo humus de lombriz como sustrato. Las plantas se cultivaron en cámara de crecimiento (25 ºC de temperatura, 50 % de humedad relativa y 16/8 horas de luz/oscuridad) durante 30 días. Quince días después de la siembra, se realizó una aspersión foliar de las mismas soluciones a la mitad de las plantas (VB), a razón de 10 mL por tratamiento. A los 30 días de efectuada la siembra (dds) se determinaron indicadores del crecimiento del cultivo: número de hojas, altura (cm), diámetro del tallo (cm), longitud radical (cm), masa seca aérea (g) y el área foliar (cm2), así como el contenido de clorofilas totales (Spad). El experimento se repitió dos veces y se muestran los datos de la segunda repetición. Estos datos se sometieron a un análisis de varianza simple. Las medias se compararon mediante la Prueba de Rangos Múltiples de Tukey HSD para p < 0,05.
Influencia del quitosano (Quitomax®) en el rendimiento de diferentes cultivos hortícolas
Las investigaciones se realizaron en condiciones de campo en: tomate (Solanum lycopersicum, L.), pepino (Cucumis sativum L.) y pimiento (Capsicum annuum L.), en variedades e híbridos de alta incidencia en la agricultura nacional e internacional (Amalia, Bolívar, H 3108, HA 3019, Mara, L-43, Vyta, Pomodoro, Floradade, California wonder, Lical e Inivit). Se determinaron las dosis que beneficiaban el desarrollo y rendimiento de los cultivos entre 200-400 mg ha-1. Se utilizaron diseños de Bloques al Azar y análisis de varianza y comparación de medias por las pruebas de Duncan o Tukey (p <0,05).
Influencia del quitosano en el desarrollo y el rendimiento de los cultivos de papa y frijol
Las investigaciones se realizaron en condiciones de campo utilizando derivados de quitosano de diferente masa molar (124, 66 y 13,2 KDa) con el objetivo de conocer la influencia de esta característica física en el rendimiento de papa para consumo y para semilla, además de diferentes dosis con uno de los derivados con el objetivo de definir la dosis y aplicación óptima de Quitomax para recomendar en papa y frijol. Se realizaron diseños de Bloques al Azar y las medias se compararon de acuerdo a la Prueba de Rangos Múltiples de Duncan o Tukey (p <0,05). Los tratamientos para definir dosis en papa y frijol se ilustran en la tabla 1.
Tabla 1 Descripción de las dosis y momentos de aplicación del Quitomax en ambos cultivos
| Tratamientos en papa | Tratamientos en frijol |
|---|---|
| T1: Control | T1: Control |
| T2: 100 mg ha-1, 30 días después de la plantación | T2: 200 mg ha-1, 20-25 días postsiembra |
| T3: 300 mg ha-1, 30 días después de la plantación | T3: 400 mg ha-1, 20-25 días postsiembra |
| T4: 500 mg ha-1, 30 días después de la plantación | T4: 600 mg ha-1, 20-25 días postsiembra |
| T5: 100 mg ha-1, 50 días después de la plantación | T5: 200 mg ha-1 al inicio de la floración |
| T6: 300 mg ha-1, 50 días después de la plantación | T6: 400 mg ha-1 al inicio de la floración |
| T7: 500 mg ha-1, 50 días después de la plantación | T7: 600 mg ha-1 al inicio de la floración |
| T8: 50 mg ha-1, 30 días y 50 mg ha-1, 50 días después de la plantación | T8: 100 mg ha-1, 20-25 días y 100 mg ha-1 al inicio de la floración |
| T9: 150 mg ha-1, 30 días y 150 mg ha-1, 50 días después de la plantación | T9: 200 mg ha-1, 20-25 días y 200 mg ha-1 al inicio de la floración |
| T10: 250 mg ha-1, 30 días y 250 mg ha-1, 50 días después de la plantación | T10: 400 mg ha-1, 20-25 días y 400 mg ha-1 al inicio de la floración |
Oligosacarinas en la interacción simbiótica Rhizobium-frijol común
Se utilizó la cepa simbionte de frijol Rhizobium leguminosarum, inducida con genisteína a una concentración final de 5 µM. Se determinaron las moléculas señales producidas a partir de la fracción lipídica, extraídas con n-butanol y analizadas por diferentes técnicas cromatográficas: TLC, HPLC y GC-MS. Se evaluó, además el impacto de esa inducción en el efecto del inóculo sobre plantas de frijol común en condiciones controladas.
Oligosacarinas como protectoras de plantas sometidas a estrés biótico
Plantas jóvenes de tabaco y tomate fueron asperjadas foliarmente con oligogalacturónidos (Pectimorf 0,05 y 0,5 g L-1) y quitosano (0,1, 1 y 2,5 g L-1), respectivamente, a razón de 1 mL por planta, 72 h antes de colocarse en presencia del patógeno en un bioensayo de infección descrito por Falcón-Rodríguez et al. 12 Se determinó el porcentaje (%) de infección a los cuatro días de colocadas las plantas en el patógeno de acuerdo a la escala descrita. Los datos de infección obtenidos en 15 plantas por tratamiento se procesaron con la prueba no paramétrica de Kruskal-Wallis y la de Mann-Whitney con corrección de Bonferroni, p < 0,05. Se calculó el índice de infección: I.I. = [Σ (G x F) /N x 5] x 100. 12 Adicionalmente, se determinaron indicadores enzimáticos de resistencia a patógenos. Las determinaciones de fenoles y flavonoides, 13 se realizaron a los tres y siete días después de la aspersión foliar (dda), lo que coincidió con el momento previo a colocar las plántulas en el patógeno y a los cuatro días posteriores.
Oligosacarinas y sus efectos en plantas sometidas a estreses abióticos
Las investigaciones se realizaron en condiciones controladas y de campo y mediante la aplicación a la semilla, foliar o al sustrato de crecimiento (este último solo en el estrés por metales pesados) de oligogalacturónidos (Pectimorf®), quitosano (Quitomax®) y lipo-quitinoligosacáridos (Azofert-F®) en diferentes concentraciones relacionadas con su acción bioestimulante. Se utilizaron diseños completamente aleatorizados o de Bloques al Azar (experimentos de campo) y las medias se analizaron por las Pruebas de Rangos Múltiples de Duncan o Tukey para p ˂0,05 o se presentaron con los intervalos de confianza.
Resultados y discusión
Oligosacarinas como estimuladoras del crecimiento y el rendimiento en plantas
Se demostró la acción bioestimulante del quitosano y el formulado Quitomax® mediante el tratamiento de semillas y la aspersión foliar en diferentes especies.
La imbibición de las semillas por dos horas en las soluciones de quitosano mostró un efecto bioestimulante en plántulas de tomate, respecto al control embebido en agua, en las variables número de hojas, diámetro del tallo, altura, masa seca aérea y área foliar (tabla 2). La altura de las plantas en el tratamiento de 1 g L-1, superó en un 57 % al control, mientras que las concentraciones de 0,5 y 1 g L-1 de Quitomax®, provocaron incrementos en la masa seca aérea de, aproximadamente, 59 y 129 %, respectivamente. De igual manera, los aumentos en el área foliar con ambas concentraciones fueron de más del 90 %. La aspersión foliar a los tratamientos embebidos no mejoró el efecto de la imbibición. 14
Tabla 2 Efecto del Quitomax® en el crecimiento de plantas de tomate (H 3019), mediante la imbibición de semillas (VA) o la imbibición de semillas más la aspersión foliar (VB), a los 30 días de efectuada la siembra, en cámara de crecimiento (n = 14)
| Quitomax® (g L-1) | No. hojas | Diám. tallo (cm) | Altura (cm) | Long. radical (cm) | MS aérea (g) | Área foliar (cm2) |
|---|---|---|---|---|---|---|
| 0 | 5,31 c | 0,40 bc | 13,96 c | 13,32 a | 0,305 cd | 102,2 b |
| 0,1 (VA) | 5,44 bc | 0,38 bc | 12,39 c | 11,52 ab | 0,235 d | 130,22 b |
| 0,5 (VA) | 6,25 ab | 0,38 bc | 18,02 b | 12,83 a | 0,484 ab | 196,92 a |
| 1,0 (VA) | 6,62 a | 0,48 a | 24,53 a | 13,50 a | 0,698 a | 195,64 a |
| 0,1 (VB) | 5,56 bc | 0,36 c | 14,62 c | 10,45 b | 0,377 bcd | 143,12 b |
| 0,5 (VB) | 5,94 abc | 0,38 bc | 17,52 b | 12,41 ab | 0,309 cd | 125,3 b |
| 1,0 (VB) | 6,19 abc | 0,42 b | 18,99 b | 12,31 ab | 0,466 abc | 152,4 b |
| ESx | 0,21 | 0,13 | 0,54 | 0,47 | 0,04 | 9,056 |
Los incrementos en los indicadores de crecimiento descritos están relacionados con la estimulación de diferentes procesos fisiológicos en la planta. De esta forma, aumentos de hasta el 24 % en el área foliar y del 12 % en el contenido de clorofilas obtenidos con 1 g L-1 a los 15 dds (datos no mostrados), pudieron ser responsables del incremento del 95 % de la masa seca aérea de las posturas a los 30 dds. Lo anterior justifica un aumento del crecimiento en las posturas como resultado de un mayor aporte fotosintético, como ha sido informado en trabajos anteriores con quitosano. 15
Los resultados del tratamiento de semillas en el crecimiento de las posturas en condiciones semicontroladas fueron confirmados en estudios a nivel de semillero a escala de campo en la variedad Mara. La imbibición por media hora de las concentraciones entre 0,1 y 1 g L-1 produjeron incremento de las variables de crecimiento (calidad) de las posturas desde los 10 días posteriores a la germinación (resultados no mostrados). El tratamiento con 0,5 y, en particular con 1 g L-1, causaron aumentos entre 20 y 30 % de la altura, diámetro del tallo, longitud radical y número de hojas en las posturas, lo que permitió una reducción del tiempo de semillero (adelanto para el trasplante), lo cual repercute positivamente en los costos de producción.16 Este resultado, de gran importancia en semilleros de hortícolas, fue validado con éxito en organopónicos y áreas de campo de las provincias de Mayabeque, La Habana y Granma, con el formulado Quitomax® (RFC No. 010/17).
A escala de campo se determinaron las mejores dosis y momentos de aplicación foliar del Quitomax® que benefician el rendimiento en tomate, pepino, pimiento, papa y frijol. Estos experimentos se realizaron en diferentes variedades, suelos y localidades. Se demostró que las aplicaciones a hortícolas con dosis entre 300 y 400 mg ha-1 a los 7-10 días después del trasplante mejoraron las variables reproductivas y aumentaron el rendimiento entre 30 y 70 % en condiciones de campo,17,18,19 con mejores resultados cuando se combinó con el tratamiento de imbibición de las semillas (1 g L-1) previo a la siembra (tabla 3).16 El aumento de rendimiento incluyó mejora en la calidad comercial y el contenido antioxidante de los frutos, como se demostró en tomate y pimiento. 20,21
Tabla 3 Influencia del Quitomax® en el rendimiento de especies hortícolas
| Cultivo | Variedad | Dosis usadas (mg ha-1) | Efecto causado | Referencia |
| Tomate | Mara | 0,1, 0,5 y 1 g L-1 a la semilla más |
Aumento de rendimientos entre 48 y 55 % con la combinación | 16 |
| H 3108 | 250- |
Aumento del rendimiento de 55 % | 17 | |
| Floradade | 100, 200 y |
Aumento de rendimientos entre 15 y 35 % | 19 | |
| Pomodoro | 100, 200, |
Aumentos de 30 y 45 % en rendimiento y calidad de la fruta | 20 | |
| Pimiento | California wonder | 200, 250, 300, |
Aumento de 100 % del rendimiento con 350 | 18 |
| Lical | 200, |
Aumento del 60 % del rendimiento con 300 y de calidad y actividad antioxidante | 19 | |
| Pepino | Inivit | 200, 300, 350, |
Aumento del 23 % del rendimiento con 400 | 22 |
*Dosis con mayor aumento del rendimiento
Analizando de conjunto los resultados del estudio en la capacidad bioestimulante del quitosano, se propuso una metodología de aplicación del Quitomax® en tomate y otras hortícolas en las cuales se establece previamente semillero: Imbibición de semillas previo a la siembra con 1 g L-1, seguido de una o dos aplicaciones foliares de 300-400 mg ha-1, de una semana a 10 días postrasplante o en la prefloración.
En varios de los experimentos de campo realizados en condiciones de producción en las tres especies se realizó un análisis económico, incluyendo costos de aplicación del producto, obteniéndose en cada caso, aumento de las ganancias cuando se aplicó el Quitomax®, con un costo-beneficio positivo para el productor y por encima del tratamiento control. 17,18,22
Los resultados de los diferentes experimentos en el cultivo de la papa demostraron que la aspersión foliar de 150 mg ha-1, a los 30 y 50 días de la plantación, causó las mejores respuestas de crecimiento y del rendimiento (Figura 1) con un incremento promedio de 3 t ha-1 (23 y mejorando la calidad comercial de los tubérculos que además fueron influidos por la masa molar del quitosano utilizado. (24) Se demostró, además, que la aplicación del quitosano ocasionó cambios en la distribución de tamaños de los tubérculos, beneficiando el tamaño óptimo para semilla (35-45 mm) respecto al control (datos no mostrados). Esto se logró a los 65 días después de plantados, lo cual, resulta de gran importancia ya que una menor permanencia del cultivo en el campo conlleva a un ahorro importante de recursos. 25
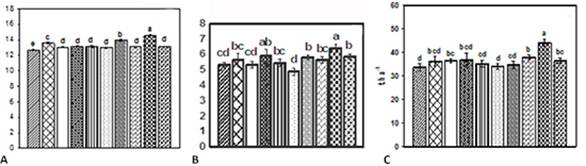
Fig. 1 Número de hojas (A) y (B) de tubérculos por planta, y (C) rendimiento estimado en el cultivo de la papa. Los tratamientos siguen el orden de la tabla de materiales y métodos. Letras diferentes indican diferencias significativas entre tratamientos según la prueba de rangos múltiples de Duncan (p <0,05).
En el cultivo del frijol, dos aplicaciones de 200 mg ha-1 a los 20-25 días de la siembra y en floración (Figura 2) fue el mejor resultado para aumentar el número de hojas, de vainas y el rendimiento del cultivo. 26
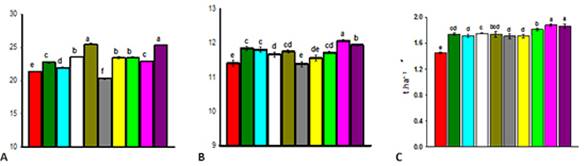
Fig. 2 Número de hojas (A), (B) de vainas por planta y (C) rendimiento estimado en el cultivo del frijol. Los tratamientos siguen el orden de la tabla de materiales y métodos. Letras diferentes indican diferencias significativas entre tratamientos según la prueba de Tukey (p < 0,05).
Los resultados en las especies antes mencionadas fueron confirmados en campos controles y extensiones en las principales provincias productoras de papa, tomate y granos del país en diferentes variedades e híbridos.
El modo de acción a través del cual las oligosacarinas promueven el crecimiento y desarrollo en las plantas no está bien definido. Sin embargo, se conoce que activan respuestas como la estimulación de enzimas relacionadas con el metabolismo primario (nitrato reductasa), el aumento del contenido de nutrientes, metabolitos primarios y secundarios, incremento en la concentración de pigmentos fotosintéticos y del proceso de fotosíntesis. Así como la promoción de un efecto antitranspirante mediante el cierre estomático por acción directa en los niveles de ácido abscísico de las células acompañantes de los estomas, que conlleva a un mejor uso del agua en la planta; entre otras.15,27,28 En este trabajo se determinaron indicadores que justifican el beneficio del proceso fotosintético, del aumento de la calidad nutricional y de la acción antioxidante de especies hortícolas.14,19,21 Por otra parte, aunque ha sido informado previamente el aumento de rendimientos con aplicación de quitosano en varios cultivos de interés, 4,6,29 por primera vez, se demuestra el efecto de dosis mucho más bajas (mg ha-1) que las informadas en la literatura (g a kg ha-1), lo que indica, en el caso de los resultados propuestos, más una acción hormonal u oligosacarínica de estos compuestos y resulta fundamental en el desarrollo de formulaciones factibles y competitivas.
Oligosacarinas en la interacción simbiótica Rhizobium-frijol común
El estudio de las señales producidas por inóculos de Rhizobium, mediante diferentes métodos cromatográficos (datos no mostrados), demostró la presencia de factores de nodulación (Nod) y de otros componentes de naturaleza lipídica como los ácidos grasos, en mayor diversidad y concentración en el inoculante inducido para frijol, lo que se traduce en una mayor actividad biológica de este bioproducto sobre las plantas.9 Este resultado permitió el desarrollo de un nuevo biofertilizante para frijol (Azofert-F®: RFC 002/17), potenciado con la síntesis de estas oligosacarinas. Su empleo en campo garantiza entre el 40 y el 70 % del nitrógeno que requiere esta leguminosa para su crecimiento y rendimiento, lo que disminuye los niveles de contaminación al suelo y las aguas por exceso de fertilizantes químicos. 30
Oligosacarinas como protectoras de plantas sometidas a estrés biótico
Los oligogalacturónidos y los derivados de quitosano inducen respuestas defensivas y resistencia en plantas contra microorganismos patógenos. 4,8 En este trabajo se informó, por primera vez, la activación de resistencia sistémica inducida por Pectimorf® y Quitomax® en posturas de tabaco y tomate, respectivamente, contra el patógeno Phytophthora nicotianae, causante de la Pata prieta en semilleros de ambas especies (tabla 4). Se demostró, además, que la resistencia obtenida en ambos casos fue el resultado de la activación de indicadores enzimáticos y del metabolismo secundario en las plantas, previo a la interacción con el patógeno, proceso crucial para la elevación de resistencia basal que detiene la infección (datos no mostrados). 14,31 La acción bioprotectora del Quitomax® en posturas de tomate fue validada en la producción de posturas para tomate de cultivo protegido en el organopónico Vivero Alamar, con resultados positivos en la reducción de enfermedades fungosas, lo que influyó en mayores rendimientos en la plantación.
Tabla 4 Efecto de la aspersión foliar de quitosano en la infección alcanzada por P. nicotianae en posturas de tomate de 25 días de sembradas*
| Tratamientos | Media de rangos | Índice de infección (%) |
|---|---|---|
| Control inoculado | 34,54 b | 100 |
| Quitosano 0,1 g L-1 | 18,67 a | 54,05 |
| Quitosano 1,0 g L-1 | 17,79 a | 51,50 |
| Quitosano 2,5 g L-1 | 27,00 ab | 78,20 |
* Los resultados se muestran como las medias de rangos en la Prueba no paramétrica de Kruskal-Wallis y como el índice de infección para cada tratamiento. Medias con diferentes letras muestran diferencias entre tratamientos en el test de Mann-Whitney con la corrección de Bonferroni (p < 0,05).
Oligosacarinas y sus efectos en plantas sometidas a estreses abióticos
Se demostró que el tratamiento durante 24 horas, a las semillas de arroz INCA LP-5 e INCA LP-7 con quitosano (100 mg L-1) (datos no mostrados) o con una mezcla de oligogalacturónidos (20 mg L-1) (tabla 5), respectivamente, estimuló el crecimiento de las plántulas de arroz en medio salino y la respuesta en ambos casos estuvo acompañada de un menor daño oxidativo. 32,33
Tabla 5 Influencia de diferentes concentraciones y modos de aplicación de una mezcla de oligogalacturónidos (Pm) en algunos indicadores del crecimiento de plántulas de arroz cv. INCA LP-7 sometidas a tratamiento de NaCl 100 mmol L-1 durante 13 días
| Tratamientos | Longitud (cm) | Masa seca (mg planta-1) | ||
|---|---|---|---|---|
| Parte aérea | Raíces | Parte aérea | Raíces | |
| Imb. Agua + SN (Control) | 19,4 a | 8,1 a | 9,9 ab | 6,1 ab |
| Imb. Agua + SN + NaCl | 12,4 d | 6,8cd | 9,2 b | 5,5b |
| Imb. Pm 10 mg L-1 + SN + NaCl | 14,6bc | 7,1bc | 11,2 a | 5,9 ab |
| Imb. Pm 20 mg L-1 + SN + NaCl | 14,9bc | 8,0ab | 11,0 a | 6,3 a |
| Imb. Agua+ SN + Pm 10 mg L-1+NaCl | 14,2 c | 6,4 cd | 10,9 a | 6,2 ab |
| Imb. Agua+ SN + Pm 20 mg L-1+NaCl | 15,8 b | 6,1 d | 11,1 a | 5,9ab |
| E.S.x | 0,37* | 0,25* | 0,30* | 0,18* |
Letras iguales representan medias que no difieren significativamente según prueba de rangos múltiples de Tukey para p ≤0,05.
De igual forma, se constató en el cultivo del frijol, que dos aspersiones foliares con Quitomax® (tabla V) a razón de 200 mg ha-1 cada una 34,35 o con Pectimorf® (tabla 6) a 150 mg ha-1 (36) fueron capaces de mitigar los efectos adversos que el déficit hídrico provoca en el crecimiento de las plantas y en la producción de granos.
En la tabla 6 se muestran los resultados de la influencia del Quitomax® en los indicadores del crecimiento, evaluados a los 42 días y del rendimiento de plantas de frijol sometidas a dos regímenes de riego. Se puede apreciar que las dos aspersiones foliares efectuadas con este polímero fueron capaces de estimular la masa seca total, el área foliar y el rendimiento de las plantas de frijol, independientemente, del régimen de riego a que estén sometidas.
Tabla 6 Influencia de dos aspersiones foliares con Quitomax® en algunos indicadores del crecimiento y rendimiento de plantas de frijol cv. Tomeguín 93 sometidas a dos regímenes de riego (medias ±intervalos de confianza)
| Tratamientos | Masa seca total (g) | Área foliar (cm2) | No. vainas planta-1 | No. granos vaina-1 | Rendimiento (kg m-2) |
|---|---|---|---|---|---|
| R100 | 7,71 ±0,51 | 1 781,02 ±37,95 | 7,74 ±0,04 | 5,03 ±0,01 | 337,64 ±14,28 |
| R100+ Quitomax® | 10,68 ±0,27 | 1 872,82 ±34,56 | 8,18 ±0,06 | 5,18 ±0,02 | 404,89 ±10,44 |
| R50+ Quitomax® | 10,73 ±0,37 | 1 752,14 ±68,00 | 5,74 ±0,04 | 4,05 ±0,02 | 260,65 ±8,64 |
| R50 | 8,99 ±0,24 | 1 482,36 ±47,99 | 4,48 ±0,03 | 3,74 ±0,01 | 166,13 ±3,19 |
R100, R50 - Riego al 100 % y 50 % de la evapotranspiración estándar del cultivo, respectivamente.
La estimulación en el crecimiento que presentaron las plantas tratadas con Quitomax® y sometidas a déficit hídrico pudo estar relacionada con un mejor estado hídrico de las plantas, el cual se reflejó en un contenido relativo de agua, un potencial hídrico y de turgencia superiores; así como una mayor conductancia estomática en comparación con las plantas estresadas no asperjadas. También, pudo estar influido por el mayor contenido de pigmentos fotosintéticos encontrado. 34,35
A diferencia del resultado anterior, en el caso de las aspersiones foliares con Pectimorf®, la influencia de estas en el rendimiento y sus componentes solamente se obtuvo en las plantas sometidas a déficit hídrico (tabla 7), aspecto en el cual es necesario continuar profundizando 36 ya que, algunos autores han informado la capacidad de esta mezcla de oligogalacturónidos de estimular el crecimiento y el rendimiento de los cultivos. 37,38) En cuanto al estrés por metales pesados, los resultados evidenciaron que el tratamiento a las semillas con la mezcla de oligogalacturónidos contrarrestó el efecto de la toxicidad por Cu2+ en plántulas de tomate (figura 3) y produjo cambios en el patrón de acumulación de dicho metal en el suelo. 39
Tabla 7 Influencia de dos aspersiones foliares con Pectimorf® sobre el rendimiento y sus componentes de plantas de frijol cv. Tomeguín 93 sometidas a dos regímenes de riego (medias ±intervalos de confianza)
| Tratamientos | No. vainas planta-1 | No. granos vaina-1 | No. granos planta-1 | Rendimiento (kg m-2) |
|---|---|---|---|---|
| R100 | 7,76 ±0,30 | 5,04 ±0,08 | 39,1 ±1,3 | 0,285 ±0,010 |
| R100+Pectimorf® | 6,00 ±0,16 | 4,24 ±0,09 | 25,4 ±1,0 | 0,187 ±0,007 |
| R50+Pectimorf® | 5,53 ±0,28 | 3,67 ±0,09 | 20,3 ±1,3 | 0,147 ±0,006 |
| R50 | 5,16 ±0,18 | 3,37 ±0,07 | 17,4 ±0,4 | 0,120 ±0,003 |
R100, R50 - Riego al 100 % y 50 % de la evapotranspiración estándar del cultivo, respectivamente
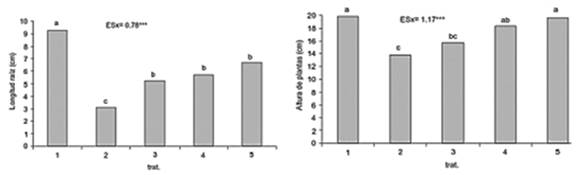
Fig. 3 Influencia del tratamiento a las semillas con oligogalacturónidos en el crecimiento de plantas de tomate sometidas a estrés por Cu2+. T1-Imbibición en agua y crecimiento en suelo sin contaminar, T2-Imbibición en agua y crecimiento en suelo contaminado, T3, T4, T5- Imbibición en oligogalacturónidos 10, 20 y 30 mg L-1, respectivamente y crecimiento en suelo contaminado.
Esta mezcla de oligogalacturónidos posee características estructurales y propiedades que le permitió retener iones metálicos y modificar la distribución de los cationes Fe2+, Cd2+ y Cu2+ en el suelo; por lo que la aplicación de la misma en diferentes formas y combinaciones no solo modificó la biodisponibilidad de dichos cationes en un suelo contaminado, sino que además favoreció el proceso de fitoextracción por plantas de tomate y estimuló la producción de biomasa sin manifestación visual de toxicidad en las plantas. 40,41
En otro resultado, la presencia de factores Nod en inoculantes inducidos incrementó la nodulación y el contenido de N total en las plantas de soya bajo estrés hídrico (datos no mostrados). 42
Conclusiones
Los resultados de estas investigaciones aportan basamentos científicos que contribuyen a conocer los mecanismos de acción de las oligosacarinas en plantas de interés económico. Se demuestra la actividad biológica de estos compuestos en el crecimiento, desarrollo y rendimiento de diferentes cultivos, su participación en la simbiosis Rhizobium-leguminosas, así como su papel en la mitigación de efectos adversos del estrés biótico y abiótico. Se definen dosis y modos de aplicación efectivos para su aplicación. La exitosa validación, introducción, extensión, y en algunos casos generalización de estos resultados en la práctica productiva, permitió el Registro de tres nuevos productos bioestimulantes (Pectimorf®, Quitomax® y Azofert-F®) en el Registro Central de Fertilizantes de Cuba, que incrementan los rendimientos, sustituyen fertilizantes y plaguicidas, a la vez que muestran protección de las plantas ante el cambio climático, con la correspondiente disminución de los costos de producción. Su naturaleza inocua y biodegradable, así como la posibilidad de sustituir productos contaminantes, le confieren un impacto ambiental positivo.














