Introducción
Los cementos óseos de poli (metacrilato de metilo) (PMMA) se han utilizado internacionalmente desde finales de los años 60’s con gran éxito en cirugía ortopédica. 1,2 Hoy día ellos poseen diferentes aplicaciones (figura 1): 3-8
fijación de prótesis metálicas a la estructura ósea en los procedimientos de artroplastias de articulaciones como pueden ser la reconstrucción total de la cadera (ATC), rodilla (ATR) y hombro (ATH);
relleno de cavidades óseas de origen traumático o patológico;
reforzamiento de la tornillería en aflojamientos de placas de osteosíntesis o fijadores internos;
estabilización de cuerpos vertebrales en caso de fracturas;
terapia local antibacteriana ya sea como medida profiláctica combinado con bajas dosis; de antibiótico, o en el tratamiento de procesos sépticos crónicos utilizando altas dosis de fármacos en forma de dispositivos temporales
A pesar de que se considera que los cementos poseen una aceptable durabilidad clínica,9 con el paso de los años ellos son aislados del tejido óseo por una membrana fibrosa que se forma como resultado de la reacción a cuerpo extraño, lo que favorece el aflojamiento protésico a largo plazo.10 Además, los cementos óseos poseen propiedades mecánicas muy diferentes al tejido óseo humano lo que posibilita en algunos casos que la prótesis, el hueso o el propio cemento se fracture o en otros casos se produzca una reabsorción ósea por apantallamiento excesivo de esfuerzos mecánicos por parte de la prótesis que conlleva a un aflojamiento protésico que da lugar a la necesidad del recambio del implante.11,12 Por último, una de las complicaciones más serias asociadas a implantes son las infecciones periprotésicas donde la multiplicidad de gérmenes, la formación de biofilms y los fenómenos de resistencia bacteriana adquirida hacen muy complejo la solución clínica.13,14 En estos casos los cementos cargados de antibióticos (ALBC) permiten la personalización de dispositivos temporales ajustando la dosis y el tipo de fármaco para su cesión local a una concentración y por un tiempo que garanticen la erradicación de la infección.15,16
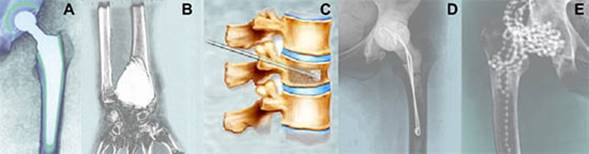
Fig. 1 Representación esquemática de aplicaciones en cirugía de los cementos óseos acrílicos. A) Prótesis de cadera cementada en la artroplastia total de la cadera (ATC); B) Relleno de cavidades quísticas luego de la exéresis de tumores óseos; C) Procedimiento de vertebroplastia percutánea para estabilización de cuerpos vertebrales con fractura; D) Espaciador protésico de cemento óseo acrílico cargado con antibiótico en reintervenciones quirúrgicas de prótesis de cadera séptica; e) Rosario de perlas de cemento óseo acrílico cargado con antibiótico en el tratamiento de infecciones periprotésicas
La gran diversidad de problemáticas clínicas donde los cementos acrílicos pueden ser utilizados como parte de la solución médica justifica el gran interés de la comunidad científica en la búsqueda de nuevas y mejores formulaciones de cementos óseos acrílicos. Este trabajo expone los principales resultados obtenidos en dos de las líneas de investigación abordadas en el proyecto denominado: “Estudio de nuevas formulaciones de cementos óseos acrílicos con potenciales aplicaciones biomédicas” del Programa Nacional de Ciencias Básicas, Cuba. La primera dirigida a transformar el cemento de PMMA (no bioactivo) en un sustituto óseo capaz de inducir la formación de nuevo tejido óseo adyacente al implante, para un mejor vínculo tejido-implante a largo plazo y por ende potencialmente mayor durabilidad clínica, y como segunda línea se proponen formulaciones de cementos con antibiótico de mayor efectividad antibacteriana que los convencionales para el control de cuadros sépticos provocados tanto por gérmenes grampositivos como gramnegativos.
Métodos
Desarrollo de cementos acrílicos bioactivos
Cementos acrílicos con rellenos de micro/nano hidroxiapatita
Síntesis de nanoHA: A partir de la reacción de neutralización de una disolución diluida de ácido ortofosfórico goteada de forma constante y a temperatura ambiente sobre una suspensión de hidróxido de calcio, el precipitado se lavó con etanol varias veces, se secó a 110 °C por dos horas y finalmente se sinterizó a 1000 °C durante una hora. Obtención de microHA: Se obtuvo por molienda y tamizado entre 56 μm y 80 μm a partir de hidroxiapatita porosa Coralina® HAP-200 obtenida de los corales marinos de la familia Porites porites mediante tratamiento hidrotermal. Silanización: Ambas hidroxiapatitas fueron silanizadas con 3-trimetoxisililpropilmetacrilato antes de su utilización. 17 La caracterización de ambas hidroxiapatitas (HA) se llevó a cabo por espectroscopia infrarroja de transformada de Fourier (FTIR), difracción de rayos-X (DRX), microscopia electrónica de barrido (SEM) y microscopía electrónica de transmisión (TEM).
Componentes de los cementos óseos: Parte sólida (PS): Autocril® (ACRILEST, Cuba) constituido por poli (metacrilato de metilo) (PMMA) con 1,2 % de peróxido de benzoilo (PBO) al cual se adicionó un 9 % de BaSO4 como agente radiopaco. Parte líquida (PL): Autocril® (ACRILEST, Cuba) constituido por metacrilato de metilo (MMA) y 0,4 % de N,N-dimetil-p-toluidina (DMpT).
Cementos óseos modificados
Cementos densos: Se llevó a cabo un diseño experimental con 45 ejecuciones (5 réplicas por composición) en el cual se probaron dos relaciones PS/PL: 2/1 y 1,5/1, diferente contenido de carga inorgánica (30 %, 40 % y 50 %) y diferentes proporciones en peso de MicroHA/NanoHA (60:40; 55:45; 50:50). Las variables respuestas analizadas fueron: resistencia a la compresión axial, módulo de elasticidad a compresión, resistencia a la flexión, módulo de elasticidad en flexión, temperatura máxima de polimerización, tiempo de fraguado, porosidad y contenido de monómero residual. Se compararon con muestras control (cemento sin aditivos) y con un cemento comercial (Subitón-G(, Argentina). Se llevaron a cabo estudios de bioactividad por inmersión en fluido biológico simulado (SBF). También se llevaron a cabo ensayos de citotoxicidad in vitro en líneas celulares de osteoblastos MC3T3-E1 y de fibroblastos L929 a extractos de los cementos con 30 % de carga inorgánica por ser los de mayor contenido de monómero residual y potencialmente más tóxicos.
Cementos porosos: Se evaluó una relación PS/PL: 2/1 con contenido de carga 40 % y relación de cargas 50:50 y 60:40. Se evaluó la Resistencia a Compresión y Bioactividad.
Los experimentos se realizaron en orden aleatorio. Para el tratamiento estadístico de los resultados se empleó el programa STATGRAPHICS® Centuriun XV.
Cementos acrílicos con vidrios de fosfato CaO-P2O5-Na2O
Obtención de los vidrios: Se prepararon dos vidrios de composiciones nominales (mol %): 44,5CaO-44,5P2O5-11NaO (BV11) y 44,5CaO-44,5P2O5-6NaO-5TiO2 (G5) utilizando como reactivos CaO, Na2CO3, NH4H2PO4 y TiO2. Los precursores fueron pesados, mezclados homogéneamente y calentados en crisol de Pt/10%Rh a una velocidad de 2 °C/min para su fusión de 1250 °C a1350 °C la cual se mantuvo por 8 h. La mezcla fue vaciada en moldes metálicos precalentados de 350 °C a 530 °C dependiendo de la temperatura de transición vítrea (Tg) de cada vidrio. Finalmente, los vidrios fueron recocidos por debajo de su respectiva Tg y enfriados lentamente para eliminar tensiones residuales. Silanización: Los vidrios fueron pulverizados a 90 μm con ayuda de molino de ágata planetario, se trataron térmicamente por 2 h a 100 °C y fueron tratados con 3-trimetoxisililpropilmetacrilato en acetona. Finalmente fueron centrifugados, lavados y secados por 2h. Los vidrios silanizados fueron caracterizados a través de análisis de composición química por microsonda, FTIR, área superficial, distribución, tamaño de partículas, espectroscopia fotoelectrónica de rayos-X (XPS), análisis térmico diferencial (ATD), análisis termogravimétrico y SEM. Componentes de los cementos óseos modificados: PS: 60 % de perlas de PMMA (Bonar Polymer Ltd.) con 2,6 % de PBO, 10 % de BaSO4 y 30 % de relleno de partículas de vidrio silanizado. PL: 97,3 % de MMA, 2,7 % de N,N-DMpT y 80 ppm de hidroquinona (HQ). Se evaluó la bioactividad de las nuevas formulaciones de cementos por inmersión de discos de los cementos en soluciones frescas de SBF a 37 °C ±0,1 °C por 30 d y se analizaron las superficies por SEM-EDS y FTIR.
Desarrollo de cementos cargados con antibióticos
Cementos con antibióticos simples
Se evaluó la cinética de liberación de diferentes antibióticos desde matrices acrílicas en dosis equivalentes a las que se utilizarían en los recambios protésicos luego de procesos infecciosos (1,25 g/estuche de cemento). Componentes de los cementos óseos modificados: como en el epígrafe 1.1 pero con 3,125 % del antibiótico correspondiente: ciprofloxacina, cefalexina, ceftriaxona, meropenem, cefazolina y ceftazidima en PS. Se hicieron fraguar muestras con forma cilíndrica de 6 mm de diámetro y 12 mm de altura. Se colocaron individualmente en recipientes con 2,5 mL de agua y a diferentes intervalos de tiempo desde 30 min y hasta 240 d se cambiaron los extractos por medio fresco. Los extractos se analizaron mediante espectroscopia ultravioleta-visible (UV-Vis) a los máximos de absorción de cada fármaco.
Cementos óseos con doble fármaco
Se estudiaron mezclas de antibióticos ciprofloxacina/meropenem y ciprofloxacina/ceftazidima en comparación con los cementos con sus respectivos cementos con antibióticos simples y también en comparación con cemento con gentamicina el cual se considera el fármaco convencional. Componentes de los cementos óseos modificados: como en el epígrafe 1.1 pero con 3,125 % de mezclas de antibióticos en PS: Se hicieron fraguar muestras en probetas esféricas de 6 mm de diámetro. Se colocaron individualmente en recipientes con 2,5 mL de agua y se hicieron extractos a diferentes intervalos de tiempo hasta 30 d. Se evaluaron los perfiles de liberación por UV-Vis y se desarrolló una nueva metodología para llevar a cabo un estudio de la efectividad microbiológica de estas nuevas formulaciones de cementos óseos ante gérmenes grampositivos (Staphylococcus aureus, ATCC 29213) y gramnegativos (Pseudomonas aeruginosa, ATCC 25668) modificando el método de Kirby-Bauer de difusión en platos de Agar. 18
Composites cemento-rellenos híbridos microHA/nanoHA-portadores de fármacos
Se realizó un estudio exploratorio de cementos composites con rellenos híbridos de microHA/nanoHA como portadores de las combinaciones de fármacos: ciprofloxacina/meropenem y ciprofloxacina/ceftazidima. Componentes de los cementos óseos modificados: como en el epígrafe 1.1 pero con 3,125% de mezclas de antibiótico en PS. Se evaluaron composites con 30 % y 40 % de carga inorgánica y relación de cargas 50/50. Para la preparación de las probetas, después del mezclado de ambas fases se burbujeó nitrógeno por 30 s con un flujo de 3 L/h y se fraguaron las muestras bajo vacío. El estudio de liberación se llevó a cabo en medio acuoso y con auxilio de la espectroscopia UV-Vis.
Cementos con aceite ozonizado Oleozon(
Componentes de los cementos óseos modificados: como en el epígrafe 1.2 pero con 10 % del antibiótico correspondiente (ciprofloxacina 5 %+meropenem 5 %) en PS o 10 % de Oleozon( en PL. Se hicieron fraguar las muestras en probetas esféricas de unos 6 mm de diámetro. Se colocaron individualmente en recipientes con 2,5 mL de agua y se hicieron extractos a diferentes tiempos hasta 30 d. Se evaluaron los perfiles de liberación por espectroscopia UV-Vis y se evaluó por el método de microdilución la efectividad microbiológica de estas nuevas formulaciones de cementos óseos ante gérmenes gramnegativos (Pseudomonas aeruginosa, ATCC 27853). Para ello 100 μL de una suspensión 5x104 CFU/ml de las bacterias en medio Mueller Hinton se colocaron asépticamente en platos de 96 pocillos junto a 100 μL de cada extracto y se realizaron lecturas a 405 nm en equipo de Microelisa por 24 h para cada período de extracción.
Resultados y discusión
Cementos acrílicos con rellenos de micro/nano hidroxiapatita
Entre los aditivos bioactivos que con más expectativas ha sido estudiado como relleno de formulaciones de cementos acrílicos se encuentra la hidroxiapatita (HA). Ello se debe a que la HA es el componente inorgánico principal del tejido óseo. Por tanto, dada la analogía química entre la apatita natural y la sintética, ésta posee excelente biocompatibilidad y no provoca reacción de rechazo al ser implantada en el tejido vivo; es osteoconductiva (facilita el crecimiento de nuevo hueso sobre ella) y principalmente es bioactiva dado que estimula la formación de una capa de hidroxicarbonatoapatita en la interface hueso-implante que posibilita la unión química entre ambos. La literatura ha abordado la inclusión de HA micrométrica, pero los resultados coinciden en que no resulta posible incrementar mucho la carga inorgánica dado que se debilitan sustancialmente las propiedades mecánicas finales del composite. 18-21
Los cementos óseos destinados a la fijación protésica deben cumplir con estrictas propiedades mecánicas estipuladas en las normas ISO 5833 22 o ASTM F451 23 dado que se espera que ellos permanezcan por más de 20 años a 25 años en el interior del cuerpo humano sometidos a grandes esfuerzos mecánicos cíclicos. Por ello es imprescindible una evaluación integral del efecto de los aditivos en los cementos sobre un conjunto de propiedades como las de fraguado, propiedades mecánicas estáticas y dinámicas, bioactividad y citotoxicidad in vitro.
Los resultaros obtenidos revelaron que los cementos modificados con rellenos híbridos de microHA/nanoHA silanizadas cumplen con las normativas y exigencias internacionales en lo referente a resistencia mecánica a compresión, temperatura máxima de polimerización, módulo de elasticidad a flexión, contenido de monómero residual y porosidad.22,23) Todas las formulaciones resultaron bioactivas, lo cual quedó demostrado por la presencia de cristales en forma de nanoagujas, típico de estructuras apatíticas, sobre la superficie de los materiales luego del ensayo de inmersión en SBF luego es muy probable de que in vivo el material tenga similar comportamiento y a través de esta capa pueda establecer un enlace directo con el tejido óseo.24
En la figura 2A se observa la morfología acicular de las partículas de nanoHA sintetizadas en el trabajo y sus dimensiones nanométricas. La figura 2B muestra una micrografía SEM de las partículas de microHA que se utilizaron como relleno micrométrico del cemento. Las caracterizaciones FTIR y DRX evidenciaron que en el proceso de síntesis se obtuvieron fases cristalinas puras de hidroxiapatita [Ca10(PO4)6(OH)2] y también se demostró la efectividad del proceso de silanización. La figura 2C muestra la micrografía SEM de las perlas de PMMA (Acrilest() componente fundamental de la parte sólida del cemento. En esta imagen se aprecia la forma esférica del PMMA con distribución de tamaños micrométricos. Por su parte la serie D de la figura 2 corresponde con micrografías SEM de la superficie de discos de cemento sumergidos por 7 d en SBF como ejemplo de los ensayos de bioactividad. Se observa en la figura D1, que en la superficie del cemento sin relleno inorgánico solo se aprecian perlas de PMMA embebidas en la matriz acrílica y partículas dispersas del agente radiopaco (BaSO4) y no hay señales de deposición superficial de otras sustancias ya que los cementos convencionales no son bioactivos, sin embargo, las figuras D2 a D4 revelan que sobre las muestras se ha desarrollado una capa de aglomerados globulares uniforme que cubre toda la superficie del material. La caracterización por energía dispersiva de rayos-X (EDS) indicó que en todos los casos los componentes químicos de la misma son los iones Ca y P exclusivamente. Las imágenes que se muestran corresponden con las muestras con menor contenido de carga inorgánica (30 %) y lo que sucede con el aumento de la relación microHA/nanoHA en donde se aprecia una mayor deposición mientras mayor contenido de nanoHA. Es de notar que con solo 7 d se haya obtenido este resultado notable para todas las composiciones: 30 %, 40 % y 50 % de relleno, puesto que trabajos de la literatura de cementos con HA solo reportan deposición apatítica micrométrica después de largos periodos de inmersión en SBF. 17

Fig. 2 A) Micrografía TEM de las nanoHA sintetizadas. B) Micrografía SEM partículas de MicroHA. C) Micrografía SEM perlas de PMMA (Acrilest(). D1-D4) Micrografías SEM de la superficie de discos de cemento sumergidos por 7 d en SBF: D1) Cemento sin relleno inorgánico, D2) Cemento carga inorgánica: 30 %-microHA/nanoHA:60/40, D3) Cemento carga inorgánica:30 %-microHA/nanoHA:55/45, D4) Cemento carga inorgánica:30 %-microHA/nanoHA: 50/50.
El contenido de monómero residual promedio determinado después de las muestras fraguadas osciló en un intervalo comprendido entre 0,8 ± 0,3 % y 1,93 ± 0,04 % inferiores al Cemento Control sin relleno y al cemento comercial Subitón Quirúrgico G®. Este resultado resulta favorable, ya que un menor contenido de monómero residual podría significar menor riesgo de afectación toxicológica en el tejido circundante al implante. Esta hipótesis se verificó con los estudios llevados a cabo en formulaciones con 30 % de relleno híbrido de MicroHA/NanoHA las cuales demostraron ser no citotóxicas tanto en cultivos celulares de fibroblastos (L929) como para células osteoblásticas (MC3T3-E1). 25
Los resultados obtenidos en esta investigación indican además que las perlas de uso estomatológico fabricadas en Acrilest( (Cuba) reúnen los requisitos de peso molecular, morfología, contenido de peróxido entre otros aspectos para preparar cementos acrílicos para aplicaciones ortopédicas ya que éstos cumplen con las exigencias internacionales de las normas ISO (5833) y ASTM (F451). Asimismo, quedó demostrado de los resultados que los composites preparados con rellenos híbridos pudieran ser considerados una alternativa a los cementos óseos acrílicos convencionales para el relleno de defectos óseos y que pueden soportar esfuerzos mecánicos significativos. No obstante, para la fijación de prótesis articulares a pesar de tener potencialidades de unirse al hueso circundante con el paso del tiempo sería prudente evaluar el comportamiento mecánico de los mismos en ensayos de fatiga para resultados más concluyentes.
Cementos acrílicos con rellenos de vidrios de fosfato silanizados
Es conocido que los vidrios del sistema SiO2-CaO-Na2O-P2O5 fueron los materiales cerámicos con los cuales se estableció por primera vez el concepto de osteointegración a finales de la década de 1970. Estos vidrios base sílice fueron los primeros desarrollados y se denominaron Biovidrios (45S5 Bioglass®). 26 La formulación del Bioglass® ha sido la base de diferentes productos comerciales con aplicaciones en estomatología, ortopedia y cirugía maxilofacial y además ha servido para el desarrollo de diversos vitrocerámicos con amplia utilización en cirugía. 27 Una característica que distingue a los vidrios base sílice es que son bioestables. Sin embargo, nuevos vidrios de fosfato biodegradables parecen ser una mejor opción ante determinadas aplicaciones.
En este trabajo se evaluaron formulaciones de cementos óseos con vidrios de fosfato del sistema CaO-P2O5-Na2O (mayor velocidad de biodegradación) y otro con composición base CaO-P2O5-Na2O-TiO2 (menor velocidad de biodegradación), los que fueron denominados BV11 y G5, respectivamente. Se llevó a cabo un estudio profundo del proceso de silanización dado que: permite la unión química entre las partículas inorgánicas de los vidrios y la matriz acrílica orgánica para evitar que disminuyan significativamente las propiedades mecánicas y además se ha reportado que los iones Si proporcionan sitios para la nucleación apatítica en SBF y mejor comportamiento bioactivo. 28
Los resultados obtenidos por ATD y XPS indicaron que la técnica de silanización fue efectiva (figura 3A y 3B). Esta reacción como tratamiento superficial es difícil de verificar, sin embargo, pudo ser cuantificado que la misma ocurre en alrededor de un 1 % (1,69 % ±0,02 % para el BV11sil y 0,93 % ±0,01 % para el G5sil). Las figuras 3C y 3D demuestran que ambas formulaciones de PMMA/Biovidrio fueron bioactivas como se aprecia de las micrografías SEM-EDS de la superficie de los materiales en los que se observó una nueva cubierta de aglomerados luego del ensayo en SBF. 29 La espectroscopía infrarroja confirmó que estos aglomerados eran fosfatocálcicos y específicamente de hidroxicarbonatoapatita que es la precursora de la unión directa implante-hueso. 29

Fig. 3 XPS que confirman la silanización de los vidrios. A) Vidrio BV11 silanizado. B) Vidrio G5 silanizado. Micrografías SEM de cementos modificados con 30 % de vidrios de fosfatos silanizados después de inmersos por 30 d en SBF. C) con BV11 y D) con G5.
Los resultados indican que los composites de acrílicos con vidrios de fosfato silanizados constituyen una vía para transformar el cemento PMMA no bioactivo en un tipo de sustituto óseo con adecuado comportamiento a largo plazo.
Desarrollo de cementos cargados con antibióticos
El tejido óseo es el segundo tejido más sustituido del cuerpo humano y los cuadros sépticos del mismo resultan en complicaciones graves que con frecuencia son muy traumáticas para los pacientes. Por lo general, este tipo de situación ocasiona dolor intenso, limitaciones de movimiento, puede conducir a amputaciones y eventualmente conducir a la muerte. La solución médica requiere generalmente de largos tratamientos con antibióticos vía sistémica, intervenciones quirúrgicas extras, largas estadías hospitalarias y por tanto mayores costos. 4,-8
En el caso de una infección periprotésica solo tratamientos farmacológicos no resuelven la situación, sino que se requiere extraer el implante original, hacer un desbridamiento exhaustivo del tejido dañado, colocar un dispositivo temporal para antibioticoterapia local hasta controlar el proceso infeccioso, para por último colocar la prótesis definitiva. Ante estas situaciones, los cementos ALBC resultan útiles. En primer lugar, se emplean en artroplastias primarias combinados con fármacos en bajas dosis ((1 g/estuche de cemento) como método preventivo de la sepsis (profilaxis) y que puedan cumplir a la vez su función de enlace entre la prótesis y el hueso.8 En segundo lugar, pueden combinarse con altas dosis de fármacos y ser utilizados para la reimplantación de prótesis (1-2 g/estuche de cemento) y también para la fabricación de rosarios de perlas o como espaciadores protésicos para la liberación local y transitoria de antibióticos en concentraciones muy altas (3,6-12 g/estuche de cemento) cuando existe evidencia de procesos sépticos.8 Además, los cementos con altas dosis se utilizan también para controlar la sepsis en fracturas abiertas o en casos de osteomielitis.8
En la actualidad, los cementos ALBC constituyen un desafío. Ello se debe, entre otras causas, a la diversidad de gérmenes que pueden encontrarse en sepsis profundas del sistema musculoesquelético, a la alta incidencia de infecciones polimicrobianas, a la formación de biolfilms en las superficies protésicas donde las bacterias se protegen de la acción de los fármacos y también al incremento de la resistencia bacteriana adquirida a los antibióticos más habituales. Por ello, cada día se evalúan nuevas estrategias en la investigación de cementos ALBC: incorporación de nuevos fármacos, mezclas de ellos, estudios para evaluar las dosis óptimas, métodos de evaluación de efectividad in vitro e in vivo de estas nuevas formulaciones, entre otros. 30,31
En este trabajo se abordó la problemática desde diversas aristas: cementos con antibióticos simples y cementos con antibióticos combinados.
Cementos con antibióticos simples
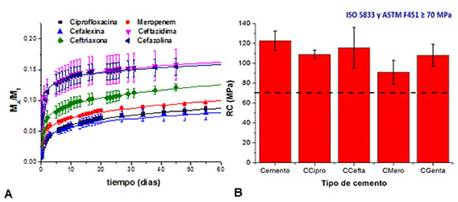
Se estudiaron cementos acrílicos convencionales cargados con seis tipos de antibióticos simples: ciprofloxacina, cefalexina, ceftriaxona, meropenem, cefazolina y ceftazidima en dosis de 1,25 g por estuche de cemento. Primeramente, se verificó la estabilidad térmica de cada uno de los fármacos por ATD. Posteriormente se estudiaron los perfiles de liberación in vitro desde los cementos en medio acuoso durante un periodo de 8 meses (o sea a largo plazo), así como, sus propiedades mecánicas de resistencia a la compresión.
Se demostró que para todas las formulaciones las concentraciones liberadas en los primeros estadíos superan las concentraciones mínimas inhibitorias (MIC) de algunos gérmenes por lo cual pueden ser efectivos ante procesos sépticos en los periodos del postoperatorio inmediato. (32 Además, todos los antibióticos liberan por un período mayor a 240 d, lo cual ocurre también en situaciones reales y debe ser tomado en cuenta cuando se quiere estudiar los fenómenos de resistencia adquirida.
La figura 4A, muestra los perfiles de liberación obtenidos en los primeros 60 d, se observa que en ese periodo solo se ha cedido al medio aproximadamente entre 6 y 17 % de la cantidad inicial que contienen. Destaca además que todas las formulaciones liberan inicialmente rápido, lo que corresponde a la disolución del antibiótico superficial de las probetas, para luego mantener una liberación sostenida en el tiempo. Asimismo, todas las formulaciones de cemento con antibiótico superaron los 70 MPa de resistencia a la compresión exigidos por las normas para la utilización como método de fijación de prótesis.33 Esto es indicativo de que todos los cementos con los fármacos estudiados en este trabajo cumplen con los requisitos mecánicos para su empleo en recambios protésicos y además poseen actividad terapéutica por lo cual constituyen alternativas para los cirujanos según el tipo de patógeno específico ocasionante de la infección.
Cementos con antibióticos combinados
El análisis de los resultados anteriores permitió proponer el empleo combinado de algunos fármacos para incrementar el espectro antibacteriano de los cementos. Específicamente se llevó a cabo un estudio de cementos acrílicos con combinación de fármacos: ciprofloxacina/meropenem y ciprofloxacina/ceftazidima, del cual no se tenía antecedentes en la literatura científica en comparación con cementos con Gentamicina que es el cemento convencional.
La liberación de todos los fármacos a los 30 d fue menor del 15 % 34 en concordancia con otros reportes de cementos ALBC con otros fármacos. Se detectó además que ocurre el fenómeno de “oportunismo pasivo”, el cual solo ha sido demostrado para determinadas parejas de antibióticos, en él se incrementa la cesión de fármacos ya que se produce un incremento en la porosidad superficial del cemento y se forman pequeños túneles o grietas en las capas más externas que permite el acceso del solvente más al interior y por ende una mayor extracción del fármaco.
Se propuso también un nuevo modelo semiempírico que describe mejor la cinética de liberación considerando los fenómenos físico-químicos (disolución y difusión) que tienen lugar durante la liberación de los fármacos: M t M i = k 1 1− e − n 1 t + k 2 t n 2 en comparación con otros modelos de la literatura y con mejor poder predictivo.34
En cuanto a los ensayos de susceptibilidad antimicrobiana se comprobó que al séptimo día de los ensayos aún existe efecto antibacteriano para algunas de las propuestas de cemento, figura 5. La figura 5A muestra los resultados de los ensayos frente a cultivos de Staphylococcus aureus (Sa), a las primeras 24 h y después de 7 d. Se observa que en el cemento sin fármaco (control 1 y 7 d) no hay halos de inhibición, lo que indica que no hay efecto antibacteriano. La formulación con gentamicina posee un efecto similar desde las primeras 24 horas hasta el séptimo día lo que indica que mantiene un efecto constante cada 24 h frente a Sa en este periodo. Los cementos con las mezclas de antibióticos son superiores a cementos con gentamicina en las primeras 72 h (posoperatorio inmediato) y solo ciprofloxacina/meropenem mantiene un efecto equivalente al cemento con gentamicina hasta el día 7. 34
En contraste la figura 5B, muestra el poder antibacteriano de las formulaciones frente a cultivos de Pseudomonas aeruginosa (Ps). El cemento sin fármaco (control 1 y 7 d) no presenta halos de inhibición o sea no hay efecto antibacteriano. Cemento con gentamicina posee efecto el primer día, pero disminuye significativamente su acción y al séptimo día inhibe muy pocas bacterias. Todas las otras combinaciones cemento-fármaco a las 24 h resultan mucho mejor que el cemento convencional. Los cementos con las mezclas de fármacos propuestas poseen mejor efecto durante los 7 d frente a este tipo de germen gramnegativo. La combinación ciprofloxacina/meropenem resulta la mejor de las opciones. 34
El estudio llevado a cabo con matrices compuestas de cemento, relleno híbrido microHA/nanoHA porosas y con mezclas de fármacos demostró que las mezclas son superiores a sus análogas con gentamicina y mejores los materiales porosos con relación a los materiales densos. La figura 5C muestra cómo se liberan los fármacos desde cementos con 40% de carga inorgánica en relación microHA/nanoHA 50/50, se puede observar que los cementos porosos a los 7 d de liberación duplican la cantidad de fármaco ceftazidima cedida al medio y también resulta mayor la cantidad eluida de ciprofloxacina en comparación con los cementos densos con mezclas ciprofloxacina/ceftazidima. 35

Fig. 5 A) Progresión del ensayo de susceptibilidad contra S. aureus por 7 d. B) Progresión del ensayo de susceptibilidad contra P. aeruginosa por 7 d. C) Liberación desde muestras densas y porosas de composites con microHA/nanoHA. D) Liberación desde cemento con mezcla de ciprofloxacina/meropenem/Oleozon(.
Otro de los trabajos referidos a cementos con antibióticos combinados fue el desarrollo de cementos cargados con Oleozón( y mezclas de ciprofloxacina/meropenem y ciprofloxacina/meropenem/Oleozón®. Siendo el primer reporte del empleo de aceites ozonizados en combinación con los cementos óseos acrílicos. 36 Los cementos óseos cargados con fármacos se preparan en el propio salón quirúrgico y tienen la ventaja de poder ser personalizados según la afección del paciente con su dosis y tipo de fármaco.
Los aceites ozonizados han demostrado efectividad contra infecciones virales, contra hongos, bacterias o protozoos y en general contra un gran número de especies de microorganismos. En este trabajo, se evaluó la efectividad antimicrobiana de las nuevas formulaciones contra cultivos de Pseudomonas aeruginosa el cual constituye uno de los microrganismos oportunistas más difíciles de erradicar en infecciones periprotésicas ya que adquiere resistencia frente a un gran número de fármacos. La figura 5D, muestra cómo se ceden al medio de forma individual los principios activos desde cementos con los 3 principios combinados. El Oleozón® por su naturaleza hidrófoba se eluye a una menor velocidad en comparación con los otros dos fármacos. Sin embargo, induce una mayor cesión de los dos antibióticos hidrofílicos debido al efecto del “oportunismo masivo”. Los ensayos de Microelisa demostraron que extractos de cemento con esta combinación de fármacos erradica el 100 % del crecimiento bacteriano aún a los 11 d de extracción. 36
Conclusiones
Los resultados de las investigaciones que se reportan en este trabajo profundizan en dos rutas de investigación de actualidad en el campo de los cementos. Se explora como hacer bioactivos los cementos para lograr implantes con mayor durabilidad clínica de los que hoy se dispone internacionalmente. Para ello se propone el uso de rellenos híbridos microHA/nanoHA con mayor contenido de relleno y diferentes cargas inorgánicas sin afectar propiedades mecánicas y se demuestra bioactividad en 7 d por inmersión en SBF. De igual manera se demuestra que es posible utilizar vidrios bioactivos de fosfato silanizados para lograr formulaciones de cementos bioactivas y parcialmente biodegradables.
Con el objetivo de contrarrestar infecciones musculoesqueléticas se evalúa la liberación de diferentes fármacos en bajas dosis y se demuestra que al menos por 8 meses se ceden al medio. Se propone una nueva combinación de fármacos: ciprofloxacina/meropenem y se demuestra mayor efectividad desde el punto de vista antibacteriano que el cemento convencional con gentamicina contra gérmenes grampositivos y gramnegativos. Se describe un nuevo modelo semiempírico que reproduce con alta fiabilidad la cesión al medio de estos fármacos. Se propone por primera vez el empleo de aceite ozonizado, el cual solo y combinado con mezclas ciprofloxacina/meropenem inhibe sustancialmente el crecimiento de cultivos de Pseudomonas aeruginosa.