Introducción
Una inmunoterapia exitosa contra el cáncer requiere la inducción de una respuesta inmune celular efectiva mediada por linfocitos T CD8+ citotóxicos (CTL) en combinación con un adecuado ambiente inmunológico.1) La activación de linfocitos T CD8+ y su diferenciación a CTL requiere el reconocimiento por estas células de los complejos formados entre moléculas del complejo principal de histocompatibilidad de clase I (MHC-I) y los péptidos antigénicos presentados por las células presentadoras de antígenos (APC).2) En este proceso son necesarias, además, señales co-estimuladoras y la presencia de citocinas tales como la interleucina (IL)-12 y el interferón tipo I. 3,4 Aunque las células dendríticas (DC) son APC esenciales por su capacidad de procesar antígenos (Ag) exógenos y presentarlos a los linfocitos T CD8+5, evento identificado como presentación cruzada,6 la capacidad de los macrófagos (Mϕs) ha sido también reconocida para cumplir esta función in vitro e in vivo.7,8
La presentación cruzada de Ag ocurre frecuentemente por la ruta citosólica, lo que implica una transferencia de los Ag desde el compartimento endosomal al citosol para su degradación por el proteasoma. Los péptidos son transportados al retículo endoplasmático o a los fagosomas por las proteínas transportadoras asociadas con el procesamiento de Ag (TAP), lo que resulta en la formación de los complejos péptido-MHC clase I. Por el contrario, en la ruta vacuolar los Ag internalizados son degradados dentro de los compartimentos endosomales por proteasas lisosomales y los péptidos resultantes se asocian con las moléculas MHC clase I en los endosomas y fagosomas.9,10,11) La inducción de CTLs específicos a Ag tumorales es una estrategia terapéutica relevante debido a que median la lisis específica de la célula tumoral y también proporcionan al hospedero una respuesta de memoria de larga duración que puede prevenir la recurrencia del cáncer.12
Se han diseñado diferentes estrategias basadas en liposomas con el propósito de mejorar la presentación cruzada de Ag, las cuales incluyen liposomas sensibles al pH,13) liposomas catiónicos14 y la inclusión en estas vesículas de inmunomoduladores, como ligandos de receptores tipo Toll (TLR),15 o péptidos membranotrópicos y PFP.16) Particularmente, la co-encapsulación en liposomas sensibles al pH de Ag con Listeriolisina O (LLO), una PFP de la bacteria Gram (+) Listeria monocitogenes, ha potenciado respuestas de CTL funcionales y protectoras como resultado de una eficaz entrega de los Ag al citosol de las APC.17,18
Las sticholisinas (St) I y II (StI y StII), pertenecientes a la familia de proteínas actinoporinas, son PFP producidas por la anémona del mar Caribe Stichodactyla helianthus. .( 19,20,21) Estas proteínas de aproximadamente 20 kDa y carentes de cisteína en su estructura, son capaces de permeabilizar membranas modelos y celulares mediante la formación de poros oligoméricos de diámetro 2 nm.22,23,24 La actividad permeabilizante de estas proteínas se potencia significativamente en presencia de esfingomielina y exhiben una gran similitud estructural.19,20,21,25) La homología funcional de las St con las PFP de origen bacteriano hace de estas actinoporinas moléculas atractivas para potenciar la presentación cruzada de Ag en las APC. La incorporación de las St a liposomas pudiera ser conveniente para la generación de CTL específicos a un Ag, similar a lo que se ha informado con LLO. (17,18) Considerando lo descrito, el objetivo de este trabajo fue explorar la habilidad de StII, co-encapsulada con el Ag modelo ovoalbúmina (OVA) en liposomas, de inducir una respuesta de CTL específica al Ag funcional en un modelo tumoral, la contribución de su actividad formadora de poros a esta respuesta inmune y aspectos mecanísticos de su propiedades inmunoduladoras.
Métodos
Obtención y caracterización de los liposomas que encapsulan StII y OVA
Se prepararon liposomas mediante el procedimiento de deshidratación-rehidratación (DRV), 26) constituidos por dipalmitoil fosfatidilcolina (DPPC) y colesterol (Col) en una relación equimolar y en una proporción de 16 μmoles de lípidos: 80 μg de OVA: 10 μg de StII (Lp/OVA/StII). Como control se prepararon liposomas sin StII (Lp/OVA). En la caracterización de los liposomas se evaluaron los parámetros de eficiencia de encapsulación y tamaño/polidispersidad de las partículas, mediante marcaje con yodo radioactivo (125I) de las proteínas y dispersión dinámica de la luz, respectivamente. La resistencia de los liposomas a la acción de StII se comprobó con un ensayo de permeabilización de liposomas cargados con el fluoróforo carboxifluoresceína. Todos estos ensayos se realizaron según se describen. 27
Evaluación in vivo de la citotoxicidad de linfocitos T CD8+ específicos a OVA
Ratones C57BL/6 salvajes o knockout de TLR-4 se inmunizaron los días 0 y 12 con Lp/OVA/StII o Lp/OVA. Las inmunizaciones se realizaron por vía s.c. con una dosis de 50 μg de OVA en una proporción de 10 μmol lípidos totales y 6,25 μg St en 200 μL. Como control negativo se inyectó un grupo de animales con tampón fosfato salino (PBS). El control positivo consistió en OVA adyuvada en ácido polinosínico-policitidílico (OVA/PIC), administrado como se explicó previamente. 27 Se prepararon células “diana” a partir de células totales del bazo de ratones C57BL/6 vírgenes.
La suspensión celular se separó en dos grandes fracciones de igual concentración. Una de las fracciones celulares se incubó con el péptido inmunodominante de OVA, SIINFEKL y posteriormente con el fluoróforo diacetato de carboxifluoresceína succinimidil éster (CFSE++). La otra suspensión celular no expuesta al péptido se incubó con una menor concentración de CFSE (CFSE+). Ambas suspensiones celulares se mezclaron en una relación 1:1 y se inocularon por vía i.v. a los animales a los 20 días de la primera inmunización. 27)
A las 16-18 h, los ratones se sacrificaron y se les extrajo el ganglio linfático (GL) inguinal más próximo al sitio de inmunización. La suspensión celular de cada ganglio se analizó por citometría de flujo determinando el número de eventos correspondientes a las células marcadas con CFSE++ y CFSE+, lo que posibilitó la estimación del porcentaje de lisis específica. 27) En algunos ensayos se eliminaron las células T CD4+ en los animales inmunizados con el empleo de un anticuerpo monoclonal (AcM) anti-CD4+, para evaluar la contribución de estos linfocitos a la respuesta de CTLs inducida por las preparaciones liposomales.
Evaluación de la actividad antitumoral en un escenario preventivo
Ratones C57BL/6 se inmunizaron con Lp/OVA/StII o Lp/OVA, tal y como se describe en el epígrafe anterior; como control negativo, un grupo recibió PBS. El día 19 de cada estudio los ratones se retaron por vía s.c. con las células tumorales E.G7-OVA en 200 μL.27) El prendimiento y el volumen tumoral se monitorearon con la medición de los diámetros perpendiculares. Se registró en el tiempo el porcentaje de animales sin tumor (prendimiento tumoral) y al final del ensayo, el porcentaje de ratones vivos. En algunos ensayos se estudió el papel que desempeñaban los linfocitos T CD8+ en la respuesta antitumoral generada por Lp/OVA/StII, con la administración de un AcM anti-CD8 por vía i.p., 24 h antes de la inoculación del tumor. Como control se le administró PBS en lugar del AcM anti-CD8, a un grupo de animales inmunizado previamente con Lp/OVA/StII.
Detección de la presentación cruzada del Ag mediante el ensayo del hibridoma de células T LacZ
Las DCs y los Mϕs derivados de médula ósea (BM-DC y BM-Mϕs, respectivamente) se prepararon según se informó previamente. 28,29 La presentación cruzada de Ag del péptido OVA257-264 se detectó usando la línea del hibridoma de células T CD8+ B3Z que expresa β-galactosidasa bajo el control del promotor de IL-2. 30 Brevemente, las BM-DCs y los BM-Mϕs se cultivaron en placas de 96 pozos de fondo plano en medio RPMI que contenía antibióticos y 10% de Suero fetal Bovino (FBS).
Después de 24 h, las células se incubaron con o sin inhibidores químicos, disueltos en medio RPMI sin FBS durante 30 minutos. Las BM-DC y los BM-Mϕs se pulsaron, en presencia o ausencia de inhibidores, con OVA en forma soluble o con las preparaciones liposomales Lp/OVA/StII, o Lp/OVA. 31) Como control positivo, las células se incubaron con el péptido SIINFEKL. Después de la estimulación, las células se cultivaron conjuntamente con las células T CD8+ B3Z. 31
Después de 24 h, se eliminó el sobrenadante y se adicionaron a los pozos 100 μL de tampón LacZ que contenía clorofenol rojo-β-D galactopiranosido 0,15 mM en PBS más Nonidet P-40 al 0,13%, MgCl2 9 mM y β-mercaptoetanol 0,1 mM. Las placas se incubaron durante 5 h a 37 °C. La absorbancia se midió a 570/620 nm utilizando un lector de placas SpectraMax.
Ensayos de activación de células dendríticas
A partir de ratones C57BL/6 salvajes y knockout de TLR-4 o TLR-2 se generaron BM-DCs inmaduras por el procedimiento descrito anteriormente. 28 En placas de 6 pozos las células se expusieron a diferentes estímulos (StII, StI, o LLO, 1 μg/mL) disueltos en 2-3 mL de medio RPMI sin suero, durante 3 h. Posteriormente, se añadió en cada pozo FBS 10% y se mantuvieron en las mismas condiciones de incubación durante 18 h a 20 h.
Como controles negativo y positivo del ensayo se añadió a las células medio o el lipopolisacárido bacteriano LPS (1 μg/mL), 27 respectivamente. Las células se colectaron con PBS (4°C), se marcaron con los anticuerpos correspondientes, 27 para el análisis por citometría de flujo de los niveles de expresión de los marcadores de maduración de DCs: CD40, CD86 y CD80. Para eliminar la posible presencia de endotoxinas en las PFP. Estas se pre-incubaron con polimixina B (pmxB,10 μg/mL) en RPMI durante 20 min a 37 °C, excepto LLO que se pre-incubó de 25 °C a 28 °C.
Resultados y discusión
Liposomas que co-encapsulan StII y el Ag OVA inducen una respuesta de células T CD8+ y una respuesta antitumoral específicas a este Ag
Los liposomas que co-encapsulaban StII y OVA (Lp/OVA/StII) mostraron elevados porcentajes de encapsulación, similar para ambas proteínas (~50 %) y tamaños de partículas de ~2 μm. La eficiencia de encapsulación para el Ag OVA y el tamaño de las partículas no resultaron modificados por la presencia de StII. La composición lipídica seleccionada (DPPC y Col 1:1) para la producción de los liposomas posibilitó que estas vesículas fueran resistentes a la actividad formadora de poros de StII.
Los ratones inmunizados con Lp/OVA/StII mostraron una expansión significativa de las células T CD8+ específicas a OVA y un incremento en la proporción de linfocitos T CD8+ de memoria, en comparación con aquellos tratados con Lp/OVA o PBS. 27 En correspondencia con estos resultados, la actividad citotóxica específica a OVA generada por Lp/OVA/StII en estos animales fue robusta, en relación a los grupos que recibieron Lp/OVA e incluso OVA/PIC como control positivo (figura 1). Estos resultados demuestran que la preparación Lp/OVA/StII es capaz no sólo de expandir las células T CD8+, sino también de potenciar una respuesta de CTL específica al Ag. Además, se evidencia que este efecto depende de la presencia de StII en la vesícula liposomal, lo cual sugiere un posible incremento relativo de la introducción del Ag en una ruta endógena de presentación en el MHC-I mediado por la PFP.

Fig. 1 Inducción de una respuesta de CTL específica al Ag OVA por la formulación liposomal que co-encapsula OVA y StII. Ratones C57BL/6 se inmunizaron por vía s.c. los días 0 y 12 con Lp/OVA/StII o Lp/OVA. Otros dos grupos se inyectaron con PBS u OVA/PIC como controles (-) y (+), respectivamente. El día 20, los ratones recibieron por vía i.v. una mezcla de células “diana” (CFSE++) y células control (CFSE+). A las 16 h a 18 h se extrajo de los ratones el GL inguinal más próximo al sitio de inmunización, se determinó el número de eventos correspondientes a las células CFSE++ y CFSE+, y se calculó la lisis específica (%). A) Histogramas correspondientes a las células CFSE++ y CFSE+ de ratones representativos de cada grupo experimental. B) Porcentajes de lisis de las células “blanco”. Letras diferentes indican diferencias significativas entre los grupos según la prueba de Tukey (p <0,05). Se muestran las medias (puntos) de cuatro experimentos independientes con su valor medio (línea horizontal).
Adicionalmente, se determinó si la colaboración de las células T CD4+ era relevante para la inducción de CTL por Lp/OVA/StII. Los animales inmunizados con Lp/OVA/StII y tratados con el AcM anti-CD4 presentaron porcentajes de citotoxicidad similares a aquellos inmunizados con esta formulación que no tenían afectadas las células T CD4+ (66,8 % y 74,7 %, respectivamente, p = 0,66). Los resultados demuestran que la formulación Lp/OVA/StII en este escenario es capaz de generar una respuesta de CTL específica al Ag, aun en ausencia de células T CD4+. (27
Para determinar si la respuesta de CTL inducida por Lp/OVA/StII era eficaz en conferir inmunidad protectora, se seleccionó un escenario tumoral. Los animales se inyectaron con Lp/OVA/StII, Lp/OVA, PBS en un esquema igual al del ensayo de CTL in vivo y siete días después se inocularon con las células tumorales que expresan OVA, E.G7-OVA. El porcentaje de ratones libres de tumor y de animales vivos en los grupos inmunizados con Lp/OVA/StII mostraron valores notablemente mayores que los tratados con Lp/OVA (figura 2A). En resumen, la inmunización con Lp/OVA/StII promueve una robusta protección antitumoral específica al Ag, superior a la que se origina con Lp/OVA, por lo que la incorporación de StII a los liposomas determina que se potencie tanto la respuesta de CTLs, como la inmunidad antitumoral en un escenario preventivo. (27
El papel crucial de los CTLs en la actividad antitumoral inducida por la preparación Lp/OVA/StII se comprobó con la eliminación de la población de linfocitos T CD8+. Los animales desprovistos de células T CD8+ experimentaron una reducción del porcentaje de ratones libres de tumor (p= 0,001) y una ausencia de animales vivos al final del experimento (Figura 2B), con respecto a los que no recibieron el AcM anti-CD8. Estos resultados confirman que la formulación Lp/OVA/StII activa linfocitos T CD8+ y éstos contribuyen notablemente a la respuesta antitumoral que generan dichos liposomas. Sin embargo, este efecto no se abrogó totalmente con la eliminación de las células T CD8+, dadas las diferencias que se observaron entre este grupo y el control negativo, lo cual sugiere la posible activación de otras células efectoras en la respuesta frente a tumor.27

Fig. 2 Potenciación de la respuesta antitumoral inducida por liposomas con StII co-encapsulada con el Ag OVA y efecto de la eliminación de linfocitos T CD8+. A) ratones C57BL/6 fueron inmunizados con Lp/OVA/StII o Lp/OVA los días 0 y 12 (7-10 animales/grupo). Siete días después los animales se retaron con 3 x 105 células E.G7-OVA. Un grupo de ratones recibió PBS (control negativo). B) Uno de dos grupos de ratones inmunizados con Lp/OVA/StII fue tratado con una dosis única (i.p.) de un AcM anti- CD8+ (1 mg/ratón), en tanto el otro recibió PBS, un día antes de inocular las células tumorales. Los resultados se expresan como porcentajes de animales sin tumor en el tiempo y vivos el último día del ensayo, Letras diferentes indican diferencias estadísticas entre los grupos de acuerdo con las pruebas de Log-rank (p <0,05) (A) y la prueba U de Mann-Whitney entre los grupos de ratones tratados o no con anti-CD8 (*p = 0,04) (B). Se muestra un experimento representativo de tres ensayos con iguales resultados. 27
La respuesta citotóxica específica a OVA mediada por las sticholisinas en liposomas no depende de su actividad formadora de poros
Las respuestas de CTL y antitumoral que se indujeron con Lp/OVA/StII indicaron un posible papel de StII en la presentación del Ag en las moléculas del MHC-I como se ha informado para liposomas que portan LLO y un Ag,17,18,32 y donde la actividad formadora de poros de la PFP resultó imprescindible. Por esta razón, se estudió la importancia de la actividad funcional de StII para la capacidad de los liposomas que la contienen de inducir respuesta de CTL. Con este fin se obtuvo una variante de las St que forma dímeros irreversiblemente inactivos a partir del mutante de StI (93% homología con StII), StIW111C, con el empleo del reactivo homobifuncional bis(maleimido) hexano, el cual se nombró StIW111Cirrev. Después de comprobar la identidad y grado de pureza por electroforesis del StIW111Cirrev, así como su incapacidad para formar poros, se realizó un ensayo de CTLs in vivo similar a lo descrito anteriormente. Se prepararon liposomas que lo contenían (Lp/OVA/StIW111C irrev ) y se comparó con liposomas que portaban el mutante StIW111C formando predominantemente dímeros reversibles estabilizados por enlaces bisulfuros 33 (Lp/OVA/StIW111Crev) o la St parental (Lp/OVA/StI). De manera interesante, los animales que recibieron Lp/OVA/StIW111Cirrev mostraron un porcentaje de lisis específica a OVA similar al de los ratones que recibieron las formulaciones Lp/OVA/StI o Lp/OVA/StIW111Crev (figura 3). Además, todos los grupos experimentales tratados con los diferentes liposomas exhibieron un valor medio de actividad citotóxica equivalente al observado cuando los animales se inmunizaron con Lp/OVA/StII (Figura 1B). Este resultado constituyó la primera evidencia de la no dependencia de la respuesta citotóxica específica a OVA mediada por las Sts de la actividad formadora de poros de estas PFPs. 27
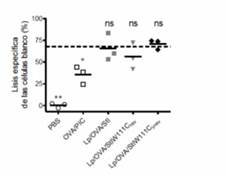
Fig. 3 Estimulación de una respuesta de CTLs específica a OVA por liposomas que co-encapsulan el dímero inactivo irreversiblemente StI W111C irrev y el Ag.
Se inyectaron ratones C57BL/6 los días 0 y 12 con Lp/OVA/StIW111Cirrev, Lp/OVA/StIW111Crev, Lp/OVA/StI, OVA/PIC o PBS. El ensayo se realizó como se describe en la figura 1. En el gráfico se representa la actividad citotóxica (%) de cada ratón individual (puntos). Línea discontinua: media de la lisis específica de las células “diana” (%) en ratones inmunizados con Lp/OVA/StII (figura 1B). El análisis estadístico se realizó respecto a los valores de Lp/OVA/StII mediante la prueba de Dunnett (p < 0,05). Los datos corresponden a un experimento representativo de dos ensayos independientes con resultados similares. 27
StII co-encapsulada con OVA en liposomas induce la presentación cruzada del Ag en macrófagos pero no en células dendríticas in vitro a través de la ruta vacuolar
StII encapsulada con OVA en liposomas induce una significativa proliferación de linfocitos T CD8+ y respuesta de linfocitos T citotóxicos in vivo. Para investigar cuáles APCs participan en esta respuesta, se evaluó la habilidad de las BM-DC y los BM-MΦs de activar las células B3Z T CD8+ específicas al péptido SIINFEKL después de la estimulación con OVA encapsulada con o sin StII en liposomas. Las BM-DC no fueron capaces de inducir una significativa activación de las células T CD8+ cuando ellas fueron estimuladas con la OVA encapsulada en liposomas con o sin StII (entre 4 % y 9 %) (figura 4A). Estas APC solamente provocaron una significativa activación de las células T CD8+ cuando fueron estimuladas con 25 μg/mL de OVA libre (30%). Similares resultados se obtuvieron empleando linfocitos T CD8+ de ratones OT-I específicos al péptido SIINFEKL. 27)
De manera interesante, la simple mezcla de SII con OVA sí indujo la presentación cruzada del Ag en BM-DC (manuscrito en preparación). La baja capacidad de las BM-DCs de internalizar estas vesículas pudiera explicar en parte el comportamiento de estas APCs al menos in vitro. Por el contrario, los BM-MΦs mostraron una evidente capacidad de promover la presentación cruzada del péptido derivado del Ag OVA en MHC clase I cuando estas células fueron estimuladas con Lp/OVA/StII siendo significativamente superior a lo observado con la preparación Lp/OVA (figura 4B). Además, sólo las células B3Z T CD8+ activadas por los BM-MΦs pulsados con Lp/OVA/StII o con el control experimental del péptido SIINFEKL, indujeron una secreción notable de IL-2. 31 En resumen, solamente la formulación liposomal conteniendo OVA encapsulada con StII fue capaz de inducir la presentación cruzada del Ag en BM-MΦs, indicando la habilidad de esta PFP para promover la presentación de este en el contexto de MHC clase I.
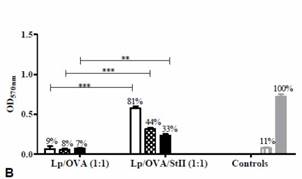

Fig. 4 Presentación cruzada de OVA en BM-MΦs y en BM-DCs mediada por StII co-encapsulada con OVA en liposomas. A) BM-DC y B) BM-MΦs de ratones C57BL/6 fueron incubados con las concentraciones indicadas de OVA en Lp/OVA/StII o Lp/OVA. Ambas células incubadas con 25 μg/mL de OVA libre y 10 nM del péptido SIINFEKL fueron usados como controles. Posteriormente, las células fueron co-cultivadas durante 24h con las células B3Z T CD8+ específicas a OVA y que expresan β-Galactosidasa bajo el promotor de IL-2. A y B muestran la media ± desviación estándar de la densidad óptica a 570nm correspondiente a la actividad enzimática. La eficiencia de la presentación cruzada del Ag en relación al péptido SIINFEKL se indica sobre cada barra. El análisis estadístico fue realizado mediante la prueba de U de Mann-Whitney: ** p <0,01, *** p <0,001. 31
La presentación cruzada de OVA en BM-Mϕs resultó significativamente reducida con el uso de los inhibidores de la fagocitosis y del aparato de Golgi, citocalasina D y brefeldina A, respectivamente, lo que indica que estas células internalizan estas partículas a través de un mecanismo de fagocitosis y que la existencia de un aparato de Golgi funcional es relevante para la presentación cruzada del Ag mediado por los liposomas que contienen StII.31
En la vía clásica de presentación en MHC clase I, las proteínas citosólicas son catabolizadas por el proteasoma antes de la formación de los complejos péptidos-MHC clase I. La presentación cruzada de Ag exógenos en MHC clase I puede también involucrar el transporte al citosol seguido por el procesamiento por el proteasoma o degradación por proteasas lisosomales en el compartimento endosomal. (9,10,11 Con el propósito de conocer la maquinaria proteolítica implicada en la generación de péptidos MHC clase I de OVA co-encapsulada con StII en los liposomas, el ensayo de presentación cruzada del Ag fue realizado en presencia de inhibidores del proteasoma o de las proteasas lisosomales.
Sorprendentemente, el tratamiento con epoxomicina, inhibidor del proteosoma, no afectó la presentación cruzada de OVA co-encapsulada con StII en los liposomas, 31 pero sí obstruyó la de OVA libre, lo que demuestra que la inhibición con epoxomicina fue efectiva en estas condiciones experimentales. Sin embargo, la incubación de los BM-MΦs con el inhibidor general de catepsinas o con leupeptina, el cual es un inhibidor de proteasas cisteíno, serino y treonina, decreció significativamente la presentación cruzada de OVA encapsulada con StII en liposomas. 31 Como era de esperar, la presentación del péptido exógeno SIINFELK no fue modificada por ninguno de los inhibidores empleados. En su conjunto estos resultados indican que OVA encapsulada con StII en liposomas no requiere de la proteólisis citosólica para su presentación cruzada, pero si depende de la degradación lisosomal, lo que demuestra que StII co-encapsulada con OVA en estos liposomas induce la presentación cruzada del Ag por la ruta vacuolar. 31
Después de demostrar la capacidad de los BM-MΦs para realizar la presentación cruzada de OVA co-encapsulada con StII en liposomas in vitro, se estudió la relevancia de los MΦs en la inducción de la respuesta de CTL por esta formulación liposomal in vivo. Los ratones C57BL/6 fueron desprovistos de los MΦs mediante la administración de liposomas que contenían clodronato por vía i.p. 34 y se realizó el ensayo de CTL, tal como se describe en la figura 1. El análisis de las células de la cavidad peritoneal por citometría de flujo reveló una eliminación aproximada del 85%, de los MΦs.31) El análisis cuantitativo del porcentaje de células “dianas” lisadas indica que la eliminación de los MΦs provocó una significativa reducción de los CTLs específicos a OVA (∼90 %).31) Estos resultados demostraron el rol esencial que tienen estas APC en el cross-priming de los linfocitos T CD8+inducido por la formulación liposomal Lp/OVA/StII in vivo.
Estos resultados en su conjunto evidencian, por primera vez, eventos mecanísticos de la presentación cruzada del Ag en APC mediada por StII en liposomas, diferentes a los descritos previamente para la PFP, LLO. 16,17,18,32
StII y la isoforma StI inducen la maduración de las células presentadoras de antígenos
Los resultados obtenidos presuponen que la actividad formadora de poros en las membranas de las St no es determinante en la inmunomodulación que estas PFP ejercen sobre la actividad de CTL y, por tanto, es probable que otro mecanismo condicionado por su estructura 3D sea relevante en la generación de dicha respuesta inmune. Por esta razón, se evaluó la maduración de APC como DC, mecanismo esencial para la activación de CTs. BM-DC de ratones se expusieron a StII o a la isoforma StI, en su forma libre. Como control se utilizó LPS en presencia o ausencia de pmxB y se comparó el efecto de las St con LLO en presencia de pmxB.
En la figura 5 se aprecia que ambas St, aun pre-incubadas con pmxB, originaron un marcado incremento en el porcentaje de BM-DC que exponían en su superficie las moléculas co-estimuladoras CD86, CD40 y CD80 (figura 5A) y en el nivel de su expresión en membrana (figura 5B), en comparación con el medio + pmxB (control negativo). Como era de esperar, el LPS (control positivo) mezclado con pmxB exhibió una reducción notable del porcentaje de células positivas y en el nivel de su expresión de los marcadores en membrana, valores que se equipararon a los observados en el control negativo. Además, el incremento en la expresión de las moléculas co-estimuladoras que indujeron ambas St fue equivalente al que originó LLO (figura 5B) y se abrogó cuando se evaluaron St desnaturalizadas por calor (manuscrito en preparación).
Se evidenció que ambas St en su estructura nativa, independientemente de la contaminación con LPS, comparten la propiedad de madurar DC in vitro, lo cual se logra comprender debido a su elevada homología estructural. 19) Esta capacidad pudiera explicar, en parte, el efecto inmunomodulador de estas PFP y su contribución a la respuesta inmune celular mediada por los liposomas que la contienen.
La maduración de las células dendríticas inducida por StII y la respuesta de linfocitos T citotóxicos generada por los liposomas que contienen esta PFP dependen del TLR-4
Debido a que StII fue capaz de madurar DC, uno de los eventos que se derivan de la interacción de TLR de las APC con sus respectivos ligandos, se presumió que los efectos de esta PFP pudieran estar asociados con la activación de uno o más de dichos receptores. Para corroborar esta hipótesis, BM-DC de animales deficientes de TLR-4 (KO TLR-4) o TLR-2 (KO TLR-2) y de animales normales como control del experimento, se incubaron con StII+ pmxB o LPS, como control de ligando de TLR-4. 35,36 Se evaluó la expresión de los marcadores CD40 y CD86 en la superficie de las BM-DC. Nuevamente se observó que StII aumentó la presencia de estos marcadores en las BM-DC de los animales normales en términos de porcentajes de células positivas, en relación a las células no estimuladas (figura 5C y D).
Sin embargo, la expresión de las moléculas de superficie se redujo significativamente en BM-DC de KO TLR-4 expuestas a StII, contrario a lo que ocurrió en BM-DC de KO TLR-2 (figuras 5C y D). Estos resultados sugieren la participación del TLR-4 en la maduración de BM-DC que induce StII. Además, se realizó un ensayo de CTL in vivo donde se evaluó el efecto de Lp/OVA/StII en ratones deficientes de TLR-4. La inmunización con los liposomas originó en los ratones salvajes una respuesta de CTL equivalente a la que se informó en la Figura 1, mientras que en los KO TLR-4 se evidenció una citotoxicidad considerablemente menor (figura 5E). Con este resultado se demuestra que el TLR-4 y por tanto, los mecanismos que se derivan de su activación, influyen en la respuesta inmune mediada por CTL que induce la formulación Lp/OVA/StII.
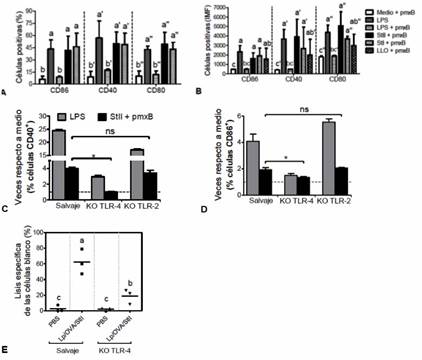
Fig. 5 Maduración de las DC por StII in vitro: Dependencia de TLR-4 e influencia de este receptor en la respuesta de CTL que inducen los liposomas que contienen esta PFP. A y B) Porcentajes e intensidad media de fluorescencia (IMF), respectivamente, de células CD11c+ que expresan CD86, CD40 y CD80. C y D) Gráficos que muestran la razón entre BM-DC (%) CD40+ o CD86+ estimuladas respecto a aquellas no estimuladas (medio). Línea discontinua: células no estimuladas. BM-DC de ratones C57BL/6, salvaje o deficientes de TLR-4 o TLR-2 (KO TLR-4 y KO TLR-2, respectivamente), se incubaron durante 3 h con StII pre-tratadas con pmxB. A las 18 h a 20 h de una ulterior incubación se detectaron las células CD11c+ que expresaban moléculas co-estimuladoras en su superficie mediante citometría de flujo. En algunos ensayos se adicionó la isoforma StI o la PFP bacteriana LLO, esta última como referencia. Se muestran las medias ± desviación estándar de los valores medios de tres experimentos independientes. E) Porcentajes de lisis de las células “diana” en animales individuales (puntos). Se realizaron ensayos de CTLs in vivo como se describe en la figura 1, con ratones C57BL/6 salvajes y KO TLR-4 inyectados con Lp/OVA/StII o PBS. Se muestran los resultados de un experimento que se repitió dos veces con iguales resultados. Letras distintas significan diferencias estadísticamente significativas de acuerdo con la prueba de Tukey (p <0,05).
Conclusiones
Estos hallazgos en su conjunto constituyen la primera demostración de que una plataforma vacunal basada en StII, PFP de un organismo eucariota marino, encapsulada en liposomas funciona eficientemente para inducir una respuesta de CTL robusta de relevancia para la inmunoterapia del cáncer, con una contribución de StII que va más allá de su habilidad de formar poros en membranas















