INTRODUCCIÓN
La herpetofauna cubana cuenta con 58 especies de anfibios y 142 reptiles. Su índice de endernismo (84,5 %) es muy alto aun cuando los vertebrados en general no son numerosos en la fauna cubana. 1
Se reconoce mundialmente la importancia ecológica de los anfibios, al considerarlos excelentes indicadores de la salud de los ecosistemas dada su sensibilidad para responder a ligeros cambios en el medioambiente, ya sea durante la etapa larval o en la adulta. Dichas respuestas se han utilizado para revelar fragmentación del hábitat, impacto de los plaguicidas y otras acciones humanas en el medio.
Es motivo de preocupación la disminución de anfibios a nivel global, motivada por varios factores 2 como la destrucción del hábitat, el cambio climático y la propagación de una enfermedad fúngica llamada quitridiomicosis. Esta afectación de la biodiversidad es considerada por muchos especialistas como la peor de la historia.
Por otra parte, los reptiles también son vitales en el funcionamiento de los ecosistemas. Muchos se alimentan de roedores e insectos por lo que influyen en el control del equilibrio en las zonas donde habitan.3) Su papel en las tramas tróficas es muy diverso y su distribución está también afectada por la actividad humana.
El neotrópico es un área con una gran diversidad y densidad de anfibios y reptiles, no obstante, no existen muchos estudios que dentro de la biología de la reproducción aborden la histología de las gónadas y los eventos ultraestructurales de la gametogénesis. Situación similar ocurre con la herpetofauna cubana, con vacíos de información en estos temas que el presente estudio pretende resolver. De ahí que el objetivo sea mostrar el impacto de los estudios histológicos y ultraestructurales de las gónadas de anfibios y reptiles cubanos en la determinación del estado reproductivo del ejemplar y las etapas de la gametogénesis.
MÉTODOS
Se incluyen en el estudio once especies de ranas del género Eleutherodactylus: E. atkinsi, E. blairhedgesi, E. casparii, E. dimidiatus, E. goini, E. planirostris, E. pinarensis, E. riparius, E. thomasi, E. varleyi y E. zugi; un hílido, Osteopilus septentrionalis; y las ocho especies de sapos bufónidos del género Peltophryne que habitan en Cuba, una de ellas con tres subespecies: P. florentinoi, P. fustiger, P. peltocephala, P. taladai, P. catalauciceps, P. empusa, P. gundlachi, P. longinasa longinasa, P. l. cajalbanensis y P. l. dunni. En total son 22 especies.
Se recolectaron también tres especies de anolinos, Anolis sagrei, A. homolechis y A. luteogularis; de otros dos lagartos, Leiocephalus carinatus y L. cubensis; un geckónido, Hemidactylus mabouia; y cinco pequeñas serpientes: Cubophis cantherigerus, Arrhyton vittatum, Tropidophis melanurus, Tropidophis pardalis y Caraiba andreae, para once especies en total.
Se recolectaron tres ejemplares hembras y tres machos de cada especie en sus zonas de distribución típicas y fueron trasladados a la Facultad de Biología, de la Universidad de La Habana. Se anestesiaron éticamente y las gónadas fueron extraídas mediante un procedimiento quirúrgico convencional.
Se utilizaron para las descripciones y análisis realizados la histología clásica convencional, así como otras técnicas avanzadas: inmunofluorescencia, microscopía electrónica de transmisión (MET) y microscopía de fuerza atómica (MFA).
Para la microscopía óptica, las muestras se procesaron mediante las técnicas clásicas de histología. 4 Se empleó fijación con paraformaldehído al 4 % en PBS (0,01 M, pH 7,6) por 24 horas. Se tiñeron con hematoxilina-eosina (H-E), tricrómica de Mallory, tricrómica de Masson, tinción de Gallego y PAS-hematoxilina. Las preparaciones fueron observadas en un microscopio óptico Nikon E800, con cámara digital para el registro fotográfico.
Se aplicó el inmunomarcaje fluorescente de los patrones de transcripción mediante la detección de proteínas SR. La inmunodetección se realizó por el método indirecto en cortes de 3 μm a 5 μm de grosor a partir de las muestras obtenidas con la histología clásica y montados sobre portaobjetos de vidrio silanizados (Sigma). Se realizó una tinción para determinar el grado de compactación del ADN con 4´,6-diamidino-2-fenilindol (DAPI). Los núcleos se tiñen en diversos tonos de azul dependiendo del estado de compactación de la cromatina (de azul claro o casi blanco que denota mayor compactación hasta azul brillante, menos compactación).
Las imágenes obtenidas fueron procesadas mediante los programas ScionImage, Image J y Adobe Photoshop.
Se fijaron también fragmentos de las gónadas en glutaraldehído al 2,5 % en buffer fosfato (pH 7,4) de 24 horas a 48 horas para ser procesados con la técnica convencional para MET. 5) Los cortes semifinos fueron teñidos con azul de toluidina y los ultrafinos fueron contrastados utilizando acetato de uranilo (PolySciences) al 3 % y citrato de plomo (PolySciences) al 0,3%. Las rejillas se observaron en un MET JEOL JEM 1010 que opera a 80 kV y se realizó el registro digital de las imágenes.
Para complementar la descripción de la morfología externa de los espermatozoides, se prepararon suspensiones de espermatozoides de cuatro especies (E. planirostris, P. fustiger, P. longinasa dunni y P. taladai). Se extrajeron los testículos de cada ejemplar y se maceraron en paraformaldehído al 4 % (Sigma) en PBS (0,01 M, pH 7,6). Se extendió una gota de la suspensión en un portaobjetos y se dejó secar a temperatura ambiente. Las preparaciones se observaron en un MFA Digital Instruments, BioScope, operado en modo de contacto con un controlador Nanoscope IIIa. Las imágenes fueron obtenidas en una computadora conectada al microscopio a través del controlador Nanoscope IIIa y software Bioscope versión 4,32 ce.
RESULTADOS Y DISCUSIÓN
Anfibios
El sistema reproductor de ambos sexos consiste de gónadas pareadas delante de los riñones, donde se desarrollan los gametos, y conductos para su transportación 6,7. Los ovarios de las especies estudiadas tanto ranas (Eleutherodactylus y Osteopilus septentrionalis) como sapos (Peltophryne), consisten de una cavidad central y su aspecto es racimoso en etapa de actividad reproductiva (Fig. 1). Se distinguen células germinales en distintas fases de desarrollo: ovogonias, diploides, que se forman en los lechos germinales y con núcleo conspicuo; ovocitos cubiertos durante todo su desarrollo por una única capa de células somáticas epiteliales -células foliculares- llamada capa granulosa, y al exterior la teca, de tejido conectivo. 8
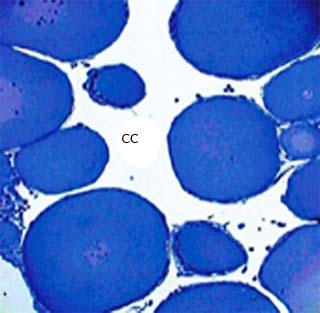
Fig. 1 Corte de ovario de Eleutherodactylus goini donde se observan varios ovocitos y la cavidad central (CC). Azul de toluidina, 200X
Los ovocitos se clasifican en previtelogénicos, vitelogénicos y postvitelogénicos, acorde al proceso de síntesis y deposición del vitelo. 8,9,10 Es evidente un lecho germinal y en ocasiones dos, como en los cortes histológicos procedentes de O. septentrionalis. Esto garantiza una abundante puesta de huevos 11 en este anuro muy exitoso y considerado invasor en otras latitudes. 12 También presentan en todos los estadios, sintetizada por el ovocito, una membrana acelular por fuera de la membrana plasmática, denominada membrana vitelina. 13,14
Durante la previtelogénesis se observaron, tanto al microscopio de campo claro como al electrónico, numerosos nucléolos y cromosomas plumosos o lamp brush. Los nucléolos evidencian la producción de ARN ribosomal y los cromosomas plumosos, del ARN mensajero que aporta el citoplasma materno y garantiza la síntesis proteica del futuro embrión. 9,14,15
Los ovocitos vitelogénicos muestran una acumulación progresiva de vitelo en forma de plaquetas vitelinas, desde la periferia hasta la zona del citoplasma cercana al núcleo. 9,16,17) En los posvitelogénicos el núcleo está desplazado hacia uno de los polos de la célula, denominado polo animal, disposición típica en anuros. 14) El otro extremo llamado polo vegetativo, tiene mayor concentración de vitelo. En este estadio ocurre la ovulación. 9) Fue numerosa la cantidad de ovocitos vitelogénicos durante la etapa reproductiva lo cual supone un gran número de huevos por puesta y por consiguiente una mayor producción de larvas y adultos. 18
Se identifica en una hembra adulta de P. peltocephala la presencia de un órgano de Bidder, lo cual dada la abundancia de ovocitos vitelogénicos encontrados en el ovario, es quizás una limitante para el desarrollo posterior de este órgano ante la necesidad de hembras en estas poblaciones. 19
Los testículos tienen forma ovoide, algo más alargados en los sapos. Algunos no llegan a 1cm como en los eleuterodactílidos y el sapo pequeño P. empusa. En los sapos grandes, su diámetro mayor es de alrededor de 4 cm. Se distinguen cuerpos grasos a su alrededor, sobre todo en etapa no repro ductiva, cuando muestran mayor desarrollo, como en otros anfibios 17 donde se ha descrito su estacionalidad. 18) Los cuerpos grasos están vinculados en las hembras a la síntesis de vitelo; 8) aunque en los machos no hay consenso de su función y pueden constituir una reserva de energía para el cortejo y el apareamiento. 18,20) Al exterior de los testículos se encuentra la túnica albugínea, capa fina de tejido conectivo, transparente, de color blanquecino o incluso, muy pigmentada. 21
Se corroboró la presencia de un órgano de Bidder situado en la posición craneal del testículo. Se considera un ovario vestigial, inactivo aparentemente y solo con ovocitos previtelogénicos, 22,23,24 aunque su color azul brillante al teñirlo con DAPI (Fig. 2) y su ultraestructura al MET, permite considerarlo como potencialmente funcional pues sugiere que son células con transcripción activa. 19
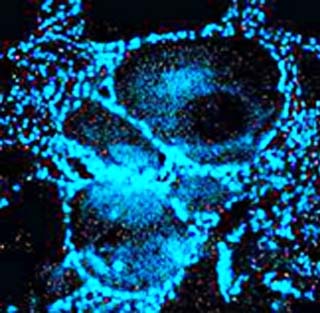
Fig. 2 Tinción con DAPI en órgano de Bidder de Peltophryne taladai. Se muestra el marcaje azul brillante en el núcleo de las células foliculares que rodean a los ovocitos previtelogénicos. 200X
Este órgano ha sido objeto de polémicas al atribuírsele diversas funciones, 25,26,27 entre ellas endocrina en ambos sexos y sin relación con el desarrollo de las gónadas. 28). Se discute asimismo que pueda tener un carácter sinapomórfico; no obs tante, por su condición hasta ahora única, pudiera ser una apormorfía. 29
El tejido conectivo de la túnica penetra al interior del testículo y rodea compartimientos internos, los lóbulos seminíferos. Entre ellos existe tejido intersticial formado por células de Leydig, fibroblastos y vasos sanguíneos. 30
Las células masculinas en desarrollo se agrupan en cistos en el interior de los lóbulos seminíferos, condición común en anamniotas 6,31 por lo que la espermatogénesis en el género Eleutherodactylus, 16,17 en Osteopilus septentrionalis32 y en el género Peltophryne21,22 es cística. 33,34). Los cistos incluyen una célula de Sertoli sobre la que se ubican las células sexuales en un mismo estadio de diferenciación. 16,17,30
Las espermatogonias, dan lugar a los espermatocitos I que entran en la profase meiótica, visible al microscopio de campo claro y al MET. Los espermatocitos I se dividen en dos espermatocitos II haploides, que rápidamente originan cada uno dos espermátidas, redondeadas inicialmente. Estas, por la espermiogénesis que ocurre sobre el citoplasma de las células de Sertoli, originan los espermatozoides -particularmente abundantes en O. septentrionalis- que son liberados al lumen de los lóbulos seminíferos. 17,30,32
El marcaje fluorescente mostró la presencia en los primeros estadios del espermatogénesis, la disminución en las etapas intermedias y la desaparición en el espermatozoide a punto de ser liberado del patrón moteado, lo que demuestra que la intensidad de su actividad transcripcional va disminuyendo hasta que se compacta la cromatina.
Los espermatozoides de los eleuterodactílidos poseen la típica cabeza con un acrosoma peculiar y cola alargada donde destaca una membrana ondulante. 35) La esencia morfológica y funcional de la cola es el axonema, 36 el cual a nivel ultraestructural presenta el patrón de microtúbulos 9 más 2, aunque entre los dobletes no existe en este género brazos de dineína, indicador de poca movilidad del espermatozoide. La pérdida de los brazos de dineína no resulta contradictoria durante el desarrollo evolutivo de esta célula si se considera la corta distancia que recorren los espermatozoides hasta el ovocito en el momento de la fertilización en estas especies.
En O. septentrionalis, igualmente, en la cabeza del espermatozoide se encuentra el acrosoma alargado, debajo un espacio subacrosómico y el núcleo, muy electrodenso. La región de la cola correspondiente a la pieza media presenta una vaina mitocondrial rodeando el axonema 32 que se aprecia al MET (Fig. 3).
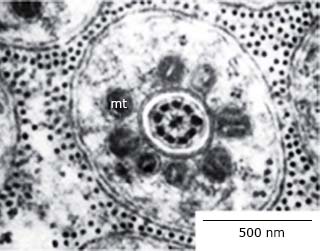
Fig. 3 Corte transversal de la cola de un espermatozoide de Osteopilus septentrionalis a nivel de la pieza media. Se observa al centro el axonema, las mitocondrias (mt) y la membrana plasmática al exterior.
En los espermatozoides de los sapos la cabeza es de forma cónica o alargada como en P. empusa. Destaca la presencia de dos colas en P. fustiger y P. taladai (sapos grandes) lo cual constituye una modificación a la condición flagelada más frecuente en los tetrápodos. En P. empusa se observó también indicios de membrana ondulante, ornamento que se ha propuesto como otra característica distintiva en los miembros de la familia Bufonidae.23 Ambos caracteres fueron verificados al MFA. 37
La morfología de los espermatozoides en anuros es similar incluso a nivel ultraestructural a la de los espermatozoides de otros anfibios, aunque algunas características distintivas deben ser tenidas en cuenta para futuros análisis taxonómicos y evolutivos. Los resultados permiten esquematizar un espermatozoide tipo en ranas y sapos.
Reptiles
El sistema reproductor femenino en los lagartos estudiados presenta dos ovarios lobulados localizados anteriores a los riñones, en posición dorsal 38,39 y su tamaño presenta variaciones acordes a la época reproductiva. 40 Los ovarios desembocan en los oviductos, donde tiene lugar la formación de las envolturas del huevo, y terminan en la cloaca. 6 Alrededor de los ovarios en la cavidad abdominal pueden observarse cuerpos grasos, grandes y de color blanquecino o amarillo, muy desarrollados en etapa de regresión o recrudescencia gonadal. 40 Estos hallazgos coinciden con las variaciones ováricas y las propuestas de ciclos reproductivos en reptiles. 41,42,43
Los folículos se encuentran en la corteza ovárica en el mismo o en diferentes estadios de desarrollo y por fuera se ubica la teca, en ocasiones pigmentada y muy conspicua, 44 como ocurre en Hemidactylus mabouia.38 El epitelio folicular, en los previtelogénicos, al microscopio de campo claro se observa estratificado, y se denomina capa granulosa, muy característica y solo presente en las hembras del orden Squamata.42 Contiene tres tipos celulares: pequeñas, intermedias y grandes o piramidales (Fig. 4).
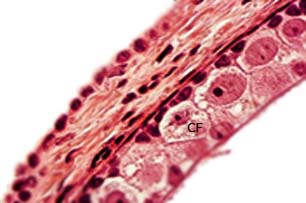
Fig. 4 Periferia de un ovocito previtelogénico de Tropidophis melanurus. Se observan las células foliculares (CF) características. H-E 400X
La tinción con DAPI en cortes de ovarios permite apreciar una coloración azul brillante en los núcleos de estas células indicando su estado activo transcripcional. Entre las células foliculares fue posible distinguir al MET complejos de unión del tipo unión estrecha. La zona radiata sobre la membrana vitelina o zona pellucida, evidencia las interrelaciones entre la membrana plasmática del ovocito y las prolongaciones citoplasmáticas de las células foliculares, homóloga a la membrana vitelina de los anfibios 13 y otros grupos. 14 Se observa una agrupación de mitocondrias o cuerpo de Balbiani en los ovocitos jóvenes situado en el citoplasma yuxtanuclear. 38
Al avanzar la vitelogénesis el ovocito aumenta su diámetro. Las plaquetas vitelinas, se distribuyen por todo el citoplasma como en el resto de reptiles, aves, peces y mamíferos ovíparos, ya que el vitelo nutre al embrión. 14,42) A medida que esto ocurre las capas de células foliculares van disminuyendo y permanece la de células grandes, que se aplana en los ovocitos postvitelogénicos al reordenarse como resultado del aumento de tamaño considerable del ovocito. 42 En ninguno de los cortes de ovarios analizados se observaron lechos germinales de ovogonias ni atresia folicular.
En las hembras de las serpientes, el sistema reproductor consta de dos ovarios pequeños y alargados uno situado muy por delante del otro, característica notable pues muchos ofidios por la forma de su cuerpo solo presentan un ovario. 45) Son vivíparas y se observaron en algunos ejemplares embriones en el oviducto. La histología del ovario es similar a lo descrito anteriormente para los lagartos cubanos y de otras latitudes, 43 pero su ultraestructura muestra grasa y pigmentos. Estos animales de cuerpo largo y delgado, no albergan cuerpos grasos grandes y quizás la grasa intraovárica sea una estrategia ante la necesidad de material lipídico para la síntesis de vitelo dada la ausencia de cuerpos grasos.
En ciertas regiones, incluso en Cuba en determinadas épocas del año, los testículos disminuyen en diámetro y puede encontrarse en adultos un predominio de solo un tipo celular en su interior. 42 En las especies estudiadas el testículo derecho se encuentra ligeramente más arriba que el izquierdo, detrás del hígado. Los cubre la túnica albugínea similar a otros vertebrados 6 que puede ser delgada y transparente, blanquecina o negra como en Anolis sagrei, pues hay muchos pigmentos. 46 Los cuerpos grasos, cuando están pre sentes, pueden ser grandes y como en otras especies, amarillo claro o casi blancos. 44
En el interior de los testículos, se hallan los túbulos seminíferos separados por tejido intersticial. Cada túbulo presenta una membrana basal, sobre la que se asientan las espermatogonias. Se apreció en etapa reproductiva una disposición radial de las células sexuales desde esa membrana basal, donde se ubican las menos diferenciadas, hasta el lumen, clásica de los verdaderos amniotas. 6,43
Como ya se mencionó anteriormente en anfibios, 31) las células de Sertoli sostienen en su citoplasma a las células sexuales en desarrollo. En los túbulos seminíferos en reposo o en recrudescencia, solamente se encuentran presentes espermatogonias y algún espermatocito I sobre las células de Sertoli. Este período en Cuba corresponde a la época de seca, entre octubre y abril, donde ocurre una disminución o ausencia de actividad reproductiva. Cuando la gónada está en pleno apogeo reproductivo, generalmente en meses lluviosos y de altas temperaturas, en el interior de los túbulos se desarrolla la espermatogénesis completa, igual que en otras especies. 46,47) La ultraestructura de las células sexuales masculinas confirma los hallazgos histológicos y, por ejemplo, muestran a los espermatocitos I como las células más grandes y con cromoso mas en diferentes etapas de la profase I de la meiosis. 48,49
En las espermátidas se distingue el cuerpo cromatoide o nuage descrito en otros reptiles en esta etapa del espermatogénesis que constituye un agregado de vesículas, en ocasiones cerca del complejo de Golgi. 50) La espermiogénesis se distingue por varios eventos que van convirtiendo a una espermátida re donda en un espermatozoide, como se refiere por otros autores. 51
En los machos de las serpientes cubanas los testículos se encuentran dorsales, el derecho más cercano a la parte anterior del animal. Su forma es muy alargada y su túnica albugínea es de color blanco, sin pigmentos. Asociados a las gónadas se detectaron cuerpos grasos de diferentes tonalidades de amarillo en algunas etapas del año, correspondiendo a períodos de recrudescencia gonadal. 52
Los espermatozoides de los lagartos presentan características similares. La cabeza es alargada, al igual que el acrosoma, y tiene muy conspicuas sus propias membranas. En las tres especies del género Anolis se aprecia un espacio subacrosómico, como característica distintiva, y una región electrolúcida epinuclear no presente en los espermatozoides de otros lagartos estudiados. Su espermatozoide muestra un centriolo distal en la concavidad posterior del núcleo o fosa nuclear, los centriolos proximal y distal perpendiculares entre sí, similar a lo informado por otros autores, 51,53 además presenta hombros nucleares.
La cola del espermatozoide maduro posee un axonema que la recorre en toda su longitud. En los tres anolinos se observaron cuerpos densos a lo largo de la cola, rodeando al axonema en la pieza principal y cuerpos intermitocondriales en la pieza media. Estos últimos están también presentes en la cola del espermatozoide de Hemidactylus mabouia, aunque solo a nivel de la pieza media, y se comienzan a organizar durante la espermiogénesis. Un espermatozoide completo reconstruido de H. mabouia se observa en la figura 5.

Fig. 5 Reconstrucción del espermatozoide completo de Hemidactylus mabouia a partir de fotomicrografías al MET.
Los espermatozoides en las serpientes exhiben los mismos elementos comunes de los espermatozoides móviles descritos anteriormente. 54,55) En Cubophis cantherigerus se describe la presencia de una vaina fibrosa todavía a nivel de la pieza final de la cola del espermatozoide maduro, no presente en otros reptiles ni en otros vertebrados, quizás para proporcionarle más estabilidad.
Al analizar los túbulos seminíferos y el epidídimo de Anolis sagrei, exitoso colonialista e invasor en distintas latitudes, se aprecia una gran abundancia de espermatozoides en su interior. 56) Igualmente se distingue una gran estabilidad en el tejido germinal y abundantes espermatozoides en el lagarto Hemidactylus mabouia, tal y como ocurre en la rana platanera Osteopilus septentrionalis, ambos considerados invasores. 11,12,38
Conclusiones
La histología clásica establece diferencias a nivel celular en ovarios y testículos de anfibios y reptiles por lo que es adecuada para determinar la condición de la gónada y, en consecuencia, el estado reproductivo del ejemplar, aspecto esencial para describir los ciclos gonadales que se suceden en estas especies.
Los caracteres histológicos y ultraestructurales permiten clasificar los tipos celulares de la gametogénesis. La ovogénesis incluye una etapa de crecimiento o vitelogénesis y el ovocito se acompaña de células somáticas, que conforman un epitelio simple en anfibios y estratificado en reptiles, con un reordenamiento en una capa en el último estadio. La espermatogénesis es cística en anfibios y radial en reptiles.
Estos resultados se compilan en un Atlas que ofrece por primera vez para Cuba evidencias fotomicrográficas hasta el nivel ultraestructural del proceso de formación de las células sexuales en especies de nuestra herpetofauna, cuya importancia ecológica, evolutiva y taxonómica es fundamental para la salud de los ecosistemas y la supervivencia humana.














