INTRODUCCIÓN
Los métodos para diagnóstico microbiológico actualmente no satisfacen las necesidades en la clínica por no posibilitar una temprana terapia antimicrobiana. Tampoco satisfacen la velocidad en que se necesita disponer los datos de la contaminación o del límite microbiano de productos farmacéuticos, alimentos y otros. Es por eso que surge la necesidad del desarrollo de nuevos métodos. 1
Varios métodos rápidos se han desarrollado para solucionar la respuesta demorada en el diagnóstico, 1 incluyendo los basados en la nanotecnología mediante la construcción de nanosensores 2,3 o acoplando nanopartículas a anticuerpos monoclonales, 4 zondas de ADN o ARN. 5
El objetivo de la investigación consistió en el desarrollo de una plataforma tecnológica flexible para el diagnóstico rápido de microorganismos empleando nanopartículas de arcillas, fosfatos de calcio, cerámicas y zeolitas.
MÉTODOS
Se diseñaron mezclas originales de bases nutritivas, todas patentadas por los autores, a partir de materias primas nacionales tales como extractos de Saccharomyces cerevisiae6) e lpomoea batatas;7 hidrolizados enzimáticos de corazón de res (8) y sangre bovina; 9 hidrolizados enzimáticos o ácido de caseína; 10,11 mezcla de peptona 12) y se seleccionaron las que acortaron significativamente la fase lag de crecimiento microbiano hasta sólo 60 min a 120 min, midiendo el valor de la densidad óptica (DO) en el tiempo. 13 Se diseñó, una mezcla de sales y otras sustancias como las vitaminas que participan en la síntesis de enzimas microbianas, 14,15 todas grado p.a. (Applichem, Alemania); entre ellas (NH4)SO4, Mn(SO4)2, ZnSO4, MgSO4, NaCl, CaCl, Na2HPO4, NaSO3, tiamina, riboflavina, niacina, ácido pantoténico, piridoxina, biotina, ácido fólico, cianocobalamina, L-histidina monoclorhidrato; L-triptófano y L-metionina. 16 Se diseñaron composiciones para la detección de las fluorescencias y cromogénesis, adicionando sustratos empleados por los autores en medios de cultivo y se ensayaron en diversos métodos cualitativos y cuantitativos, para cepas de colección de la American Type Culture Collection (ATCC), cepas aisladas y muestras de aguas y orina para microorganismos, como Escherichia coli, coliformes, Enterococcus, Streptococcus, Staphylococcus, Candida. 17,18,19,20,21,22 Entre los sustratos estudiados se encuentran los derivados del fenol, de la para-nitro-anilina; del indolil, la metilcumarina y metilumbeliferil (MU) para actividades galactosidasa, glucuronidasa, decarboxilasa, glucosidasa y fosfatasa; se seleccionaron los que mostraron la aparición de reacciones de degradación enzimática de hasta un máximo de 6 h para combinarlos con las nanopartículas. 16
Se obtuvieron y caracterizaron nanopartículas de arcillas y cerámicas naturales o artificiales escogidos entre un amplio rango, seleccionando entre ellos la sal de fosfato de calcio de origen natural hidroxiapatita Coralina® (CNIC, Cuba) (denominada indistintamente como HAP-S, CHA y CFN); Osteosynt®, cerámica sintética de fosfato tricálcico, Einco Biomaterials, Brasil (HAP-56, BCP y OSDG); nanopartículas de hidroxiapatita sintética código 677418, Sigma-Aldrich (HAP nano); cerámica de tierra silícea purificada y calcinada, código 1.07910.0250, Merck (TS); bentonita hidrofílica nanoclay código 682659, Sigma-Aldrich (BT); nanopartículas de bentonita, CAS 1302-78-9, Sigma-Aldrich (BT nano); nanopartículas de halosita código 685445, Sigma-Aldrich (Hal); zeolita natural purificada tipo clinoptilolita ZNPmed® (IMRE, Cuba) (Z). Las nanopartículas se obtuvieron por métodos de síntesis (OSDG) o a partir de fuentes naturales (OFN) y procesándolas por secado por aspersión (spray-drying) en la fase final a escala piloto. 23
La composición y características de las nanopartículas y nanocompuestos se evaluaron por los siguientes métodos: pH por potenciometría, pérdida por desecación y capacidad de absorción de agua por gravimetría, potencial ζ y tamaño de partículas por dispersión dinámica de la luz, las características superficiales por microscopía de barrido (SEM). 24,25,26 La composición química se determinó por espectrometría de absorción atómica (EAA), el espectro infrarrojo y el espectro de absorción se determinó por Espectroscopía Infrarroja por transformación de Fourie (FTIR), el perfil de degradación térmica (TGA) se efectuó por análisis termogravimétrico. 24,25 El efecto de la actividad inhibitoria de las nanoestructuras y nanocompuestos se ejecutó por el método de Kirby-Bauer en Agar de Mueller-Hinton (BioCen, Cuba) 25 y mediante microscopía electrónica de barrido y de transmisión. 24,25,27
La obtención de los nanocompuestos y las estructuras tridimensionales a partir de los materiales originales (arcillas, sales de fosfato de calcio, cerámicas, zeolitas) se ejecutaron fundamentalmente por métodos de absorción, dispersión, precipitación, centrifugación y spray-drying. 20 Para el desarrollo de métodos específicos de detección, aislamiento, identificación, diferenciación y recuento de bacterias y hongos se estudiaron cepas de ATCC, aisladas y muestras biológicas y de aguas, diferentes relaciones de volumen o masa de nanocompuestos/muestra, de volumen de inóculo/muestra; tiempo de detección, temperatura de incubación. 20,25 Se emplearon como indicadores la DO medida en espectrofotómetro, 12 intensidad de la fluorescencia en el equipo SUMA (CIE, Cuba) o mediante observación visual bajo luz ultravioleta a longitud de onda de 366 nm.
Para la evaluación funcional como diagnosticadores de las composiciones nutritivas y los nanocompuestos que conforman la plataforma tecnológica se evaluaron múltiples parámetros, tales como sensibilidad, especificidad y exactitud relativas, índice Kappa, diferencias por Chi cuadrado, discrepancias, regresión lineal. 28.29,30) Todos los análisis estadísticos como Anova, prueba post hoc de Tukey y estadística descriptiva (media, Std. Dev.) se realizaron con Statistica 8 (Statsoft Inc., EE. UU.).
RESULTADOS
Se diseñaron nuevas mezclas de bases nutritivas, todas garantizaron una reducción del tiempo de duración de la fase lag de crecimiento de máximo 120 min, gracias a los originales procesos de hidrólisis y extracción, resultando seleccionadas para conformar las composiciones nutritivas los extractos de S. cerevisiae e I. batatas; hidrolizados enzimáticos de corazón de res, sangre bovina, hidrolizados enzimático o ácido de caseína.
En la figura 1 se muestran, a manera de ejemplo, 3 combinaciones de bases nutritivas (g/L): V1: peptona de sangre 6,37; peptona de soya 3,24; triptona 9,97; extracto de levadura 3,24; extracto de carne 2,43; NaCl 0,5 y Na2HPO4 0,1; V2: peptona de sangre 6,0; peptona de soya 5,0, triptona 5,0; extracto de levadura 5,0; extracto de carne 3,0; NaCl 0,5 y Na2HPO4 0,1 y V3: peptona de sangre 6,0; peptona de soya 6,0; triptona 3,0; extracto de levadura 6,0; extracto de carne 4,0; NaCl 0,5 y Na2HPO4 0,1. Se logra para los 3 microorganismos ensayados reducir la fase lag de crecimiento a un máximo de 2 h y el inicio de la fase de crecimiento exponencial.
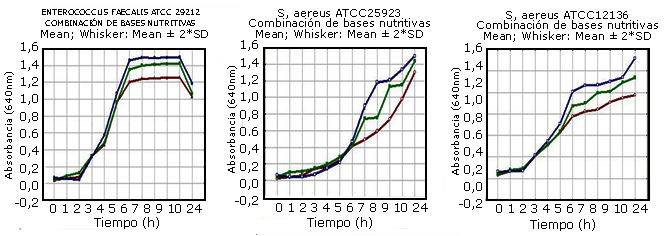
Fig. 1 Crecimiento expresado en densidad óptica (DO) de cepas de ATCC Enterococcus faecalis 29212, Staphylococcus aureus 25923 y Streptococcus agalactiae 12136 con diferentes combinaciones de peptona de sangre, peptona de soya, triptona, extracto de levadura y extracto de carne.
Con la original mezcla de sales y otras sustancias se obtuvieron composiciones para detectar fluorescencia y cromogénesis, como ejemplo las denominadas CCL y ADC, introducidas en la producción en BioCen y registradas en el Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED) (CromoCen CCL y Agar Dextrosa de Sabouraud de composición original).
De los sustratos ensayados se seleccionó 1 serie de composiciones diferentes, como ejemplo los derivados del MU para detectar actividades galactosidasa, glucuronidasa, decarboxilasa, la glucosidasa y fosfatasa, que incluyen a: 2-nitrofenil-p-D-galactopiranósido, 4-metilumbeliferil-p-D-glucurónido, 4-metilumbeliferil-fosfato, L-prolina-metilcumarina y 4-metilumbeliferil-13-D-glucósido, los cuales, combinados con las composiciones nutritivas, posibilitaron la detección e identificación por fluorescencia en menor tiempo para bacterias y hongos, todos con un máximo de detección de 6 h.
En el ejemplo de la composición CCL empleada para detectar, identificar y enumerar E. coli y coliformes en 97 muestras de agua potable se obtuvo, para el análisis cualitativo de coliformes totales, una exactitud relativa de 94,85 % ± 0,90 %, sensibilidad relativa de 94,74 % ± 0,90 %, especificidad relativa de 95,24 % ± 0,80 %, índice Kappa de 0,86. El análisis de equivalencia de los métodos cuantitativos mostró una diferencia relativa media de los recuentos de 9,29. El análisis de regresión reveló la linealidad de los recuentos transformados a Log, resultando la ecuación de regresión y = 0,04 x + 1,09 x. El análisis de varianza arrojó un valor de F de 2,99; menor del crítico (3,05). Para E. coli como método cualitativo la exactitud relativa resultó 96,00 % ± 0,94 %, la sensibilidad relativa 92,18 % ± 0,88 % y la especificidad relativa de 100,00 % a 1,00 %. Para el análisis como método cuantitativo la diferencia relativa media de los recuentos transformados a Log fue de 0,31; y una linealidad adecuada (ecuación de regresión y = 0,02 x + 0,99 x).
Se obtuvieron o caracterizaron nanopartículas de arcillas naturales o artificiales, zeolitas y cerámicas, seleccionando entre ellos la halosita, tierra de diatomea, bentonitas, hidroxiapatitas, la ZNPmed® y fosfatos de calcio. Las nanopartículas empleadas se obtuvieron por OSDG o a partir de OFN y procesándolas por métodos no químicos, entre ellos molienda en molinos de bolas, dispersión en fase líquida, centrifugación, procesamiento por spray-drying en la fase final a escala piloto y mezcla para conformar los nanocompuestos.
De la caracterización de los nanomateriales diseñados, se seleccionaron para los próximos ensayos la hidroxiapatita BCP (con 65 % de hidroxiapatita y 35 % de fosfato tricálcico masa/masa), la ZNPmed® y la bentonita nano (Sigma-Aldrich). Se demostró que las nanopartículas poseían tamaños desde 20 nm a 200 nm y más en algunos agregados diseñados combinándolas con otras sustancias, con superficies altamente rugosas, con diámetros y cavidades de un mínimo de holgura de 1 nm a 5 nm y hasta el rango milimétrico en las estructuras tridimensionales obtenidas a partir de agregados de los nanocompuestos (figura 2). La difracción de rayos X mostró los picos característicos de los materiales, en casos evidenciando la cristalinidad de las estructuras de la hidroxiapatita y de las nanopartículas de fosfatos tricálcicos sintéticos.
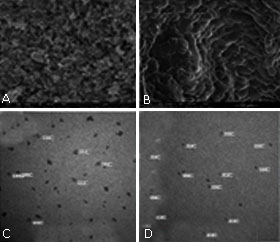
Fig. 2 Imágenes de Microscopía Electrónica de Barrido de diferentes nanocompuestos. A: superficie de nanocompuesto de hidroxiapatita Coralina® con mezcla nutritiva CCL, B: superficie de nanocompuesto de cerámica de fosfato de calcio bifásico sintético y mezcla nutritiva CCL, C: tamaño de partícula de nanocompuesto de ZNPmed® con mezcla nutritiva CNM, D: tamaño de partícula de nanocompuesto de bentonita nano con mezcla nutritiva CNM
El análisis termogravimétrico manifestó pérdidas de masa de 6 % a 12 % entre 25 °C y 750 °C y el análisis térmico diferencial no evidenció cambios energéticos con sólo una zona de transformación de 500 °C a 1250 °C, asociados a la pérdida de masa de componentes volátiles, demostrando su elevada estabilidad. Los materiales mostraron una muy baja pérdida por desecación (< 5 %) y adecuada capacidad de absorción de agua entre 20 % y 40 % de su masa. El potencial ζ resultó negativo con valores de -10 mV a -20 mV y el pH cercano al neutro (6,8-7,2).
Ninguno de los nanocompuestos de las variantes incluidas en la plataforma diagnóstica mostraron propiedades inhibitorias contra los principales patógenos, tales como E. coli, Pseudomonas aeruginosa, E. faecalis y S. aureus (figura 3).
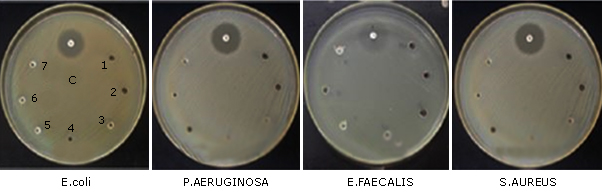
Fig. 3 Efecto antimicrobiano de las partículas de tamaño nanométrico (HAP-S) a diferentes concentraciones 0,05 (1); 0,5 (2); 1,0 (3); 5,0 (4); 10 (5); 15 (6); 20 (7) % m/v contra E. coli (ATCC 25922), P. aeruginosa (ATCC 27853), E. faecalis (ATCC 29212) y S. aureus (ATCC 25923) en Agar de Mueller-Hinton. Los pocillos centrales superiores (c) muestran los halos de inhibición contra gentamicina, amikacina, sulfametoxasol-trimetoprim y cloranfenicol respectivamente
Se estableció, por microscopías electrónica de barrido y de transmisión, que los nanocompuestos no dañan la pared celular y por el contrario se adhieren a ellas garantizando la degradación de los sustratos por las enzimas microbianas en el ejemplo de E. coli (figura 4).

Fig. 4 Imágenes de la microscopía de barrido y de transmisión que demuestran la integridad de las células de E. coli en contacto con nanocompuestos para detectar actividad glucuronidasa. A y B: microscopía electrónica de barrido de células completas de E. coli en contacto con estructuras tridimensionales del nanocompuesto de hidroxiapatita sintética y composición fluorogénica CCL. C, D y E: microscopia de transmisión de cortes longitudinales y transversales de células de E. coli en contacto con nanocompuesto de bentonita con la composición fluorogénica CNM
En modelos de detección de E. coli por método fluorescente, ensayando nanopartículas de hidroxiapatitas con un sustrato para la actividad glucuronidasa, se demostró la dependencia del tiempo mínimo de detección de la presencia de nanopartículas, la concentración de la bacteria en la muestra, el volumen de inóculo, el proceso de hidratación del nanocompuesto, logrando, en las primeras experiencias, reducir el tiempo de detección de 18 h a 24 h a 150 min y a 60 min con co-enzimas y co-factores. Similares resultados se obtuvieron para el modelo de un microorganismo Gram-positivo E. faecalis.
Posteriormente se logró detectar E. coli en muestras directas de orina en períodos de 10 min [sepsis urinaria de 107 unidades formadoras de colonias (UFC)/mL a 108 UFC/mL] a 60 min (infección urinaria aproximadamente de 104 UFC/mL a 106 UFC/mL) en comparación con el período de incubación al no emplear las nanoestructuras (de 3 h a 5 h). Otros microorganismos fueron detectados e identificados en diferentes muestras, incluyendo orina y aguas, entre ellos Enterococcus spp., P. aeruginosa, S. aureus, coliformes, Candida spp.
Desde el punto de vista tecnológico, se diseñó la plataforma para el diagnóstico a partir de las nanopartículas de manera muy flexible. Se ensayaron microorganismos aerobios y anaerobios con múltiples variantes de presentación: pequeñas esferas, combinadas con soportes para conformar membranas filtrantes, con otros soportes para obtener filtros multicapas, para muestras líquidas, sólidas y para detectar las señales en las muestras o en el líquido que las contiene (figura 5).

Fig. 5 Formas de presentación de los nanocompuestos que integran la plataforma tecnológica para el diagnóstico rápido de microorganismos. A: comprimidos para adicionar directamente a muestras líquidas; B: en polvo para adicionar a muestras líquidas para técnica de Número Más Probable o diagnóstico directo en tubos u otros contenedores; C: microdosis dispensadas o liofilizadas en placas o microplacas para detección visual o automatizada en lectores de fluorescencia, densidad óptica u otras señales; D: adicionados directamente a bulbos con fármacos o productos biológicos; E: en viales a los que se le adiciona la muestra para lectura visual; F: incorporados a membranas filtrantes para la técnica de filtración por membrana con posibilidad de identificación y recuento de micro colonias sobre la membrana o identificación alrededor de la membrana en medio líquido, sólido o semisólido.
Se logró detectar un mínimo de 1 UFC/mL hasta 109 UFC/mL de manera visual y automatizada empleando un equipo SUMA del Centro de Inmunoensayo.
Los resultados mostraron que las más apropiadas por la rapidez en la identificación y la factibilidad de su obtención fueron la hidroxiapatita Coralina®, la cerámica de hidroxiapatita sintética (Einco Biomaterials), bentonita nanométrica (Sigma-Aldrich) y la zeolita ZNPmed®.
DISCUSIÓN
Los hidrolizados y extractos desarrollados proporcionaron una duración de la fase lag mucho menor que otros hidrolizados 31 que requieren para ello 5 h debido a que los métodos propios de hidrólisis y purificación posibilitan que los microorganismos se adapten rápidamente al nuevo ambiente altamente rico en nutrientes, con presiones osmóticas y pH más adecuados.
El diseño de las mezclas originales de bases nutritivas está acorde a la tendencia de los últimos años para acelerar el inicio de la multiplicación celular y el aumento de la biomasa. 32,33
El empleo de mezclas de co-factores y co-enzimas para acelerar la síntesis de enzimas microbianas es una práctica actual, la inclusión de las sales minerales garantiza los elementos constitutivos de las enzimas; y las vitaminas actúan, entre otras funciones, como co-enzimas o sus precursores e intervienen en la síntesis del ADN. 13,34
Las composiciones para la detección fluorescencia y cromogénesis logradas, como en el caso más relevante de la denominada CCL, demostraron resultados comparables con otras formulaciones convencionales, pero acortando el tiempo de respuesta y posibilitando el registro sanitario en el CECMED. 17 Investigaciones anteriores ejecutadas en BioCen para el registro de medios de cultivo cromogénicos y fluorogénicos, así como de otros autores extranjeros demostraron la utilidad de los sustratos para la detección, identificación y enumeración de bacterias y levaduras. 17,18,19,35 Sin embrago, no existían referencias previas, ni en BioCen, ni a escala mundial, de su combinación con arcillas, cerámicas y zeolitas para detectar la actividad enzimática de bacterias y hongos, las cuales brindaron los resultados de detección e identificación por fluorescencia en menor tiempo, todos con un máximo de detección de 6 h. 24,25,26,36
Durante la validación de los métodos alternativos en muestras de agua con las nuevas composiciones (bases nutritivas, promotores de crecimiento y sustratos fluorogénicos y cromogénicos), aún sin su combinación con las nanopartículas, se evidenció que los parámetros de desempeño cualitativos y cuantitativos mostraron valores superiores o equivalentes a los métodos convencionales, con la ventaja de una reducción en 3 veces de la respuesta. 37,38) Los parámetros de diagnóstico relativos resultaron siempre superiores al 94 % y se logró la equivalencia de los recuentos y linealidad de la regresión de los recuentos, todos en correspondencia a los requisitos internacionales. 28,29,30
Los novedosos métodos desarrollados de obtención de las nanopartículas y de los nanocompuestos difieren significativamente de los comúnmente empleados a escala mundial para transformar las arcillas, cerámicas y zeolitas, que incluyen la modificación química, el empleo de surfactantes, ultrasonido e intercambio iónico, entre otros. 39,40,41
En la presente investigación, se emplearon operaciones más sencillas, de menor costo y que pueden ser ejecutadas en las instalaciones industriales de BioCen, entre ellas, el molinado con bolas, sedimentación, centrifugación y el procesamiento por spray-drying que ofrece ventajas muy significativas. Esta última operación posibilitó obtener nanopartículas y nanocompuestos con elevada relación superficie/volumen, porosidad y rugosidad de la superficie, que garantiza absorber mayor volumen de las mezclas nutritivas y sustratos y disponibilizarlos para su posterior contacto con los microorganismos en las muestras, además de garantizar una amplia superficie de contacto para la ocurrencia anticipada de las reacciones enzimáticas de degradación de los sustratos. 16
Las nanopartículas mantuvieron las características propias de los nanomateriales de origen natural o sintéticos, reportados por otros autores, entre ellas, composición elemental, tamaño de partículas y potencial ζ. 42,43
Relevante y novedosa, a escala mundial, resultó la total inhibición del efecto tóxico de los nanomateriales de arcillas sobre los microorganismos reportado anteriormente, 44,45,46) gracias a la adición de las composiciones nutritivas en lugar de la modificación o sustitución química de grupos tóxicos en la estructura de las nanopartículas.
Los nanocompuestos se integran a la membrana externa de las bacterias posibilitando el intercambio de las composiciones y por tanto la ocurrencia de las reacciones enzimáticas y su alta porosidad y rugosidad de la superficie no resultan dañinas para la integridad de las células. 25,27
La novedosa plataforma tecnológica posibilitó dar respuesta al hito diagnóstico de reducir el período de incubación para la detección e identificación de bacterias en diferentes muestras a un mínimo de 10 min a 60 min en el ejemplo del diagnóstico de E. coli en muestras directas de orina, lo que posibilita la aplicación de una terapia oportuna para el tratamiento de infecciones y al aplicar los nanocompuestos al análisis de productos alimenticios y farmacéuticos liberarlos en menor tiempo y satisfacer más eficientemente las necesidades de la industria.
La original plataforma tecnológica desarrollada posibilita flexibilidad no sólo con respecto a los formatos de presentación anteriores, 47 aplicación a diferentes técnicas de diagnóstico, sino que posibilita, como ninguna otra solución técnica anterior, 48,49 detectar, identificar o diferenciar, aislar y enumerar diferentes especies y géneros de bacterias y hongos en un rango tan amplio de concentración en las muestras de 1 a 109 UFC/unidad de manera visual o con el novedoso empleo del lector de fluorescencia del SUMA.
Se logra, además, una reducción del consumo de reactivo, de sus costos, del gasto de energía (el tiempo de incubación se reduce de 24 h -48 h -72 h a 10 min -60 min).
Se puede concluir que se seleccionaron hidrolizados y extractos de proteínas y se diseñaron originales combinaciones entre ellas y con co-factores y co-enzimas que posibilitaron reducir la fase lag de crecimiento microbiano y acelerar el inicio de la fase de crecimiento exponencial a 2 h de cultivo. Fueron obtenidas nuevas composiciones nutritivas con sustratos fluorogénicos y cromogénicos con elevada exactitud diagnóstica relativa superior al 94 % para el diagnóstico de E. coli, coliformes y otros géneros y especies de microorganismos.
Por otro lado, se lograron seleccionar arcillas, cerámicas y zeolita modificadas para obtener nanopartículas de 20 nm a 200 nm y sus estructuras tridimensionales con elevadas relación superficie/volumen, porosidad y rugosidad de la superficie, entre ellas la hidroxiapatita sintética, la bentonita-nano y la zeolita natural purificada ZNPmed® que resultaron ser termoestables, con adecuada capacidad de absorción, lo que posibilitó por primera vez a escala mundial, desarrollar y patentar en Cuba y en el extranjero una novedosa y flexible plataforma tecnológica para obtener nanocompuestos empleando la tecnología de spray-drying, combinando los nanomateriales con las composiciones nutritivas que, sobre la base de la detección de reacciones enzimáticas, posibilitó la detección, identificación y enumeración simultánea de microorganismos en períodos reducidos de tiempo, llegando hasta un mínimo de 10 min a 60 min que posibilita el desarrollo ulterior de nuevos diagnosticadores específicos.
Los nanocompuestos obtenidos no dañan las células por lo que a partir de ellos se pueden aislar y estudiar los microorganismos detectados, posibilitan el diagnóstico rápido de diferentes géneros, especies y cepas de bacterias y hongos en diversos tipos de muestras con disímiles formatos de los dispositivos y por distintos métodos diagnóstico tales como filtración por membrana, en caldo líquido, en placas, en alícuotas o en soportes sólidos.
Por otra parte, se han escalado, hasta el nivel industrial, y comercializado hidrolizados proteicos, extractos, sus mezclas, las composiciones nutritivas; las nanopartículas, nanoagregados y nanocompuestos se han escalado hasta nivel piloto y existen todas las condiciones para su escalado a nivel industrial si fuese necesaria una demanda mayor.














