INTRODUCCIÓN
El CIGB-247 es una vacuna para la terapia del cáncer, que emplea como antígeno una molécula recombinante y representativa de la isoforma 121 del factor de crecimiento del endotelio vascular (VEGF) humano. 1 El antígeno se combina con el adyuvante VSSP, de origen bacteriano 2 al cual se le incorpora el gangliósido de fuente natural N acetil GM3. La vacunación con el CIGB-247 en modelos experimentales animales es segura 3 y tiene efectos antitumorales y antimetastásicos. 1,4
La primera exposición de humanos a la vacuna CIGB-247 se evaluó en el marco del estudio clínico CENTAURO, en pacientes con tumores sólidos avanzados. El grupo inmunizado con la mayor dosis de antígeno mostró los resultados más favorables en la inducción de anticuerpos de clase IgG específicos al VEGF, en la capacidad de bloquear la interacción de la molécula con el VEGFR2, en la reducción significativa del VEGF plaquetario y en la generación de clones de linfocitos T específicos y secretores de IFN-γ. 5 Aunque este grupo resultó el de mayores ventajas desde el punto de vista inmunológico, también indicó la necesidad de incrementar dosis de antígeno y adyuvante o el uso de adyuvantes alternativos con el objetivo de mejorar la inmunogenicidad. Como consecuencia, se inició el estudio CENTAURO-2. 6
Paralelamente, la continuidad de la inmunización fuera del marco del estudio clínico CENTAURO, permitió documentar indicios de beneficios clínicos objetivos en un grupo de pacientes. 7 Estos resultados sentaron las bases para la propuesta del uso del CIGB-247 en un programa de uso compasional (PUC) en pacientes que carecían de otras alternativas terapéuticas o para aquellos que no cumplían con los criterios de inclusión de los estudios clínicos de la vacuna. 8
Estos 3 estudios en pacientes permitieron conocer en detalle a los efectores inmunológicos que podrían estar participando en el mecanismo de acción de la vacuna y los causantes potenciales de producir efectos antiangiogénicos y antitumorales. Por ejemplo, se desconocía si, además de la IgG, la respuesta de anticuerpos generaba otras clases como la IgM e IgA. Conocer este elemento es importante porque la participación de otras clases de inmunoglobulinas puede contribuir a la inhibición del ligando y a involucrar otros efectos biológicos mediados por sus regiones constantes Fc.
Hasta ahora no se había podido precisar si la respuesta de anticuerpos era capaz de bloquear la interacción del VEGF con el otro receptor, el VEGFR1, incluso si tenía la propiedad de bloqueo dual, es decir, inhibir de forma simultánea las interacciones VEGF/VEGFR2 y VEGF/VEGFR1. Esto tiene relevancia si se tiene en cuenta que ambas interacciones median procesos como la angiogénesis tumoral y la inmunosupresión inducida por tumor, 9,10 mecanismos que emplean los tumores para su desarrollo y diseminación. En este sentido, tampoco se había podido evaluar si los anticuerpos policlonales impedían la unión del VEGF al anticuerpo monoclonal bevacizumab. Este anticuerpo posee especificidad por un epítope relevante para la actividad proangiogénica del VEGF y se encuentra aprobado por la FDA para el tratamiento de diferentes tipos de tumor. 11,16
El anticuerpo monoclonal bevacizumab, es un antiangiogénico, al cual se le asocian efectos adversos relacionados con las altas dosis que se administran y por el efecto abrupto en la reducción del VEGF. 17 Aunque la inmunoterapia activa con el CIGB-247 induce una reducción significativa en los niveles de VEGF plaquetario, 5 no se sabe si estos niveles disminuyen por debajo de los valores fisiológicos. Por tal motivo se hizo necesario investigar los niveles de VEGF plaquetario en individuos sanos y compararlos con los niveles detectados en los pacientes vacunados.
Existen relativamente pocos estudios de vacunas para cáncer que incluyan largos períodos de inmunización, y por tanto es escasa la información en relación a los cambios que se producen en la respuesta inmunológica generada en este tipo de pacientes. Al incrementarse el número de pacientes vacunados con el CIGB-247, se incrementó el número de individuos que acumulan sobrevidas superiores al año e incluso superior a los 3 años. 6,8 Esta oportunidad permitió estudiar la presencia y las características de los efectores inmunológicos, no descritos hasta el momento, que incluyó las subclases de IgG y los linfocitos T CD8 citotóxicos.
La presente investigación tiene como objetivo estudiar a los efectores inmunológicos que se inducen en los pacientes inmunizados con el CIGB-247, que incluyen elementos humorales y celulares. Este estudio pretende detectar a las diferentes clases y subclases de inmunoglobulinas, evaluar su especificidad por epítopes relevantes en el VEGF y demostrar la presencia de linfocitos T CD8 citotóxicos específicos. También, este trabajo se propone presentar las primeras evidencias preliminares de la posibilidad de combinar el CIGB-247 con otros regímenes oncoterapéuticos.
MÉTODOS
Antígeno vacunal y adyuvantes
El antígeno y el adyuvante fosfato de aluminio se produjeron en la unidad de desarrollo del CIGB bajo condiciones de buenas prácticas de producción. El adyuvante VSSP se produjo en el Centro de Inmunología Molecular. El antígeno se diluyó en agua y se mezcló con el adyuvante. El volumen del inmunógeno nunca excedió el valor de 1mL y se administró por vía subcutánea.
Selección de los pacientes
Los pacientes del estudio clínico CENTAURO continuaron las re-inmunizaciones mensuales con la dosis de 400 µg del antígeno y 200 µg del adyuvante VSSP. El estudio clínico CENTAURO-2 fue un ensayo clínico de fase Ib, en pacientes con tumores sólidos avanzados de distintos tipos. 6 El PUC incluyó pacientes oncológicos con tumores sólidos o hematológicos. 8 Todos los estudios se llevaron a cabo bajo el estricto cumplimiento de los requisitos éticos establecidos por la declaración de Helsinki.
El estudio clínico CENTAURO-2 reclutó a un total de 50 pacientes, distribuidos de manera aleatoria en 5 grupos de 10 individuos cada uno. Los grupos experimentales fueron: 400 µg de antígeno más 200 µg de VSSP; 400 µg de antígeno más 400 µg de VSSP; 800 µg de antígeno más 200 µg de VSSP; 200 µg de antígeno más 0,7 mg Al3+; 400 µg de antígeno más 0,7 mg Al3+. El PUC incluyó a un total de 153 pacientes, los cuales se inmunizaron con 400 µg de antígeno más 200 µg de VSSP. Las combinaciones de antígeno con el adyuvante VSSP o con el fosfato de aluminio se administraron según se describe previamente. 6
Selección de individuos aparentemente sanos
Un total de 93 individuos aparentemente sanos dieron su consentimiento para la extracción de sangre siguiendo la práctica de la institución (CIGB). No se incluyeron sujetos con historial previo de cáncer, enfermedades inflamatorias, diabetes, sicklemia, uso de drogas anti-inflamatorias, o mujeres en período menstrual.
Obtención de las células mononucleares de sangre periférica
Las células mononucleares de sangre periférica (CMSP) se aislaron a partir de la sangre colectada en tubos que contenían el anticoagulante EDTA y mediante un gradiente de Ficoll (GE Healthcare, 17-1440-03). Se extrajo la capa o anillo de CMSP y se congeló en suero fetal bovino suplementado con DMSO al 10 % en viales criogénicos que se conservaron en nitrógeno líquido.
Conjugación del anticuerpo bevacizumab a biotina
El anticuerpo bevacizumab se conjugó covalentemente a la molécula de biotina según procedimiento descrito anteriormente 8 y empleando la relación de 0,1 mg de biotina por mg de anticuerpo.
Purificación de la fracción de IgG de los sueros de pacientes vacunados
Los sueros obtenidos posterior a la vacunación inicial, clasificados como positivos a anticuerpos IgG anti-VEGF y procedentes de diferentes pacientes incluidos en el PUC se mezclaron y la fracción de IgG del suero se purificó por cromatografía de afinidad, según instrucciones del fabricante, con una matriz de proteína A (GE Healthcare, 17-1279-02).
ELISA indirecto para la detección de anticuerpos de clase IgG, IgM e IgA con especificidad por el VEGF humano
Para la detección de las diferentes clases de anticuerpos se procedió como se describe anteriormente. (6, 18) Brevemente, el ELISA se basó en inmovilizar el VEGF humano en una placa de ELISA de alta unión. Posteriormente se adicionaron los sueros humanos y cada una de las clases de anticuerpos se detectó con un anticuerpo conjugado y específico a cada una de ellas. La reacción de revelado empleó como cromógenos OPD o TMB y como sustrato de la enzima el H2O2. Los valores de absorbancia son directamente proporcionales a la cantidad de anticuerpos contenidos en el suero.
ELISA de competencia para evaluar la capacidad de los sueros humanos de bloquear las interacciones VEGF/VEGFR2, VEGF/VEGFR1 o VEGF/bevacizumab
El ensayo ELISA se realizó según se describe anteriormente. 6,8,18 Para evaluar la capacidad bloqueadora de los sueros sobre cada una de estas interacciones se inmovilizó el VEGF humano en una placa de ELISA de alta unión. Posteriormente se adicionaron los sueros que se incubaron simultáneamente con el VEGFR2, el VEGFR1 o el bevacizumab biotinilado. La cantidad de receptor unido al VEGF se detectó con un anticuerpo conjugado y específico a cada uno de ellos. En caso del bevacizumab biotinilado se empleó el conjugado de estreptavidina peroxidasa. Los valores de absorbancia son inversamente proporcionales a la actividad bloqueadora contenida en el suero.
ELISA indirectos para la detección de subclases de IgG específicos al VEGF humano
Una placa de ELISA de alta unión se recubrió con VEGF humano a una concentración de 2,5 µg/mL. Luego del bloqueo, se aplicaron los sueros humanos. La presencia en el suero de cada una de las subclases de IgG específicas se detectó con los anticuerpos biotinilados anti-subclase (anti-IgG1, anti-IgG2, anti-IgG3 o anti-IgG4). 6
Cuantificación de VEGF
Para la cuantificación de los niveles de VEGF se empleó un ELISA comercial ofertado por RγD Systems (SVE00). El ensayo se realizó según instrucciones del fabricante. El VEGF plaquetario se expresó en pg de VEGF/106 plaquetas. 19
ELISPOT para la detección de linfocitos periféricos CD8+ específicos al VEGF y secretores de IFN-γ
El ensayo se realizó según se describe anteriormente en las células mononucleares de sangre periférica. 5,7 Brevemente, se contó por citometría de flujo el número células CD3 positivas, vivas y no apoptóticas. Entre 100 000 y 150 000 células se sembraron en placa con fondo en U, las cuales se sometieron por 8 días a los estímulos con VEGF, un anticuerpo monoclonal anti-CD28 e IL-2. Las células CD8+ se seleccionaron mediante la siembra de las células re-estimuladas en una placa de ELISPOT (R and D Systems, EL3094). El procedimiento se realizó según instrucciones del fabricante. La secreción de IFN-γ se detectó con un anticuerpo específico a la citocina. El conteo del número de clones secretores de IFN-γ se realizó con un lector de placas de ELISPOT (AELVIS, Alemania) y el programa ELI Analyse.
RESULTADOS Y DISCUSIÓN
La inmunización con el CIGB-247 induce además de la IgG, anticuerpos IgM e IgA específicos al VEGF
La figura 1 muestra el valor inverso de los títulos de anticuerpos específicos al VEGF, para las clases de inmunoglobulinas IgG, IgM e IgA. En el ensayo clínico CENTAURO-2, de los 39 individuos disponibles, 26 pacientes fueron positivos para anticuerpos IgG, 11 para IgA y 7 para IgM. El grupo de pacientes vacunados con la máxima dosis de antígeno (2Ag+V), mostró el mayor número de pacientes positivos para anticuerpos específicos de clase IgG, IgM o IgA (figuras 1 A-C). En relación a los títulos de anticuerpos, los valores indicaron la siguiente tendencia: IgG > IgM > IgA (figuras 1 A- C).
La figura 1 D muestra un análisis similar para los pacientes que se incluyeron en el PUC. Este estudio confirmó los resultados obtenidos en el ensayo clínico CENTAURO-2, indicando a la IgG como inmunoglobulina predominante, acompañada también por la IgM e IgA.
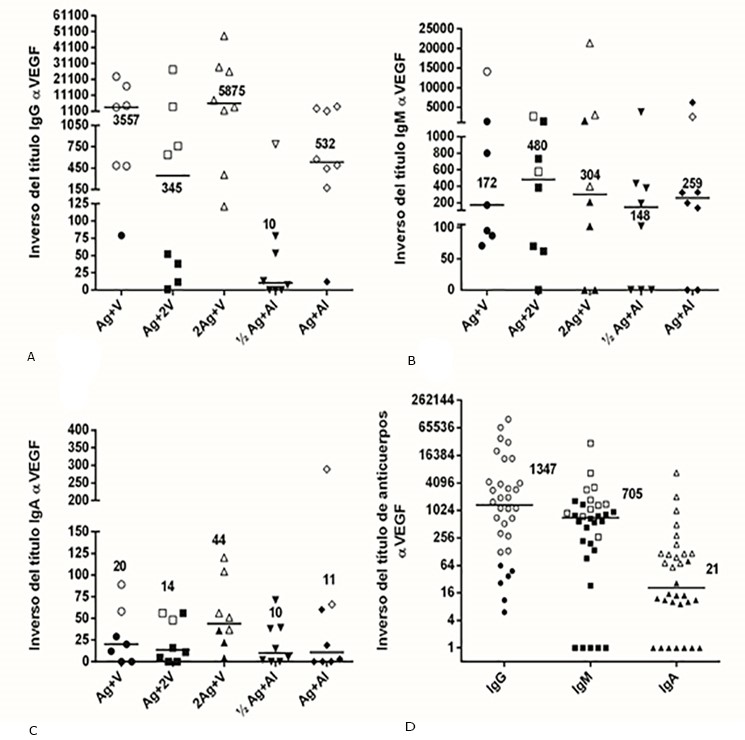
Fig. 1 Títulos de anticuerpos específicos para el VEGF humano detectados durante la fase de inducción para los pacientes del estudio clínico CENTAURO-2 y del PUC.
Título de anticuerpo específico para la clase de anticuerpo IgG (A), IgM (B) e IgA (C) en los pacientes del ensayo CENTAURO-2. Estudio de clases de anticuerpos en los pacientes del PUC (D). El valor inverso del título de anticuerpo correspondiente al valor pre-vacunación se sustrajo del valor hallado post-vacunación y es el resultado que se muestra en el eje “y”. Las barras horizontales representan la mediana de los títulos, cuyos valores se muestran para cada uno de los grupos de tratamiento o para cada una de las clases de anticuerpos. Los símbolos en blanco o negro representan a pacientes con muestras de suero positivo o negativo para anticuerpos respectivamente. Leyenda: 400 µg de antígeno + 200 µg de VSSP, Ag+V; 400 µg de antígeno + 400 µg de VSSP, Ag+2V; 800 µg de antígeno + 200 µg de VSSP, 2Ag+V; 200 µg de antígeno + 0,7 mg de Al3+, ½Ag+Al; 400 µg de antígeno + 0,7 mg de Al3+, Ag+Al. Resultados que se publicaron en la revista BMC Immunology. 6,8
Por primera vez se demuestra que la inmunización induce anticuerpos de clase IgM e IgA específicos al VEGF, 6,8 inmunoglobulinas que pudieran contribuir, junto a la IgG, al bloqueo del ligando y a la participación de otros procesos biológicos mediados por la región Fc.
El VEGF es un factor soluble donde la depleción del ligando es el mecanismo efector más importante. Por tanto, la IgM y la IgA pueden bloquear la interacción entre el VEGF y los receptores. Además de la depleción del ligando, la potenciación de la presentación antigénica mediada por FcγR es otro de los mecanismos que contribuyen a la inmunidad contra los tumores. 20 Se conoce que los inmunocomplejos formados por los anticuerpos IgG y el antígeno, pueden incrementar la captura del antígeno por parte de las células dendríticas, y con ello potenciar la presentación cruzada del mismo. 21,22 Un mecanismo similar se describe para anticuerpos del tipo IgM e IgA a través del Fcα/μR o el FcαRI. 23,24 Este tipo de mecanismo pudiera estar presente e involucrar a los anticuerpos de tipo IgM e IgA específicos que se inducen con el CIGB-247.
Con la cronicidad de la vacunación se induce un cambio de subclase desde IgG1 hacia la subclase IgG4 de mayor afinidad
En el estudio clínico CENTAURO-2, la subclase predominante en todos los períodos fue la IgG1 (figura 2 A). La subclase IgG4 incrementó con el tiempo su presencia como inmunoglobulina predominante desde un 0 % entre las semanas 5 y 16 hasta un 30,8 % de los pacientes entre las semanas 46 y 56. De ahí que constituyó la segunda subclase de relevancia al año de re-inmunizaciones. 6)
Un análisis similar se realizó en las muestras de los pacientes incluidos en el PUC (figura 2 B). En este caso, el estudio abarcó hasta los 3 años de vacunación crónica. La IgG1 fue la subclase predominante durante la fase de inducción y durante las semanas 49 y 96. En dicho período, la subclase IgG4 ocupó el segundo lugar en relevancia. Entre los 2 y los 3 años de inmunizaciones repetidas, la subclase IgG4 fue la inmunoglobulina mayoritaria debido a que se detectó como predominante en el 43 % de las muestras de suero disponibles (figura 2 B).
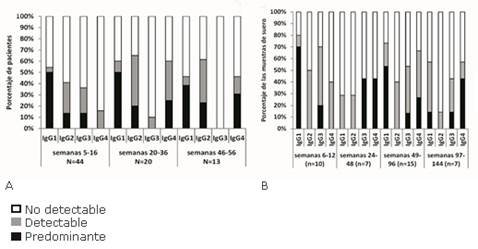
Fig. 2 Subclases de IgG específicas al VEGF que se generaron con la inmunización durante las fases de inducción y de mantenimiento. (A) Estudio en los pacientes del ensayo clínico CENTAURO-2. (B) Estudio en los pacientes del PUC. (N): representa el número de pacientes evaluados. (n): representa el número de muestras de suero evaluadas. Resultados que se publicaron en la revista BMC Immunology. 6,8
Se evidenció que en los pacientes de larga supervivencia, se puede inducir el cambio desde IgG1 hacia la subclase IgG4 de mayor afinidad. 6,8 Este resultado también se obtuvo en los pacientes del estudio clínico CENTAURO que mostraron más de 3 años de sobrevida. 7 Por tanto, con la cronicidad de la vacunación, no se detecta la ocurrencia de tolerancia inmunológica, sino más bien se produce una maduración de la respuesta inmunitaria humoral. Se reporta por primera vez la generación de anticuerpos de mayor afinidad en el contexto de la vacunación con el CIGB-247. Esta característica es relevante para el bloqueo del VEGF como factor soluble. La inducción de una especificidad por el VEGF procedente de distintas clases de inmunoglobulinas y diferentes subclases de IgG, son sin duda alguna, elementos favorables para la obtención de una respuesta efectiva neutralizante contra este factor de crecimiento. Si a esto le agregamos la policlonalidad para cada tipo de anticuerpo, entonces la capacidad de esta respuesta de inhibir el VEGF o de bloquear su interacción con los receptores naturales se hace mucho más efectiva.
La inmunización con el CIGB-247 induce anticuerpos con la capacidad de bloquear las interacciones VEGF/VEGFR2, VEGF/VEGFR1, VEGF/bevacizumab
El estudio clínico CENTAURO-2 confirmó los resultados de que se induce una respuesta de anticuerpos que bloquean la interacción del VEGF con el VEGFR2 (figura 3A). 6 Sin embargo, por primera vez, tanto en el estudio CENTAURO-2 como en el PUC se demuestra la existencia de otras cualidades de la respuesta inmunitaria humoral como su capacidad dual de bloquear de manera simultánea la unión del VEGF al VEGFR2 y al VEGFR1 (figuras 3B y 3C). La detección de una actividad de bloqueo dual indica que el CIGB-247 constituye una estrategia válida para bloquear el eje VEGF/VEGFRs, el cual participa activamente en la estimulación de procesos como la angiogénesis tumoral y la inmunosupresión inducida por tumores. 9,10 Ambos procesos son de gran relevancia para el desarrollo de los tumores y sus metástasis.
La fracción de IgG purificada a partir del suero de pacientes vacunados (IgG comp) indicó la presencia de anticuerpos que bloquean el epítope en el VEGF que une al anticuerpo monoclonal bevacizumab (figura 3D). Este resultado indicó que se encuentra comprometido un epítope en el VEGF relevante para su actividad pro-angiogénica. Este aspecto es de gran interés considerando que este anticuerpo está aprobado por la FDA en el tratamiento de varios tipos de tumor. 11,13,16,25

Fig. 3 Actividad de bloqueo durante la fase de inducción que se genera contra las interacciones VEGF/VEGFR2, VEGF/VEGFR1 y VEGF/bevacizumab. Actividad bloqueadora sobre las interacciones VEGF/VEGFR2 (A) y VEGF/VEGFR1 (B) en los pacientes del estudio clínico CENTAURO-2. (C): Actividad bloqueadora sobre las interacciones VEGF/VEGFR2 y VEGF/VEGFR1 generada durante la fase de inducción en los pacientes incluidos en el PUC. (D): Inhibición de la interacción VEGF/bevacizumab. Las líneas discontinuas representan los valores de corte que define la positividad para la prueba.
El bevacizumab se usó como control positivo de inhibición. IgG comp e IgG neg se evaluaron a la misma concentración total de IgG. Los valores de p se calcularon según la prueba t de student no pareada. Se consideró significación estadística cuando se obtuvo una p < 0,05. Leyenda: 400 µg de antígeno + 200 µg de VSSP, Ag+V; 400 µg de antígeno + 400 µg de VSSP, Ag+2V; 800 µg de antígeno + 200 µg de VSSP, 2Ag+V; 200 µg de antígeno + 0,7 mg de Al3+, ½Ag+Al; 400 µg de antígeno + 0,7 mg de Al3+, Ag+Al. Resultados que se publicaron en la revista BMC Immunology. 6,8
La inmunización con el CIGB-247 no induce reducción completa del VEGF plaquetario sino que contribuye a normalizarlos
Antes de vacunarse (semana 0), las plaquetas de los pacientes con cáncer cargan más VEGF que las plaquetas de individuos sanos (figura 4A). Después de la vacunación (semana 13), no existen diferencias significativas en los niveles de VEGF plaquetario entre los individuos sanos y los pacientes con cáncer (figura 4B). Después de la vacunación, los niveles de VEGF plaquetario en los pacientes con cáncer se encuentran dentro del rango fisiológico establecido a partir de la medición efectuada en 93 individuos supuestamente sanos. Estos resultados indican que la vacunación con el CIGB-247 contribuye a normalizar estos niveles. 26
Esta nueva característica del CIGB-247 de normalizar los niveles de VEGF plaquetario en presencia de los mayores niveles de anticuerpos que se inducen (semana 13), es un elemento distintivo que difiere en relación al anticuerpo bevacizumab. Por ejemplo, Karp et al. demostraron que 2 h después de la administración endovenosa de bevacizumab, los pacientes pueden experimentar una reducción completa en la biodisponibilidad del VEGF. 27 De ahí que esta reducción brusca del VEGF biodisponible causada por el bevacizumab, es un escenario totalmente diferente al causado por el CIGB-247. Por tanto, después de la vacunación, permanecen dentro de las plaquetas, determinados niveles de VEGF activo, probablemente suficientes para sostener la vasculatura y mantener otros procesos fisiológicos normales dependientes del factor. Esto a su vez, ayudaría a explicar el por qué las toxicidades típicas que se reportan para los anti-angiogénicos como el bevacizumab, 17 no se encontraron en el curso de los estudios clínicos CENTAURO y CENTAURO-2, así como en el PUC. 5,6,8
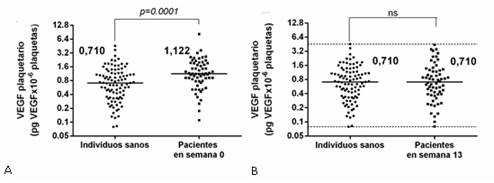
Fig. 4 Niveles de VEGF plaquetario en individuos sanos y en pacientes con cáncer. Ambos grupos de sujetos incluyeron hombres y mujeres. Los pacientes con cáncer fueron 24 individuos del estudio CENTAURO y 38 individuos del estudio CENTAURO-2, para un total de 62. (A): Niveles de VEGF plaquetario en individuos sanos y en pacientes con cáncer antes de recibir la primera inmunización (semana 0). (B): Niveles de VEGF plaquetario en individuos sanos y en pacientes con cáncer después de culminar la fase de inducción (semana 13). Cada punto representa un paciente y las barras horizontales indican la mediana del VEGF plaquetario para lo cual se indican sus valores respectivos. Las líneas discontinuas representan el rango (máximo y mínimo) de los niveles de VEGF plaquetario obtenido a partir de los 93 individuos sanos. Los valores de p se calcularon según la prueba de Mann-Whitney. Se consideró significación estadística cuando se obtuvo una p<0,05. (ns): no significativo. Resultados que se publicaron en la revista BMC Immunology. 26
La inmunización con el CIGB-247 genera linfocitos T CD8 citotóxicos específicos al VEGF
La tabla 1 muestra los resultados de la prueba de ELISPOT CD8+/IFN-γ en los pacientes del estudio clínico CENTAURO que mostraron una sobrevida entre los 2 años y los 3 años. En la semana 49, los 8 pacientes eran positivos para la prueba de ELISPOT de IFN-γ, de los cuales 4 (CH07, CH15, CH19 y CH28) mostraron actividad secretora de IFN-γ asociada a los linfocitos CD8+. En 2 pacientes (CH11 y CH25) no se detectó secreción de la citocina relacionada a esta subpoblación de linfocitos T. Entre las semanas 129 y 145; 4 pacientes (CH07, CH11, CH19 y CH28) mostraron actividad secretora de IFN-γ asociada a los linfocitos CD8+, mientras que en 1 paciente (CH15), no se detectó secreción de la citocina relacionada a esta subpoblación de linfocitos T. El paciente CH18 se clasificó como negativo en la prueba de ELISPOT de IFN-γ, sin embargo, mostró positividad para el ELISPOT de secreción de la citocina asociada a los linfocitos CD8+.
Por primera vez se demuestra que la vacunación con el CIGB-247 logra mantener una respuesta inmunitaria celular mediada por linfocitos T específicos al VEGF humano, potencialmente representada por los linfocitos CD8+ con actividad citotóxica. Hasta nuestros conocimientos no existe una vacuna basada en el VEGF que en humanos genere este tipo de linfocitos. Estos elementos celulares de la respuesta inmunitaria poseen relevancia en la actividad contra los tumores, debido a su capacidad de eliminar directamente a las células malignas. La presencia de una respuesta inmunitaria mediada por linfocitos T CD8, durante las diferentes etapas del proceso de vacunación con el CIGB-247, puede explicar en cierta medida, los beneficios clínicos observados en un número de pacientes con sobrevida superior a los 2 años. 7
Tabla 1 Resultados del ELISPOT CD8α positivo/IFN-γ en los pacientes del estudio clínico CENTAURO sometidos a la vacunación sostenida con CIGB-247 por más de 2 años
| Paciente | Semana 49 | Semanas 129-145* | |||
|---|---|---|---|---|---|
| IFN-γ | CD8+IFN-γ | IFN-γ | CD8+IFN-γ | ||
| CH07 | + | + | + | + | |
| CH11 | + | - | + | + | |
| CH15 | + | + | + | - | |
| CQ17 | + | NR | - | NR | |
| CH18 | + | NR | - | + | |
| CH19 | + | + | + | + | |
| CH25 | + | - | - | - | |
| CH28 | + | + | + | + | |
Leyenda: (+): representa a una muestra de células clasificada como positiva para la prueba de ELISPOT. (-): representa a una muestra de células clasificada como negativa para la prueba de ELISPOT; (IFN-γ): medición de interferón gamma que se mide en las CMSP totales; CD8+IFN-γ: medición de IFN-γ en la población de linfocitos CD8+ que se selecciona a partir de las CMSP totales; (NR): no realizado por disponibilidad de muestra. (*) semanas expresadas en forma de rango debido a que no todas las muestras de CMSP se tomaron en la misma semana para diferentes pacientes. Resultados que se publicaron en la revista Vaccine. 7
La inmunización con el CIGB-247 puede combinarse con otras terapias oncológicas
El PUC hizo posible la administración de la vacuna a pacientes con cáncer con características diferentes y bajo distintos tratamientos a los que se incluyeron en los estudios clínicos CENTAURO y CENTAURO-2. 8 Este nuevo contexto permitió evaluar la seguridad e inmunogenicidad del CIGB-247 en pacientes oncológicos con características más cercanas a la práctica médica en Cuba. Por ejemplo, pacientes vacunados con CIGB-247 y tratados de manera concomitante con radioterapia, quimioterapia, terapias biológicas o con drogas inmunosupresoras, no cumplían con los criterios de inclusión. En este nuevo escenario, el CIGB-247 fue capaz de inducir una respuesta detectable de anticuerpos específicos al VEGF. También se obtuvieron evidencias de la potencialidad de combinar la vacuna del CIGB-247 con la quimioterapia sin afectar la respuesta anti-VEGF. 8 Estos resultados sentaron las bases para el diseño de un estudio clínico fase II de eficacia que está en curso que incluye la combinación del CIGB-247 con la quimioterapia y la cirugía (RPCEC00000246).
Relevancia de los efectores inmunológicos y propuesta de mecanismo de acción
El CIGB-247 es la primera vacuna dirigida al VEGF que se administró en humanos y sus resultados se apoyan en 2 estudios clínicos de fase I, denominados CENTAURO y CENTAURO-2, y en un PUC. Estos estudios demostraron la inmunogenicidad del CIGB-247 en pacientes con cáncer.
La presencia de diferentes clases de inmunoglobulinas como la IgM y la IgA, así como la subclase IgG4, dentro de la respuesta inmunitaria, así como la detección de linfocitos T CD8 específicos, convierten al CIGB-247, en la única inmunoterapia activa basada en el VEGF humano, con evidencias de activar la rama humoral y celular del sistema inmunológico.
Además del CIGB-247, existe sólo un candidato vacunal, denominado VEGF 26-104/RFASE, que fue desarrollado por Wentink y colaboradores, 28 y que se ha evaluado en el marco de un estudio clínico fase I en pacientes con tumores sólidos avanzados. En ninguno de los 18 pacientes inmunizados se detectó una respuesta de anticuerpos específica al VEGF humano autólogo. 29
El análisis de todos los resultados obtenidos para el CIGB-247, permitió establecer un posible mecanismo de acción de la vacuna, el cual se basa en la generación de una respuesta de anticuerpo policlonal caracterizada por la presencia de inmunoglobulinas de distintas clases y subclases que muestran diferente avidez y afinidad por el VEGF, permitiendo un bloqueo más efectivo de su actividad pro-angiogénica. Al disminuir la actividad pro-angiogénica, se incide negativamente sobre la angiogénesis tumoral. También se activa la respuesta inmunitaria mediada por células, con la inducción de linfocitos T CD8 citotóxicos que son capaces de producir la muerte por apoptosis de las células tumorales. Los efectos provocados por las ramas humoral y celular de la respuesta inmunitaria tienen actividad anti-tumoral.















