INTRODUCCIÓN
Las actinoporinas (AP) son proteínas formadoras de poro (PFP) producidas por las anémonas marinas que experimentan cambios conformacionales resultantes en la formación de poros en la membrana celular. 1,2 Este mecanismo transcurre a través de la unión a la membrana, transferencia del extremo amino hacia la interfase lipídica y oligomerización de los protómeros. 3,4 Sticholysinas I y II (StI/II), producidas por la anémona Stichodactyla helianthus,5-7 se encuentran entre las AP más potentes descritas en la naturaleza. 8 Debido a su actividad citolítica, las St tienen aplicaciones potenciales en la construcción de inmunotoxinas 9 y como parte de sistemas de liberación de moléculas al citosol celular. 10 El desarrollo de estas y otras aplicaciones debe acompañarse de un profundo conocimiento de su mecanismo de acción, así como de las propiedades de la membrana que modulan su actividad. 11
Las St muestran gran afinidad por la esfingomielina (SM), (12-14 un esfingolípido ubicuo en la membrana de los organismos eucariontes, aunque no se conocen los determinantes estructurales que condicionan este reconocimiento preferencial. Además de SM, fosfatidilcolina (PC) y colesterol (Chol), las membranas celulares contienen otros lípidos en menores cantidades que pudieran modular la unión y formación de poros por las AP, tales como los esfingolípidos (SL). Adicionalmente a la SM, (12,15-19 se ha documentado la contribución de la coexistencia de fases lipídicas a la actividad de las AP, (20-22 pero sin resultados concluyentes. La contribución de otros componentes lipídicos, (23 entre ellos los esteroles, 20-22 así como las propiedades físicoquímicas que emergen de la composición lipídica de la membrana, y regulan la actividad formadora de poros (AFP), son aún poco comprendidas. No existe suficiente evidencia experimental que permita generalizar cuáles son las plataformas lipídicas más adecuadas para la formación de poros por las AP y en qué medida las propiedades fisicoquímicas dependen de su composición. A las St, 24 se suma en esta propuesta la caracterización de la AFP de nigrelysina (Ngr), una AP de la anémona por Anthopleura nigrescens,25,26 que comparte rasgos estructurales y funcionales con las St y permite extender el espectro de las conclusiones aquí descritas a otros miembros de la familia de las AP.
MÉTODOS
Las St se purificaron a partir del cuerpo de S. helianthus.24) Ngr se identificó 25) y posteriormente se obtuvo mediante técnicas de biología molecular a partir de A. nigrescens. (26 La unión a sistemas lipídicos y a membranas modelos se llevó a cabo mediante: inmunotinción en placa delgada (IPD), (27,28 asociación con monocapas lipídica 29 y unión a liposomas. (28,30 La influencia de la coexistencia de fases lipídicas se analizó mediante microscopía de epifluorescencia, 29 de ángulo de Brewster (30,31 o en modo fluorescente mediante microscopía óptica. 30 La AFP se evaluó mediante la liberación de un fluoróforo al medio extravesicular (28 o por la pérdida de contraste de fase de vesículas. 30,31
RESULTADOS Y DISCUSIÓN
La unión y actividad permeabilizante de StII y Ngr a las membranas está condicionada por su composición lipídica
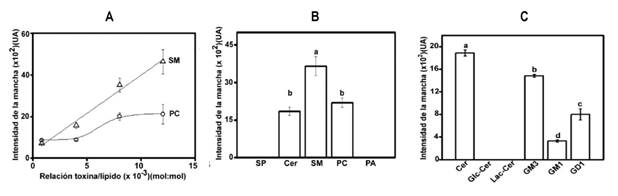
Estos estudios permitieron describir los determinantes estructurales que condicionan la mayor unión de StII a la SM cuando se compara con PC. A pesar de que ambos fosfolípidos comparten el mismo grupo de cabeza polar, la fosforilcolina (POC), el reconocimiento por StII y Ngr de la SM fue superior al de PC (figura 1A). Con el objetivo de identificar motivos estructurales de la SM responsables de la mayor afinidad de StII, se realizaron estudios de IPD en presencia de esfingosina (SP), ceramida (Cer) y ácido fosfatídico (PA). La SP y la Cer son compuestos de base esfingoide, mientras el PA deriva del glicerol, todos ellos carecen del grupo POC. StII no reconoció ni a la SP ni al PA; sin embargo, se unió en igual extensión a Cer y a PC, pero en menor medida que a la SM (figura 1B). Esto permitió concluir que la unión preferencial de StII a la SM resulta de contener POC en la cabeza polar y Cer en su región interfacial.
diferentes relaciones molares toxina/lípido. Cada punto representa la media ± la desviación estándar (DE) (n = 3). Los datos experimentales de la unión de StII con PC se ajustaron a una función sigmoidal de Hill (R2 = 0,99), mientras que los correspondientes a la interacción de la toxina con SM, se ajustaron a una línea recta (R2 = 0,97). B) Unión de StII a SP, Cer, SM, PC y PA. Relación molar toxina/lípido 8x10-3. C) Reconocimiento de lípidos derivados de la ceramida por StII mediante IPD. Cer: Ceramida, Glc-Cer: Glucosilceramida, Lac-Cer: Lactosilceramida. GM3, GM1 y GD1 son gangliósidos. Relación molar toxina/lípido 8x10-3. B) y C) Los valores de intensidad de las manchas se muestran en unidades arbitrarias (UA). Las barras muestran la media ± DE (n = 5). Las letras diferentes indican diferencias significativas entre los tratamientos (p < 0,05) mediante la prueba de Tukey a posteriori.
Con el objetivo de estudiar otros derivados de la Cer, se evaluó la unión de StII a los glicoesfingolípidos neutros (Gn): glucosil ceramida (G-Cer) y lactosil ceramida (Lac-Cer), y a los glicoesfingolípidos ácidos, los gangliósidos (Gs), GM3, GM1 y GD1 (figura 1C). StII no interactuó con los Gn; sin embargo, la presencia de 1 o 2 residuos de ácido siálico en los Gs monosialos: GM3 y GM1 y el disialo: GD1, respectivamente, facilitó el reconocimiento por StII. La asociación de StII con Gs resultó significativamente menor en comparación con la Cer (figura 1C), lo cual subraya el hecho de que los azúcares presentes en los glicoesfingolípidos dificultan la interacción de StII con la base Cer. La ausencia de reconocimiento de los Gn por StII pudiera explicarse por la ausencia del grupo POC y como consecuencia del menor acceso de la toxina a la base Cer de los Gn. En contraste, la unión de StII a los Gs fue significativamente mayor que con los Gn, lo cual probablemente se deba a la presencia de ácido siálico que pudiera favorecer las interacciones electrostáticas con los aminoácidos básicos de la proteína. La complejidad estructural de los Gs reduce la asociación de StII con estos lípidos en comparación con la Cer y la SM. 28 La asociación preferencial relativa de StII con lípidos individuales observada en IPD, se reprodujo cuando la toxina se enfrentó al sistema más complejo de monocapas lipídicas (figura 2).
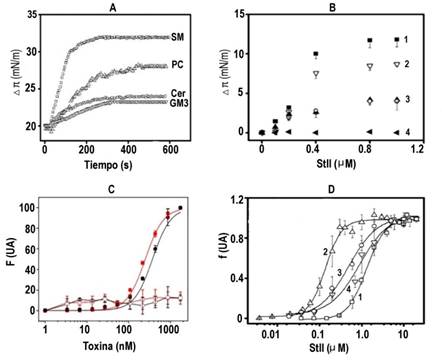
Fig. 2 Unión y actividad permeabilizante de StII y Ngr en sistemas lipídicos complejos. A) Curso temporal del incremento de la presión superficial (π) en monocapas luego de la adición de StII (0,8 μM). B) Incremento de Δπ en función de la concentración de toxina en monocapas de SM (1), PC (2), Cer (3) GM 3 (3) y SP, Glc-Cer, PA y Lac-Cer (4). Presión inicial de la monocapa sin toxina: 20 mN.m-1. (C) Actividad permeabilizante de StII (símbolos negros) y Ng (símbolos rojos) en liposomas de PC (símbolos abiertos) y PC:SM (1:1, símbolos cerrados) 26 D) Liberación del fluoróforo de liposomas de PC (1), PC:SM, 1:1 (2), PC:Cer, 1:1 (3) y PC:GM3, 1:1 (4). en función de la concentración de StII. Los valores de f (15 min) se normalizaron y las curvas se ajustaron a una función sigmoidal de Hill. En todos los casos R2 > 0,94. Los datos representan la media ± DE (n = 5). Concentración lipídica: 10 μM. Tampón TBS-NaCl 300 mM, pH 7,4.
Así, se observó que StII se une e inserta en mayor extensión a monocapas lipídicas de SM en comparación con PC (figura 2A). Por su parte, StII no reconoció al PA (figura 1B y 2B) lo que indica que la unión a PC ocurre principalmente a través del grupo POC. En su conjunto, los resultados en IPD y monocapas lipídicas indican que StII requiere para su unión relevante a la membrana tanto la presencia del grupo POC, presente en PC y SM, como la unidad de Cer característica de la SM. 28
Con el objetivo de explicar la mayor afinidad de StII por la SM con respecto a la PC, desde el punto de vista estructural, se modeló la estructura tridimensional de cada complejo StII:lípido y se realizaron simulaciones de dinámica molecular. El análisis de la estructura promedio de los complejos StII:lípido predijo la formación de 2 enlaces de hidrógeno estables entre StII y la SM y solo 1, menos estable, con la PC lo cual puede explicar la mayor afinidad de StII por SM. 28
Las St permeabilizan células y vesículas lipídicas mediante la formación de poros oligoméricos 11,12,23 por consiguiente, la unión competente a la membrana conduce a la liberación de los contenidos solubles al medio externo. 23,31 Consistente con los resultados de unión, tanto StII como Ngr permeabilizaron de manera más rápida y eficaz liposomas que contenían SM (figura 2C, D). 28
La unión y la AFP en liposomas de PC: Cer y PC:GM3 fueron significativamente superiores a la de liposomas formados solo por PC, posiblemente por la contribución del esfingolípido a las propiedades interfaciales (figura 2D). Sin embargo, la actividad fue menor que en las vesículas formadas por PC:SM (figura 2D) debido a la mayor penetración de StII a las membranas que contenían SM, en contraste con la asociación más superficial en el resto de las composiciones lipídicas. 28
Efecto de la estructura y dinámica de la membrana (estado de fase, fluidez y presencia de dominios lipídicos) en la unión y en la AFP de las AP
Existe escasa información referida al efecto de la estructura y dinámica de la membrana en la unión y AFP de las AP.
Estudios en monocapas lipídicas en la interfase aire: agua: Efecto de la proporción de SM, de la longitud de cadena y las insaturaciones de los ácidos grasos de la PC sobre la unión de StI
Con este fin, se combinaron estudios de incorporación de StI a monocapas con diferente proporción de SM acompañados de una caracterización de propiedades físicas del sistema.
En monocapas, la velocidad inicial y la eficacia de incorporación de StI se potenciaron en mezclas equimolares de PC:SM y disminuyeron cuando la mezcla se encontraba enriquecida en cualquiera de estos componentes. La escasa afinidad de StI por las monocapas con bajas proporciones de SM (menor e igual que 30 mol %) pudiera explicarse por su rol esencial en la interacción de las St con las membranas. 19,29,32,33) El aumento de la proporción de SM por encima de 50 mol % provocó la disminución de la velocidad y de la extensión de la unión de StI a las monocapas, lo que probablemente se encuentre asociado al aumento de la viscosidad de los filmes a altas proporciones de SM. Esto es crucial en el proceso de penetración de la toxina en la monocapa, debido a que su inserción debe provocar el desplazamiento lateral de los componentes lipídicos y su reacomodo. Estos procesos pueden estar favorecidos en una fase fluida y fácilmente deformable tal como el líquido expandido (LE) en monocapas que contienen hasta 50 mol % de SM y limitados en aquellas con difusión lateral restringida de sus componentes (mayor que 50 mol % de SM). 29
La disminución de la longitud de cadena de los ácidos grasos y la presencia del doble enlace en las cadenas hidrocarbonadas de la PC provocan la disminución de las interacciones de van der Waals entre las cadenas acílicas de moléculas vecinas, lo que redunda en membranas más fluidas. 34) Se emplearon monocapas lipídicas que contenían proporciones equimolares de SM y PC saturadas con longitudes de cadena de 14 (DMPC), 16 (DPPC), 18 (DSPC) y 20 (DAPC) átomos de C. Para estudiar el efecto de las insaturaciones se empleó la DOPC que contiene una insaturación en configuración cis entre los átomos de C 9 y 10 en las 2 cadenas de ácidos grasos. Se seleccionaron las mezclas equimolares de PC:SM puesto que esta proporción resultó óptima para la unión de StI en el sistema de monocapas lipídicas. La coexistencia de fases (LE/Líquido condensada (LC)) no fue el factor determinante de la mayor asociación de StI a monocapas de PC:SM (50:50). De hecho, las monocapas de DPPC:SM y DSPC:SM mostraron dominios y, consecuentemente interfases, ausentes en las que contenían DMPC y DOPC, organizadas únicamente en fase LE; sin embargo, en todas, StI se unió de modo similar. 29
La microscopía de epifluorescencia permitió demostrar que frente a la coexistencia de fases LE/LC, StI prefiere la fase LE, más fluida, incluso en aquellos casos en que la fase LC, más compacta, se encuentra más enriquecida en SM (figura 3). 29 Estos resultados enfatizan que la velocidad y la eficacia de asociación de StI a las monocapas de PC:SM dependen del adecuado balance entre el contenido de SM en la mezcla y la fluidez del sistema lipídico y no de la coexistencia de fases, como se postuló para la Eqt II. 21
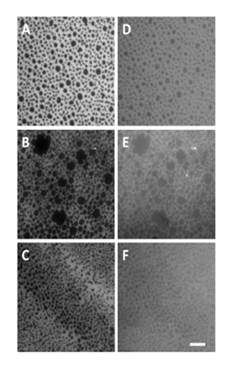
Fig. 3 Localización topográfica de StI en monocapas lipídicas con coexistencia de fases LE/LC. Imágenes representativas de microscopía de epifluorescencia de monocapas lipídicas transferidas a soportes sólidos. Composición lipídica: A y D) DSPC:eSM (50:50), B y E) SM 18:0:POPC (70:30), C y F) SM 18:0/SM 18:1 (70:30) conteniendo en todos los casos Rho-PE (1 mol %). La columna de la izquierda (A-C) muestra imágenes de las monocapas lipídicas visualizadas a través de un filtro para la λ de emisión de la rodamina (610 nm) y la columna de la derecha (D-F) muestra los mismos campos visualizados a través de un filtro para la λ de emisión de Alexa 488 con la cual se encontraba marcada StI. Cada imagen es representativa de dos experimentos realizados independientemente. La barra blanca mostrada en F representa 10 μm y es equivalente para todas las fotos. πo: 20 mN.m-1; concentración de la mezcla StI-Alexa: StI 1:5 (mol:mol): 0,8 μmol.L-1; TBS-145mmol.L-1 NaCl, pH 7,4; T: 23 ±2 C. 29
Estudios en sistemas liposomales: efecto de la proporción de SM, de la longitud de cadena y las insaturaciones de la PC en la actividad funcional de StI
Los resultados de los estudios con sistemas liposomales fueron, en general, consistentes con los hallazgos en monocapas. Así, la afinidad de StI por los liposomas aumentó con la presencia de SM y resultó máxima en vesículas que contenían de 30 mol % a 70 mol % de SM. La AFP de StI fue máxima en la mezcla equimolar de PC:SM y disminuyó significativamente cuando predominaron la PC o la SM. El incremento de la proporción de SM en la membrana pudiera disminuir la fluidez de la bicapa lo que dificultaría las etapas de oligomerización e inserción del extremo amino de StI en la membrana. Aquellos liposomas que contenían una baja proporción de SM (menor o igual que 15 mol %) fueron permeabilizados en menor extensión o no permeabilizados (0 mol %) por la acción de StI, debido a la menor afinidad de la toxina por sistemas con pequeña proporción o carentes de SM, como demostramos en monocapas y en bicapas (figura 2C) que coincide con los hallazgos previamente descritos para otras AP. 23,31
Con vistas a profundizar en el efecto de la fluidez en la actividad funcional de StI, se estudió su unión y actividad permeabilizante en vesículas unilaminares pequeñas (SUV) de PC:SM de las mismas composiciones que las empleadas en los estudios de unión a monocapas. La afinidad de StI fue similar por todas las vesículas que contenían las PC saturadas de 14, 16, y en menor medida, la de 18 átomos de C. 35 En correspondencia con los resultados de unión a monocapas, StI presentó menos afinidad por los liposomas que contenían la PC de mayor número de átomos de C. 20 En contraste, StI resultó más afín por los liposomas que contenían la PC insaturada en comparación con la PC saturada de igual número de C. 35
Por otra parte, la actividad permeabilizante en los SUV disminuyó significativamente con el aumento de la longitud de las cadenas hidrocarbonadas. A su vez, los liposomas que contenían PC insaturada fueron más sensibles a la acción de StI que los que contenían la PC saturada de igual longitud de cadena. Así, los liposomas de DMPC:SM y DOPC:SM, caracterizados por la mayor fluidez resultaron más sensibles a la acción de StI. 35
A partir de análisis de los resultados de unión se infirió que la mayor actividad permeabilizante de StI en las vesículas que contienen DMPC o DOPC es consecuencia de diferencias en una etapa del mecanismo de formación de poros posterior a la unión de la toxina a la membrana. Por otro lado, a pesar de que se ha argumentado que la coexistencia de fases y las interfases laterales, derivadas de dicha coexistencia, favorecen la afinidad de estas toxinas por la membrana, 20-22,36,37 nuestros resultados apoyan la idea de que su existencia no es determinante para la unión y la permeabilización en membranas de PC:SM sino la disponibilidad de SM en un ambiente fluido.
Los esteroles incrementan la unión y la actividad permeabilizante de StI independientemente de su capacidad de generar coexistencia de fases
Se emplearon monocapas y liposomas formados por mezclas ternarias de DOPC: SM: esterol (1:1:1) (figura 4) que contenían Chol o ergosterol (Erg), promotores de la formación de fases líquido ordenadas en membranas fosfolipídicas o Cln que inhibe su formación. (38) La inclusión de Chol y Erg en sistemas de DOPC:SM promovió la coexistencia de fases líquidas LE/LC tanto en monocapas lipídicas como sus equivalentes Ld/Lo en bicapas, en contraposición con la Cln donde solo pudo visualizarse una fase líquida continua (LE/Ld, figura 4I). 35
La inclusión de los esteroles en la mezcla de DOPC:SM favoreció la unión toxina-membrana y su AFP en el orden Chol mayor que Erg mayor e igual que Cln mayor que PC:SM (figura 4). StI siguió el mismo comportamiento en monocapas y bicapas que contenían esteroles. Se ha demostrado que la fase más fluida es la plataforma más adecuada para la AFP de las AP. 39 La AFP de StI en las membranas que contenían Chol fue mayor que aquellas que contenían Erg. (figura 4). 35
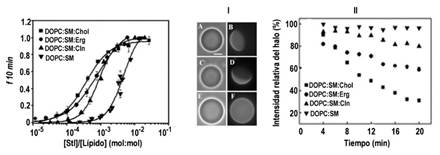
Fig. 4 Efecto de la naturaleza química de los esteroles en la actividad permeabilizante de StI en sistemas vesiculares. Dependencia de la actividad permeabilizante de StI en función de la relación molar lípidos/StI a los 10 min de adicionada la toxina a los SUV. f10 es la proporción de fluoróforo liberado. Cada punto corresponde a la media de tres determinaciones independientes y la barra indica la DE. Las curvas corresponden al ajuste de los datos experimentales a la función sigmoidal de Hill (R2 > 0,96). (I) Visualización de GUV de diferente composición lipídica en contraste de fase y modo fluorescente: DOPC:SM:Chol (1:1:1) (A y B), DOPC:SM:Erg (1:1:1) (C y D) y DOPC:SM:Cln (1:1:1) (E y F) conteniendo en todos los casos 0.2 mol % Rho-PE. La barra escala blanca en A equivale a 20 μm y es representativa para todas las imágenes. Paneles de la izquierda: modo contraste de fase, paneles de la derecha, modo fluorescente. (II) Curvas cinéticas representativas que muestran el % de GUV que experimentan una disminución de contraste de fase después de la adición de StI. Composición lipídica: (■) DOPC:SM:Chol (1:1:1), (●) DOPC:SM:Erg (1:1:1), (▲) DOPC:SM:Cln (1:1:1) y (▼) DOPC:SM (1:1).
Si extrapolamos los resultados obtenidos en monocapas a los de bicapas, resulta tentador especular que la fase Ld de las vesículas que contenían Chol se comporta como una fase más fluida y con menor cohesión lipídica que la fase equivalente de las membranas que contienen Erg. Por consiguiente, una mayor fluidez puede brindar un medio más favorable para la oligomerización y la inserción del N-terminal de StI en las membranas que contienen Chol. Adicionalmente, el área ocupada por la fase LE en las monocapas de DOPC:SM:Chol es menor que el correspondiente en las membranas que contienen Erg, 35 como se describió previamente para bicapas. (38 El confinamiento de StI a un área reducida con una cantidad relativamente elevada de SM (40 en una fase menos ordenada pudiera ser una estrategia para reducir el área difusional y facilitar la oligomerización y la inserción del N-terminal de StI en la membrana. Consecuentemente, la AFP de StI, en las vesículas que contienen Chol, es más eficiente debido tanto a la mayor fluidez de la fase Ld como al efecto concentrador sobre StI. En resumen, ambos Chol y Erg, potenciaron la actividad de StI. A diferencia del Chol y Erg, la Cln no favoreció la actividad de StI en todos los sistemas vesiculares, posiblemente debido a su incapacidad de promover la separación lateral de fases. La potenciación de la unión y la actividad permeabilizante de StI promovida por los esteroles parece resultar de la mayor heterogeneidad molecular de la membrana que alcanza su máxima expresión en las mezclas que contienen Chol y Erg como resultado de la coexistencia de fases.
Conclusiones
StII reconoció, además de la SM, a la Cer y a los glicoesfingolípidos aniónicos, no así a los neutros. Las simulaciones de dinámica molecular predijeron la formación de dos enlaces de hidrógeno estables con la SM y uno menos estable con la fosfatidilcolina. Asimismo, sugirieron que las interacciones electrostáticas determinan su interacción preferencial con la SM. La condición de equimolaridad de PC y SM, análoga a la encontrada en las membranas citoplasmáticas de las células eucariontes, favorece la unión y formación del poro por StI y Ngr. Bajo esta condición, se alcanza un balance favorable entre la disponibilidad del esfingofosfolípido y la fluidez de la membrana, necesario para la unión y formación de poros.
La AFP de las AP es un fenómeno multifactorial que trasciende el simple reconocimiento de la SM, en el que participan otros lípidos de la membrana de base ceramida que posiblemente modulen este mecanismo en las membranas celulares. Los esteroles constituyen el 3er componente lipídico más abundante en las membranas celulares animales y se les ha atribuido una función reguladora de sus propiedades físicoquímicas. El Chol y el Erg, típicos de animales o levaduras y hongos, respectivamente, inducen la separación lateral de fase en mezclas ternarias con PC y SM. La potenciación de la actividad de StI generada por los esteroles resulta de la heterogeneidad de la membrana e incluye, además de la separación lateral de fases, el grado de hidratación de la cabeza polar y la propensión a formar fases no laminares, entre otros.